专题1《化学反应与能量变化》检测题(含解析) 2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》检测题(含解析) 2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 809.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 10:35:18 | ||
图片预览




文档简介
专题1《化学反应与能量变化》检测题
一、单选题
1.由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
A.石墨Ⅰ极为正极,石墨Ⅱ极为负极
B.Y的化学式可能为NO
C.石墨Ⅰ极的电极反应式为NO2+NO3--e-===N2O5
D.石墨Ⅱ极上发生氧化反应
2.根据工业上离子交换膜法制烧碱的方法,可以用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。下列说法错误的是
A.该电解槽的阳极反应式为2H2O-4e-=4H++O2↑
B.制得的氢氧化钾溶液从出口D导出
C.通电开始后,阴极附近溶液pH增大
D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为O2+2H2O-4e-=4OH-
3.汽车尾气中的NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由Rh、Pd、Pt等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析正确的是
A.催化剂能改变 B.NOx发生了氧化反应
C.CO转化为CO2时,转化为 D.的水溶液能导电,为电解质
4.下列说法不正确的是
A.汽车尾气中有NOx ,主要是汽油不充分燃烧引起的
B.日用铝制品表面覆盖着氧化膜,对金属起保护作用
C.实验室常用粗锌和稀硫酸反应制取H2
D.从海水中提取溴的过程涉及氧化还原反应
5.一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为:。该装置工作时,下列叙述正确的是
A.Al电极区的电极反应式:
B.Al为正极
C.每消耗27gAl,有通过溶液转移到石墨电极上
D.若采用“食盐水+NaOH溶液”作电解质溶液,电极反应式相同
6.已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2 放热。关于下列ΔH的判断正确的是
CO(aq)+H+(aq) HCO (aq) ΔH1
HCO (aq)+H+(aq) H2CO3(aq) ΔH2
H2CO3(aq) H2O(l)+CO2(g) ΔH3
OH-(aq)+H+(aq) H2O(l) ΔH4
A.ΔH1<0 ΔH2>0 B.ΔH1+ΔH2>0
C.ΔH1+ΔH2+ΔH3>0 D.ΔH2<ΔH4
7.断开1 mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A—B键的键能。已在H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1,推求N≡N键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.1130 kJ·mol-1
8.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
9.周期表中ⅥA族元素及其化合物应用广泛。用硫黄熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯()常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性溶液制备Te。下列化学反应表示正确的是
A.的燃烧:
B.和浓硫酸反应:
C.电解强碱性溶液的阴极反应:
D.向溶液中滴加足量溶液,有白色沉淀生成:
10.已知:①能量越低的物质越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定 B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相似 D.红磷容易发生自燃而白磷不会自燃
11.锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是
A.放电过程中,a电极的电极反应式为2H2O + Mn2+ - 2e- = MnO2 + 4H+
B.放电过程中,转移 0.4 mol e-时,b电极消耗 0.8 mol OH-
C.充电过程中,b电极接外接电源的正极
D.充电过程中,b电极反应为:Zn2+ + 2e-= Zn
12.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(l) △H = -285.8kJ/mol
当1mol液态水变为水蒸气时,其热量变化是
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
13.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2Ag2O+Zn+H2O。在此电池放电时,负极上发生反应的物质是
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
14.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将和转化为和燃料()。下列说法正确的是
A.该装置将化学能转化为光能和电能
B.电极的反应为
C.每生成,有被还原
D.该装置工作时,从极区向极区迁移
二、填空题
15.(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
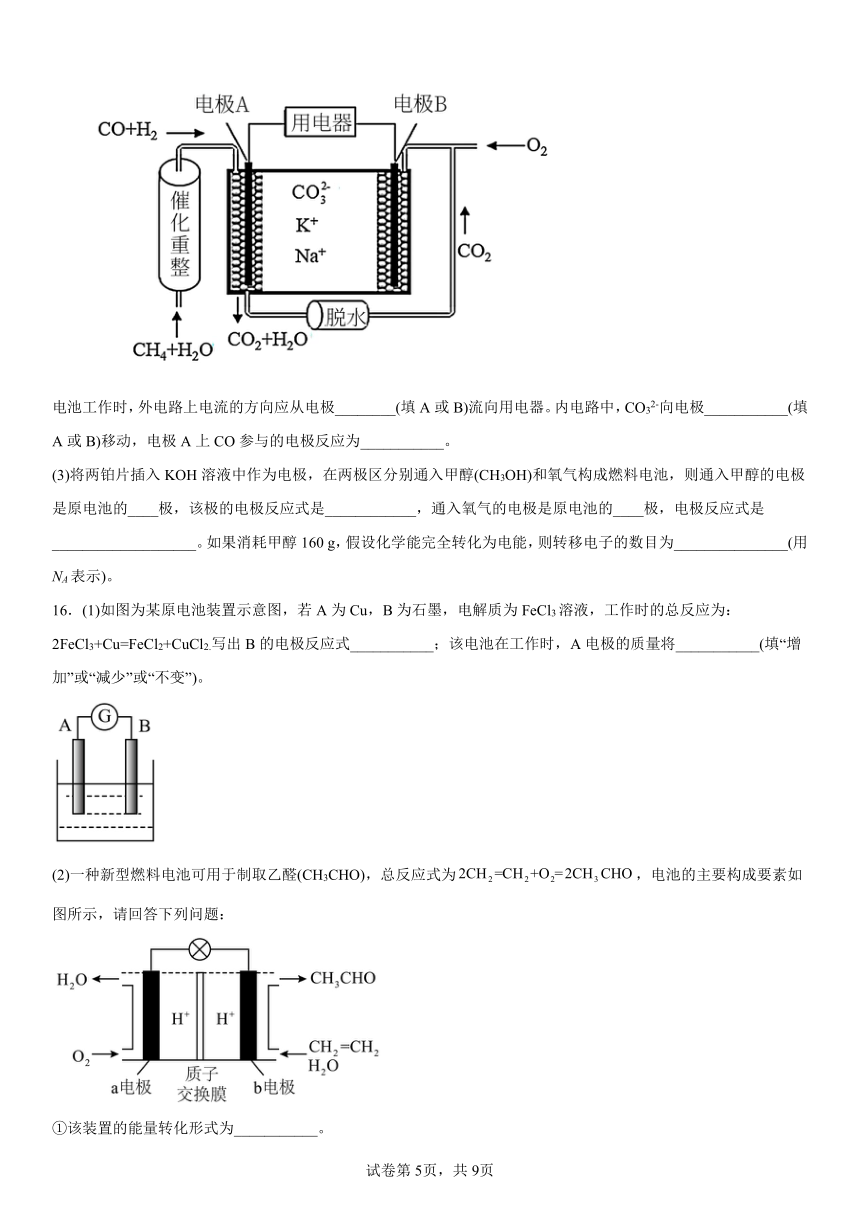
(2)一种熔融碳酸盐燃料电池原理示意如图所示:
电池工作时,外电路上电流的方向应从电极________(填A或B)流向用电器。内电路中,CO32-向电极___________(填A或B)移动,电极A上CO参与的电极反应为___________。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____极,该极的电极反应式是____________,通入氧气的电极是原电池的____极,电极反应式是___________________。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________(用NA表示)。
16.(1)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2.写出B的电极反应式___________;该电池在工作时,A电极的质量将___________(填“增加”或“减少”或“不变”)。
(2)一种新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,电池的主要构成要素如图所示,请回答下列问题:
①该装置的能量转化形式为___________。
②a电极为燃料电池的___________极,该电极的电极反应式为___________。
③电池工作时,H+由___________电极(填“a”或“b”,下同)移向___________电极。
④生成3.3g乙醛时,需要消耗标准状况下的氧气___________mL。
17.如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:
(1)电源B极的名称是________。
(2)乙装置中电解反应的总化学方程式是________________________。
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
18.写出下列反应的热化学方程式:
(1)N2(g)和H2(g)反应生成1mol NH3(g),放出46.1kJ热量_____。
(2)46g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出1366.8 kJ热量_____。
(3)已知断裂1molH2(g)中的H-H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中1molH-O键能放出463kJ的能量,试着写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式________。.
(4)到目前为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式______。
19.电解装置如图所示:
(1)当用惰性电极电解时,c为_______极,电极反应_______,d为_______极,电极反应_______,电解总反应的化学方程_______
(2)若用此装置进行铁上镀铜则c为_______(填铁或铜)电解液浓度_______(增大,减小或不变)
(3)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子_______mol。
(4)若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极_______(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______(填离子符号)形式进入溶液,c电极发生的反应_______
20.金属的腐蚀可分为化学腐蚀和电化学腐蚀。下列腐蚀类型中
①铜板在氯化铁溶液中被腐蚀②钢铁在空气中生锈而被腐蚀③化工厂里的铁与氯气反应被腐蚀④铜铝电线接头处铝被腐蚀⑤高温下铁丝被氧气腐蚀⑥铜在空气中生成铜绿而被腐蚀
(1)属于化学腐蚀是_______________(填序号,下同)。
(2)属于电化学腐蚀的是_______________。
21.工业合成氨中氢气的重要来源是水煤气,有关反应如下:①;②,它们的能量变化如图所示。
(1)写出图1表示的反应的热化学方程式:_______。
(2)_______。
(3)已知几种共价键的键能如表所示:
化学键 CO
a 799 1076 465
则a为_______。
(4)在恒容密闭容器中发生反应:。达到平衡后,改变条件使CO的平衡转化率增大,则该反应的_______(填“增大”“减小”或“不变”)。
22.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒 b.锌板 c.铜板 d.钠块
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为__________
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________。
③0.4molCuSO4和0.4molNaCl溶于水,配成1L溶液,用该镁燃料电池用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是_________________;
②电镀结束后,装置Ⅰ中溶液的pH_____________;(填写“变大”“变小”或“不变”)装置Ⅱ中Cu2+的物质的量浓度_______________;(填写“变大”“变小”或“不变”)
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标况)。
23.完成下列问题:
Ⅰ.
(1)若A为Zn,B为Cu,溶液C为硫酸溶液,则正极上发生的电极反应式:_______,溶液中移向_______(填“正极”或“负极”)。
(2)若A为Al,B为Mg,溶液C为氢氧化钠溶液,则正极是_______(填“Mg”或“Al”)。
Ⅱ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个化学电池(正极材料用碳棒),回答下列问题:
(3)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(4)若导线上转移电子1mol,则生成银_______g.
24.如右图所示:
(1)将铜棒和铝棒用导线连接后置于盛稀盐酸的烧杯中,看到的现象是________。铝棒做________极,该极的电极反应方程式为__________。
(2)如果将盐酸换成NaOH溶液,该电池发生的总反应离子方程式为____________。此时铝棒做________极,该极的电极反应方程式为_____________。
(3)如果将盐酸换成浓硝酸溶液,则铝棒做________极。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】在燃料电池中通入氧气的为正极,通入燃料的为负极,由图可知,石墨Ⅱ上氧气得到电子,则石墨Ⅱ为正极,石墨I上NO2失去电子,石墨I为负极,结合负极发生氧化反应、正极发生还原反应分析解答。
【详解】A.根据上述分析,石墨Ⅱ为正极,石墨I为负极,故A错误;
B.石墨I为负极,石墨I上NO2失去电子,N元素的化合价应从+4价升高,Y不可能为NO,故B错误;
C.石墨I上NO2失去电子,N元素的化合价升高,因此Y为N2O5,负极反应为NO2+NO3--e-═N2O5,故C正确;
D.石墨Ⅱ为正极,发生还原反应,故D错误;
答案选C。
2.D
【详解】A.左边电极连接电源正极,为电解槽的阳极,其电极反应式为↑,A正确;
B.右边电极是电解槽的阴极,阴极上水电离产生的氢离子得到电子变为氢气逸出,剩余氢氧根离子,溶液中的K+穿过阳离子交换膜进入到阴极室与OH-结合生成KOH溶液从出口D导出,B正确;
C.根据B选项分析,通电开始后,阴极生成KOH,使附近溶液pH增大,C正确;
D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极是O2得到电子发生还原反应,故正极的电极反应式为:,D错误;
故合理选项是D。
3.C
【详解】A.催化剂只能改变反应的活化能,不能改变反应的ΔH,A错误;
B.由图可知,NOx变为氮气,氮元素的化合价降低,得电子被还原,发生还原反应,B错误;
C.CO转化为CO2时,碳元素化合价升高,CeO2反应时得电子化合价降低生成CeO2-m,C正确;
D.NO2的水溶液能导电是因为NO2与水反应生成了硝酸,硝酸可以导电,NO2本身在水溶液中无法电离,不能导电,所以NO2为非电解质,D错误;
故答案选C。
4.A
【分析】
【详解】A.汽车尾气中的氮氧化物主要来自于燃料气缸中氮气在放电情况下与氧气反应产生,汽油的不充分燃烧产生的是CO气体,A错误;
B.铝制品表面容易形成一层致密的氧化膜,使金属不被进一步腐蚀保护了内层金属,B正确;
C.实验室制备氢气用粗锌和稀硫酸反应,目的是粗锌中杂质和锌构成原电池,加快反应的速率,C正确;
D.海水中存在溴离子,提取成溴单质一定要涉及氧化还原反应,D正确;
故选A。
5.A
【分析】放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,MnO2得电子,石墨为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3,结合原电池原理分析解答。
【详解】A.MnO2得电子为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3,负极电极反应式为,选项A正确;
B.根据上述分析,石墨为正极,Al为负极,选项B错误;
C.电子从负极流向正极,但是电子只能在导线和电极上移动,不能通过溶液,选项C错误;
D.若采用食盐水+NaOH溶液作电解质溶液,负极生成的氢氧化铝会被氢氧化钠溶解,电极反应式不同,选项D错误;
答案选A。
6.B
【分析】由题意可知,碳酸氢钠溶液与盐酸反应生成二氧化碳的反应为吸热反应,△H'>0,碳酸钠溶液与盐酸反应生成二氧化碳的反应为放热反应,△H''<0,将已知反应依次编号为①②③④,由盖斯定律可知,②+③可得HCO3-(aq)+H+(aq) H2O(l)+CO2(g) △H'=△H2+△H3>0,①+②+③可得CO32-(aq)+2H+(aq) H2O(l)+CO2(g)△H''=△H1+△H2+△H3<0,②-④可得碳酸氢根离子的水解反应HCO3-(aq)+ H2O(l) H2CO3(aq)+OH-(aq),盐类水解反应为吸热反应,则△H'''=△H2—△H4>0。
【详解】A.由分析可知,△H2+△H3>0,△H1+△H2+△H3<0,则△H1<0;碳酸的分解反应为吸热反应,△H3>0,由△H2+△H3>0可知,△H2可能大于0,也可能小于0,A项错误;
B.由分析可知,△H2+△H3>0,B项正确;
C.由分析可知,△H1+△H2+△H3<0,C项错误;
D.由分析可知,△H2-△H4>0,则△H2>△H4,D项错误;
答案选B。
7.B
【详解】已知:H﹣H键能为436kJ/mol,H﹣N键能为391kJ/mol,令N≡N的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ/mol,反应热=反应物的总键能﹣生成物的总键能,故x+3×436kJ/mol﹣2×3×391kJ/mol=﹣92kJ/mol,解得:x="946" kJ/mol。
故选B。
8.A
【详解】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A错误;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B正确;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C正确;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D正确;
故选A。
9.D
【详解】A.利用已知条件中的数据进行计算,要注意应为液态,选项A错误;
B.有强还原性,浓硫酸有强氧化性,二者不能共存,选项B错误;
C.强碱性溶液中发生反应的离子方程式不应用表示,选项C错误;
D.因足量,与应为等物质的量参与反应,选项D正确;
答案选D。
10.A
【详解】A.白磷转化成红磷是放热反应,说明红磷能量比白磷低,红磷比白磷稳定,A正确;
B.红磷能量比白磷低,红磷稳定,B错误;
C.已知信息不能得出红磷和白磷的结构相似,且红磷和白磷的结构不同,C错误;
D.红磷的着火点比白磷高,故白磷比红磷更易燃,D错误;
故答案选D。
11.B
【分析】由图像可得该电池放电时,b电极为负极,电极反应式为:,a点击为正极,电极反应式为:,充电时则a电极做阳极,b电极做阴极。
【详解】A.放电时a电极做正极,发生还原反应,而不是失电子得氧化反应,A错误;
B.放电时b电极得反应为,则反应转移0.4mol电子时,b电极参与反应得氢氧根得物质的量,B正确;
C.放电时b电极做负极,充电时b电极做阴极,外接电源得负极,C错误;
D.b电极环境为碱性溶液,锌离子无法稳定存在,D错误;
故选B。
12.D
【详解】由盖斯定律,反应1+反应2得到H2O(g)= H2O(l) △H =+241.8+(-285.8) =-44 kJ/mol,所以H2O(l)= H2O(g) △H =+44 kJ/mol,当1mol液态水变为水蒸气时,吸热44KJ,故选:D。
13.D
【详解】电池放电时为原电池,负极物质化合价升高,失去电子,放电过程为从右往左进行,根据Zn的化合价由0价升高到+2价可知,Zn在负极上发生氧化反应,则负极上发生反应的物质是Zn,答案选D。
14.D
【详解】A.该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,A错误;
B. a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,B错误;
C.电池总的方程式为:6CO2+8H2O2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,每生成,有被还原,C错误;
D.a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以该装置工作时H+从阳极b极区向阴极a极区迁移,D正确;
答案选D。
15. 2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH- Cd-2e-+2OH-=Cd(OH)2 变小 B A CO-2e-+CO32-=2CO2 负极 CH3OH-6e-+8OH-=CO32-+6H2O 正极 O2+4e-+2H2O=4OH- 30NA
【分析】(1)放电过程为原电池反应,根据总反应化学方程式分析,Cd作原电池负极,失电子,在碱性溶液中生成Cd(OH)2;NiO(OH)在碱溶液中得到电子发生还原反应生成Ni(OH)2,根据氢氧根离子浓度变化判断溶液酸碱性的变化;
(2)分析熔融碳酸盐燃料电池原理示意图,通入氧气的一端为原电池正极,通入一氧化碳和氢气的一端为负极,电流从正极流向负极,溶液中阴离子移向负极,A电极上一氧化碳失电子发生氧化反应生成二氧化碳;
(3)甲醇、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,在得失电子相等的条件下,将电极反应式相加即得电池反应式,结合电极反应和电子守恒计算。
【详解】(1)放电过程为原电池反应,根据总反应化学方程式Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2可知:NiO(OH)在碱溶液中得到电子发生还原反应生成Ni(OH)2,所以正极电极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-;Cd作原电池负极,失电子在碱性溶液中生成Cd(OH)2,负极电极反应为:Cd-2e-+2OH-=Cd(OH)2,由于放电时负极不断消耗OH-,因此附近溶液在c(OH-)逐渐降低,溶液的碱性逐渐变小;
(2)分析熔融碳酸盐燃料电池原理示意图,通入O2的一端为原电池正极,通入CO和H2的一端为负极,电流从正极流向负极,电池工作时,外电路上电流的方向应从电极B流向用电器,内电路中,CO32-向负极A电极移动,电极A上CO参与的电极反应,CO失电子发生氧化反应生成CO2,该电极反应为:CO-2e-+CO32-=2CO2;
(3)CH3OH、O2和KOH溶液构成燃料电池,CH3OH易失电子发生氧化反应,通入CH3OH的电极为负极,CH3OH失去电子被氧化,与溶液中的OH-结合形成H2O,负极上电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;通入O2的电极为正极,O2得到电子,与溶液中的H2O结合形成OH-,正极上电极反应式为为O2+4e-+2H2O=4OH-。160 g甲醇的物质的量是n(CH3OH)==5 mol,根据负极反应式可知:每1 mol甲醇发生反应,转移电子的物质的量是6 mol,则反应的甲醇物质的量是5 mol,则转移电子数目为N(e-)=5 mol×6NA/mol=30NA。
【点睛】本题考查了化学电源新型电池,根据原电池中负极失去电子,发生氧化反应;正极上得到电子,发生还原反应,溶液中阳离子向正极定向移动,阴离子向负极定向移动。结合电解质溶液书写电极反应式。在燃料电池中通入燃料的电极为负极,通入氧气的电极为正极,注意碱性条件下甲醇失电子不能生成氢离子,要生成碳酸根离子,为易错点。
16. 2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+) 减小 化学能转化为电能 正 b a 840
【分析】A为Cu,铜作还原剂,作原电池的负极,B为石墨,铁离子得电子,作正极,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=2FeCl2+CuCl2;新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,a电极为燃料电池的正极,氧气得电子,发生还原反应,乙烯失电子,b极作负极。
【详解】(1)若A为Cu,铜作还原剂,作原电池的负极,B为石墨,铁离子得电子,作正极,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=2FeCl2+CuCl2,B的电极反应式2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+);该电池在工作时,Cu-2e-=Cu2+,A电极的质量将减小(填“增加”或“减少”或“不变”)。故答案为:2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+);减小;
(2)①该装置为燃料电池,能量转化形式为化学能转化为电能。故答案为:化学能转化为电能;
②a电极为燃料电池的正极,氧气得电子,发生还原反应,该电极的电极反应式为。故答案为:正;;
③a为正极,b为负极,电池工作时,阳离子移向正极,H+由b电极(填“a”或“b”,下同)移向a电极。故答案为:b;a;
④由方程 ,生成3.3g乙醛时,物质的量为=0.075mol,需要消耗标准状况下的氧气 =840mL,故答案为:840。
17. 负极 2NaCl+2H2O H2 ↑ +Cl2 ↑ + 2NaOH 1:2 银 AgNO3
【详解】试题分析:将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极显碱性,则F极反应为 ,F是阴极。所以电源B是负极、A是正极。
解析:根据以上分析,(1)电源B极的名称是负极。
(2)用惰性电极电解氯化钠溶液,阳极生成氯气,阴极生成氢气,乙装置中电解反应的总化学方程式是2NaCl+2H2O H2 ↑ +Cl2 ↑ + 2NaOH。
(3)甲装置C极反应式为 ,D极的极反应式为 ,根据电子守恒,两种物质的物质的量比是1:2。
(4)电镀时镀件作阴极、镀层金属作阳极,含有镀层金属的盐溶液作电解质,G是阳极、H是阴极,欲用丙装置给铜镀银,G应该是银,电镀液的主要成分是AgNO3。
点睛:电解池中阳极失电子发生氧化反应,阴极得电子发生还原反应,如乙池中E是阳极、F是阴极,E电极反应式是 ,F电极反应式是。
18. N2(g)+3H2(g)=2NH3(g) △H= 92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol 2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1 Fe(s)+CO(g)═Fe(s)+CO2(g) △H= 11kJ/mol
【详解】(1)N2(g)与H2(g)反应生成1mol NH3(g),放出46.1kJ热量,则生成2mol NH3(g),放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H= 92.2kJ/mol;故答案为:N2(g)+3H2(g)=2NH3(g) △H= 92.2kJ/mol;
(2)46g C2H5OH(l)物质的量为=1mol,1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为: C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol;故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol;
(3)已知2H2(g)+O2(g)═2H2O(g),△H=反应物的键能和 生成物的键能和=2×436kJ mol 1+498kJ mol 1 4×463kJ mol 1= 482kJ mol 1△H= 482kJ mol 1,O2(g)与H2(g)反应生成H2O(g)的热化学方程式为2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1,故答案为:2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1;
(4)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1= 25kJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2= 47kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19kJ/mol
根据盖斯定律将方程式变形(3×① ② 2×③)得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1 △H2 2×△H3)= 11kJ/mol,故答案为:Fe(s)+CO(g)═Fe(s)+CO2(g) △H= 11kJ/mol。
19.(1) 阳极 4OH--4e-=O2↑+2H2O 阴极 2Cu2++4e-=2Cu 2CuSO4+2H2O2Cu+O2↑+2H2SO4
(2) 铜 不变
(3)0.25
(4) c Fe2+ Cu-2e-=Cu2+
【分析】根据电解装置图可知,当用惰性电极电解时,c与电源的正极相连,则c为阳极,d与电源的负极相连,则d为阴极;若用此装置进行铁上镀铜,阳极是镀层金属铜,c为 铜;阴极是镀件,d为 铁,电解液浓度 不变;电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来。
(1)
当用惰性电极电解时,c与电源正极相连,为阳极极,氢氧根失电子发生氧化反应,电极反应4OH--4e-=O2↑+2H2O,d与电源负极相连,为阴极极,铜离子得电子,发生还原反应,电极反应2Cu2++4e-=2Cu,电解总反应的化学方程2CuSO4+2H2O2Cu+O2↑+2H2SO4,故答案为:阳极;4OH--4e-=O2↑+2H2O;阴极;2Cu2++4e-=2Cu;2CuSO4+2H2O2Cu+O2↑+2H2SO4;
(2)
若用此装置进行铁上镀铜,阳极为镀层金属,阴极为待镀金属,则c为铜(填铁或铜)电解液浓度不变(增大,减小或不变),故答案为:铜;不变;
(3)
电镀一段时间后对电极进行称量发现两极质量差为16克,根据阳极:Cu-2e→Cu2+、阴极:Cu2++2e→Cu 两极质量差为128,当两极质量差为16克,说明转移的电子为×2=0.25mol。故答案为:0.25;
(4)
若用此装置进行粗铜的电解精炼。,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来,则要求粗铜板是图中电极c(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以Fe2+(填离子符号)形式进入溶液,c电极发生的反应Cu-2e-=Cu2+故答案为:c;Fe2+;Cu-2e-=Cu2+。
20.(1)①③⑤
(2)②④⑥
【分析】金属与接触到的物质直接发生氧化还原反应而被氧化损耗的过程叫做化学腐蚀;电化学腐蚀就是金属和电解质组成两个电极,组成腐蚀原电池;
①铜板在氯化铁溶液中被腐蚀,铜与氯化铁发生氧化还原反应,生成氯化铜与铁,属于化学腐蚀;
②钢铁在空气中生锈而被腐蚀,钢铁在潮湿的空气中,会在钢铁的表面产生一层水膜,这层水膜导致钢铁表面产生电化学腐蚀,属于电化学腐蚀;
③化工厂里的铁与氯气反应被腐蚀,铁与氯气直接反应而腐蚀会生成氯化铁,属于化学腐蚀;
④铜铝电线接头处铝被腐蚀,由于二者金属活泼性不同,产生电位差,形成原电池,属于电化学腐蚀;
⑤高温下铁丝被氧气腐蚀,铁和氧气在高温下生成四氧化三铁,属于化学腐蚀;
⑥铜在空气中生成铜绿而被腐蚀,铜在空气中的二氧化碳、氧气和水共同腐蚀下产生的一种被称作碱式碳酸铜的物质,属于电化学腐蚀。
【详解】(1)据分析可知,①③⑤为化学腐蚀,故答案为①③⑤。
(2)据分析可知,②④⑥为电化学腐蚀,故答案为②④⑥。
21. 90.3 449 不变
【分析】靠近纵坐标的为反应物,反应物总能量大于生成物总能量,为放热反应;反之为吸热反应。
【详解】(1)图(1)反应物为C和H2O,生成物为CO和H2,反应物总能量低于生成物总能量,故该反应为吸热反应,热化学方程式为, 故填:;
(2)同理可得图2的热化学方程式,由盖斯定律,将①和②相加消去CO得热化学方程式,故填:90.3;
(3)根据,=,解得a=449,故填:449。
(4)对于反应,该反应的反应热与物质的状态、各物质的系数有关,与平衡是否移动无关,故改变条件使CO转化率增大,不变,故填:不变。
22. b 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2↑ 5.6 O2 CH4-8e-+10OH-=CO32-+7H2O 变小 不变 1.12
【分析】(1)形成原电池时,Fe作正极被保护;活泼性比Fe强的金属作负极,被腐蚀。
(2)①原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此判断正负极。
②镁能和热水反应生成氢氧化镁和氢气。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积。
(3)II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2。
①装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,甲烷失电子和氢氧根离子反应生成碳酸根离子和水。
②装置Ⅰ中消耗氢氧化钾溶液PH减小,电镀过程中阳极上溶解的铜质量等于阴极上析出铜的质量。
③根据整个装置中电子转移相等计算消耗的甲烷的体积。
【详解】(1)该装置形成原电池,Fe作负极被保护,所以应该连接比Fe活泼的金属,故锌板。
故答案为:b;
(2)①电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为 1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,离子方程式为。
故答案为:负;。
②镁能和热水反应生成氢氧化镁和氢气而导致负极利用率降低,反应方程式为。
故答案为: 。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出铜的物质的量为0.3mol,阴极上转移电子的物质的量,根据原子守恒知,溶液中,氯离子完全放电时转移电子的物质的量,所以阳极上生成的气体是氯气和氧气,生成氯气的体积为0.2mol即4.48L。根据电极反应,,转移0.2mol电子,生成氧气的物质的量是0.05mol,即1.12L,所以另一个电极上生成的气体在标准状况下的体积是。
故答案为:5.6。
(3)①通过装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2 ,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为,
故答案为: O2;。
②根据I中电池反应为,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变。
故答案为:变小;不变。
③左边原电池和右边电解池转移电子数相等,所以消耗甲烷的体积。
故答案为:1.12。
【点睛】电解硫酸铜和氯化钠溶液时,阳极上Cl-先放电,然后OH-放电,阴极上Cu2+放电,后H+放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积。
23.(1) 2H++2e-=H2↑ 负极
(2)Mg
(3) Cu 氧化 AgNO3溶液
(4)108
【解析】(1)
若A为Zn,B为Cu,溶液C为硫酸溶液,Zn比Cu活泼,则Zn是负极,Zn转化成Zn2+,Cu是正极,H+转化成H2,故正极上发生的电极反应式2H++2e-=H2↑;原电池中阴离子向负极移动,故向负极移动;
(2)
若A为Al,B为Mg,溶液C为氢氧化钠溶液,Al与NaOH可以自发的发生氧化还原反应,故Al是负极,Mg是正极;
(3)
已知反应Cu+2Ag+=2Ag+Cu2+中Cu转化为Cu2+,化合价升高失去电子,发生氧化反应,故电池的负极反应式为:Cu-2e-=Cu2+,Ag+转化为Ag,化合价降低得到电子发生还原反应,故电池的正极反应式为:Ag++e-=Ag,则该电池的负极材料是Cu,发生氧化反应,电解质溶液是含有Ag+的电解质溶液,通常为AgNO3溶液;
(4)
根据电子守恒结合正极反应式Ag++e-=Ag可知若导线上转移电子1 mol,则生成银1mol×108g/mol=108g。
24. 铜棒上有无色气体生成,铝棒不断溶解 负 Al-3e-=Al3+ 2Al + 2OH -+2H2O=2AlO2- + 3H2↑ 负 Al-3e-+4OH-=AlO2-+2H2O 正
【分析】(1)铜棒和铝棒与稀盐酸构成原电池,铝比铜活泼,铝棒失电子作负极,铜作正极;(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝能够与氢氧化钠溶液反应,铜不能;(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,铜能够溶于浓硝酸;结合原电池原理分析解答。
【详解】(1)铜棒和铝棒与稀盐酸构成原电池,铝比铜活泼,铝棒失电子作负极,铝逐渐溶解,铜作正极,正极上氢离子得电子生成氢气,所以铜棒上有无色气体生成,铝的电极反应式为Al-3e-=Al3+,故答案为铜棒上有无色气体生成,铝棒不断溶解;负;Al-3e-=Al3+;
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝能够与氢氧化钠溶液反应,反应的离子方程式为2Al + 2OH -+2H2O=2AlO2- + 3H2↑,铜不能,铝棒失电子作负极,Al在碱性条件下生成AlO2-,则铝电极的电极反应方程式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为2Al + 2OH -+2H2O=2AlO2- + 3H2↑;负;Al-3e-+4OH-=AlO2-+2H2O;
(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,铜能够溶于浓硝酸,因此Cu失电子作负极,铝作正极,故答案为正。
【点睛】本题的难点是(2)中负极反应式的书写,可以首先书写正极反应式,再根据负极反应式=总反应-正极反应式书写。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
A.石墨Ⅰ极为正极,石墨Ⅱ极为负极
B.Y的化学式可能为NO
C.石墨Ⅰ极的电极反应式为NO2+NO3--e-===N2O5
D.石墨Ⅱ极上发生氧化反应
2.根据工业上离子交换膜法制烧碱的方法,可以用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。下列说法错误的是
A.该电解槽的阳极反应式为2H2O-4e-=4H++O2↑
B.制得的氢氧化钾溶液从出口D导出
C.通电开始后,阴极附近溶液pH增大
D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为O2+2H2O-4e-=4OH-
3.汽车尾气中的NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由Rh、Pd、Pt等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析正确的是
A.催化剂能改变 B.NOx发生了氧化反应
C.CO转化为CO2时,转化为 D.的水溶液能导电,为电解质
4.下列说法不正确的是
A.汽车尾气中有NOx ,主要是汽油不充分燃烧引起的
B.日用铝制品表面覆盖着氧化膜,对金属起保护作用
C.实验室常用粗锌和稀硫酸反应制取H2
D.从海水中提取溴的过程涉及氧化还原反应
5.一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为:。该装置工作时,下列叙述正确的是
A.Al电极区的电极反应式:
B.Al为正极
C.每消耗27gAl,有通过溶液转移到石墨电极上
D.若采用“食盐水+NaOH溶液”作电解质溶液,电极反应式相同
6.已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2 放热。关于下列ΔH的判断正确的是
CO(aq)+H+(aq) HCO (aq) ΔH1
HCO (aq)+H+(aq) H2CO3(aq) ΔH2
H2CO3(aq) H2O(l)+CO2(g) ΔH3
OH-(aq)+H+(aq) H2O(l) ΔH4
A.ΔH1<0 ΔH2>0 B.ΔH1+ΔH2>0
C.ΔH1+ΔH2+ΔH3>0 D.ΔH2<ΔH4
7.断开1 mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A—B键的键能。已在H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1,推求N≡N键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.1130 kJ·mol-1
8.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法。下列叙述错误的是
A.电镀铜时,只能选用氯化铜溶液作电解质溶液
B.镀层金属通常是在空气或溶液里不易起变化的金属或合金
C.电镀的方法可以应用在铜的精炼上
D.电镀的主要目的之一是使金属增强抗腐蚀的能力
9.周期表中ⅥA族元素及其化合物应用广泛。用硫黄熏蒸中药材的传统由来已久;是一种易燃的有毒气体(燃烧热为),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯()常作氯化剂或氯磺化剂。硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性溶液制备Te。下列化学反应表示正确的是
A.的燃烧:
B.和浓硫酸反应:
C.电解强碱性溶液的阴极反应:
D.向溶液中滴加足量溶液,有白色沉淀生成:
10.已知:①能量越低的物质越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定 B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相似 D.红磷容易发生自燃而白磷不会自燃
11.锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是
A.放电过程中,a电极的电极反应式为2H2O + Mn2+ - 2e- = MnO2 + 4H+
B.放电过程中,转移 0.4 mol e-时,b电极消耗 0.8 mol OH-
C.充电过程中,b电极接外接电源的正极
D.充电过程中,b电极反应为:Zn2+ + 2e-= Zn
12.已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(l) △H = -285.8kJ/mol
当1mol液态水变为水蒸气时,其热量变化是
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
13.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2Ag2O+Zn+H2O。在此电池放电时,负极上发生反应的物质是
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
14.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将和转化为和燃料()。下列说法正确的是
A.该装置将化学能转化为光能和电能
B.电极的反应为
C.每生成,有被还原
D.该装置工作时,从极区向极区迁移
二、填空题
15.(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。则正极的反应式是___________,负极的反应式是___________。放电时负极附近的溶液的碱性________(填“不变”、“变大”或“变小”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示:
电池工作时,外电路上电流的方向应从电极________(填A或B)流向用电器。内电路中,CO32-向电极___________(填A或B)移动,电极A上CO参与的电极反应为___________。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲醇(CH3OH)和氧气构成燃料电池,则通入甲醇的电极是原电池的____极,该极的电极反应式是____________,通入氧气的电极是原电池的____极,电极反应式是___________________。如果消耗甲醇160 g,假设化学能完全转化为电能,则转移电子的数目为_______________(用NA表示)。
16.(1)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2.写出B的电极反应式___________;该电池在工作时,A电极的质量将___________(填“增加”或“减少”或“不变”)。
(2)一种新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,电池的主要构成要素如图所示,请回答下列问题:
①该装置的能量转化形式为___________。
②a电极为燃料电池的___________极,该电极的电极反应式为___________。
③电池工作时,H+由___________电极(填“a”或“b”,下同)移向___________电极。
④生成3.3g乙醛时,需要消耗标准状况下的氧气___________mL。
17.如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:
(1)电源B极的名称是________。
(2)乙装置中电解反应的总化学方程式是________________________。
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
18.写出下列反应的热化学方程式:
(1)N2(g)和H2(g)反应生成1mol NH3(g),放出46.1kJ热量_____。
(2)46g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出1366.8 kJ热量_____。
(3)已知断裂1molH2(g)中的H-H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中1molH-O键能放出463kJ的能量,试着写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式________。.
(4)到目前为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式______。
19.电解装置如图所示:
(1)当用惰性电极电解时,c为_______极,电极反应_______,d为_______极,电极反应_______,电解总反应的化学方程_______
(2)若用此装置进行铁上镀铜则c为_______(填铁或铜)电解液浓度_______(增大,减小或不变)
(3)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子_______mol。
(4)若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极_______(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______(填离子符号)形式进入溶液,c电极发生的反应_______
20.金属的腐蚀可分为化学腐蚀和电化学腐蚀。下列腐蚀类型中
①铜板在氯化铁溶液中被腐蚀②钢铁在空气中生锈而被腐蚀③化工厂里的铁与氯气反应被腐蚀④铜铝电线接头处铝被腐蚀⑤高温下铁丝被氧气腐蚀⑥铜在空气中生成铜绿而被腐蚀
(1)属于化学腐蚀是_______________(填序号,下同)。
(2)属于电化学腐蚀的是_______________。
21.工业合成氨中氢气的重要来源是水煤气,有关反应如下:①;②,它们的能量变化如图所示。
(1)写出图1表示的反应的热化学方程式:_______。
(2)_______。
(3)已知几种共价键的键能如表所示:
化学键 CO
a 799 1076 465
则a为_______。
(4)在恒容密闭容器中发生反应:。达到平衡后,改变条件使CO的平衡转化率增大,则该反应的_______(填“增大”“减小”或“不变”)。
22.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒 b.锌板 c.铜板 d.钠块
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为__________
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________。
③0.4molCuSO4和0.4molNaCl溶于水,配成1L溶液,用该镁燃料电池用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是_________________;
②电镀结束后,装置Ⅰ中溶液的pH_____________;(填写“变大”“变小”或“不变”)装置Ⅱ中Cu2+的物质的量浓度_______________;(填写“变大”“变小”或“不变”)
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标况)。
23.完成下列问题:
Ⅰ.
(1)若A为Zn,B为Cu,溶液C为硫酸溶液,则正极上发生的电极反应式:_______,溶液中移向_______(填“正极”或“负极”)。
(2)若A为Al,B为Mg,溶液C为氢氧化钠溶液,则正极是_______(填“Mg”或“Al”)。
Ⅱ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个化学电池(正极材料用碳棒),回答下列问题:
(3)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(4)若导线上转移电子1mol,则生成银_______g.
24.如右图所示:
(1)将铜棒和铝棒用导线连接后置于盛稀盐酸的烧杯中,看到的现象是________。铝棒做________极,该极的电极反应方程式为__________。
(2)如果将盐酸换成NaOH溶液,该电池发生的总反应离子方程式为____________。此时铝棒做________极,该极的电极反应方程式为_____________。
(3)如果将盐酸换成浓硝酸溶液,则铝棒做________极。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】在燃料电池中通入氧气的为正极,通入燃料的为负极,由图可知,石墨Ⅱ上氧气得到电子,则石墨Ⅱ为正极,石墨I上NO2失去电子,石墨I为负极,结合负极发生氧化反应、正极发生还原反应分析解答。
【详解】A.根据上述分析,石墨Ⅱ为正极,石墨I为负极,故A错误;
B.石墨I为负极,石墨I上NO2失去电子,N元素的化合价应从+4价升高,Y不可能为NO,故B错误;
C.石墨I上NO2失去电子,N元素的化合价升高,因此Y为N2O5,负极反应为NO2+NO3--e-═N2O5,故C正确;
D.石墨Ⅱ为正极,发生还原反应,故D错误;
答案选C。
2.D
【详解】A.左边电极连接电源正极,为电解槽的阳极,其电极反应式为↑,A正确;
B.右边电极是电解槽的阴极,阴极上水电离产生的氢离子得到电子变为氢气逸出,剩余氢氧根离子,溶液中的K+穿过阳离子交换膜进入到阴极室与OH-结合生成KOH溶液从出口D导出,B正确;
C.根据B选项分析,通电开始后,阴极生成KOH,使附近溶液pH增大,C正确;
D.若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极是O2得到电子发生还原反应,故正极的电极反应式为:,D错误;
故合理选项是D。
3.C
【详解】A.催化剂只能改变反应的活化能,不能改变反应的ΔH,A错误;
B.由图可知,NOx变为氮气,氮元素的化合价降低,得电子被还原,发生还原反应,B错误;
C.CO转化为CO2时,碳元素化合价升高,CeO2反应时得电子化合价降低生成CeO2-m,C正确;
D.NO2的水溶液能导电是因为NO2与水反应生成了硝酸,硝酸可以导电,NO2本身在水溶液中无法电离,不能导电,所以NO2为非电解质,D错误;
故答案选C。
4.A
【分析】
【详解】A.汽车尾气中的氮氧化物主要来自于燃料气缸中氮气在放电情况下与氧气反应产生,汽油的不充分燃烧产生的是CO气体,A错误;
B.铝制品表面容易形成一层致密的氧化膜,使金属不被进一步腐蚀保护了内层金属,B正确;
C.实验室制备氢气用粗锌和稀硫酸反应,目的是粗锌中杂质和锌构成原电池,加快反应的速率,C正确;
D.海水中存在溴离子,提取成溴单质一定要涉及氧化还原反应,D正确;
故选A。
5.A
【分析】放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,MnO2得电子,石墨为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3,结合原电池原理分析解答。
【详解】A.MnO2得电子为正极,则Al为负极,失电子,在氨水溶液中Al失电子生成Al(OH)3,负极电极反应式为,选项A正确;
B.根据上述分析,石墨为正极,Al为负极,选项B错误;
C.电子从负极流向正极,但是电子只能在导线和电极上移动,不能通过溶液,选项C错误;
D.若采用食盐水+NaOH溶液作电解质溶液,负极生成的氢氧化铝会被氢氧化钠溶解,电极反应式不同,选项D错误;
答案选A。
6.B
【分析】由题意可知,碳酸氢钠溶液与盐酸反应生成二氧化碳的反应为吸热反应,△H'>0,碳酸钠溶液与盐酸反应生成二氧化碳的反应为放热反应,△H''<0,将已知反应依次编号为①②③④,由盖斯定律可知,②+③可得HCO3-(aq)+H+(aq) H2O(l)+CO2(g) △H'=△H2+△H3>0,①+②+③可得CO32-(aq)+2H+(aq) H2O(l)+CO2(g)△H''=△H1+△H2+△H3<0,②-④可得碳酸氢根离子的水解反应HCO3-(aq)+ H2O(l) H2CO3(aq)+OH-(aq),盐类水解反应为吸热反应,则△H'''=△H2—△H4>0。
【详解】A.由分析可知,△H2+△H3>0,△H1+△H2+△H3<0,则△H1<0;碳酸的分解反应为吸热反应,△H3>0,由△H2+△H3>0可知,△H2可能大于0,也可能小于0,A项错误;
B.由分析可知,△H2+△H3>0,B项正确;
C.由分析可知,△H1+△H2+△H3<0,C项错误;
D.由分析可知,△H2-△H4>0,则△H2>△H4,D项错误;
答案选B。
7.B
【详解】已知:H﹣H键能为436kJ/mol,H﹣N键能为391kJ/mol,令N≡N的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=﹣92kJ/mol,反应热=反应物的总键能﹣生成物的总键能,故x+3×436kJ/mol﹣2×3×391kJ/mol=﹣92kJ/mol,解得:x="946" kJ/mol。
故选B。
8.A
【详解】A.电镀铜时,可以选用可溶性铜盐作电解质溶液,不一定要选用氯化铜溶液,故A错误;
B.电镀的主要目的之一是使金属增强抗腐蚀的能力,镀层金属通常是在空气或溶液里不易起变化的金属或合金,故B正确;
C.电镀和精炼铜都是电解原理的应用,都是在阴极上析出金属,故C正确;
D.电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,电镀是应用电解原理在某些金属表面镀上一薄层其他金属的方法,故D正确;
故选A。
9.D
【详解】A.利用已知条件中的数据进行计算,要注意应为液态,选项A错误;
B.有强还原性,浓硫酸有强氧化性,二者不能共存,选项B错误;
C.强碱性溶液中发生反应的离子方程式不应用表示,选项C错误;
D.因足量,与应为等物质的量参与反应,选项D正确;
答案选D。
10.A
【详解】A.白磷转化成红磷是放热反应,说明红磷能量比白磷低,红磷比白磷稳定,A正确;
B.红磷能量比白磷低,红磷稳定,B错误;
C.已知信息不能得出红磷和白磷的结构相似,且红磷和白磷的结构不同,C错误;
D.红磷的着火点比白磷高,故白磷比红磷更易燃,D错误;
故答案选D。
11.B
【分析】由图像可得该电池放电时,b电极为负极,电极反应式为:,a点击为正极,电极反应式为:,充电时则a电极做阳极,b电极做阴极。
【详解】A.放电时a电极做正极,发生还原反应,而不是失电子得氧化反应,A错误;
B.放电时b电极得反应为,则反应转移0.4mol电子时,b电极参与反应得氢氧根得物质的量,B正确;
C.放电时b电极做负极,充电时b电极做阴极,外接电源得负极,C错误;
D.b电极环境为碱性溶液,锌离子无法稳定存在,D错误;
故选B。
12.D
【详解】由盖斯定律,反应1+反应2得到H2O(g)= H2O(l) △H =+241.8+(-285.8) =-44 kJ/mol,所以H2O(l)= H2O(g) △H =+44 kJ/mol,当1mol液态水变为水蒸气时,吸热44KJ,故选:D。
13.D
【详解】电池放电时为原电池,负极物质化合价升高,失去电子,放电过程为从右往左进行,根据Zn的化合价由0价升高到+2价可知,Zn在负极上发生氧化反应,则负极上发生反应的物质是Zn,答案选D。
14.D
【详解】A.该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,A错误;
B. a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,B错误;
C.电池总的方程式为:6CO2+8H2O2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,每生成,有被还原,C错误;
D.a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以该装置工作时H+从阳极b极区向阴极a极区迁移,D正确;
答案选D。
15. 2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH- Cd-2e-+2OH-=Cd(OH)2 变小 B A CO-2e-+CO32-=2CO2 负极 CH3OH-6e-+8OH-=CO32-+6H2O 正极 O2+4e-+2H2O=4OH- 30NA
【分析】(1)放电过程为原电池反应,根据总反应化学方程式分析,Cd作原电池负极,失电子,在碱性溶液中生成Cd(OH)2;NiO(OH)在碱溶液中得到电子发生还原反应生成Ni(OH)2,根据氢氧根离子浓度变化判断溶液酸碱性的变化;
(2)分析熔融碳酸盐燃料电池原理示意图,通入氧气的一端为原电池正极,通入一氧化碳和氢气的一端为负极,电流从正极流向负极,溶液中阴离子移向负极,A电极上一氧化碳失电子发生氧化反应生成二氧化碳;
(3)甲醇、氧气和氢氧化钾溶液构成燃料电池,甲烷易失电子发生氧化反应,则甲烷所在电极为负极,氧气所在电极为正极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,在得失电子相等的条件下,将电极反应式相加即得电池反应式,结合电极反应和电子守恒计算。
【详解】(1)放电过程为原电池反应,根据总反应化学方程式Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2可知:NiO(OH)在碱溶液中得到电子发生还原反应生成Ni(OH)2,所以正极电极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-;Cd作原电池负极,失电子在碱性溶液中生成Cd(OH)2,负极电极反应为:Cd-2e-+2OH-=Cd(OH)2,由于放电时负极不断消耗OH-,因此附近溶液在c(OH-)逐渐降低,溶液的碱性逐渐变小;
(2)分析熔融碳酸盐燃料电池原理示意图,通入O2的一端为原电池正极,通入CO和H2的一端为负极,电流从正极流向负极,电池工作时,外电路上电流的方向应从电极B流向用电器,内电路中,CO32-向负极A电极移动,电极A上CO参与的电极反应,CO失电子发生氧化反应生成CO2,该电极反应为:CO-2e-+CO32-=2CO2;
(3)CH3OH、O2和KOH溶液构成燃料电池,CH3OH易失电子发生氧化反应,通入CH3OH的电极为负极,CH3OH失去电子被氧化,与溶液中的OH-结合形成H2O,负极上电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;通入O2的电极为正极,O2得到电子,与溶液中的H2O结合形成OH-,正极上电极反应式为为O2+4e-+2H2O=4OH-。160 g甲醇的物质的量是n(CH3OH)==5 mol,根据负极反应式可知:每1 mol甲醇发生反应,转移电子的物质的量是6 mol,则反应的甲醇物质的量是5 mol,则转移电子数目为N(e-)=5 mol×6NA/mol=30NA。
【点睛】本题考查了化学电源新型电池,根据原电池中负极失去电子,发生氧化反应;正极上得到电子,发生还原反应,溶液中阳离子向正极定向移动,阴离子向负极定向移动。结合电解质溶液书写电极反应式。在燃料电池中通入燃料的电极为负极,通入氧气的电极为正极,注意碱性条件下甲醇失电子不能生成氢离子,要生成碳酸根离子,为易错点。
16. 2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+) 减小 化学能转化为电能 正 b a 840
【分析】A为Cu,铜作还原剂,作原电池的负极,B为石墨,铁离子得电子,作正极,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=2FeCl2+CuCl2;新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,a电极为燃料电池的正极,氧气得电子,发生还原反应,乙烯失电子,b极作负极。
【详解】(1)若A为Cu,铜作还原剂,作原电池的负极,B为石墨,铁离子得电子,作正极,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=2FeCl2+CuCl2,B的电极反应式2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+);该电池在工作时,Cu-2e-=Cu2+,A电极的质量将减小(填“增加”或“减少”或“不变”)。故答案为:2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+);减小;
(2)①该装置为燃料电池,能量转化形式为化学能转化为电能。故答案为:化学能转化为电能;
②a电极为燃料电池的正极,氧气得电子,发生还原反应,该电极的电极反应式为。故答案为:正;;
③a为正极,b为负极,电池工作时,阳离子移向正极,H+由b电极(填“a”或“b”,下同)移向a电极。故答案为:b;a;
④由方程 ,生成3.3g乙醛时,物质的量为=0.075mol,需要消耗标准状况下的氧气 =840mL,故答案为:840。
17. 负极 2NaCl+2H2O H2 ↑ +Cl2 ↑ + 2NaOH 1:2 银 AgNO3
【详解】试题分析:将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极显碱性,则F极反应为 ,F是阴极。所以电源B是负极、A是正极。
解析:根据以上分析,(1)电源B极的名称是负极。
(2)用惰性电极电解氯化钠溶液,阳极生成氯气,阴极生成氢气,乙装置中电解反应的总化学方程式是2NaCl+2H2O H2 ↑ +Cl2 ↑ + 2NaOH。
(3)甲装置C极反应式为 ,D极的极反应式为 ,根据电子守恒,两种物质的物质的量比是1:2。
(4)电镀时镀件作阴极、镀层金属作阳极,含有镀层金属的盐溶液作电解质,G是阳极、H是阴极,欲用丙装置给铜镀银,G应该是银,电镀液的主要成分是AgNO3。
点睛:电解池中阳极失电子发生氧化反应,阴极得电子发生还原反应,如乙池中E是阳极、F是阴极,E电极反应式是 ,F电极反应式是。
18. N2(g)+3H2(g)=2NH3(g) △H= 92.2kJ/mol C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol 2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1 Fe(s)+CO(g)═Fe(s)+CO2(g) △H= 11kJ/mol
【详解】(1)N2(g)与H2(g)反应生成1mol NH3(g),放出46.1kJ热量,则生成2mol NH3(g),放热92.2kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H= 92.2kJ/mol;故答案为:N2(g)+3H2(g)=2NH3(g) △H= 92.2kJ/mol;
(2)46g C2H5OH(l)物质的量为=1mol,1mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为: C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol;故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= 1366.8kJ/mol;
(3)已知2H2(g)+O2(g)═2H2O(g),△H=反应物的键能和 生成物的键能和=2×436kJ mol 1+498kJ mol 1 4×463kJ mol 1= 482kJ mol 1△H= 482kJ mol 1,O2(g)与H2(g)反应生成H2O(g)的热化学方程式为2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1,故答案为:2H2(g)+O2(g)═2H2O(g) △H= 482kJ mol 1;
(4)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1= 25kJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2= 47kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19kJ/mol
根据盖斯定律将方程式变形(3×① ② 2×③)得:Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1 △H2 2×△H3)= 11kJ/mol,故答案为:Fe(s)+CO(g)═Fe(s)+CO2(g) △H= 11kJ/mol。
19.(1) 阳极 4OH--4e-=O2↑+2H2O 阴极 2Cu2++4e-=2Cu 2CuSO4+2H2O2Cu+O2↑+2H2SO4
(2) 铜 不变
(3)0.25
(4) c Fe2+ Cu-2e-=Cu2+
【分析】根据电解装置图可知,当用惰性电极电解时,c与电源的正极相连,则c为阳极,d与电源的负极相连,则d为阴极;若用此装置进行铁上镀铜,阳极是镀层金属铜,c为 铜;阴极是镀件,d为 铁,电解液浓度 不变;电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来。
(1)
当用惰性电极电解时,c与电源正极相连,为阳极极,氢氧根失电子发生氧化反应,电极反应4OH--4e-=O2↑+2H2O,d与电源负极相连,为阴极极,铜离子得电子,发生还原反应,电极反应2Cu2++4e-=2Cu,电解总反应的化学方程2CuSO4+2H2O2Cu+O2↑+2H2SO4,故答案为:阳极;4OH--4e-=O2↑+2H2O;阴极;2Cu2++4e-=2Cu;2CuSO4+2H2O2Cu+O2↑+2H2SO4;
(2)
若用此装置进行铁上镀铜,阳极为镀层金属,阴极为待镀金属,则c为铜(填铁或铜)电解液浓度不变(增大,减小或不变),故答案为:铜;不变;
(3)
电镀一段时间后对电极进行称量发现两极质量差为16克,根据阳极:Cu-2e→Cu2+、阴极:Cu2++2e→Cu 两极质量差为128,当两极质量差为16克,说明转移的电子为×2=0.25mol。故答案为:0.25;
(4)
若用此装置进行粗铜的电解精炼。,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来,则要求粗铜板是图中电极c(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以Fe2+(填离子符号)形式进入溶液,c电极发生的反应Cu-2e-=Cu2+故答案为:c;Fe2+;Cu-2e-=Cu2+。
20.(1)①③⑤
(2)②④⑥
【分析】金属与接触到的物质直接发生氧化还原反应而被氧化损耗的过程叫做化学腐蚀;电化学腐蚀就是金属和电解质组成两个电极,组成腐蚀原电池;
①铜板在氯化铁溶液中被腐蚀,铜与氯化铁发生氧化还原反应,生成氯化铜与铁,属于化学腐蚀;
②钢铁在空气中生锈而被腐蚀,钢铁在潮湿的空气中,会在钢铁的表面产生一层水膜,这层水膜导致钢铁表面产生电化学腐蚀,属于电化学腐蚀;
③化工厂里的铁与氯气反应被腐蚀,铁与氯气直接反应而腐蚀会生成氯化铁,属于化学腐蚀;
④铜铝电线接头处铝被腐蚀,由于二者金属活泼性不同,产生电位差,形成原电池,属于电化学腐蚀;
⑤高温下铁丝被氧气腐蚀,铁和氧气在高温下生成四氧化三铁,属于化学腐蚀;
⑥铜在空气中生成铜绿而被腐蚀,铜在空气中的二氧化碳、氧气和水共同腐蚀下产生的一种被称作碱式碳酸铜的物质,属于电化学腐蚀。
【详解】(1)据分析可知,①③⑤为化学腐蚀,故答案为①③⑤。
(2)据分析可知,②④⑥为电化学腐蚀,故答案为②④⑥。
21. 90.3 449 不变
【分析】靠近纵坐标的为反应物,反应物总能量大于生成物总能量,为放热反应;反之为吸热反应。
【详解】(1)图(1)反应物为C和H2O,生成物为CO和H2,反应物总能量低于生成物总能量,故该反应为吸热反应,热化学方程式为, 故填:;
(2)同理可得图2的热化学方程式,由盖斯定律,将①和②相加消去CO得热化学方程式,故填:90.3;
(3)根据,=,解得a=449,故填:449。
(4)对于反应,该反应的反应热与物质的状态、各物质的系数有关,与平衡是否移动无关,故改变条件使CO转化率增大,不变,故填:不变。
22. b 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2↑ 5.6 O2 CH4-8e-+10OH-=CO32-+7H2O 变小 不变 1.12
【分析】(1)形成原电池时,Fe作正极被保护;活泼性比Fe强的金属作负极,被腐蚀。
(2)①原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此判断正负极。
②镁能和热水反应生成氢氧化镁和氢气。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积。
(3)II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2。
①装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,甲烷失电子和氢氧根离子反应生成碳酸根离子和水。
②装置Ⅰ中消耗氢氧化钾溶液PH减小,电镀过程中阳极上溶解的铜质量等于阴极上析出铜的质量。
③根据整个装置中电子转移相等计算消耗的甲烷的体积。
【详解】(1)该装置形成原电池,Fe作负极被保护,所以应该连接比Fe活泼的金属,故锌板。
故答案为:b;
(2)①电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为 1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,离子方程式为。
故答案为:负;。
②镁能和热水反应生成氢氧化镁和氢气而导致负极利用率降低,反应方程式为。
故答案为: 。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出铜的物质的量为0.3mol,阴极上转移电子的物质的量,根据原子守恒知,溶液中,氯离子完全放电时转移电子的物质的量,所以阳极上生成的气体是氯气和氧气,生成氯气的体积为0.2mol即4.48L。根据电极反应,,转移0.2mol电子,生成氧气的物质的量是0.05mol,即1.12L,所以另一个电极上生成的气体在标准状况下的体积是。
故答案为:5.6。
(3)①通过装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2 ,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为,
故答案为: O2;。
②根据I中电池反应为,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变。
故答案为:变小;不变。
③左边原电池和右边电解池转移电子数相等,所以消耗甲烷的体积。
故答案为:1.12。
【点睛】电解硫酸铜和氯化钠溶液时,阳极上Cl-先放电,然后OH-放电,阴极上Cu2+放电,后H+放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积。
23.(1) 2H++2e-=H2↑ 负极
(2)Mg
(3) Cu 氧化 AgNO3溶液
(4)108
【解析】(1)
若A为Zn,B为Cu,溶液C为硫酸溶液,Zn比Cu活泼,则Zn是负极,Zn转化成Zn2+,Cu是正极,H+转化成H2,故正极上发生的电极反应式2H++2e-=H2↑;原电池中阴离子向负极移动,故向负极移动;
(2)
若A为Al,B为Mg,溶液C为氢氧化钠溶液,Al与NaOH可以自发的发生氧化还原反应,故Al是负极,Mg是正极;
(3)
已知反应Cu+2Ag+=2Ag+Cu2+中Cu转化为Cu2+,化合价升高失去电子,发生氧化反应,故电池的负极反应式为:Cu-2e-=Cu2+,Ag+转化为Ag,化合价降低得到电子发生还原反应,故电池的正极反应式为:Ag++e-=Ag,则该电池的负极材料是Cu,发生氧化反应,电解质溶液是含有Ag+的电解质溶液,通常为AgNO3溶液;
(4)
根据电子守恒结合正极反应式Ag++e-=Ag可知若导线上转移电子1 mol,则生成银1mol×108g/mol=108g。
24. 铜棒上有无色气体生成,铝棒不断溶解 负 Al-3e-=Al3+ 2Al + 2OH -+2H2O=2AlO2- + 3H2↑ 负 Al-3e-+4OH-=AlO2-+2H2O 正
【分析】(1)铜棒和铝棒与稀盐酸构成原电池,铝比铜活泼,铝棒失电子作负极,铜作正极;(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝能够与氢氧化钠溶液反应,铜不能;(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,铜能够溶于浓硝酸;结合原电池原理分析解答。
【详解】(1)铜棒和铝棒与稀盐酸构成原电池,铝比铜活泼,铝棒失电子作负极,铝逐渐溶解,铜作正极,正极上氢离子得电子生成氢气,所以铜棒上有无色气体生成,铝的电极反应式为Al-3e-=Al3+,故答案为铜棒上有无色气体生成,铝棒不断溶解;负;Al-3e-=Al3+;
(2)铜棒和铝棒与氢氧化钠溶液构成原电池,铝能够与氢氧化钠溶液反应,反应的离子方程式为2Al + 2OH -+2H2O=2AlO2- + 3H2↑,铜不能,铝棒失电子作负极,Al在碱性条件下生成AlO2-,则铝电极的电极反应方程式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为2Al + 2OH -+2H2O=2AlO2- + 3H2↑;负;Al-3e-+4OH-=AlO2-+2H2O;
(3)铜棒和铝棒与浓硝酸构成原电池,铝遇到浓硝酸会钝化,铜能够溶于浓硝酸,因此Cu失电子作负极,铝作正极,故答案为正。
【点睛】本题的难点是(2)中负极反应式的书写,可以首先书写正极反应式,再根据负极反应式=总反应-正极反应式书写。
答案第1页,共2页
答案第1页,共2页
