第3章不同聚集状态的物质与性质同步练习(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章不同聚集状态的物质与性质同步练习(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 10:40:34 | ||
图片预览



文档简介
第3章不同聚集状态的物质与性质 同步练习
一、单选题
1.核磁共振氢谱是测定有机分子结构最有用的工具之一。在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物中氢原子的种类。下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是
A.CH3OH B.CH3CHO C.CH3COOH D.CH3COCH3
2.下列各物质中,按熔点由高到低的顺序排列正确的是
A.Rb>K>Na>Li
B.KCl>NaCl>MgCl2>MgO
C.石墨>金刚石>SiO2>钠
D.H2O>CH4>硫磺>H2
3.三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是
A.分子中的N原子为杂化
B.分子中不存在孤电子对
C.它的沸点比的沸点低
D.因的键能大,所以的沸点高
4.下列说法正确的是
A.分子晶体中,共价键键能越大,分子越稳定
B.由非金属元素组成的化合物一定是共价化合物
C.共价晶体中一定含有共价键,离子晶体中不可能含有共价键
D.分子晶体中一定存在共价键和范德华力
5.下列有关晶体的叙述中,错误的是
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.白磷分子晶体中,微粒之间通过共价键结合,键角为60°
C.在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl- (或Na+)
D.离子晶体在熔化时,离于键被破坏,而分子晶体熔化时,化学键不被破坏
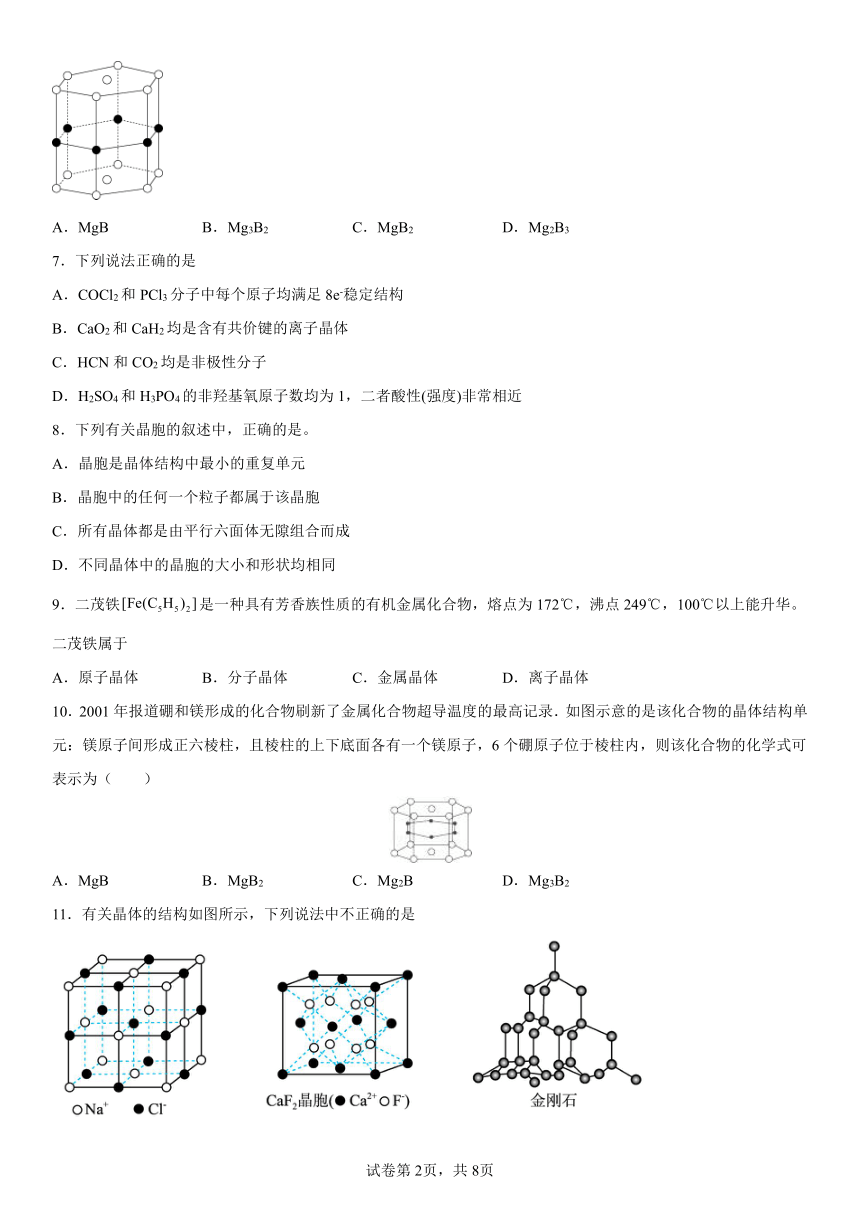
6.硼和镁可形成超导化合物。如图所示是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上、下面上还各有一个镁原子; 6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为
A.MgB B.Mg3B2 C.MgB2 D.Mg2B3
7.下列说法正确的是
A.COCl2和PCl3分子中每个原子均满足8e-稳定结构
B.CaO2和CaH2均是含有共价键的离子晶体
C.HCN和CO2均是非极性分子
D.H2SO4和H3PO4的非羟基氧原子数均为1,二者酸性(强度)非常相近
8.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
9.二茂铁是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上能升华。二茂铁属于
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
10.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
A.MgB B.MgB2 C.Mg2B D.Mg3B2
11.有关晶体的结构如图所示,下列说法中不正确的是
A.在晶体中,距最近且相等的有6个
B.在晶体中,每个晶胞平均占有4个
C.在金刚石晶体中,碳原子与碳碳键个数之比为1:2
D.晶体在熔融状态下不导电
12.CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2)制备CuCl的工艺流程如图1:
下列说法不正确的是
A.“浸取”时的离子方程式为
B.“滤渣①”的成分是Fe(OH)3
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质
D.CuCl的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是12
13.用石英和焦炭作为原料,可通过如下反应制备粗硅:SiO2(s)+2C(s)2CO(g)+Si(s)。下列有关说法错误的是
A.该制备反应是熵增过程 B.SiO2、CO均为分子晶体
C.该反应属于置换反应 D.每生成1mol,转移电子数约为2.408×1024
14.2022年北京冬奥会成功举办,本届冬奥会体现了科技创新与艺术设计的完美融合,下列说法错误的是
A.本次冬奥会衣物采用石墨烯纺织物柔性发热材料,石墨烯属于混合型晶体
B.速滑竞赛服使用了蜂窝样式的聚氨酯材料,聚氨酯属于有机高分子材料
C.冬奥会使用二氧化碳跨临界直冷制冰过程环保高效,涉及化学变化
D.采用氢燃料电池车,开发了全新的车载光伏发电系统,体现“绿色出行”的理念
15.下表给出几种氯化物的熔点和沸点:
NaCl MgCl2 AlCl3 SiCl4
熔点/℃ 801 714 190 -70
沸点/℃ 1413 1412 180 57.57
有关表中所列四种氯化物的性质,以下叙述正确的是
①氯化铝在加热时能升华
②四氯化硅在晶态时属于分子晶体
③氯化钠晶体中粒子之间以离子键结合
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式、键的极性、晶格能等影响
A.仅② B.仅③④ C.仅①②④ D.①②③④
二、填空题
16.铜与氧元素形成的晶胞如图所示:
晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(,,),则d的坐标参数为___,已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则晶胞参数为____cm(列出计算式即可)。
17.某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为___。
(2)已知: ,请写出A与稀、冷的KMnO4溶液在碱性条件下反应后产物的结构简式___。
(3)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式___。
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为___。
18.(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为________
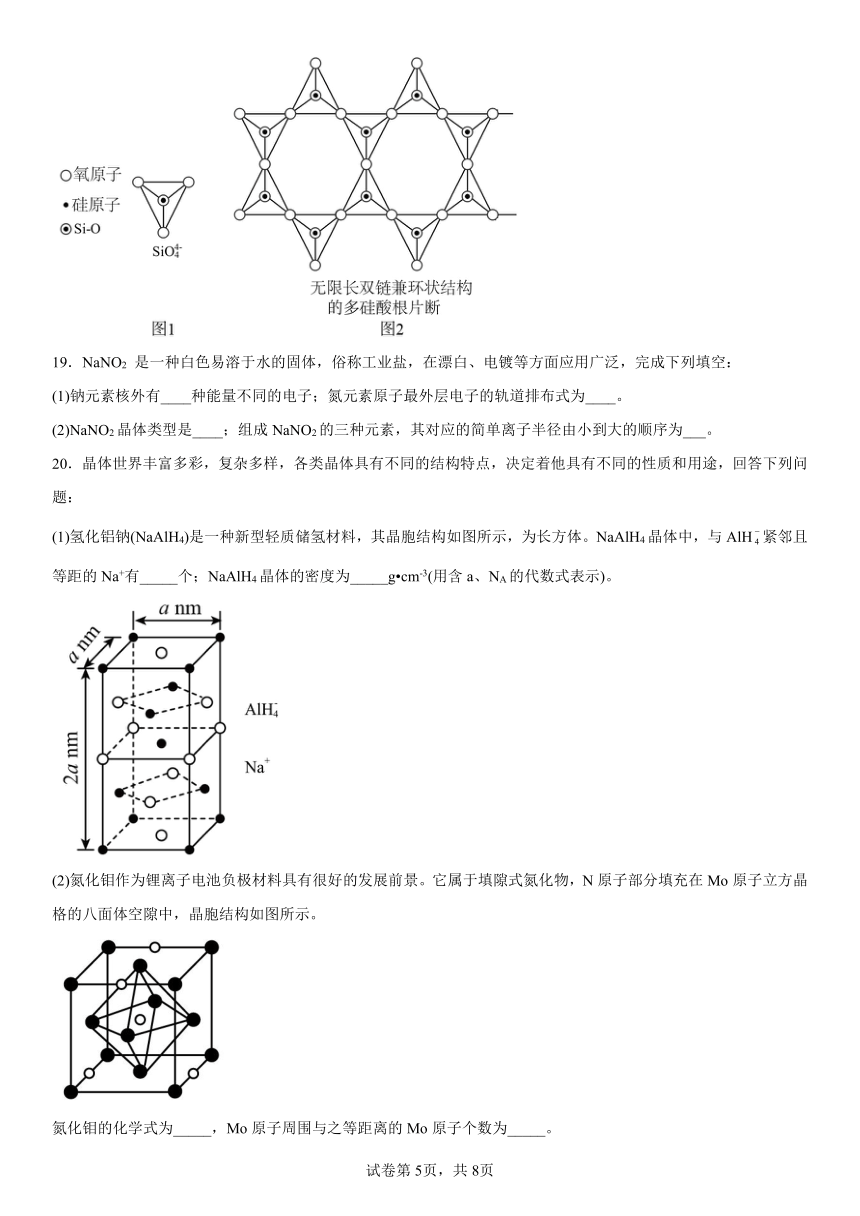
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为________(以含正整数 n 的代数式表示)。
19.NaNO2 是一种白色易溶于水的固体,俗称工业盐,在漂白、电镀等方面应用广泛,完成下列填空:
(1)钠元素核外有____种能量不同的电子;氮元素原子最外层电子的轨道排布式为____。
(2)NaNO2晶体类型是____;组成NaNO2的三种元素,其对应的简单离子半径由小到大的顺序为___。
20.晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与AlH紧邻且等距的Na+有_____个;NaAlH4晶体的密度为_____g cm-3(用含a、NA的代数式表示)。
(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
氮化钼的化学式为_____,Mo原子周围与之等距离的Mo原子个数为_____。
(3)ZnS的晶胞结构如图所示:晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为_____;已知ZnS的晶胞密度是ag/cm3,则Zn2+与S2-的最短距离为_____pm(用含a、NA的代数式表示)。
(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为_____。
21.按要求回答问题
(1)乙醇的沸点远高于环氧乙烷的沸点,原因是_______。
(2)一些氧化物的熔点如表所示:
氧化物
熔点/℃ 1570 1132 23.8 -75.5
解释表中氧化物之间熔点差异的原因_______。
22.各图为几种分子、晶体或晶胞的结构示意图。
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是_______、晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是_______。
(2)冰、金刚石、、、干冰5种晶体的熔点由高到低的顺序为_______。
(3)每个晶胞中实际占有_______个原子,每个MgO晶胞中实际占有_______个镁离子,晶体中每个周围距离最近且相等的有_______个。
(4)金刚石和晶体都是碳元素形成的单质,晶体中含键数目为_______。
23.晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为,密度为。
(1)晶胞中,位于各顶点位置,位于_______位置,两个之间的最短距离为_______。
(2)用、表示阿伏加德罗常数的值_______(列计算式)。
24.CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为(,,),则B、C的原子坐标参数分别为___。该晶胞中CdSe键的键长为___。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为___。
25.(1)在下列物质中,_______(填序号,下同)是晶体,_______是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有__________,而非晶体______________;另外非晶体具有物理性质__________的特点,而晶体具有物理性质__________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是__________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【分析】核磁共振氢谱图中,吸收峰的个数等于氢原子的种类,吸收峰的面积之比等于各种氢原子的个数之比。
【详解】A.CH3OH分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故A不符题意;
B.CH3CHO分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故B不符题意;
C.CH3COOH分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故C不符题意;
D.CH3COCH3分子中只有一种氢原子,在核磁共振氢谱中只给出一种峰(信号),故D符合题意;
答案选D。
2.C
【详解】A. 碱金属元素的单质其熔点从上到下逐渐减小,则熔点:Rb<K<Na<Li,A错误;
B. 离子晶体的中离子半径越小,所带电荷数越大,晶格能越大,熔点越高,则熔点:KCl<NaCl<MgCl2<MgO,B错误;
C. 石墨是混合型晶体,金刚石、二氧化硅是原子晶体,钠是金属晶体,碳原子半径小于硅原子半径,金刚石熔点大于二氧化硅,则熔点:石墨>金刚石>SiO2>钠,C正确;
D. 水分子间存在氢键,氢气的相对分子质量最小,硫磺常温下是固体,则熔点:硫磺>H2O>CH4>H2,D错误;答案选C。
3.C
【详解】A.NCl3中N原子与Cl原子形成3个δ键,N原子上还有一对孤电子对,N原子为杂化,故A错误;
B.三氯化氮(NCl3)中N原子最外层有5个电子,与3个Cl原子形成三个共用电子对,还有1个孤电子对,故B错误;
C.分子晶体的相对分子质量越大,分子间作用力就越大,沸点越高,所以它的沸点比PCl3沸点低,故C正确;
D.沸点属于物理性质,键能大小影响化学性质;分子晶体的相对分子质量决定其沸点,虽然N-Cl键能大,但NCl3沸点低,故D错误;
故选C。
4.A
【详解】A.分子晶体中,分子间作用力大的熔沸点高;共价键的键能越大,物质的分子稳定性越大,A正确;
B.由非金属元素组成的化合物可能是共价化合物,也可能是离子化合物,如HCl为共价化合物,NH4Cl为离子化合物,B错误;
C.共价晶体中一定含有共价键,离子晶体中可能含有共价键,如NaOH为离子晶体,阳离子Na+与阴离子OH-之间以离子键结合,在阴离子OH-中存在共价键,C错误;
D.分子晶体中一定存在范德华力,若物质分子是单原子分子,就不存在共价键;若为双原子或多原子分子,就存在共价键,因此分子晶体中不一定存在共价键,一定存在范德华力,D错误;
故合理选项是A。
5.B
【详解】白磷分子晶体中,分子中是共价键结合,微粒之间不是共价键结合,是分子间作用力,键角为60°,所以B错了。答案选B。
6.B
【详解】Mg原子处于晶胞顶点与面心上,顶点上Mg原子为6个晶胞共用,面心上的Mg原子为2个晶胞共用,B原子位于棱柱的侧棱上,为3个晶胞共用,故晶胞中Mg原子数目为,B原子数目为,Mg原子和B原子数目比为3:2,则其化学式为Mg3B2,故选B;
答案选B。
7.A
【详解】A.COCl2和PCl3都是共价化合物,电子式分别为、,可知每个原子均满足8e-稳定结构,故A项正确;
B.CaO2和CaH2都为离子晶体,电子式分别为、,所以CaH2中不含有共价键,故B项错误;
C.CO2空间结构对称,正电中心和负电中心重合为非极性分子;HCN空间结构不对称,正电中心和负电中心不重合为极性分子,故C项错误;
D.根据含氧酸分子中非羟基氧原子数越多,该含氧酸的酸性就越强。H2SO4中非羟基氧原子数为2,是强酸;H3PO4中非羟基氧原子数为1,是中强酸,二者酸性相差很大,故D项错误;
答案选A。
8.A
【详解】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
9.B
【详解】分子晶体一般具有熔点、沸点较低,易升华和熔融状态下不导电的特性,故由二茂铁是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上能升华,可以推断二茂铁属于分子晶体,故答案为:B。
10.B
【分析】利用均摊法先计算出镁原子与硼原子个数。再求出原子个数比即可解答。
【详解】处于六棱柱顶点上的镁原子同时为6个结构单元所共有,每个镁原子有属于该结构单元;处于面上的镁原子同时为2个结构单元所共有,每个镁原子有属于该结构单元;处于棱柱内的6个硼原子,则完全属于该结构单元。故每个结构单元中有镁原子:l2×+2×=3,有硼原子6个。故化学式可表示为MgB2。故B正确,ACD错误;
答案选B。
11.D
【详解】A.根据氯化钠晶体的结构图,在晶体中,距最近且相等的有6个,距最近且相等的有6个,故A正确;
B.根据均摊原则,在晶胞中,位于立方体的8个顶角和6个面心,所以的数目是,故 B正确;
C.金刚石晶体中,每个C原子形成4个共价键,两个C原子共用一个共价键,所以在金刚石晶体中,碳原子与碳碳键个数比为1:2,故C正确;
D.是离子化合物,在熔融状态下能够完全电离出自由移动的和,能够导电,故D错误;
选D。
12.B
【详解】A.“浸取”时,CuFeS2在酸性条件下与氧气发生氧化还原反应,反应的离子方程式为4CuFeS2+17O2+4H+=4Cu2++4Fe3++8SO+2H2O,A正确;
B.加入过量氧化铜调节pH的目的是将铁离子转化为氢氧化铁除去,因此“滤渣①"的成分是Fe(OH)3和过量的CuO,B不正确;
C."还原"时加入NaCl和浓盐酸主要是为了提供Cl-,跟铜元素形成可溶于水的物质,然后经过一系列操作得到CuCl,C正确;
D.由CuCl的晶胞图可知,每个氯离子周围与之距离最近的氯离子数目是12,D正确,
故选B。
13.B
【详解】A.该制备反应气体分子数增多,是熵增过程,A项正确;
B.SiO2为共价晶体,B项错误;
C.该反应是化合物和单质反应生成另一种化合物和单质,属于置换反应,C项正确;
D.硅元素从+4价降低至0价,则每生成1mol Si转移4mole-,其数目为:2.408×1024,D项正确;
故选:B。
14.C
【详解】A.石墨烯为新型无机非金属材料,属于混合型晶体,A正确;
B.聚氨酯材料为人工合成的高分子材料,属于合成有机高分子材料,B正确;
C.干冰气化吸热,使周围温度降低,从而制冰,该过程没有新物质生成,不涉及化学变化,C错误;
D.氢气燃烧生成水,不污染环境,采用氢燃料电池车,开发了全新的车载光伏发电系统,体现“绿色出行”的理念,D正确;
答案选C。
15.D
【详解】①由表格中的数据可知AlCl3的熔沸点较低,则AlCl3属于分子晶体,加热时能升华,①项正确;
②由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,②项正确;
③由表格中的数据可知,NaCl的沸点为1465℃,则属于离子晶体,粒子之间以离子键结合,③项正确;
④氯化镁的熔沸点比氯化钠的低,并且都属于离子晶体,所以主要是受堆积方式、键的极性、晶格能等影响,④项正确;
②③④正确;
答案选D。
16. (,,)
【详解】由晶胞示意图可知,位于顶点的a和体心的b的坐标参数依次为(0,0,0)、(,,),d位于体对角线的处,则d的坐标参数为(,,);晶胞中Cu原子的个数为4,O原子的个数为8×+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g·mol-1,设晶胞的参数为a,晶胞的质量为a3ρ=×144,则a=cm。
17. C8H8
【分析】某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。碳原子个数为=8,氢原子个数为=8,则分子式为C8H8,则其结构简式为。根据其结构分析。
【详解】(1)某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。碳原子个数为=8,氢原子个数为=8,则分子式为C8H8,则其结构简式为。
(2)根据已知分析,苯乙烯在该条件下连接碳碳双键的碳原子各上一个羟基,故结构简式为。
(3)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,则相对分子质量为,则分子式为C8H16,结构简式为;
(4)苯乙烯加聚生成聚苯乙烯,结构简式为。
18. AB (Si4O11)n6n
【详解】(1)根该晶体一截面上原子原子的排布情况可知,每一个A原子周围有2个B原子,每一个B原子周围有2个A原子,所以该晶体的化学式可以表示为AB。
(2)由许多四面体构成,每个Si与周围4个氧原子形成四面体,取图中所示结构单元:,结构单元中处于共用边上的O原子为每个结构单元提供,处于结构单元内的氧原子有9个,其中4个的投影与Si重合,故结构单元共用氧原子数目为9+4×=11,结构单元内Si原子4个,结构单元化合价为:(-2)×11+(+4)×4=-6,故该多硅酸根离子的化学式通式为(Si4O11)n6n。
19. 4 离子晶体 r(Na+)【详解】(1)Na为11号元素,其核外电子排布式为,即Na原子核外有4个不同的能级,则有4种不同能量的电子;N为7号元素,核外有2个电子层,最外层有5个电子,则最外层的电子排布式为,则其轨道排布式为,故答案为:4;;
(2) NaNO2属于离子化合物,所以属于离子晶体;组成NaNO2的三种元素,其对应的简单离子分别为,均为10电子结构,由具有相同电子层结构的离子“序小径大”,所以离子半径大小关系为r(Na+)20.(1) 8
(2) Mo2N 12
(3) 50% ×1010
(4)(0.3333,0.6667,0.6077)
【详解】(1)观察体心的,可以看出与紧邻且等距的Na+有8个;在一个晶胞中,Na+有6×+4×=4,Na+和个数相等,所以一个晶胞的质量为=,晶胞的体积为a2×2anm3=2a3nm3=2a3×10-21cm3,所以NaAlH4晶体的密度为=g/cm3。
(2)从晶胞结构可以看出,Mo原子位于顶点和面心,共有=4个Mo原子,氮原子部分填充在Mo原子立方晶格的八面体空隙中,氮原子共有=2个,所以氮化钼的化学式为Mo2N,从晶胞结构可以看出,Mo原子周围与之等距离的Mo原子有12个。
(3)Zn2+位于立方体的顶点和面心,能够围成八个四面体空隙,S2-在晶胞内部只有4个,所以四面体空隙的填充率为50%;在一个晶胞中,Zn2+个数为8×+6×=4,S2-个数为4,所以一个晶胞的质量为g=g,晶胞密度为ag/cm3,则晶胞的体积为cm3,晶胞的边长为pm,Zn2+与S2-的最短距离为体对角线的四分之一,所以Zn2+与S2-的最短距离为×1010pm。
(4)Co的晶胞可以看做是由两个正三棱柱构成的,1和2号氧原子分别位于两个正三棱柱里,晶胞含对称中心,1号氧原子的分数坐标为(0.6667,0.3333,0.1077),则2号O原子的分数坐标为(0.3333,0.6667,0.6077)。
21.(1)乙醇分子间存在氢键,而环氧乙烷分子间不存在氢键
(2)Li2O、Na2O为离子晶体,熔点与离子键有关,离子半径Li+Na2O;P4O6、SO2为分子晶体,分子间作用力与相对分子质量有关,故P4O6>SO2,离子晶体熔化破坏离子键作用力大于分子晶体的分子间作用力,所以熔点:Li2O>Na2O>P4O6>SO2
【解析】(1)
由于乙醇中含有羟基,羟基与羟基之间能够形成氢键,而环氧乙烷中不含羟基,没有分子间氢键,则导致乙醇的沸点远高于环氧乙烷的沸点,故答案为:乙醇分子间存在氢键,而环氧乙烷分子间不存在氢键;
(2)
已知Li2O、Na2O是由阴、阳离子构成的离子晶体,熔点与离子键有关,离子半径Li+Na2O,而P4O6、SO2是由分子构成的分子晶体,熔点与分子间作用力有关,分子间作用力与相对分子质量成正比,故P4O6>SO2,离子晶体熔化破坏离子键作用力大于分子晶体的分子间作用力,所以Li2O>Na2O>P4O6>SO2,故答案为:Li2O、Na2O为离子晶体,熔点与离子键有关,离子半径Li+Na2O;P4O6、SO2为分子晶体,分子间作用力与相对分子质量有关,故P4O6>SO2,离子晶体熔化破坏离子键作用力大于分子晶体的分子间作用力,所以熔点:Li2O>Na2O>P4O6>SO2。
22.(1) 干冰晶体 冰晶体
(2)金刚石冰干冰
(3) 4 4 8
(4)
【详解】(1)根据各晶体的构成和分析,分子晶体中粒子之间为范德华力,构成晶体的粒子之间主要以范德华力结合形成的晶体是干冰晶体、冰晶体;故答案为:干冰晶体;冰晶体;
(2)熔点的一般规律:共价晶体>离子晶体>分子晶体,再结合晶体微粒作用力可得,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石冰干冰,故答案为:金刚石冰干冰;
(3)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为=4;MgO晶胞中Mg2+位于棱上与体心,晶胞中Mg2+数目为1+12×=4,;在CaCl2晶体中,每个Cl-周围最近距离的Ca2+分布在一个顶点以及和这个顶点相连的三个面的面心上,一共是4个,每个Ca2+被8个Cl-所包围,故答案为:4:4:8;
(4)C60晶体中,每2个C原子形成一个π键,则1mol C60晶体中含π键数目为1mol×60××NAmol-1=30NA,故答案为:30NA。
23.(1) 面心
(2)
【详解】(1)Na3OCl晶体结构中空心白球类原子6×=3、顶点阴影球类原子8×=1、实心黑球类原子1×1=1、根据Na3OCl化学式,可判断钠原子应为空心白球处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的倍,所以两个Na之间的最短距离为;
(2)已知:晶胞参数为anm,密度为,,则。
24. B(,,),C(,,) anm ×100%
【详解】原子坐标参数A为(,,),根据0点定位,则B、C的原子坐标参数分别为B(,,),C(,,);设该晶胞中CdSe键的键长为x,设体对角线为y,x=y,则y2=(a)2+(a)2+(a)2,则x=a;在晶胞中,Cd原子数为×8+×6=4,Se原子数为4,已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为= =×100%;
25. ②⑤⑥⑧⑨ ①③④⑦⑩ 规则的几何外形 没有规则的几何外形 各向同性 各向异性 ②④
【详解】(1)明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体,即②⑤⑥⑧⑨;塑料、松香、玻璃、石蜡、橡胶都是非晶体,即①③④⑦⑩;
(2)晶体和非晶体在外形上有差别,晶体都具有规则的几何外形;而非晶体没有规则的几何外形;另外非晶体具有物理性质各向同性的特点,而晶体具有物理性质各向异性的特点;
(3)晶体的重要特征就是各向异性和有固定的熔点,因此判断物质是晶体还是非晶体可②从各向异性或各向同性上来判断,④从有无固定熔点来判,即②④。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.核磁共振氢谱是测定有机分子结构最有用的工具之一。在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物中氢原子的种类。下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是
A.CH3OH B.CH3CHO C.CH3COOH D.CH3COCH3
2.下列各物质中,按熔点由高到低的顺序排列正确的是
A.Rb>K>Na>Li
B.KCl>NaCl>MgCl2>MgO
C.石墨>金刚石>SiO2>钠
D.H2O>CH4>硫磺>H2
3.三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是
A.分子中的N原子为杂化
B.分子中不存在孤电子对
C.它的沸点比的沸点低
D.因的键能大,所以的沸点高
4.下列说法正确的是
A.分子晶体中,共价键键能越大,分子越稳定
B.由非金属元素组成的化合物一定是共价化合物
C.共价晶体中一定含有共价键,离子晶体中不可能含有共价键
D.分子晶体中一定存在共价键和范德华力
5.下列有关晶体的叙述中,错误的是
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.白磷分子晶体中,微粒之间通过共价键结合,键角为60°
C.在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl- (或Na+)
D.离子晶体在熔化时,离于键被破坏,而分子晶体熔化时,化学键不被破坏
6.硼和镁可形成超导化合物。如图所示是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上、下面上还各有一个镁原子; 6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为
A.MgB B.Mg3B2 C.MgB2 D.Mg2B3
7.下列说法正确的是
A.COCl2和PCl3分子中每个原子均满足8e-稳定结构
B.CaO2和CaH2均是含有共价键的离子晶体
C.HCN和CO2均是非极性分子
D.H2SO4和H3PO4的非羟基氧原子数均为1,二者酸性(强度)非常相近
8.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
9.二茂铁是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上能升华。二茂铁属于
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
10.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
A.MgB B.MgB2 C.Mg2B D.Mg3B2
11.有关晶体的结构如图所示,下列说法中不正确的是
A.在晶体中,距最近且相等的有6个
B.在晶体中,每个晶胞平均占有4个
C.在金刚石晶体中,碳原子与碳碳键个数之比为1:2
D.晶体在熔融状态下不导电
12.CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2)制备CuCl的工艺流程如图1:
下列说法不正确的是
A.“浸取”时的离子方程式为
B.“滤渣①”的成分是Fe(OH)3
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质
D.CuCl的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是12
13.用石英和焦炭作为原料,可通过如下反应制备粗硅:SiO2(s)+2C(s)2CO(g)+Si(s)。下列有关说法错误的是
A.该制备反应是熵增过程 B.SiO2、CO均为分子晶体
C.该反应属于置换反应 D.每生成1mol,转移电子数约为2.408×1024
14.2022年北京冬奥会成功举办,本届冬奥会体现了科技创新与艺术设计的完美融合,下列说法错误的是
A.本次冬奥会衣物采用石墨烯纺织物柔性发热材料,石墨烯属于混合型晶体
B.速滑竞赛服使用了蜂窝样式的聚氨酯材料,聚氨酯属于有机高分子材料
C.冬奥会使用二氧化碳跨临界直冷制冰过程环保高效,涉及化学变化
D.采用氢燃料电池车,开发了全新的车载光伏发电系统,体现“绿色出行”的理念
15.下表给出几种氯化物的熔点和沸点:
NaCl MgCl2 AlCl3 SiCl4
熔点/℃ 801 714 190 -70
沸点/℃ 1413 1412 180 57.57
有关表中所列四种氯化物的性质,以下叙述正确的是
①氯化铝在加热时能升华
②四氯化硅在晶态时属于分子晶体
③氯化钠晶体中粒子之间以离子键结合
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式、键的极性、晶格能等影响
A.仅② B.仅③④ C.仅①②④ D.①②③④
二、填空题
16.铜与氧元素形成的晶胞如图所示:
晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(,,),则d的坐标参数为___,已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则晶胞参数为____cm(列出计算式即可)。
17.某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为___。
(2)已知: ,请写出A与稀、冷的KMnO4溶液在碱性条件下反应后产物的结构简式___。
(3)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式___。
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为___。
18.(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为________
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为________(以含正整数 n 的代数式表示)。
19.NaNO2 是一种白色易溶于水的固体,俗称工业盐,在漂白、电镀等方面应用广泛,完成下列填空:
(1)钠元素核外有____种能量不同的电子;氮元素原子最外层电子的轨道排布式为____。
(2)NaNO2晶体类型是____;组成NaNO2的三种元素,其对应的简单离子半径由小到大的顺序为___。
20.晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与AlH紧邻且等距的Na+有_____个;NaAlH4晶体的密度为_____g cm-3(用含a、NA的代数式表示)。
(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
氮化钼的化学式为_____,Mo原子周围与之等距离的Mo原子个数为_____。
(3)ZnS的晶胞结构如图所示:晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为_____;已知ZnS的晶胞密度是ag/cm3,则Zn2+与S2-的最短距离为_____pm(用含a、NA的代数式表示)。
(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为_____。
21.按要求回答问题
(1)乙醇的沸点远高于环氧乙烷的沸点,原因是_______。
(2)一些氧化物的熔点如表所示:
氧化物
熔点/℃ 1570 1132 23.8 -75.5
解释表中氧化物之间熔点差异的原因_______。
22.各图为几种分子、晶体或晶胞的结构示意图。
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是_______、晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是_______。
(2)冰、金刚石、、、干冰5种晶体的熔点由高到低的顺序为_______。
(3)每个晶胞中实际占有_______个原子,每个MgO晶胞中实际占有_______个镁离子,晶体中每个周围距离最近且相等的有_______个。
(4)金刚石和晶体都是碳元素形成的单质,晶体中含键数目为_______。
23.晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为,密度为。
(1)晶胞中,位于各顶点位置,位于_______位置,两个之间的最短距离为_______。
(2)用、表示阿伏加德罗常数的值_______(列计算式)。
24.CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为(,,),则B、C的原子坐标参数分别为___。该晶胞中CdSe键的键长为___。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为___。
25.(1)在下列物质中,_______(填序号,下同)是晶体,_______是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有__________,而非晶体______________;另外非晶体具有物理性质__________的特点,而晶体具有物理性质__________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是__________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【分析】核磁共振氢谱图中,吸收峰的个数等于氢原子的种类,吸收峰的面积之比等于各种氢原子的个数之比。
【详解】A.CH3OH分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故A不符题意;
B.CH3CHO分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故B不符题意;
C.CH3COOH分子中有两种氢原子,个数比为3:1,在核磁共振氢谱中给出两种峰(信号),故C不符题意;
D.CH3COCH3分子中只有一种氢原子,在核磁共振氢谱中只给出一种峰(信号),故D符合题意;
答案选D。
2.C
【详解】A. 碱金属元素的单质其熔点从上到下逐渐减小,则熔点:Rb<K<Na<Li,A错误;
B. 离子晶体的中离子半径越小,所带电荷数越大,晶格能越大,熔点越高,则熔点:KCl<NaCl<MgCl2<MgO,B错误;
C. 石墨是混合型晶体,金刚石、二氧化硅是原子晶体,钠是金属晶体,碳原子半径小于硅原子半径,金刚石熔点大于二氧化硅,则熔点:石墨>金刚石>SiO2>钠,C正确;
D. 水分子间存在氢键,氢气的相对分子质量最小,硫磺常温下是固体,则熔点:硫磺>H2O>CH4>H2,D错误;答案选C。
3.C
【详解】A.NCl3中N原子与Cl原子形成3个δ键,N原子上还有一对孤电子对,N原子为杂化,故A错误;
B.三氯化氮(NCl3)中N原子最外层有5个电子,与3个Cl原子形成三个共用电子对,还有1个孤电子对,故B错误;
C.分子晶体的相对分子质量越大,分子间作用力就越大,沸点越高,所以它的沸点比PCl3沸点低,故C正确;
D.沸点属于物理性质,键能大小影响化学性质;分子晶体的相对分子质量决定其沸点,虽然N-Cl键能大,但NCl3沸点低,故D错误;
故选C。
4.A
【详解】A.分子晶体中,分子间作用力大的熔沸点高;共价键的键能越大,物质的分子稳定性越大,A正确;
B.由非金属元素组成的化合物可能是共价化合物,也可能是离子化合物,如HCl为共价化合物,NH4Cl为离子化合物,B错误;
C.共价晶体中一定含有共价键,离子晶体中可能含有共价键,如NaOH为离子晶体,阳离子Na+与阴离子OH-之间以离子键结合,在阴离子OH-中存在共价键,C错误;
D.分子晶体中一定存在范德华力,若物质分子是单原子分子,就不存在共价键;若为双原子或多原子分子,就存在共价键,因此分子晶体中不一定存在共价键,一定存在范德华力,D错误;
故合理选项是A。
5.B
【详解】白磷分子晶体中,分子中是共价键结合,微粒之间不是共价键结合,是分子间作用力,键角为60°,所以B错了。答案选B。
6.B
【详解】Mg原子处于晶胞顶点与面心上,顶点上Mg原子为6个晶胞共用,面心上的Mg原子为2个晶胞共用,B原子位于棱柱的侧棱上,为3个晶胞共用,故晶胞中Mg原子数目为,B原子数目为,Mg原子和B原子数目比为3:2,则其化学式为Mg3B2,故选B;
答案选B。
7.A
【详解】A.COCl2和PCl3都是共价化合物,电子式分别为、,可知每个原子均满足8e-稳定结构,故A项正确;
B.CaO2和CaH2都为离子晶体,电子式分别为、,所以CaH2中不含有共价键,故B项错误;
C.CO2空间结构对称,正电中心和负电中心重合为非极性分子;HCN空间结构不对称,正电中心和负电中心不重合为极性分子,故C项错误;
D.根据含氧酸分子中非羟基氧原子数越多,该含氧酸的酸性就越强。H2SO4中非羟基氧原子数为2,是强酸;H3PO4中非羟基氧原子数为1,是中强酸,二者酸性相差很大,故D项错误;
答案选A。
8.A
【详解】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
9.B
【详解】分子晶体一般具有熔点、沸点较低,易升华和熔融状态下不导电的特性,故由二茂铁是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上能升华,可以推断二茂铁属于分子晶体,故答案为:B。
10.B
【分析】利用均摊法先计算出镁原子与硼原子个数。再求出原子个数比即可解答。
【详解】处于六棱柱顶点上的镁原子同时为6个结构单元所共有,每个镁原子有属于该结构单元;处于面上的镁原子同时为2个结构单元所共有,每个镁原子有属于该结构单元;处于棱柱内的6个硼原子,则完全属于该结构单元。故每个结构单元中有镁原子:l2×+2×=3,有硼原子6个。故化学式可表示为MgB2。故B正确,ACD错误;
答案选B。
11.D
【详解】A.根据氯化钠晶体的结构图,在晶体中,距最近且相等的有6个,距最近且相等的有6个,故A正确;
B.根据均摊原则,在晶胞中,位于立方体的8个顶角和6个面心,所以的数目是,故 B正确;
C.金刚石晶体中,每个C原子形成4个共价键,两个C原子共用一个共价键,所以在金刚石晶体中,碳原子与碳碳键个数比为1:2,故C正确;
D.是离子化合物,在熔融状态下能够完全电离出自由移动的和,能够导电,故D错误;
选D。
12.B
【详解】A.“浸取”时,CuFeS2在酸性条件下与氧气发生氧化还原反应,反应的离子方程式为4CuFeS2+17O2+4H+=4Cu2++4Fe3++8SO+2H2O,A正确;
B.加入过量氧化铜调节pH的目的是将铁离子转化为氢氧化铁除去,因此“滤渣①"的成分是Fe(OH)3和过量的CuO,B不正确;
C."还原"时加入NaCl和浓盐酸主要是为了提供Cl-,跟铜元素形成可溶于水的物质,然后经过一系列操作得到CuCl,C正确;
D.由CuCl的晶胞图可知,每个氯离子周围与之距离最近的氯离子数目是12,D正确,
故选B。
13.B
【详解】A.该制备反应气体分子数增多,是熵增过程,A项正确;
B.SiO2为共价晶体,B项错误;
C.该反应是化合物和单质反应生成另一种化合物和单质,属于置换反应,C项正确;
D.硅元素从+4价降低至0价,则每生成1mol Si转移4mole-,其数目为:2.408×1024,D项正确;
故选:B。
14.C
【详解】A.石墨烯为新型无机非金属材料,属于混合型晶体,A正确;
B.聚氨酯材料为人工合成的高分子材料,属于合成有机高分子材料,B正确;
C.干冰气化吸热,使周围温度降低,从而制冰,该过程没有新物质生成,不涉及化学变化,C错误;
D.氢气燃烧生成水,不污染环境,采用氢燃料电池车,开发了全新的车载光伏发电系统,体现“绿色出行”的理念,D正确;
答案选C。
15.D
【详解】①由表格中的数据可知AlCl3的熔沸点较低,则AlCl3属于分子晶体,加热时能升华,①项正确;
②由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,②项正确;
③由表格中的数据可知,NaCl的沸点为1465℃,则属于离子晶体,粒子之间以离子键结合,③项正确;
④氯化镁的熔沸点比氯化钠的低,并且都属于离子晶体,所以主要是受堆积方式、键的极性、晶格能等影响,④项正确;
②③④正确;
答案选D。
16. (,,)
【详解】由晶胞示意图可知,位于顶点的a和体心的b的坐标参数依次为(0,0,0)、(,,),d位于体对角线的处,则d的坐标参数为(,,);晶胞中Cu原子的个数为4,O原子的个数为8×+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g·mol-1,设晶胞的参数为a,晶胞的质量为a3ρ=×144,则a=cm。
17. C8H8
【分析】某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。碳原子个数为=8,氢原子个数为=8,则分子式为C8H8,则其结构简式为。根据其结构分析。
【详解】(1)某含苯烃的化合物A,其相对分子质量为104,碳的质量分数为92.3%。碳原子个数为=8,氢原子个数为=8,则分子式为C8H8,则其结构简式为。
(2)根据已知分析,苯乙烯在该条件下连接碳碳双键的碳原子各上一个羟基,故结构简式为。
(3)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,则相对分子质量为,则分子式为C8H16,结构简式为;
(4)苯乙烯加聚生成聚苯乙烯,结构简式为。
18. AB (Si4O11)n6n
【详解】(1)根该晶体一截面上原子原子的排布情况可知,每一个A原子周围有2个B原子,每一个B原子周围有2个A原子,所以该晶体的化学式可以表示为AB。
(2)由许多四面体构成,每个Si与周围4个氧原子形成四面体,取图中所示结构单元:,结构单元中处于共用边上的O原子为每个结构单元提供,处于结构单元内的氧原子有9个,其中4个的投影与Si重合,故结构单元共用氧原子数目为9+4×=11,结构单元内Si原子4个,结构单元化合价为:(-2)×11+(+4)×4=-6,故该多硅酸根离子的化学式通式为(Si4O11)n6n。
19. 4 离子晶体 r(Na+)
(2) NaNO2属于离子化合物,所以属于离子晶体;组成NaNO2的三种元素,其对应的简单离子分别为,均为10电子结构,由具有相同电子层结构的离子“序小径大”,所以离子半径大小关系为r(Na+)
(2) Mo2N 12
(3) 50% ×1010
(4)(0.3333,0.6667,0.6077)
【详解】(1)观察体心的,可以看出与紧邻且等距的Na+有8个;在一个晶胞中,Na+有6×+4×=4,Na+和个数相等,所以一个晶胞的质量为=,晶胞的体积为a2×2anm3=2a3nm3=2a3×10-21cm3,所以NaAlH4晶体的密度为=g/cm3。
(2)从晶胞结构可以看出,Mo原子位于顶点和面心,共有=4个Mo原子,氮原子部分填充在Mo原子立方晶格的八面体空隙中,氮原子共有=2个,所以氮化钼的化学式为Mo2N,从晶胞结构可以看出,Mo原子周围与之等距离的Mo原子有12个。
(3)Zn2+位于立方体的顶点和面心,能够围成八个四面体空隙,S2-在晶胞内部只有4个,所以四面体空隙的填充率为50%;在一个晶胞中,Zn2+个数为8×+6×=4,S2-个数为4,所以一个晶胞的质量为g=g,晶胞密度为ag/cm3,则晶胞的体积为cm3,晶胞的边长为pm,Zn2+与S2-的最短距离为体对角线的四分之一,所以Zn2+与S2-的最短距离为×1010pm。
(4)Co的晶胞可以看做是由两个正三棱柱构成的,1和2号氧原子分别位于两个正三棱柱里,晶胞含对称中心,1号氧原子的分数坐标为(0.6667,0.3333,0.1077),则2号O原子的分数坐标为(0.3333,0.6667,0.6077)。
21.(1)乙醇分子间存在氢键,而环氧乙烷分子间不存在氢键
(2)Li2O、Na2O为离子晶体,熔点与离子键有关,离子半径Li+
【解析】(1)
由于乙醇中含有羟基,羟基与羟基之间能够形成氢键,而环氧乙烷中不含羟基,没有分子间氢键,则导致乙醇的沸点远高于环氧乙烷的沸点,故答案为:乙醇分子间存在氢键,而环氧乙烷分子间不存在氢键;
(2)
已知Li2O、Na2O是由阴、阳离子构成的离子晶体,熔点与离子键有关,离子半径Li+
22.(1) 干冰晶体 冰晶体
(2)金刚石冰干冰
(3) 4 4 8
(4)
【详解】(1)根据各晶体的构成和分析,分子晶体中粒子之间为范德华力,构成晶体的粒子之间主要以范德华力结合形成的晶体是干冰晶体、冰晶体;故答案为:干冰晶体;冰晶体;
(2)熔点的一般规律:共价晶体>离子晶体>分子晶体,再结合晶体微粒作用力可得,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石冰干冰,故答案为:金刚石冰干冰;
(3)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为=4;MgO晶胞中Mg2+位于棱上与体心,晶胞中Mg2+数目为1+12×=4,;在CaCl2晶体中,每个Cl-周围最近距离的Ca2+分布在一个顶点以及和这个顶点相连的三个面的面心上,一共是4个,每个Ca2+被8个Cl-所包围,故答案为:4:4:8;
(4)C60晶体中,每2个C原子形成一个π键,则1mol C60晶体中含π键数目为1mol×60××NAmol-1=30NA,故答案为:30NA。
23.(1) 面心
(2)
【详解】(1)Na3OCl晶体结构中空心白球类原子6×=3、顶点阴影球类原子8×=1、实心黑球类原子1×1=1、根据Na3OCl化学式,可判断钠原子应为空心白球处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的倍,所以两个Na之间的最短距离为;
(2)已知:晶胞参数为anm,密度为,,则。
24. B(,,),C(,,) anm ×100%
【详解】原子坐标参数A为(,,),根据0点定位,则B、C的原子坐标参数分别为B(,,),C(,,);设该晶胞中CdSe键的键长为x,设体对角线为y,x=y,则y2=(a)2+(a)2+(a)2,则x=a;在晶胞中,Cd原子数为×8+×6=4,Se原子数为4,已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为= =×100%;
25. ②⑤⑥⑧⑨ ①③④⑦⑩ 规则的几何外形 没有规则的几何外形 各向同性 各向异性 ②④
【详解】(1)明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体,即②⑤⑥⑧⑨;塑料、松香、玻璃、石蜡、橡胶都是非晶体,即①③④⑦⑩;
(2)晶体和非晶体在外形上有差别,晶体都具有规则的几何外形;而非晶体没有规则的几何外形;另外非晶体具有物理性质各向同性的特点,而晶体具有物理性质各向异性的特点;
(3)晶体的重要特征就是各向异性和有固定的熔点,因此判断物质是晶体还是非晶体可②从各向异性或各向同性上来判断,④从有无固定熔点来判,即②④。
答案第1页,共2页
答案第1页,共2页
