第2章化学键化学反应规律课后练习题(含解析)2022-2023学年下学期高一化学鲁科版(2019)必修1
文档属性
| 名称 | 第2章化学键化学反应规律课后练习题(含解析)2022-2023学年下学期高一化学鲁科版(2019)必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 10:44:12 | ||
图片预览




文档简介
第2章化学键 化学反应规律 课后练习题
一、单选题
1.已知:H2 (g)+F2(g) =2HF(g) △H=- 270 kJ /mol,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1 mol 氢气与1 mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJ
C.在相同条件下,2 mol 氟化氢气体的总能量大于1 mol 氢气与1 mol 氟气的总能量
D.2 mol氟化氢气体分解成1mol的氢气积1mol的氟气吸收270kJ热量
2.如图所示,a在金属活动性顺序中排在氢之前,b为碳棒,下列说法中不正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出
C.导线上有电流,电子移动方向为a→b
D.反应后a极质量减小
3.反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:S
B.Na+的结构示意图:
C.Na2S的电子式:
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
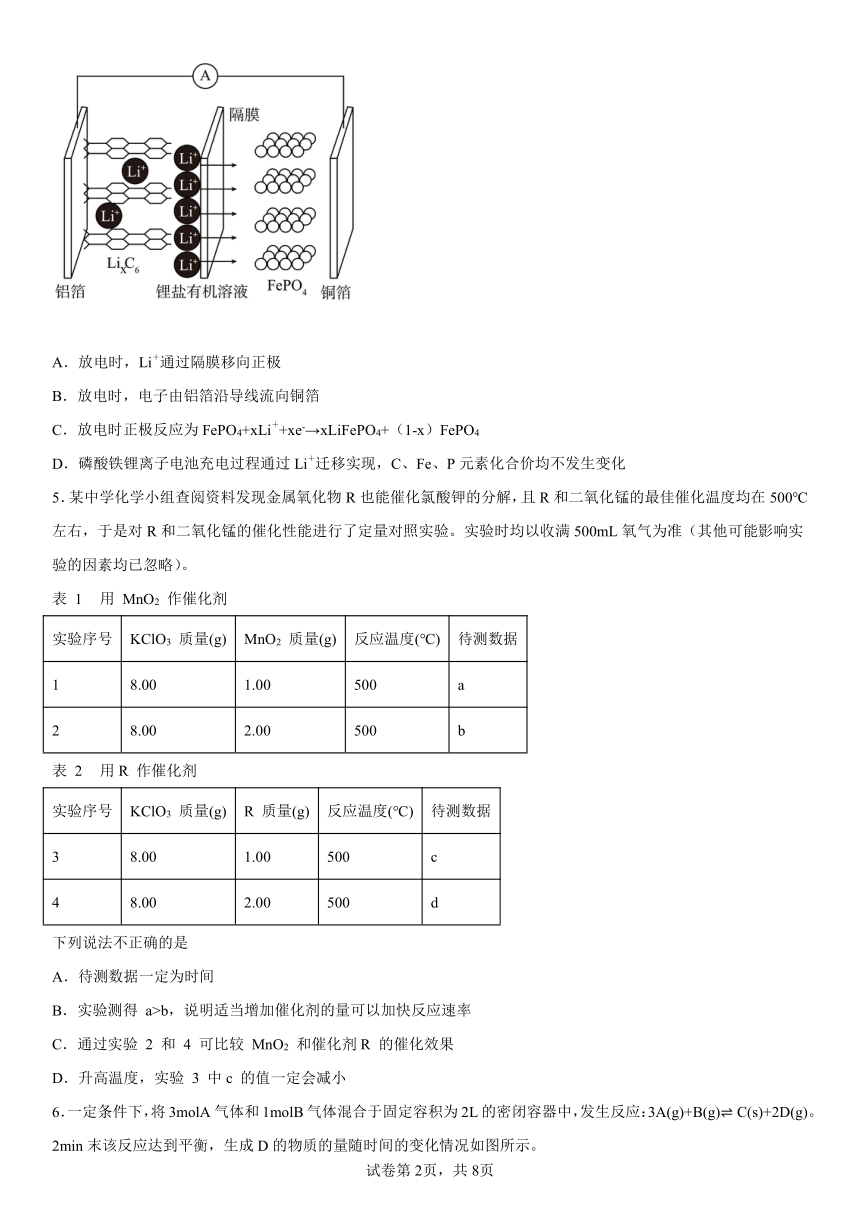
4.2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
5.某中学化学小组查阅资料发现金属氧化物R也能催化氯酸钾的分解,且R和二氧化锰的最佳催化温度均在500℃左右,于是对R和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表 1 用 MnO2 作催化剂
实验序号 KClO3 质量(g) MnO2 质量(g) 反应温度(℃) 待测数据
1 8.00 1.00 500 a
2 8.00 2.00 500 b
表 2 用R 作催化剂
实验序号 KClO3 质量(g) R 质量(g) 反应温度(℃) 待测数据
3 8.00 1.00 500 c
4 8.00 2.00 500 d
下列说法不正确的是
A.待测数据一定为时间
B.实验测得 a>b,说明适当增加催化剂的量可以加快反应速率
C.通过实验 2 和 4 可比较 MnO2 和催化剂R 的催化效果
D.升高温度,实验 3 中c 的值一定会减小
6.一定条件下,将3molA气体和1molB气体混合于固定容积为2L的密闭容器中,发生反应:3A(g)+B(g) C(s)+2D(g)。2min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。
下列判断正确的是
A.若混合气体的密度不再改变时,说明则该反应达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢
C.反应过程中A和B的转化率之比为3:1
D.开始到平衡,用C表示的化学反应速率为0.1mol·L-1·min-1
7.X、Y为两种短周期元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的常见化合物或离子不可能是
A.核外电子总数为10的阴离子
B.含有共价键的离子化合物
C.阴、阳离子个数比为1∶1的离子化合物
D.双核离子或四核分子
8.如图所示,有关化学反应和能量变化的说法正确的是
图a 图b
A.图a表示的是吸热反应的能量变化
B.图b中反应物比生成物稳定
C.图a可以表示C与CO2反应生成CO的能量变化
D.图a不需要加热就能发生,图b一定需要加热才能发生
9.将a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。若a、d相连,a为负极;c、d相连,c极产生大量气泡;b、c相连,b为正极;则这四种金属中金属性最强的是
A.a B.b C.c D.d
10.下列四种稀盐酸溶液跟铁片反应,最初反应速率最快的是
A.常温下300mLlmol/L的盐酸溶液 B.标况下10mL2mol/L的盐酸溶液
C.常温下5mL2mol/L的盐酸溶液 D.标况下20mL1mol/L的盐酸溶液
11.钛有“二十一世纪的金属”、“生物金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:。下列说法正确的是
A.中子数为14的镁原子: B.结构示意图:
C.的电子式: D.钛与人体骨骼相近,具有良好的生物相容性,能制造股骨头和各种关节
12.下列反应属于放热反应的是
A.C+CO22CO B.Al与稀盐酸反应
C.KClO3受热分解 D.浓硫酸溶于水
13.下列说法中正确的是
A.如果不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用的溶液冲洗
B.用镊子从煤油中取出一小块钠,用小刀切取一块绿豆大的钠直接放入水中,剩余钠放回试剂瓶
C.铜与浓硫酸加热条件下发生反应,反应结束后,冷却,然后向试管中加水,观察溶液呈蓝色
D.比较不同条件下与反应的快慢,可通过测定收集等体积需要的时间来实现
14.少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑥⑦⑧
15.在恒温恒容密闭容器中,充入一定量N2O4(g),发生反应N2O4(g)2NO2(g)ΔH>0,下列说法正确的是
A.反应过程中v(N2O4)消耗=2v(NO2)生成
B.其他条件不变,升高温度,N2O4平衡转化率减小
C.容器中气体的平均相对分子质量保持不变时即反应达平衡
D.加压,平衡逆向移动,正反应速率或小,逆反应速率加快
二、填空题
16.Ⅰ.回答下列问题
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_______。
(2)已知某粒子的结构示意图为 。
①当x-y=10时,该粒子为_______(填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)_______、_______、_______、_______、_______。
Ⅱ.结合元素周期表回答下列问题:
(3)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。_______
(4)表中所列元素,属于短周期元素的有_______,属于主族元素的有_______。
17.下列物质中:只存在共价键的是______(填序号,下同),只存在离子键的是______,既存在离子键又存在极性共价键的是____________。
①Ar ②NH4Cl ③CO2 ④KOH
⑤HNO3 ⑥Na2O2 ⑦CaO ⑧CaCl2
18.84 消毒液主要是以次氯酸钠为主要成分的消毒剂,疫情期间,很多人在家里面备上了一些消毒液,方便给家里消毒。84 消毒液制备所需原料可由 NaCl 制备,相关的反应如下图所示,请填写下列空白。
(1)NaClO 含有的化学键类型是_______;
(2)氯化钠溶液通电后,发生反应的化学反应方程式为_______;
(3)氢气在氯气中燃烧的现象是_______;
(4)请写出 Cl2与NaOH反应的化学方程式,并标出电子转移的方向和数目_______;
(5)Cl2 与 Ca(OH)2 反应可制备漂白粉,请用化学用语说明原理_______。
19.H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式:___________________;
(3)用电子式表示Na3N 的形成过程: ___________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO)=_________;
20.(1)用KClO3在H2SO4存在下与SO2反应制得ClO2.请写出反应的离子方程式:___________。
(2)CN-可以造成水体污染,某小组采用如下方法对污水进行处理。双氧水氧化法除NaCN。
①NaCN的电子式为___________。
②碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为___________。
(3)把ag固体NaHCO3加热分解一段时间后,固体质量变为b g。尚未分解的NaHCO3质量为___________g。
21.在密闭容器中,800℃时反应体系中,随时间的变化如表:
时间/s 0 1 2 3 4 5
0.0200 0.010 0.008 0.007 0.007 0.007
(1)上述反应_________(填“是”或“不是”)可逆反应。
(2)如图所示,表示变化曲线的是_________(填字母)。用表示从内反应的平均速率_________。
(3)能说明该反应已达到平衡状态的是_________(填选项)。
A. B.容器内气体总质量保持不变
C.容器内密度保持不变 D.
22.中国科学院长春应用化学研究所在甲烷(CH4)燃料电池技术方面获得很大突破,组装出了自呼吸电池及主动式电池。甲烷燃料电池工作的原理如图所示(电池的总反应方程式为CH4+2O2=CO2+2H2O)。
(1)b处通入的物质是___(填化学式,下同)。
(2)该电池的正极反应式为___;如果把电解质溶液换成氢氧化钾溶液,则该电池的负极反应式为____。
(3)工作一段时间后,3.2g甲烷完全反应生成CO2时,消耗氧气的体积为____L(标准状况下)。
23.下表表示合成氨反应(N2+3H22NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
压强(MPa)氨的含量 温度(℃) 0.1 10 30 60 100
200 0.153 0.815 0.899 0.954 0.988
300 0.022 0.520 0.710 0.842 0.926
400 0.004 0.251 0.470 0.652 0.798
分析上表数据,回答下列问题:
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强______
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:___________________________________________________________________________________________。
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:____________________。
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:____________。
24.Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- + SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.热化学方程式中的化学计量数代表物质的量,不代表分子数,A错误;
B.2mol液态氟化氢所含能量比2mol气态氟化氢所含能量低,故生成2mol液态氟化氢比生成2mol气态氟化氢放热多,B错误;
C.该反应是放热反应,所以在相同条件下,2 mol 氟化氢气体的总能量小于1 mol 氢气与1 mol 氟气的总能量,C错误;
D.由热化学方程式可知,2mol氟化氢气体分解成1mol的氢气和1mol的氟气时应吸收270kJ的热量,D正确。
答案选D。
2.A
【分析】根据装置没有电源,则构成的是原电池装置,又由于a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极,电极本身失电子发生氧化反应,b为正极,溶液中的氢离子得电子发生还原反应,电子从负极流向正极,据此分析。
【详解】A. a为负极,本身失电子发生氧化反应,b为正极,溶液中的氢离子得电子发生还原反应,A错误;
B. b为正极,溶液中的氢离子得电子发生还原反应,所以碳棒上有气体逸出,B正确;
C. 该装置构成了原电池,导线上有电流,电子从负极流向正极,即从a→b,C正确;
D. 根据装置没有电源,则构成原电池装置,又a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极本身失电子发生氧化反应,所以a极质量减小,D正确;
故合理选项是A。
【点睛】本题考查原电池原理,明确原电池中正、负极上得失电子是解本题关键,注意电子从负极流向正极,电流则从正极经外电路流向负极,溶液中的阴离子向负极移动,阳离子向正极移动,注意对基础知识的归纳整理。
3.B
【详解】A.质量数=质子数+中子数,故中子数为20的硫原子的质量数为36,表示为S,故A错误;
B.钠离子的核外有10个电子,核内有11个质子,故其结构示意图为,故B正确;
C.Na2S由2个钠离子和1个硫离子构成,故其电子式为,故C错误;
D.CO32-水解分步进行且可逆,故其水解方程式为CO32-+H2O HCO3-+OH-,故D错误。
故选:B。
4.D
【详解】A.放电时,内电路阳离子向正极移动,则Li+通过隔膜移向正极,A说法正确;
B.放电时,外电路电子由负极流向正极,即电子由铝箔沿导线流向铜箔,B说法正确;
C.放电时正极磷酸铁得电子,与锂离子反应生成磷酸亚铁锂,反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4,C说法正确;
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,反应中Fe、P元素化合价发生变化,D、说法错误;
答案为D。
【点睛】原电池内电路阳离子向正极移动;外电路电子由负极流向正极。
5.D
【详解】A. 通过测定个收集500mL氧气所消耗得时间,因此待测数据一定为时间,故A正确;
B. 实验测得时间a>b,说明加1g二氧化锰催化剂的反应速率比加2g二氧化锰催化剂的反应速率慢,说明适当增加催化剂的量可以加快反应速率,故B正确;
C. 通过实验2和4可比较MnO2和催化剂R的催化效果,其他变量都相同,只有不同的催化剂,因此可以比较,故C正确;
D. 根据题意R和二氧化锰的最佳催化温度均在500℃左右,升高温度,催化剂活性降低,因此实验3中C的值不一定会减小,可能会增大,故D错误。
综上所述,答案为D。
6.A
【详解】A.C是固体,反应后气体质量减小,容器体积不变,密度是变量,若混合气体的密度不再改变,说明则该反应达到平衡状态,故A正确;
B.反应前后均有气体,加压正逆反应速率均加快,故B错误;
C.反应达到平衡,生成0.8molD,则反应消耗1.2molA、0.4molB,A的转化率为、B的转化率为,转化率之比为1:1,故C错误;
D.C是固体,不能用C的浓度变化表示反应速率,故D错误;
选A。
7.C
【分析】X、Y为两种短周期元素,X原子的最外层电子数为1,可能是H、Li和Na;Y原子的最外层电子数为6,则可能是O和S,据此结合物质的构成分析解答。
【详解】A.H、O元素可以形成10电子微粒OH-,A不符合题意;
B.Na、O元素可以形成Na2O2,Na2O2中含有离子键和共价键,B不符合题意;
C.X、Y两种元素不能形成阴、阳离子个数比为1∶1的离子化合物,C符合题意;
D.H、O元素可以形成OH-、H2O2,D不符合题意;
答案选C。
8.B
【详解】A.图a中反应物的总能量高于生成物的总能量,为放热反应,A项错误;
B.图b中反应物M的能量比生成物N的能量低,故反应物较稳定,B项正确;
C.图a表示的是放热反应的能量变化,C与CO2反应生成CO是吸热反应,C项错误;
D.图a表示的是放热反应,所有的燃烧均为放热反应,但是多数燃烧开始需要加热,故D项错误。
故选B。
【点睛】本题主要考查了化学反应与能量变化,注意观察图中反应物的总能量和生成物的总能量的高低,判断吸热还是放热反应,注意反应条件与反应是放热反应还是吸热反应没有关系。
9.A
【详解】由题意,若a、d相连,a为负极,则金属性a>d;c、d相连,c极产生大量气泡,则c为正极,d为负极,金属性d>c;b、c相连,b为正极,则金属性c>b;综上,这四种金属中金属性最强的是a;
故选A。
【点睛】本题从原电池的角度比较金属性的活动性顺序,正确判断原电池负极是解本题关键,原电池中,一般较活泼的金属作负极,还可以根据电子、电流的流向及电极反应现象等判断正负极。
10.C
【详解】锌与稀盐酸反应的本质为Zn+2H+═H2↑+Zn2+,根据温度越高,氢离子浓度越大,最初的反应速率越快,根据选项分析,常温下5mL2mol/L的盐酸溶液与铁片最初反应速率最快,答案选C。
11.D
【详解】A.中子数为14的镁原子质量数为26,该核素表示为,故A错误;
B.核外有18个电子,结构示意图为 ,故B错误;
C.是离子化合物,电子式为,故C错误;
D.钛有“生物金属”的美称,钛与人体骨骼相近,具有良好的生物相容性,能制造股骨头和各种关节,故D正确;
选D。
12.B
【详解】A.C与CO2高温条件下才能反应,该反应过程中吸收热量,属于吸热反应,故A不符合题意;
B.活泼金属与酸制取氢气的反应为放热反应,故B符合题意;
C.大多数分解反应属于吸热反应,氯酸钾受热分解需要从外界吸收能量,属于吸热反应,故D不符合题意;
D.浓硫酸溶于水放热,但没有化学反应发生,故D不符合题意;
故选:B。
13.B
【详解】A.化学实验中,不慎将酸沾到皮肤上,应先用毛巾擦掉皮肤表面的酸,再立即用大量水冲洗,然后用3%~5%的NaHCO3溶液冲洗,故A错误;
B.用镊子从试剂瓶中取出一小块金属钠,用滤纸吸干表面的煤油后,用小刀切一小的钠块,放入盛有水的烧杯中,剩余的钠放回试剂瓶中,故B正确;
C.反应结束后,为观察溶液颜色,需将试管中溶液缓缓加入盛有水的烧杯中,顺序不能颠倒,否则液体飞溅,易发生危险,故C错误;
D.由反应方程式Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,则比较相同浓度的Na2S2O3溶液和不同浓度的H2SO4溶液反应的反应快慢可通过测定溶液出现浑浊的时间来实现,故D错误;
故选:B。
14.C
【解析】涉及的离子方程式: ,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
【详解】A.①⑥不符合题意,故A错误;
B.⑤不符合题意,故B错误;
C.③⑦⑧均符合题意,C正确;
D.⑥不符合题意,故D错误;
答案选C。
15.C
【详解】A.和均代表正反应速率,在反应过程中反应速率之比等于化学计量数之比,所以,故A错误;
B.N2O4(g)2NO2(g) ΔH>0,正反应为吸热反应,其他条件不变,升高温度,平衡正向移动,所以N2O4平衡转化率增大,故B错误;
C.容器中气体的平均相对分子质量为:,反应物生成物均为气体所以一直不变,反应前后气体总物质的量在改变,所以容器中气体的平均相对分子质量保持不变时即反应达平衡,故C正确;
D.加压,平衡向气体体积减小的方向移动,也就是逆向移动,但正反应速率和逆反应速率都加快,故D错误;
答案为C。
16.(1)
(2) 原子 氩原子 氯离子 硫离子 钾离子 钙离子
(3)
(4) abcdefg abcdef
【解析】(1)
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素为15号元素磷元素,其原子结构示意图是 ;
(2)
①当x-y=10时,说明x =2+8+y,则电子数=质子数,该粒子为原子。
②当y=8时,则为8电子稳定结构,可能是原子,可能是第三层电子数大于4得到电子形成的离子,可能是第四层电子数小于4失去电子形成的,故该粒子可能为氩原子、氯离子、硫离子、钾离子、钙离子;
(3)
根据元素周期表结构可知,元素周期表边界为:
;
(4)
短周期元素为第一、二、三周期,故属于短周期元素的有abcdefg;主族元素为元素周期表右侧第1、2列、左侧第2、3、4、5、6列,故属于主族元素的有abcdef。
17. ③⑤ ⑦⑧ ②④
【分析】共价化合物中只有共价键;简单阴阳离子间只有离子键;若阴阳离子中存在多原子形成的离子,则该化合物中除了离子键还有共价键。
【详解】①Ar为单原子分子,原子间不存在化学键。②NH4Cl,为NH4+和Cl-间,存在离子键,NH4+中N和H之间存在极性共价键,所以NH4Cl中既有离子键又有极性共价键。③CO2,为共价分子,只有共价键。④KOH中,k+和OH-之间存在离子键,OH-中O和H之间存在极性共价键,KOH中既有离子键又有极性共价键。⑤HNO3为共价分子,只存在共价键。Na2O2中,Na+和O22-间存在离子键,O22-中的2个O原子间,存在非极性共价键,则Na2O2中既有离子键又有非极性共价键。⑦CaO中,只有简单离子Ca2+和O2-,只存在离子键。⑧CaCl2中,Ca2+和Cl-间只存在离子键;
故:只有共价键的是③⑤;只有离子键的是⑦⑧;既存在离子键又存在极性共价键的是②④。
18.(1)离子键和共价键
(2)
(3)安静的燃烧,发出苍白色火焰,瓶口有白雾生成
(4)
(5)石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为
【分析】如图,电解食盐水生成NaOH、和,其反应为;电解熔融NaCl生成金属钠和氯气,其反应为;和NaOH反应生成、NaCl和水,其反应为;
【详解】(1)属于离子化合物,其中含有离子键和共价键;
故答案为:离子键和共价键;
(2)如图,氯化钠溶液通电后,生成NaOH、和,其反应为;
故答案为:;
(3)氢气能与氯气发生反应生成氯化氢,其发生反应的现象为:氢气在氯气中安静的燃烧,发出苍白色火焰,瓶口有白雾生成;
故答案为:安静的燃烧,发出苍白色火焰,瓶口有白雾生成;
(4)和NaOH反应生成、NaCl和水,其反应为,其中Cl元素化合价既升高也降低,既是氧化剂也是还原剂,转移电子数目为1,可用单线桥表示为;
故答案为:;
(5)与石灰乳反应制备漂白粉,石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为;
故答案为:石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为。
19. 第四周期,第VIII族 → 3:7 13:2
【详解】(1) Fe元素的原子序数是26,在元素周期表中的位置是第四周期、第VIII族;
(2) (CN)2是共价化合物,依据8电子稳定结构可知电子式为:;
(3) Na3N是离子化合物,用电子式表示Na3N的形成过程为:→;
(4) 设混合气体中含有xmolNO,ymolNO2,则
则2x+(y-x)=0.1、(y-x)/2=0.02,解得:x=0.03、y=0.07,所以x:y=3:7;
(5) 还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO+12H++10Cl-;可见当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则溶液中n(Cl-):n(IO)=26:4=13:2。
20. 2ClO+SO2=2ClO2+ 2CN-+5H2O2+2OH-=2+N2↑+6H2O
【详解】(1)KClO3在H2SO4存在下与SO2反应制得ClO2和硫酸钾,离子方程式为2ClO+SO2=2ClO2+;
(2)①NaCN为离子化合物,电子式为;
②双氧水与CN-反应生成纯碱和一种无色无味的无毒气体,根据元素守恒,可判断为氮气,利用化合价升降法配平,则反应的离子方程式为2CN-+5H2O2+2OH-=2+N2↑+6H2O;
(3)NaHCO3加热分解方程式为2NaHCO3Na2CO3+CO2↑+H2O,固体质量减少为CO2、H2O的质量,
根据对应成比例,x=(a-b)g,则生成的碳酸钠固体的质量为(a-b)g,剩余固体为未分解的碳酸氢钠和生成的碳酸钠,故尚未分解的NaHCO3质量=bg-(a-b)g=g。
21. 是 b 0.003 D
【详解】(1)从表中数据可看出,反应进行3s后,n(NO)=0.007mol,且始终保持不变,从而可确定上述反应是可逆反应;
(2)从图中可看出, n(NO)=0.0013mol,结合化学反应,可确定 n(NO2)=0.0013mol,体积为2L,可知,从而确定表示NO2变化的是曲线b;
从表中数据可以得出,0~2s内, n(NO)=0.012mol,根据化学方程式, n(NO)= n(NO2),则用NO2表示0~2s内该反应的平均速率v==0.003mol/(L·s);
(3)A.不管反应进行到什么程度,总有v(NO2)=2v(O2),所以不一定达平衡状态,A不符合题意;
B.反应物和生成物均为气体,因此容器内气体的质量一直不变,所以气体质量不变,不一定达到平衡,B不符合题意;
C.容器内气体的质量不变,容器的体积不变,所以容器内密度保持不变,所以当密度不变时,反应不一定达平衡状态,C不符合题意;
D.v逆(NO)=2v正(O2)表示反应方向相反,且数值之比等于化学计量数之比,则此时反应达平衡状态,D符合题意;
答案选D。
22.(1)CH4
(2) O2+4H++4e-=2H2O CH4+10OH-+8e-=CO+7H2O
(3)8.96
【分析】原电池中阳离子流向正极,故右边为正极左边为负极。根据甲烷燃料电池的总反应方程式为CH4+2O2=CO2+2H2O,可知甲烷失去电子,发生氧化反应,故左边为负极,b通入的为甲烷,a为二氧化碳;氧气得电子,发生还原反应,故右边为正极,c为氧气。
(1)根据分析可知,b处通入的为CH4。
(2)正极为氧气得电子,电极反应式为O2+4H++4e-=2H2O;如果把电解质溶液换成氢氧化钾溶液,则该电池的负极甲烷失电子生成碳酸根,故电极反应为CH4+10OH-+8e-=CO+7H2O。
(3)根据总反应方程式为CH4+2O2=CO2+2H2O,1mol甲烷消耗氧气2mol,3.2g甲烷的物质的量为=0.2mol,故标准状况下消耗氧气的体积为0.4mol×22.4L/mol=8.96L。
23. 不能 该反应为可逆反应,在一定条件下进行时,将达到化学平衡状态,反应物不可能完全转化为生成物 增大压强,降低温度 温度为300℃,压强为30MPa
【详解】(1)由于是可逆反应,所以在一定条件下进行时,将达到化学平衡状态,反应物不可能完全转化为生成物。
(2)根据表中数据可知,降低温度或增大压强,可使平衡混合物中氨的含量增大。
(3)根据表中数据可知,欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为温度为300℃,压强为30Mpa。
24. 2Z +Y 3X 0.1 mol L-1 min-1 C 液态或固态 ① SO32-
【详解】Ⅰ.(1)由图象可知X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比等于它们的物质的量变化之比为0.6:0.2:0.4=3:1:2,所以方程式为2Z +Y 3X;
(2)v(X)==0.1 mol L-1 min-1;
(3)根据图中信息可知,反应开始时各物质的量均不为0,故该反应由正、逆反应同时开始,答案选C;
(4)因固体或纯液体的浓度为常数,改变其用量反应速率不变,故其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为液态或固态;
Ⅱ.(1)由慢反应决定整个反应过程的速率,故反应速率由①步反应决定,故答案为①;
(2)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变蓝的现象产生。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.已知:H2 (g)+F2(g) =2HF(g) △H=- 270 kJ /mol,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1 mol 氢气与1 mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJ
C.在相同条件下,2 mol 氟化氢气体的总能量大于1 mol 氢气与1 mol 氟气的总能量
D.2 mol氟化氢气体分解成1mol的氢气积1mol的氟气吸收270kJ热量
2.如图所示,a在金属活动性顺序中排在氢之前,b为碳棒,下列说法中不正确的是
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出
C.导线上有电流,电子移动方向为a→b
D.反应后a极质量减小
3.反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:S
B.Na+的结构示意图:
C.Na2S的电子式:
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
4.2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
5.某中学化学小组查阅资料发现金属氧化物R也能催化氯酸钾的分解,且R和二氧化锰的最佳催化温度均在500℃左右,于是对R和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表 1 用 MnO2 作催化剂
实验序号 KClO3 质量(g) MnO2 质量(g) 反应温度(℃) 待测数据
1 8.00 1.00 500 a
2 8.00 2.00 500 b
表 2 用R 作催化剂
实验序号 KClO3 质量(g) R 质量(g) 反应温度(℃) 待测数据
3 8.00 1.00 500 c
4 8.00 2.00 500 d
下列说法不正确的是
A.待测数据一定为时间
B.实验测得 a>b,说明适当增加催化剂的量可以加快反应速率
C.通过实验 2 和 4 可比较 MnO2 和催化剂R 的催化效果
D.升高温度,实验 3 中c 的值一定会减小
6.一定条件下,将3molA气体和1molB气体混合于固定容积为2L的密闭容器中,发生反应:3A(g)+B(g) C(s)+2D(g)。2min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。
下列判断正确的是
A.若混合气体的密度不再改变时,说明则该反应达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢
C.反应过程中A和B的转化率之比为3:1
D.开始到平衡,用C表示的化学反应速率为0.1mol·L-1·min-1
7.X、Y为两种短周期元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的常见化合物或离子不可能是
A.核外电子总数为10的阴离子
B.含有共价键的离子化合物
C.阴、阳离子个数比为1∶1的离子化合物
D.双核离子或四核分子
8.如图所示,有关化学反应和能量变化的说法正确的是
图a 图b
A.图a表示的是吸热反应的能量变化
B.图b中反应物比生成物稳定
C.图a可以表示C与CO2反应生成CO的能量变化
D.图a不需要加热就能发生,图b一定需要加热才能发生
9.将a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。若a、d相连,a为负极;c、d相连,c极产生大量气泡;b、c相连,b为正极;则这四种金属中金属性最强的是
A.a B.b C.c D.d
10.下列四种稀盐酸溶液跟铁片反应,最初反应速率最快的是
A.常温下300mLlmol/L的盐酸溶液 B.标况下10mL2mol/L的盐酸溶液
C.常温下5mL2mol/L的盐酸溶液 D.标况下20mL1mol/L的盐酸溶液
11.钛有“二十一世纪的金属”、“生物金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:。下列说法正确的是
A.中子数为14的镁原子: B.结构示意图:
C.的电子式: D.钛与人体骨骼相近,具有良好的生物相容性,能制造股骨头和各种关节
12.下列反应属于放热反应的是
A.C+CO22CO B.Al与稀盐酸反应
C.KClO3受热分解 D.浓硫酸溶于水
13.下列说法中正确的是
A.如果不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用的溶液冲洗
B.用镊子从煤油中取出一小块钠,用小刀切取一块绿豆大的钠直接放入水中,剩余钠放回试剂瓶
C.铜与浓硫酸加热条件下发生反应,反应结束后,冷却,然后向试管中加水,观察溶液呈蓝色
D.比较不同条件下与反应的快慢,可通过测定收集等体积需要的时间来实现
14.少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑥⑦⑧
15.在恒温恒容密闭容器中,充入一定量N2O4(g),发生反应N2O4(g)2NO2(g)ΔH>0,下列说法正确的是
A.反应过程中v(N2O4)消耗=2v(NO2)生成
B.其他条件不变,升高温度,N2O4平衡转化率减小
C.容器中气体的平均相对分子质量保持不变时即反应达平衡
D.加压,平衡逆向移动,正反应速率或小,逆反应速率加快
二、填空题
16.Ⅰ.回答下列问题
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_______。
(2)已知某粒子的结构示意图为 。
①当x-y=10时,该粒子为_______(填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)_______、_______、_______、_______、_______。
Ⅱ.结合元素周期表回答下列问题:
(3)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。_______
(4)表中所列元素,属于短周期元素的有_______,属于主族元素的有_______。
17.下列物质中:只存在共价键的是______(填序号,下同),只存在离子键的是______,既存在离子键又存在极性共价键的是____________。
①Ar ②NH4Cl ③CO2 ④KOH
⑤HNO3 ⑥Na2O2 ⑦CaO ⑧CaCl2
18.84 消毒液主要是以次氯酸钠为主要成分的消毒剂,疫情期间,很多人在家里面备上了一些消毒液,方便给家里消毒。84 消毒液制备所需原料可由 NaCl 制备,相关的反应如下图所示,请填写下列空白。
(1)NaClO 含有的化学键类型是_______;
(2)氯化钠溶液通电后,发生反应的化学反应方程式为_______;
(3)氢气在氯气中燃烧的现象是_______;
(4)请写出 Cl2与NaOH反应的化学方程式,并标出电子转移的方向和数目_______;
(5)Cl2 与 Ca(OH)2 反应可制备漂白粉,请用化学用语说明原理_______。
19.H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式:___________________;
(3)用电子式表示Na3N 的形成过程: ___________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO)=_________;
20.(1)用KClO3在H2SO4存在下与SO2反应制得ClO2.请写出反应的离子方程式:___________。
(2)CN-可以造成水体污染,某小组采用如下方法对污水进行处理。双氧水氧化法除NaCN。
①NaCN的电子式为___________。
②碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为___________。
(3)把ag固体NaHCO3加热分解一段时间后,固体质量变为b g。尚未分解的NaHCO3质量为___________g。
21.在密闭容器中,800℃时反应体系中,随时间的变化如表:
时间/s 0 1 2 3 4 5
0.0200 0.010 0.008 0.007 0.007 0.007
(1)上述反应_________(填“是”或“不是”)可逆反应。
(2)如图所示,表示变化曲线的是_________(填字母)。用表示从内反应的平均速率_________。
(3)能说明该反应已达到平衡状态的是_________(填选项)。
A. B.容器内气体总质量保持不变
C.容器内密度保持不变 D.
22.中国科学院长春应用化学研究所在甲烷(CH4)燃料电池技术方面获得很大突破,组装出了自呼吸电池及主动式电池。甲烷燃料电池工作的原理如图所示(电池的总反应方程式为CH4+2O2=CO2+2H2O)。
(1)b处通入的物质是___(填化学式,下同)。
(2)该电池的正极反应式为___;如果把电解质溶液换成氢氧化钾溶液,则该电池的负极反应式为____。
(3)工作一段时间后,3.2g甲烷完全反应生成CO2时,消耗氧气的体积为____L(标准状况下)。
23.下表表示合成氨反应(N2+3H22NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
压强(MPa)氨的含量 温度(℃) 0.1 10 30 60 100
200 0.153 0.815 0.899 0.954 0.988
300 0.022 0.520 0.710 0.842 0.926
400 0.004 0.251 0.470 0.652 0.798
分析上表数据,回答下列问题:
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强______
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:___________________________________________________________________________________________。
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:____________________。
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:____________。
24.Ⅰ.某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,请回答:
(1)该反应的化学方程式为_________(用X、Y、Z表示)。
(2)从反应开始至2 min末,X的平均反应速率为___________________。
(3)该反应由________(填字母序号)开始的。
A 正反应 B 逆反应 C 正、逆反应同时
(4)其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为___________态。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液中反应的化学方程式为 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O,该反应的机理较复杂,一般认为分以下几步:
①IO3- + SO32-→ IO2- + SO42-(慢); ②IO2- + SO32-→ IO- + SO42-(快);
③5I-+ 6H+ + IO3- →3I2 +3H2O(快); ④I2 + SO32- + H2O →2I- + SO42- + 2H+(快)。
(1)据此推测,该反应的总反应速率由__________步反应决定。
(2)若预先在酸性溶液中加入淀粉溶液,当_________离子(填对应离子符号)反应完时溶液才会变蓝。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.热化学方程式中的化学计量数代表物质的量,不代表分子数,A错误;
B.2mol液态氟化氢所含能量比2mol气态氟化氢所含能量低,故生成2mol液态氟化氢比生成2mol气态氟化氢放热多,B错误;
C.该反应是放热反应,所以在相同条件下,2 mol 氟化氢气体的总能量小于1 mol 氢气与1 mol 氟气的总能量,C错误;
D.由热化学方程式可知,2mol氟化氢气体分解成1mol的氢气和1mol的氟气时应吸收270kJ的热量,D正确。
答案选D。
2.A
【分析】根据装置没有电源,则构成的是原电池装置,又由于a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极,电极本身失电子发生氧化反应,b为正极,溶液中的氢离子得电子发生还原反应,电子从负极流向正极,据此分析。
【详解】A. a为负极,本身失电子发生氧化反应,b为正极,溶液中的氢离子得电子发生还原反应,A错误;
B. b为正极,溶液中的氢离子得电子发生还原反应,所以碳棒上有气体逸出,B正确;
C. 该装置构成了原电池,导线上有电流,电子从负极流向正极,即从a→b,C正确;
D. 根据装置没有电源,则构成原电池装置,又a在金属活动性顺序表中排在氢之前,b为碳棒,则a为负极本身失电子发生氧化反应,所以a极质量减小,D正确;
故合理选项是A。
【点睛】本题考查原电池原理,明确原电池中正、负极上得失电子是解本题关键,注意电子从负极流向正极,电流则从正极经外电路流向负极,溶液中的阴离子向负极移动,阳离子向正极移动,注意对基础知识的归纳整理。
3.B
【详解】A.质量数=质子数+中子数,故中子数为20的硫原子的质量数为36,表示为S,故A错误;
B.钠离子的核外有10个电子,核内有11个质子,故其结构示意图为,故B正确;
C.Na2S由2个钠离子和1个硫离子构成,故其电子式为,故C错误;
D.CO32-水解分步进行且可逆,故其水解方程式为CO32-+H2O HCO3-+OH-,故D错误。
故选:B。
4.D
【详解】A.放电时,内电路阳离子向正极移动,则Li+通过隔膜移向正极,A说法正确;
B.放电时,外电路电子由负极流向正极,即电子由铝箔沿导线流向铜箔,B说法正确;
C.放电时正极磷酸铁得电子,与锂离子反应生成磷酸亚铁锂,反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4,C说法正确;
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,反应中Fe、P元素化合价发生变化,D、说法错误;
答案为D。
【点睛】原电池内电路阳离子向正极移动;外电路电子由负极流向正极。
5.D
【详解】A. 通过测定个收集500mL氧气所消耗得时间,因此待测数据一定为时间,故A正确;
B. 实验测得时间a>b,说明加1g二氧化锰催化剂的反应速率比加2g二氧化锰催化剂的反应速率慢,说明适当增加催化剂的量可以加快反应速率,故B正确;
C. 通过实验2和4可比较MnO2和催化剂R的催化效果,其他变量都相同,只有不同的催化剂,因此可以比较,故C正确;
D. 根据题意R和二氧化锰的最佳催化温度均在500℃左右,升高温度,催化剂活性降低,因此实验3中C的值不一定会减小,可能会增大,故D错误。
综上所述,答案为D。
6.A
【详解】A.C是固体,反应后气体质量减小,容器体积不变,密度是变量,若混合气体的密度不再改变,说明则该反应达到平衡状态,故A正确;
B.反应前后均有气体,加压正逆反应速率均加快,故B错误;
C.反应达到平衡,生成0.8molD,则反应消耗1.2molA、0.4molB,A的转化率为、B的转化率为,转化率之比为1:1,故C错误;
D.C是固体,不能用C的浓度变化表示反应速率,故D错误;
选A。
7.C
【分析】X、Y为两种短周期元素,X原子的最外层电子数为1,可能是H、Li和Na;Y原子的最外层电子数为6,则可能是O和S,据此结合物质的构成分析解答。
【详解】A.H、O元素可以形成10电子微粒OH-,A不符合题意;
B.Na、O元素可以形成Na2O2,Na2O2中含有离子键和共价键,B不符合题意;
C.X、Y两种元素不能形成阴、阳离子个数比为1∶1的离子化合物,C符合题意;
D.H、O元素可以形成OH-、H2O2,D不符合题意;
答案选C。
8.B
【详解】A.图a中反应物的总能量高于生成物的总能量,为放热反应,A项错误;
B.图b中反应物M的能量比生成物N的能量低,故反应物较稳定,B项正确;
C.图a表示的是放热反应的能量变化,C与CO2反应生成CO是吸热反应,C项错误;
D.图a表示的是放热反应,所有的燃烧均为放热反应,但是多数燃烧开始需要加热,故D项错误。
故选B。
【点睛】本题主要考查了化学反应与能量变化,注意观察图中反应物的总能量和生成物的总能量的高低,判断吸热还是放热反应,注意反应条件与反应是放热反应还是吸热反应没有关系。
9.A
【详解】由题意,若a、d相连,a为负极,则金属性a>d;c、d相连,c极产生大量气泡,则c为正极,d为负极,金属性d>c;b、c相连,b为正极,则金属性c>b;综上,这四种金属中金属性最强的是a;
故选A。
【点睛】本题从原电池的角度比较金属性的活动性顺序,正确判断原电池负极是解本题关键,原电池中,一般较活泼的金属作负极,还可以根据电子、电流的流向及电极反应现象等判断正负极。
10.C
【详解】锌与稀盐酸反应的本质为Zn+2H+═H2↑+Zn2+,根据温度越高,氢离子浓度越大,最初的反应速率越快,根据选项分析,常温下5mL2mol/L的盐酸溶液与铁片最初反应速率最快,答案选C。
11.D
【详解】A.中子数为14的镁原子质量数为26,该核素表示为,故A错误;
B.核外有18个电子,结构示意图为 ,故B错误;
C.是离子化合物,电子式为,故C错误;
D.钛有“生物金属”的美称,钛与人体骨骼相近,具有良好的生物相容性,能制造股骨头和各种关节,故D正确;
选D。
12.B
【详解】A.C与CO2高温条件下才能反应,该反应过程中吸收热量,属于吸热反应,故A不符合题意;
B.活泼金属与酸制取氢气的反应为放热反应,故B符合题意;
C.大多数分解反应属于吸热反应,氯酸钾受热分解需要从外界吸收能量,属于吸热反应,故D不符合题意;
D.浓硫酸溶于水放热,但没有化学反应发生,故D不符合题意;
故选:B。
13.B
【详解】A.化学实验中,不慎将酸沾到皮肤上,应先用毛巾擦掉皮肤表面的酸,再立即用大量水冲洗,然后用3%~5%的NaHCO3溶液冲洗,故A错误;
B.用镊子从试剂瓶中取出一小块金属钠,用滤纸吸干表面的煤油后,用小刀切一小的钠块,放入盛有水的烧杯中,剩余的钠放回试剂瓶中,故B正确;
C.反应结束后,为观察溶液颜色,需将试管中溶液缓缓加入盛有水的烧杯中,顺序不能颠倒,否则液体飞溅,易发生危险,故C错误;
D.由反应方程式Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,则比较相同浓度的Na2S2O3溶液和不同浓度的H2SO4溶液反应的反应快慢可通过测定溶液出现浑浊的时间来实现,故D错误;
故选:B。
14.C
【解析】涉及的离子方程式: ,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
【详解】A.①⑥不符合题意,故A错误;
B.⑤不符合题意,故B错误;
C.③⑦⑧均符合题意,C正确;
D.⑥不符合题意,故D错误;
答案选C。
15.C
【详解】A.和均代表正反应速率,在反应过程中反应速率之比等于化学计量数之比,所以,故A错误;
B.N2O4(g)2NO2(g) ΔH>0,正反应为吸热反应,其他条件不变,升高温度,平衡正向移动,所以N2O4平衡转化率增大,故B错误;
C.容器中气体的平均相对分子质量为:,反应物生成物均为气体所以一直不变,反应前后气体总物质的量在改变,所以容器中气体的平均相对分子质量保持不变时即反应达平衡,故C正确;
D.加压,平衡向气体体积减小的方向移动,也就是逆向移动,但正反应速率和逆反应速率都加快,故D错误;
答案为C。
16.(1)
(2) 原子 氩原子 氯离子 硫离子 钾离子 钙离子
(3)
(4) abcdefg abcdef
【解析】(1)
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素为15号元素磷元素,其原子结构示意图是 ;
(2)
①当x-y=10时,说明x =2+8+y,则电子数=质子数,该粒子为原子。
②当y=8时,则为8电子稳定结构,可能是原子,可能是第三层电子数大于4得到电子形成的离子,可能是第四层电子数小于4失去电子形成的,故该粒子可能为氩原子、氯离子、硫离子、钾离子、钙离子;
(3)
根据元素周期表结构可知,元素周期表边界为:
;
(4)
短周期元素为第一、二、三周期,故属于短周期元素的有abcdefg;主族元素为元素周期表右侧第1、2列、左侧第2、3、4、5、6列,故属于主族元素的有abcdef。
17. ③⑤ ⑦⑧ ②④
【分析】共价化合物中只有共价键;简单阴阳离子间只有离子键;若阴阳离子中存在多原子形成的离子,则该化合物中除了离子键还有共价键。
【详解】①Ar为单原子分子,原子间不存在化学键。②NH4Cl,为NH4+和Cl-间,存在离子键,NH4+中N和H之间存在极性共价键,所以NH4Cl中既有离子键又有极性共价键。③CO2,为共价分子,只有共价键。④KOH中,k+和OH-之间存在离子键,OH-中O和H之间存在极性共价键,KOH中既有离子键又有极性共价键。⑤HNO3为共价分子,只存在共价键。Na2O2中,Na+和O22-间存在离子键,O22-中的2个O原子间,存在非极性共价键,则Na2O2中既有离子键又有非极性共价键。⑦CaO中,只有简单离子Ca2+和O2-,只存在离子键。⑧CaCl2中,Ca2+和Cl-间只存在离子键;
故:只有共价键的是③⑤;只有离子键的是⑦⑧;既存在离子键又存在极性共价键的是②④。
18.(1)离子键和共价键
(2)
(3)安静的燃烧,发出苍白色火焰,瓶口有白雾生成
(4)
(5)石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为
【分析】如图,电解食盐水生成NaOH、和,其反应为;电解熔融NaCl生成金属钠和氯气,其反应为;和NaOH反应生成、NaCl和水,其反应为;
【详解】(1)属于离子化合物,其中含有离子键和共价键;
故答案为:离子键和共价键;
(2)如图,氯化钠溶液通电后,生成NaOH、和,其反应为;
故答案为:;
(3)氢气能与氯气发生反应生成氯化氢,其发生反应的现象为:氢气在氯气中安静的燃烧,发出苍白色火焰,瓶口有白雾生成;
故答案为:安静的燃烧,发出苍白色火焰,瓶口有白雾生成;
(4)和NaOH反应生成、NaCl和水,其反应为,其中Cl元素化合价既升高也降低,既是氧化剂也是还原剂,转移电子数目为1,可用单线桥表示为;
故答案为:;
(5)与石灰乳反应制备漂白粉,石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为;
故答案为:石灰乳中含有水,因氯气溶于水生成HCl和HClO,分别与发生中和反应生成和和水,其反应为。
19. 第四周期,第VIII族 → 3:7 13:2
【详解】(1) Fe元素的原子序数是26,在元素周期表中的位置是第四周期、第VIII族;
(2) (CN)2是共价化合物,依据8电子稳定结构可知电子式为:;
(3) Na3N是离子化合物,用电子式表示Na3N的形成过程为:→;
(4) 设混合气体中含有xmolNO,ymolNO2,则
则2x+(y-x)=0.1、(y-x)/2=0.02,解得:x=0.03、y=0.07,所以x:y=3:7;
(5) 还原性强弱顺序为:I->Fe2+>I2,则在不断通Cl2的过程中,依次发生以下氧化还原反应:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、5Cl2+I2+6H2O=2IO+12H++10Cl-;可见当n(Cl2):n(FeI2)=1:1时,I-恰好全被氧化;当n(Cl2):n(FeI2)=1.5时,Fe2+正好全被氧化;当n(Cl2):n(FeI2)=6.5时,氯气和碘化亚铁恰好反应,反应方程式为13Cl2+2FeI2+12H2O=2FeCl3+4HIO3+20HCl,则溶液中n(Cl-):n(IO)=26:4=13:2。
20. 2ClO+SO2=2ClO2+ 2CN-+5H2O2+2OH-=2+N2↑+6H2O
【详解】(1)KClO3在H2SO4存在下与SO2反应制得ClO2和硫酸钾,离子方程式为2ClO+SO2=2ClO2+;
(2)①NaCN为离子化合物,电子式为;
②双氧水与CN-反应生成纯碱和一种无色无味的无毒气体,根据元素守恒,可判断为氮气,利用化合价升降法配平,则反应的离子方程式为2CN-+5H2O2+2OH-=2+N2↑+6H2O;
(3)NaHCO3加热分解方程式为2NaHCO3Na2CO3+CO2↑+H2O,固体质量减少为CO2、H2O的质量,
根据对应成比例,x=(a-b)g,则生成的碳酸钠固体的质量为(a-b)g,剩余固体为未分解的碳酸氢钠和生成的碳酸钠,故尚未分解的NaHCO3质量=bg-(a-b)g=g。
21. 是 b 0.003 D
【详解】(1)从表中数据可看出,反应进行3s后,n(NO)=0.007mol,且始终保持不变,从而可确定上述反应是可逆反应;
(2)从图中可看出, n(NO)=0.0013mol,结合化学反应,可确定 n(NO2)=0.0013mol,体积为2L,可知,从而确定表示NO2变化的是曲线b;
从表中数据可以得出,0~2s内, n(NO)=0.012mol,根据化学方程式, n(NO)= n(NO2),则用NO2表示0~2s内该反应的平均速率v==0.003mol/(L·s);
(3)A.不管反应进行到什么程度,总有v(NO2)=2v(O2),所以不一定达平衡状态,A不符合题意;
B.反应物和生成物均为气体,因此容器内气体的质量一直不变,所以气体质量不变,不一定达到平衡,B不符合题意;
C.容器内气体的质量不变,容器的体积不变,所以容器内密度保持不变,所以当密度不变时,反应不一定达平衡状态,C不符合题意;
D.v逆(NO)=2v正(O2)表示反应方向相反,且数值之比等于化学计量数之比,则此时反应达平衡状态,D符合题意;
答案选D。
22.(1)CH4
(2) O2+4H++4e-=2H2O CH4+10OH-+8e-=CO+7H2O
(3)8.96
【分析】原电池中阳离子流向正极,故右边为正极左边为负极。根据甲烷燃料电池的总反应方程式为CH4+2O2=CO2+2H2O,可知甲烷失去电子,发生氧化反应,故左边为负极,b通入的为甲烷,a为二氧化碳;氧气得电子,发生还原反应,故右边为正极,c为氧气。
(1)根据分析可知,b处通入的为CH4。
(2)正极为氧气得电子,电极反应式为O2+4H++4e-=2H2O;如果把电解质溶液换成氢氧化钾溶液,则该电池的负极甲烷失电子生成碳酸根,故电极反应为CH4+10OH-+8e-=CO+7H2O。
(3)根据总反应方程式为CH4+2O2=CO2+2H2O,1mol甲烷消耗氧气2mol,3.2g甲烷的物质的量为=0.2mol,故标准状况下消耗氧气的体积为0.4mol×22.4L/mol=8.96L。
23. 不能 该反应为可逆反应,在一定条件下进行时,将达到化学平衡状态,反应物不可能完全转化为生成物 增大压强,降低温度 温度为300℃,压强为30MPa
【详解】(1)由于是可逆反应,所以在一定条件下进行时,将达到化学平衡状态,反应物不可能完全转化为生成物。
(2)根据表中数据可知,降低温度或增大压强,可使平衡混合物中氨的含量增大。
(3)根据表中数据可知,欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为温度为300℃,压强为30Mpa。
24. 2Z +Y 3X 0.1 mol L-1 min-1 C 液态或固态 ① SO32-
【详解】Ⅰ.(1)由图象可知X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比等于它们的物质的量变化之比为0.6:0.2:0.4=3:1:2,所以方程式为2Z +Y 3X;
(2)v(X)==0.1 mol L-1 min-1;
(3)根据图中信息可知,反应开始时各物质的量均不为0,故该反应由正、逆反应同时开始,答案选C;
(4)因固体或纯液体的浓度为常数,改变其用量反应速率不变,故其他条件不变,只增加Y的用量,若该反应的速率不发生变化,则Y为液态或固态;
Ⅱ.(1)由慢反应决定整个反应过程的速率,故反应速率由①步反应决定,故答案为①;
(2)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变蓝的现象产生。
答案第1页,共2页
答案第1页,共2页
