第二章《分子结构与性质》同步练习(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章《分子结构与性质》同步练习(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 594.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 10:46:49 | ||
图片预览




文档简介
第二章《 分子结构与性质》同步练习
一、单选题
1.宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄(As4S4)的结构如图所示,下列说法正确的是
A.雄黄中硫的价态为+2 价
B.As 原子的核外电子排布式为[Ar]4s24p3
C.As4S4分子中 As 原子和 S 原子的杂化类型都为 sp3杂化
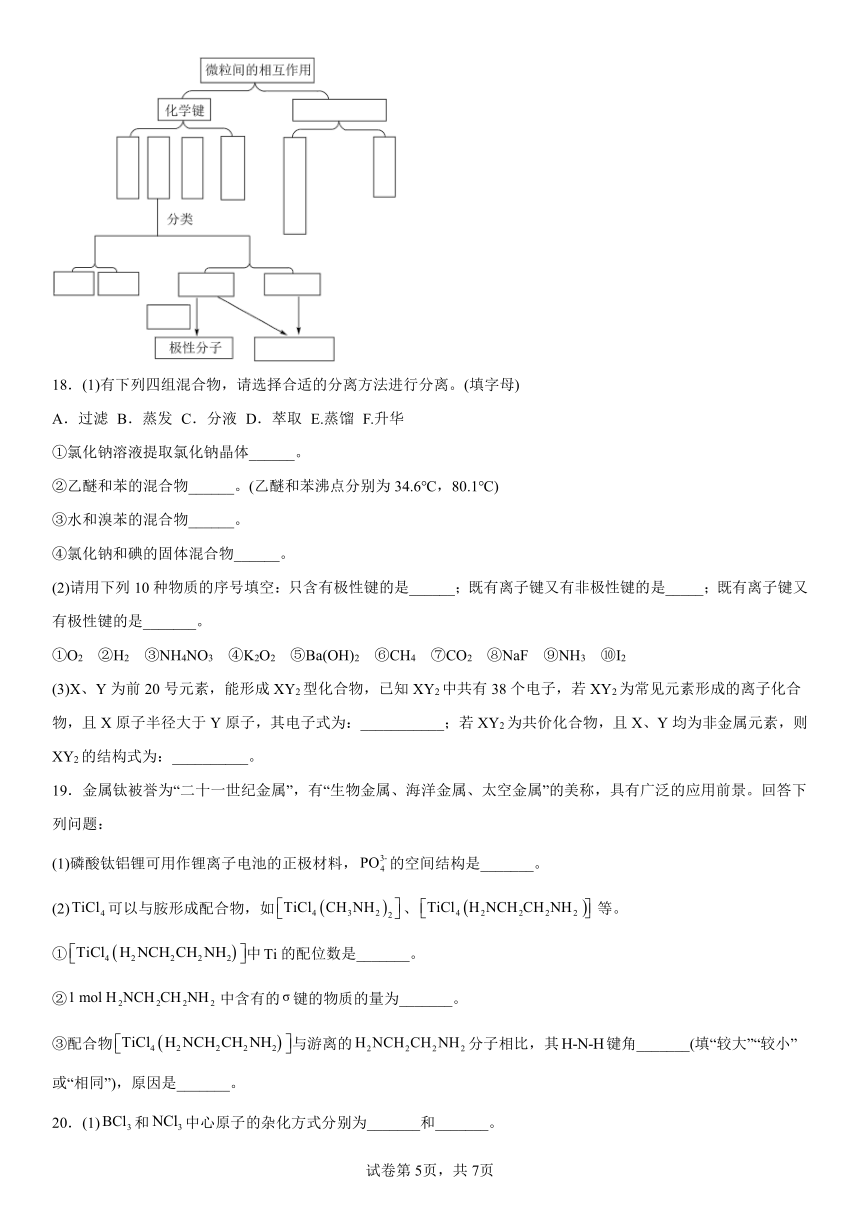
D.古代熏蒸的消毒原理与 H2O2、酒精相同
2.二氧化硫既是大气污染物,也是重要的化工原料。下列有关的说法错误的是
A.是V形的极性分子
B.二氧化硫可用于某些食品加工
C.可通过氧化制保险粉
D.煤炭燃烧时加入生石灰,通过“钙基固硫”法可将最终转化为
3.科学研究发现:红橙色更容易招蚊子,蚊子能闻到气味。下列有关的说法错误的是
A.是直线形分子 B.是由极性键形成的非极性分子
C.中键角为180° D.干冰气化时克服共价键
4.列实验事实不能用氢键来解释的是
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
5.下列分子中的碳原子为杂化的是
A. B. C. D.
6.下列事实与氢键有关的是
①NH3的熔、沸点比PH3的熔、沸点高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子即使加热至较高温度下也很难分解
A.①②③④⑤ B.①②③⑤ C.①②③④⑤⑥ D.①②③⑤⑥
7.为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol中杂化的碳原子数为0.1
B.1g的中含有的中子数为
C.2.8g由和CO组成的混合物中所含电子数为2.8
D.一定条件下,在密闭容器中足量与3mol充分反应,生成的分子数为2
8.下列反应中,有机物分子中化学键的断裂只涉及键断裂的是
A.CH4的燃烧 B.与的加成反应
C.CH4与Cl2的取代反应 D.被酸性溶液氧化
9.短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;化合物D2E2是一种具有难闻气味的黄红色液体, 与其他元素组成的物质有如下转化关系:2D2E2+2A2B = DB2↑+□↓+4AE(方框代表一种生成物)。下列说法不正确的是
A.DB2能使紫色石蕊变色·
B.简单阴离子还原性:D>E>A
C.D2E2分子中既存在极性键又存在非极性键
D.上述方程式所涉物质中□的熔点最高
10.下列物质既含有离子键,又含有非极性共价键的是
A. B. C. D.
11.前4周期元素X、Y、Z、W的原子序数依次增大。X和Y的基态原子的2p能级上各有两个未成对电子,Z与Y同族,W原子核内有29个质子,下列说法正确的是
A.W与Y形成的化合物晶胞如图所示,该化合物的化学式为WY
B.原子半径:r(Z)>r(Y)>r(X)
C.元素第一电离能:I1(Z)>I1(Y)
D.简单氢化物的沸点:Y>Z
12.下列叙述正确的是
A.水溶性:SO2>NH3>Cl2
B.热稳定性:HF>H2O>NH3>PH3
C.18 g重水(D2O)中含有的电子数目为10NA
D.标准状况下,2.24L戊烷所含原子数为1.7NA
13.意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示,正四面体结构。下列有关N4的说法正确的是
A.N4的沸点比N2低
B.N4分子中只含有非极性键,且键的夹角为109 28ˊ
C.N4分子中每个氮原子都不满足8个电子
D.1molN4中含有6mol共价键
14.的分子结构与相似,如下图所示。下列有关说法错误的是
A.是极性分子
B.分子中所有原子均满足8电子稳定结构
C.分子中既含有极性键又含有非极性键
D.的相对分子质量比大,熔、沸点高
15.下列说法正确的是
A.某原子跟其他原子形成共价键时,其共价键数目一定等于该元素原子的价电子数
B.C原子最多能形成两个共价键
C.1个N原子只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
D.已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4molN—H键断裂,则形成6molπ键
二、填空题
16.铬、铜、硼在很多领域有重要用途.请回答下列问题:
(1)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍.某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,一个该分子中含有________个σ键。
(2)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①铬同周期的基态原子中最外层电子数为2的副族元素有________种。
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有________(填字母),CS2分子的键角是________。
(3)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
在Xm-中,硼原子轨道的杂化类型有________;m= ________(填数字)。
17.微粒间的相互作用包括多种类型,微粒通过这些作用可以形成具有不同空间结构的分子或物质。本章学习了微粒间的相互作用及与其相关的许多知识,如共价键、键、键、极性键、非极性键、离子键、配位键、金属键、范德华力、氢键、分子空间结构、极性分子、非极性分子等,请通过图示的方式表示它们之间的相互关系,以加深对所学内容的理解___________。
18.(1)有下列四组混合物,请选择合适的分离方法进行分离。(填字母)
A.过滤 B.蒸发 C.分液 D.萃取 E.蒸馏 F.升华
①氯化钠溶液提取氯化钠晶体______。
②乙醚和苯的混合物______。(乙醚和苯沸点分别为34.6℃,80.1℃)
③水和溴苯的混合物______。
④氯化钠和碘的固体混合物______。
(2)请用下列10种物质的序号填空:只含有极性键的是______;既有离子键又有非极性键的是_____;既有离子键又有极性键的是_______。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(3)X、Y为前20号元素,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X原子半径大于Y原子,其电子式为:___________;若XY2为共价化合物,且X、Y均为非金属元素,则XY2的结构式为:__________。
19.金属钛被誉为“二十一世纪金属”,有“生物金属、海洋金属、太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)磷酸钛铝锂可用作锂离子电池的正极材料,的空间结构是_______。
(2)可以与胺形成配合物,如、等。
①中的配位数是_______。
②中含有的键的物质的量为_______。
③配合物与游离的分子相比,其键角_______(填“较大”“较小”或“相同”),原因是_______。
20.(1)和中心原子的杂化方式分别为_______和_______。
(2)分子的空间结构为_______,中心原子的杂化轨道类型为_______。中心原子的杂化轨道类型为_______。
(3)在硅酸盐中,四面体(如图)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。如图为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为_______。
21.碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。在基态14C原子中,核外存在_______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________________________。
(3)CS2分子中,共价键的类型有_______,C原子的杂化轨道类型是_______。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为-200C沸点为1030C,其固体属于__________晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
在石墨烯晶体中,每个C原子连接___个六元环,每个六元环占有_____个C原子。
22.按要求完成下列各题
(1)气态氢化物热稳定性大于的主要原因是___________。
(2)常温下,在水中的溶解度乙醇大于氯乙烷,原因是___________。
(3)过氧化钠的电子式是___________。
(4)溶液显碱性的原因是(用离子方程式说明)___________。
(5)已知葡萄糖的燃烧热为,试写出葡萄糖燃烧的热化学方程式___________。
23.白磷分子中P—P键易断开,若一个白磷分子中每个P—P键均断开插入一个氧原子,则一共可结合________个氧原子,这样得到磷的一种氧化物,其分子式为________。由C、H、N三种元素组成的某化合物,其分子内含4个氮原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C和C===C,则化合物的分子式为________。
24.我国科学家屠呦呦因成功从黄花蒿中提取青蒿素而获得2015年诺贝尔奖。
(1)青蒿素是治疗疟疾的有效药物,属于酯类化合物,其分子结构如图所示,请用笔在图中将酯基圈出来。____。
(2)从黄花蒿中提取青蒿素的流程如图:
研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如表:
溶剂 水 乙醇 乙醚
沸点/℃ 100 78 35
提取效率 几乎为0 35% 95%
①用水作溶剂,提取无效的原因是____。
②研究发现,青蒿素分子中的某个基团对热不稳定,据此分析用乙醚作溶剂,提取效率高于乙醇的原因是____。
(3)研究还发现,将青蒿素通过下面反应转化为水溶性增强的双氢青蒿素,治疗疟疾的效果更好。
从分子结构与性质的关系角度推测双氢青蒿素疗效更好的原因____。
(4)提取并转化青蒿素治疗疟疾的过程中,应考虑物质的____、____等性质。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.硫元素的非金属性强于砷元素,由结构示意图可知,雄黄中硫元素的价态为—2价,故A错误;
B.砷元素位于元素周期表第四周期VA族, As原子核外电子排布式为[Ar]3d104s24p3,故B错误;
C.由结构示意图可知,S和As的价层电子对数均为4,则As4S4 分子中 As 原子和 S 原子的杂化类型都为 sp3 杂化,故C正确;
D.古代熏蒸和双氧水的消毒原理均属于化学变化,而酒精的消毒原理为物理变化,原理不相同,故D错误;
故选C。
2.C
【详解】A.SO2分子的中心原子的价层电子对数为,含有1个孤对电子,其空间构型为V型,SO2分子中正负电荷中心不对称,为极性分子,A说法正确;
B.一定量的二氧化硫可用作食品的抗氧化剂,B说法正确;
C.保险粉中S的化合价为+3价,SO2中S的化合价为+4价,SO2→过程中S的化合价降低,SO2被还原,C说法错误;
D.煤炭燃烧时会生成,加入生石灰(CaO),通过“钙基固硫”法可将最终转化为,D说法正确;
答案选C。
3.D
【详解】A.CO2结构式为O=C=O,属于直线形分子,故A正确;
B.CO2分子中含有C=O键,为极性共价键,其分子结构为直线型,正负电荷中心重合,为非极性分子,故B正确;
C.CO2结构式为O=C=O,属于直线形分子,其键角为180°,故C正确;
D.干冰是分子晶体,分子晶体是分子靠分子间作用力形成的晶体,气化时克服分子间作用力,不破坏共价键,故D错误;
答案选D。
4.A
【详解】A.因为C元素的非金属性比Si强,所以CH4的稳定性比SiH4的稳定性高,与氢键无关,A错误;
B.乙醇能与水以任意比互溶的主要原因有:乙醇和水分子之间形成氢键,乙醇和水均为极性分子(相似相溶),B正确;
C.由于邻羟基苯甲醛形成分子内氢键,使熔沸点偏低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点偏高,所以邻羟基苯甲醛的沸点低于对羟基苯甲醛,C正确;
D.水分子间存在氢键从而形成缔合物,所以接近沸点的水蒸气的相对分子质量测量值大于18,D正确;
答案选A。
5.C
【详解】A.中碳形成4个σ键,为sp3杂化,故A不选;
B.HCHO中碳形成3个σ键,没有孤电子对,为sp2杂化,故B不选;
C.C2H2中碳形成2个σ键,没有孤电子对,为sp杂化,故C选;
D.C2H4中碳形成3个σ键,没有孤电子对,为sp2杂化,故D不选;
故选C。
6.B
【详解】①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键,则NH3的熔、沸点比PH3的熔、沸点高,故①正确;
②乙醇、醋酸和水分子间形成氢键,乙醇、醋酸可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④HCl比HI相对分子质量小,HCl比HI的沸点低,与氢键无关,故④错误;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
⑥稳定性与化学键有关,水分子中O-H键能大,水分子即使加热至较高温度下也很难分解,与氢键无关,故⑥错误;
综上所述,①②③⑤正确;
故选B。
7.A
【详解】A.分子中双键上的碳原子均为sp2杂化,只有1个碳原子为sp3杂化,则0.1mol中杂化的碳原子数为0.1,A正确;
B.1个分子中含有10个中子,则中含有的中子数为0.5,B错误;
C.和CO的摩尔质量均为28g/mol,2.8g由和CO组成的混合物的物质的量为0.1mol,和CO所含电子数均为14,则0.1mol 和CO组成的混合物中所含电子数为1.4,C错误;
D.由于该反应为可逆反应,存在反应限度,因此充分反应后生成的分子数小于2,D错误;
故选A。
8.B
【详解】A.CH4不含π键,且有机物燃烧时,断裂所有的化学键,A不符合题意;
B.C2H4和Cl2发生加成反应时,C2H4中的碳碳双键断裂形成碳碳单键和碳氯单键,化学键的断裂只涉及π键的断裂,B符合题意;
C.CH4不含π键,且取代反应中,断裂的化学键是单键,即σ键,C不符合题意;
D.C2H4被酸性KMnO4溶液氧化时,C2H4中的所有化学键断裂,即断裂的化学键既有σ键,又有π键,D不符合题意;
故选B。
9.B
【分析】短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;则A为H、B为O,C为Na,按质量守恒定律、2D2E2+2 A2B = DB2↑+3D↓+4AE,化合物D2E2中D呈+1价,D为难溶于水的固体单质、DB2为D的氧化物、其中D呈+4价,则D为S,D2E2中E呈-1价,AE即E的氢化物中E呈-1价,E为ⅦA中Cl,据此回答;
【详解】A.DB2即二氧化硫,为酸性氧化物,故能使紫色石蕊变红色·,A正确;
B. H还原性强,会还原水分子中的正价氢,反应剧烈并析出氢气,而硫化钠、氯化钠不会 ,故简单阴离子还原性: ,B错误;
C. D2E2分子的结构式为Cl-S-S-Cl,故既存在极性键又存在非极性键,C正确;
D. 上述方程式所涉物质中□为S,硫单质在室温下呈固态,方程式中其它物质成气态或液态,则硫单质熔点最高,D正确;
答案选B。
10.B
【详解】A.与之间为离子键,N-H、S=O、S-O、O-H为极性共价键,故A项不符合题意;
B.K+与之间为离子键,S原子与S原子之间为非极性共价键,故B项符合题意;
C.中不含离子键,故C项不符合题意;
D.Na+与之间为离子键,B原子与O原子之间为极性共价键,故D项不符合题意;
综上所述,答案为B。
11.D
【分析】前4周期元素X、Y、Z、W的原子序数依次增大,X和Y的基态原子的2p能级上各有两个未成对电子,电子排布分别为1s22s2p2、1s2s2p4,则X为C、Y为O,Z与Y同族,则Z为S元素;W原子核内有29个质子,则W为Cu元素,然后根据元素周期律分析解答。
【详解】由分析可知:X为C、Y为O、Z为S、W为Cu。
A.晶胞中白色球数目为4、黑色球数目为1+8×=2,二者数目之比为1:2,故白球表示Cu,黑球表示O,该氧化物不可能为CuO,而是表示Cu2O,A错误;
B.同周期元素从左向右原子半径逐渐减小,不同周期元素,一般情况下,原子核外电子层越多原子半径越大,则原子半径r(Z) >r(X)>r(Y),B错误;
C.同主族自上而下第一电离能逐渐减小,故元素第一电离能:I1(Z)<I1(Y),C错误;
D.Y为O、Z为S,二者的氢化物H2O、H2S都是由分子构成,分子之间以分子间作用力结合,由于H2O分子之间还存在氢键,增加了分子之间的吸引作用,导致物质的熔沸点升高,故简单氢化物的沸点:Y>Z,D 正确;
故合理选项是D。
12.B
【详解】A.NH3与水分子间能形成氢键,其极易溶于水,水溶性大于SO2,A错误;
B.非金属性:F>O>N>P,共价键键能:H-F>H-O>H-N>H-P,则热稳定性:HF>H2O>NH3>PH3,B正确;
C.D2O 分子含有10电子,18 g重水(D2O)物质的量为,其中含有的电子数目为9NA,C错误;
D.戊烷在标准状况下不是气体,不能用气体摩尔体积计算,D错误;
故选B。
13.D
【详解】A.N4和N2都是分子晶体,相对分子量越大,分子间作用力越大,沸点越高,N4的沸点比N2高,故A错误;
B.N4是正四面体型结构,键角是60°,故B错误;
C.氮原子最外层5个电子,每个氮原子和三个氮原子分别形成一个共用电子对,所以每个氮原子的最外层都达到8电子稳定结构,故C错误;
D. 由题中N4分子结构可知,一个分子中含有6个共价键,所以1mol N4中含有6mol共价键,故D正确。
答案选D。
14.D
【详解】A.该分子中,电荷分布是不均匀的,不对称的,所以是极性分子,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.Cl-S-S-Cl中硫原子和硫原子之间存在非极性键,硫和氯原子之间存在极性键,故C正确;
D.和均属于分子晶体,中存在氢键,的熔沸点高,故D错误;
答案选D。
15.C
【详解】A.非金属元素的原子形成的共价键的数目一般等于该原子最外层未成对电子数,但不一定等于该元素原子的价电子数,A项错误;
B.C原子最外层有4个电子,最多可形成4个共价键,B项错误;
C.N原子最外层轨道上有3个未成对电子,1个N原子可以与3个H原子结合形成,达到饱和,C项正确;
D.若该反应中有键断裂,则生成;1个分子中含有1个键、2个π键,生成,形成键,D项错误;
故选C。
16.(1)12
(2) 8 be 180°
(3) sp2、sp3 2
【详解】(1)A、B两种短周期元素,A是原子半径最小的元素为H元素,B原子最外层电子数是次外层的两倍为C元素,该分子由C、H两种元素组成且原子个数比为1:1的平面正六边形分子为C6H6,分子中6个碳原子的电子都以sp2杂化轨道相互重叠,形成6个碳碳σ键,又各以1个sp2杂化轨道分别跟氢原子的1s轨道进行重叠,形成6个σ键,共12个σ键;
(2)①铬是24号元素,核外电子排布式为1s22s22p63s23p63d54s1;同周期最外层排2个电子的元素有Sc、Ti、V、Mn、Fe、Co、Ni、Zn,均属于副族元素,因此共8种;
②a:C6H6的6个C之间形成大π键,为平面结构,所以C原子为sp2杂化;
b:CH3OH中C形成的化学键均为单键,所以C原子为sp3杂化;
c:甲醛的C和O之间为双键,杂化方式为sp2杂化;
d:CS2分子碳原子的价层电子对为2+×(4-2×2)=2,,所以C原子为sp杂化;
e:CCl4中碳原子价层电子对个数=4+×(4-4×1)=4,所以C原子为sp3杂化;
综上所述,碳原子采取sp3杂化的分子有be;
CS2中碳原子为sp杂化,空间构型为直线形,分子的键角是180°;
(3)1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;B一般是形成3个键,4号B形成4个键,其中1个键是配位键,配位键存在4号与5号之间;观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
17.微粒间的相互作用包括化学键、分子间作用力;
化学键包括离子键、共价键、金属键、配位键;分子间作用力包括范德华力、氢键;
共价键根据电子云重叠方式分为σ键和Π键;根据共用电子对是否偏移分为极性键和非极性键;极性键形成的分子,若正电中心和负电中心不重叠,为极性分子;极性键形成的分子,若正电中心和负电中心重叠,为非极性分子;非极性键一般形成非极性分子。
【详解】微粒间的相互作用包括化学键、分子间作用力;
化学键包括离子键、共价键、金属键、配位键;分子间作用力包括范德华力、氢键;
共价键根据电子云重叠方式分为σ键和Π键;根据共用电子对是否偏移分为极性键和非极性键;极性键形成的分子,若正电中心和负电中心不重叠,为极性分子;极性键形成的分子,若正电中心和负电中心重叠,为非极性分子;非极性键一般形成非极性分子。
18. B E C F ⑥⑦⑨ ④ ③⑤ S=C=S
【分析】已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S。
【详解】(1)①蒸发氯化钠溶液即可得到氯化钠晶体,操作为蒸发;
②乙醚和苯的沸点不同,则分离两种混合物用蒸馏的方法;
③水和溴苯为互不相溶的两种液体,可用分液进行分离;
④碘加热易升华,而氯化钠加热不分解、不升华,可用升华方法分离氯化钠和碘的固体混合物;
(2)①O2只含有O=O,非极性共价键;
②H2只含有H-H非极性共价键;
③NH4NO3含有铵根离子与硝酸根离子间的离子键,又含有极性共价键;
④K2O2含有钾离子与过氧根离子间的离子键,又含有O-O非极性共价键;
⑤Ba(OH)2含有钡离子与氢氧根离子间的离子键,又含有O-H极性共价键;
⑥CH4只含有C-H极性共价键;
⑦CO2只含有C=O极性共价键;
⑧NaF只含有钠离子与氟离子间的离子键;
⑨NH3只含有N-H极性共价键;
⑩I2只含有I-I非极性共价键;
综上所述,只含有极性键的是⑥⑦⑨;既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤;
(3)已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F,CaF2为离子化合物,电子式为;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S,该物质为CS2,结构式为S=C=S。
19.(1)正四面体
(2) 6 较大 通过配位键与结合后,原来的孤电子对变为成键电子对,对成键电子对的排斥力减小,键之间的键角增大
【详解】(1)
的中心原子S的价层电子对数为4,为sp3杂化,并且中心原子P不含有孤电子对,故的空间结构为正四面体。
(2)①中与形成2个配位键,与Cl形成4个配位键,从而得出配位键的数目为6。
②1个分子中含有11个共价单键,则中含键。
③游离的分子中每个N原子有1对孤电子对,配合物中每个N原子提供1对孤电子对与形成配位键,由于孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,所以配合物中键角较大。
20. V形
【详解】(1)的中心原子的价层电子对数为,所以为杂化;的中心原子的价层电子对数为,所以为杂化;故答案为:;;
(2)的中心原子的价层电子对数为,故为杂化;由于孤电子对数为2,所以是V形分子;的结构式是,中心原子碳原子形成3个σ键,杂化轨道数为3,故为杂化;故答案为:V形;;;
(3)由题图b可知,每个硅原子与4个氧原子形成4个σ键,故为杂化,故答案为:。
21. 电子云 2 C原子最外层有4个电子,不易得失电子 δ键和π键 SP杂化 分子 3 2
【详解】(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述,离核近的区域电子云密度较大,离核远的区域电子云密度较小;
(2)C原子核外电子排布为1s22s22p2,轨道式为如图所示:,则在基态14C原子中,核外存在2对自旋相反的电子。
(3)碳原子最外层有4个电子,化学性质比较稳定,在形成键的时候,不易得到电子也不易失去电子,所以碳在形成化合物时,其键型以共价键为主,故答案为C原子最外层有4个电子,不易得失电子;
(4)CS2分子的结构式为S=C=S,故CS2分子中,共价键的类型有δ键和π键;
(5)CS2分子中C原子形成2个δ键,孤对电子数为,则为sp杂化;
(6)Fe(CO)5熔点为253K,沸点为376K,具有分子晶体的性质,则固体应为分子晶体;
(7)石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学键,则每个C原子连接3个六元环;
(8)石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学键,则每个C原子连接3个六元环,每个六元环占有的C原子数为6×1/3=2。
22.(1)因为共价键键能H-F>H-Cl
(2)乙醇分子和水分子间能形成氢键
(3)
(4)+H2O +OH-
(5)C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) ΔH=2800kJ·mol-1
【分析】(1)
气态氢化物的稳定性与共价键的键能大小有关,故因为共价键键能H-F>H-Cl,所以气态氢化物热稳定性大于。
(2)
因为乙醇分子和水分子间能形成氢键,所以在水中的溶解度乙醇大于氯乙烷。
(3)
过氧化钠的电子式为。
(4)
溶液显碱性的原因是+H2O +OH-。
(5)
葡萄糖燃烧的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) ΔH=2800kJ·mol-1。
23. 6 P4O6 C6H12N4
【详解】试题分析:在白磷分子空间结构图中,分子内共有6个P—P键,由题意,可嵌入6个O原子,分子式为P4O6;同理4个N原子也可构成正四面体,在N—N之间嵌入6个C原子,因无C—C和C===C,为满足碳4价,化合物分子应由4个N原子和6个CH2组成,故分子式为C6H12N4。
考点:考查白磷分子的结构、分子式的判断
点评:该题是中等难度的试题,试题注重基础和能力的双向考查。有利于培养学生的逻辑思维能力和抽象思维能力,也有助于培养灵活运用基础知识解决实际问题的能力。
24.(1)
(2) 青蒿素难溶于水 由于乙醚沸点比较低,蒸馏提取所需温度较低,可保护—O—O—键不被破坏
(3)双青蒿素分子内有羟基,可以与水分子形成氢键,水溶性增强,疗效更好
(4) 溶解性 热稳定性、沸点
【解析】(1)
酯基的结构为:,则青蒿素分子中酯基的位置如图所示: ;
(2)
①观察青蒿素的分子结构,该分子中不含羟基、羧基、醛基等亲水基团,则该物质在水中的溶解能力很差;
②青蒿素分子中的醚键热稳定性较差,提取过程中不宜使用较高温度,而乙醚沸点比较低,蒸馏提取所需温度较低,可保护-O-O-键不被破坏;
(3)
相比于青蒿素,双氢青蒿素分子内有羟基,可以与水分子形成氢键,水溶性增强、疗效更好;
(4)
该过程中,应考虑物质的溶解性、热稳定性、沸点等性质。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄(As4S4)的结构如图所示,下列说法正确的是
A.雄黄中硫的价态为+2 价
B.As 原子的核外电子排布式为[Ar]4s24p3
C.As4S4分子中 As 原子和 S 原子的杂化类型都为 sp3杂化
D.古代熏蒸的消毒原理与 H2O2、酒精相同
2.二氧化硫既是大气污染物,也是重要的化工原料。下列有关的说法错误的是
A.是V形的极性分子
B.二氧化硫可用于某些食品加工
C.可通过氧化制保险粉
D.煤炭燃烧时加入生石灰,通过“钙基固硫”法可将最终转化为
3.科学研究发现:红橙色更容易招蚊子,蚊子能闻到气味。下列有关的说法错误的是
A.是直线形分子 B.是由极性键形成的非极性分子
C.中键角为180° D.干冰气化时克服共价键
4.列实验事实不能用氢键来解释的是
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
5.下列分子中的碳原子为杂化的是
A. B. C. D.
6.下列事实与氢键有关的是
①NH3的熔、沸点比PH3的熔、沸点高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子即使加热至较高温度下也很难分解
A.①②③④⑤ B.①②③⑤ C.①②③④⑤⑥ D.①②③⑤⑥
7.为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol中杂化的碳原子数为0.1
B.1g的中含有的中子数为
C.2.8g由和CO组成的混合物中所含电子数为2.8
D.一定条件下,在密闭容器中足量与3mol充分反应,生成的分子数为2
8.下列反应中,有机物分子中化学键的断裂只涉及键断裂的是
A.CH4的燃烧 B.与的加成反应
C.CH4与Cl2的取代反应 D.被酸性溶液氧化
9.短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;化合物D2E2是一种具有难闻气味的黄红色液体, 与其他元素组成的物质有如下转化关系:2D2E2+2A2B = DB2↑+□↓+4AE(方框代表一种生成物)。下列说法不正确的是
A.DB2能使紫色石蕊变色·
B.简单阴离子还原性:D>E>A
C.D2E2分子中既存在极性键又存在非极性键
D.上述方程式所涉物质中□的熔点最高
10.下列物质既含有离子键,又含有非极性共价键的是
A. B. C. D.
11.前4周期元素X、Y、Z、W的原子序数依次增大。X和Y的基态原子的2p能级上各有两个未成对电子,Z与Y同族,W原子核内有29个质子,下列说法正确的是
A.W与Y形成的化合物晶胞如图所示,该化合物的化学式为WY
B.原子半径:r(Z)>r(Y)>r(X)
C.元素第一电离能:I1(Z)>I1(Y)
D.简单氢化物的沸点:Y>Z
12.下列叙述正确的是
A.水溶性:SO2>NH3>Cl2
B.热稳定性:HF>H2O>NH3>PH3
C.18 g重水(D2O)中含有的电子数目为10NA
D.标准状况下,2.24L戊烷所含原子数为1.7NA
13.意大利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如图所示,正四面体结构。下列有关N4的说法正确的是
A.N4的沸点比N2低
B.N4分子中只含有非极性键,且键的夹角为109 28ˊ
C.N4分子中每个氮原子都不满足8个电子
D.1molN4中含有6mol共价键
14.的分子结构与相似,如下图所示。下列有关说法错误的是
A.是极性分子
B.分子中所有原子均满足8电子稳定结构
C.分子中既含有极性键又含有非极性键
D.的相对分子质量比大,熔、沸点高
15.下列说法正确的是
A.某原子跟其他原子形成共价键时,其共价键数目一定等于该元素原子的价电子数
B.C原子最多能形成两个共价键
C.1个N原子只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
D.已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4molN—H键断裂,则形成6molπ键
二、填空题
16.铬、铜、硼在很多领域有重要用途.请回答下列问题:
(1)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍.某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,一个该分子中含有________个σ键。
(2)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①铬同周期的基态原子中最外层电子数为2的副族元素有________种。
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有________(填字母),CS2分子的键角是________。
(3)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
在Xm-中,硼原子轨道的杂化类型有________;m= ________(填数字)。
17.微粒间的相互作用包括多种类型,微粒通过这些作用可以形成具有不同空间结构的分子或物质。本章学习了微粒间的相互作用及与其相关的许多知识,如共价键、键、键、极性键、非极性键、离子键、配位键、金属键、范德华力、氢键、分子空间结构、极性分子、非极性分子等,请通过图示的方式表示它们之间的相互关系,以加深对所学内容的理解___________。
18.(1)有下列四组混合物,请选择合适的分离方法进行分离。(填字母)
A.过滤 B.蒸发 C.分液 D.萃取 E.蒸馏 F.升华
①氯化钠溶液提取氯化钠晶体______。
②乙醚和苯的混合物______。(乙醚和苯沸点分别为34.6℃,80.1℃)
③水和溴苯的混合物______。
④氯化钠和碘的固体混合物______。
(2)请用下列10种物质的序号填空:只含有极性键的是______;既有离子键又有非极性键的是_____;既有离子键又有极性键的是_______。
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
(3)X、Y为前20号元素,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X原子半径大于Y原子,其电子式为:___________;若XY2为共价化合物,且X、Y均为非金属元素,则XY2的结构式为:__________。
19.金属钛被誉为“二十一世纪金属”,有“生物金属、海洋金属、太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)磷酸钛铝锂可用作锂离子电池的正极材料,的空间结构是_______。
(2)可以与胺形成配合物,如、等。
①中的配位数是_______。
②中含有的键的物质的量为_______。
③配合物与游离的分子相比,其键角_______(填“较大”“较小”或“相同”),原因是_______。
20.(1)和中心原子的杂化方式分别为_______和_______。
(2)分子的空间结构为_______,中心原子的杂化轨道类型为_______。中心原子的杂化轨道类型为_______。
(3)在硅酸盐中,四面体(如图)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。如图为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为_______。
21.碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。在基态14C原子中,核外存在_______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________________________。
(3)CS2分子中,共价键的类型有_______,C原子的杂化轨道类型是_______。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为-200C沸点为1030C,其固体属于__________晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
在石墨烯晶体中,每个C原子连接___个六元环,每个六元环占有_____个C原子。
22.按要求完成下列各题
(1)气态氢化物热稳定性大于的主要原因是___________。
(2)常温下,在水中的溶解度乙醇大于氯乙烷,原因是___________。
(3)过氧化钠的电子式是___________。
(4)溶液显碱性的原因是(用离子方程式说明)___________。
(5)已知葡萄糖的燃烧热为,试写出葡萄糖燃烧的热化学方程式___________。
23.白磷分子中P—P键易断开,若一个白磷分子中每个P—P键均断开插入一个氧原子,则一共可结合________个氧原子,这样得到磷的一种氧化物,其分子式为________。由C、H、N三种元素组成的某化合物,其分子内含4个氮原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C和C===C,则化合物的分子式为________。
24.我国科学家屠呦呦因成功从黄花蒿中提取青蒿素而获得2015年诺贝尔奖。
(1)青蒿素是治疗疟疾的有效药物,属于酯类化合物,其分子结构如图所示,请用笔在图中将酯基圈出来。____。
(2)从黄花蒿中提取青蒿素的流程如图:
研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如表:
溶剂 水 乙醇 乙醚
沸点/℃ 100 78 35
提取效率 几乎为0 35% 95%
①用水作溶剂,提取无效的原因是____。
②研究发现,青蒿素分子中的某个基团对热不稳定,据此分析用乙醚作溶剂,提取效率高于乙醇的原因是____。
(3)研究还发现,将青蒿素通过下面反应转化为水溶性增强的双氢青蒿素,治疗疟疾的效果更好。
从分子结构与性质的关系角度推测双氢青蒿素疗效更好的原因____。
(4)提取并转化青蒿素治疗疟疾的过程中,应考虑物质的____、____等性质。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.硫元素的非金属性强于砷元素,由结构示意图可知,雄黄中硫元素的价态为—2价,故A错误;
B.砷元素位于元素周期表第四周期VA族, As原子核外电子排布式为[Ar]3d104s24p3,故B错误;
C.由结构示意图可知,S和As的价层电子对数均为4,则As4S4 分子中 As 原子和 S 原子的杂化类型都为 sp3 杂化,故C正确;
D.古代熏蒸和双氧水的消毒原理均属于化学变化,而酒精的消毒原理为物理变化,原理不相同,故D错误;
故选C。
2.C
【详解】A.SO2分子的中心原子的价层电子对数为,含有1个孤对电子,其空间构型为V型,SO2分子中正负电荷中心不对称,为极性分子,A说法正确;
B.一定量的二氧化硫可用作食品的抗氧化剂,B说法正确;
C.保险粉中S的化合价为+3价,SO2中S的化合价为+4价,SO2→过程中S的化合价降低,SO2被还原,C说法错误;
D.煤炭燃烧时会生成,加入生石灰(CaO),通过“钙基固硫”法可将最终转化为,D说法正确;
答案选C。
3.D
【详解】A.CO2结构式为O=C=O,属于直线形分子,故A正确;
B.CO2分子中含有C=O键,为极性共价键,其分子结构为直线型,正负电荷中心重合,为非极性分子,故B正确;
C.CO2结构式为O=C=O,属于直线形分子,其键角为180°,故C正确;
D.干冰是分子晶体,分子晶体是分子靠分子间作用力形成的晶体,气化时克服分子间作用力,不破坏共价键,故D错误;
答案选D。
4.A
【详解】A.因为C元素的非金属性比Si强,所以CH4的稳定性比SiH4的稳定性高,与氢键无关,A错误;
B.乙醇能与水以任意比互溶的主要原因有:乙醇和水分子之间形成氢键,乙醇和水均为极性分子(相似相溶),B正确;
C.由于邻羟基苯甲醛形成分子内氢键,使熔沸点偏低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点偏高,所以邻羟基苯甲醛的沸点低于对羟基苯甲醛,C正确;
D.水分子间存在氢键从而形成缔合物,所以接近沸点的水蒸气的相对分子质量测量值大于18,D正确;
答案选A。
5.C
【详解】A.中碳形成4个σ键,为sp3杂化,故A不选;
B.HCHO中碳形成3个σ键,没有孤电子对,为sp2杂化,故B不选;
C.C2H2中碳形成2个σ键,没有孤电子对,为sp杂化,故C选;
D.C2H4中碳形成3个σ键,没有孤电子对,为sp2杂化,故D不选;
故选C。
6.B
【详解】①ⅤA族中,N的非金属性最强,NH3中分子之间存在氢键,则NH3的熔、沸点比PH3的熔、沸点高,故①正确;
②乙醇、醋酸和水分子间形成氢键,乙醇、醋酸可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④HCl比HI相对分子质量小,HCl比HI的沸点低,与氢键无关,故④错误;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
⑥稳定性与化学键有关,水分子中O-H键能大,水分子即使加热至较高温度下也很难分解,与氢键无关,故⑥错误;
综上所述,①②③⑤正确;
故选B。
7.A
【详解】A.分子中双键上的碳原子均为sp2杂化,只有1个碳原子为sp3杂化,则0.1mol中杂化的碳原子数为0.1,A正确;
B.1个分子中含有10个中子,则中含有的中子数为0.5,B错误;
C.和CO的摩尔质量均为28g/mol,2.8g由和CO组成的混合物的物质的量为0.1mol,和CO所含电子数均为14,则0.1mol 和CO组成的混合物中所含电子数为1.4,C错误;
D.由于该反应为可逆反应,存在反应限度,因此充分反应后生成的分子数小于2,D错误;
故选A。
8.B
【详解】A.CH4不含π键,且有机物燃烧时,断裂所有的化学键,A不符合题意;
B.C2H4和Cl2发生加成反应时,C2H4中的碳碳双键断裂形成碳碳单键和碳氯单键,化学键的断裂只涉及π键的断裂,B符合题意;
C.CH4不含π键,且取代反应中,断裂的化学键是单键,即σ键,C不符合题意;
D.C2H4被酸性KMnO4溶液氧化时,C2H4中的所有化学键断裂,即断裂的化学键既有σ键,又有π键,D不符合题意;
故选B。
9.B
【分析】短周期主族元素A、B、C、D、E的原子序数依次增大,A、B、C三种元素组成的化合物为强碱;则A为H、B为O,C为Na,按质量守恒定律、2D2E2+2 A2B = DB2↑+3D↓+4AE,化合物D2E2中D呈+1价,D为难溶于水的固体单质、DB2为D的氧化物、其中D呈+4价,则D为S,D2E2中E呈-1价,AE即E的氢化物中E呈-1价,E为ⅦA中Cl,据此回答;
【详解】A.DB2即二氧化硫,为酸性氧化物,故能使紫色石蕊变红色·,A正确;
B. H还原性强,会还原水分子中的正价氢,反应剧烈并析出氢气,而硫化钠、氯化钠不会 ,故简单阴离子还原性: ,B错误;
C. D2E2分子的结构式为Cl-S-S-Cl,故既存在极性键又存在非极性键,C正确;
D. 上述方程式所涉物质中□为S,硫单质在室温下呈固态,方程式中其它物质成气态或液态,则硫单质熔点最高,D正确;
答案选B。
10.B
【详解】A.与之间为离子键,N-H、S=O、S-O、O-H为极性共价键,故A项不符合题意;
B.K+与之间为离子键,S原子与S原子之间为非极性共价键,故B项符合题意;
C.中不含离子键,故C项不符合题意;
D.Na+与之间为离子键,B原子与O原子之间为极性共价键,故D项不符合题意;
综上所述,答案为B。
11.D
【分析】前4周期元素X、Y、Z、W的原子序数依次增大,X和Y的基态原子的2p能级上各有两个未成对电子,电子排布分别为1s22s2p2、1s2s2p4,则X为C、Y为O,Z与Y同族,则Z为S元素;W原子核内有29个质子,则W为Cu元素,然后根据元素周期律分析解答。
【详解】由分析可知:X为C、Y为O、Z为S、W为Cu。
A.晶胞中白色球数目为4、黑色球数目为1+8×=2,二者数目之比为1:2,故白球表示Cu,黑球表示O,该氧化物不可能为CuO,而是表示Cu2O,A错误;
B.同周期元素从左向右原子半径逐渐减小,不同周期元素,一般情况下,原子核外电子层越多原子半径越大,则原子半径r(Z) >r(X)>r(Y),B错误;
C.同主族自上而下第一电离能逐渐减小,故元素第一电离能:I1(Z)<I1(Y),C错误;
D.Y为O、Z为S,二者的氢化物H2O、H2S都是由分子构成,分子之间以分子间作用力结合,由于H2O分子之间还存在氢键,增加了分子之间的吸引作用,导致物质的熔沸点升高,故简单氢化物的沸点:Y>Z,D 正确;
故合理选项是D。
12.B
【详解】A.NH3与水分子间能形成氢键,其极易溶于水,水溶性大于SO2,A错误;
B.非金属性:F>O>N>P,共价键键能:H-F>H-O>H-N>H-P,则热稳定性:HF>H2O>NH3>PH3,B正确;
C.D2O 分子含有10电子,18 g重水(D2O)物质的量为,其中含有的电子数目为9NA,C错误;
D.戊烷在标准状况下不是气体,不能用气体摩尔体积计算,D错误;
故选B。
13.D
【详解】A.N4和N2都是分子晶体,相对分子量越大,分子间作用力越大,沸点越高,N4的沸点比N2高,故A错误;
B.N4是正四面体型结构,键角是60°,故B错误;
C.氮原子最外层5个电子,每个氮原子和三个氮原子分别形成一个共用电子对,所以每个氮原子的最外层都达到8电子稳定结构,故C错误;
D. 由题中N4分子结构可知,一个分子中含有6个共价键,所以1mol N4中含有6mol共价键,故D正确。
答案选D。
14.D
【详解】A.该分子中,电荷分布是不均匀的,不对称的,所以是极性分子,故A正确;
B.S2Cl2的电子式为 ,分子中各原子均达到8电子稳定结构,故B正确;
C.Cl-S-S-Cl中硫原子和硫原子之间存在非极性键,硫和氯原子之间存在极性键,故C正确;
D.和均属于分子晶体,中存在氢键,的熔沸点高,故D错误;
答案选D。
15.C
【详解】A.非金属元素的原子形成的共价键的数目一般等于该原子最外层未成对电子数,但不一定等于该元素原子的价电子数,A项错误;
B.C原子最外层有4个电子,最多可形成4个共价键,B项错误;
C.N原子最外层轨道上有3个未成对电子,1个N原子可以与3个H原子结合形成,达到饱和,C项正确;
D.若该反应中有键断裂,则生成;1个分子中含有1个键、2个π键,生成,形成键,D项错误;
故选C。
16.(1)12
(2) 8 be 180°
(3) sp2、sp3 2
【详解】(1)A、B两种短周期元素,A是原子半径最小的元素为H元素,B原子最外层电子数是次外层的两倍为C元素,该分子由C、H两种元素组成且原子个数比为1:1的平面正六边形分子为C6H6,分子中6个碳原子的电子都以sp2杂化轨道相互重叠,形成6个碳碳σ键,又各以1个sp2杂化轨道分别跟氢原子的1s轨道进行重叠,形成6个σ键,共12个σ键;
(2)①铬是24号元素,核外电子排布式为1s22s22p63s23p63d54s1;同周期最外层排2个电子的元素有Sc、Ti、V、Mn、Fe、Co、Ni、Zn,均属于副族元素,因此共8种;
②a:C6H6的6个C之间形成大π键,为平面结构,所以C原子为sp2杂化;
b:CH3OH中C形成的化学键均为单键,所以C原子为sp3杂化;
c:甲醛的C和O之间为双键,杂化方式为sp2杂化;
d:CS2分子碳原子的价层电子对为2+×(4-2×2)=2,,所以C原子为sp杂化;
e:CCl4中碳原子价层电子对个数=4+×(4-4×1)=4,所以C原子为sp3杂化;
综上所述,碳原子采取sp3杂化的分子有be;
CS2中碳原子为sp杂化,空间构型为直线形,分子的键角是180°;
(3)1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;B一般是形成3个键,4号B形成4个键,其中1个键是配位键,配位键存在4号与5号之间;观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
17.微粒间的相互作用包括化学键、分子间作用力;
化学键包括离子键、共价键、金属键、配位键;分子间作用力包括范德华力、氢键;
共价键根据电子云重叠方式分为σ键和Π键;根据共用电子对是否偏移分为极性键和非极性键;极性键形成的分子,若正电中心和负电中心不重叠,为极性分子;极性键形成的分子,若正电中心和负电中心重叠,为非极性分子;非极性键一般形成非极性分子。
【详解】微粒间的相互作用包括化学键、分子间作用力;
化学键包括离子键、共价键、金属键、配位键;分子间作用力包括范德华力、氢键;
共价键根据电子云重叠方式分为σ键和Π键;根据共用电子对是否偏移分为极性键和非极性键;极性键形成的分子,若正电中心和负电中心不重叠,为极性分子;极性键形成的分子,若正电中心和负电中心重叠,为非极性分子;非极性键一般形成非极性分子。
18. B E C F ⑥⑦⑨ ④ ③⑤ S=C=S
【分析】已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S。
【详解】(1)①蒸发氯化钠溶液即可得到氯化钠晶体,操作为蒸发;
②乙醚和苯的沸点不同,则分离两种混合物用蒸馏的方法;
③水和溴苯为互不相溶的两种液体,可用分液进行分离;
④碘加热易升华,而氯化钠加热不分解、不升华,可用升华方法分离氯化钠和碘的固体混合物;
(2)①O2只含有O=O,非极性共价键;
②H2只含有H-H非极性共价键;
③NH4NO3含有铵根离子与硝酸根离子间的离子键,又含有极性共价键;
④K2O2含有钾离子与过氧根离子间的离子键,又含有O-O非极性共价键;
⑤Ba(OH)2含有钡离子与氢氧根离子间的离子键,又含有O-H极性共价键;
⑥CH4只含有C-H极性共价键;
⑦CO2只含有C=O极性共价键;
⑧NaF只含有钠离子与氟离子间的离子键;
⑨NH3只含有N-H极性共价键;
⑩I2只含有I-I非极性共价键;
综上所述,只含有极性键的是⑥⑦⑨;既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤;
(3)已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X2+核外有18个电子,Y-有10个电子,则X为Ca,Y为F,CaF2为离子化合物,电子式为;若XY2为共价化合物,平均电子数约为13,则X为IVA族元素,为C;Y为VIA元素,为S,该物质为CS2,结构式为S=C=S。
19.(1)正四面体
(2) 6 较大 通过配位键与结合后,原来的孤电子对变为成键电子对,对成键电子对的排斥力减小,键之间的键角增大
【详解】(1)
的中心原子S的价层电子对数为4,为sp3杂化,并且中心原子P不含有孤电子对,故的空间结构为正四面体。
(2)①中与形成2个配位键,与Cl形成4个配位键,从而得出配位键的数目为6。
②1个分子中含有11个共价单键,则中含键。
③游离的分子中每个N原子有1对孤电子对,配合物中每个N原子提供1对孤电子对与形成配位键,由于孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,所以配合物中键角较大。
20. V形
【详解】(1)的中心原子的价层电子对数为,所以为杂化;的中心原子的价层电子对数为,所以为杂化;故答案为:;;
(2)的中心原子的价层电子对数为,故为杂化;由于孤电子对数为2,所以是V形分子;的结构式是,中心原子碳原子形成3个σ键,杂化轨道数为3,故为杂化;故答案为:V形;;;
(3)由题图b可知,每个硅原子与4个氧原子形成4个σ键,故为杂化,故答案为:。
21. 电子云 2 C原子最外层有4个电子,不易得失电子 δ键和π键 SP杂化 分子 3 2
【详解】(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述,离核近的区域电子云密度较大,离核远的区域电子云密度较小;
(2)C原子核外电子排布为1s22s22p2,轨道式为如图所示:,则在基态14C原子中,核外存在2对自旋相反的电子。
(3)碳原子最外层有4个电子,化学性质比较稳定,在形成键的时候,不易得到电子也不易失去电子,所以碳在形成化合物时,其键型以共价键为主,故答案为C原子最外层有4个电子,不易得失电子;
(4)CS2分子的结构式为S=C=S,故CS2分子中,共价键的类型有δ键和π键;
(5)CS2分子中C原子形成2个δ键,孤对电子数为,则为sp杂化;
(6)Fe(CO)5熔点为253K,沸点为376K,具有分子晶体的性质,则固体应为分子晶体;
(7)石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学键,则每个C原子连接3个六元环;
(8)石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学键,则每个C原子连接3个六元环,每个六元环占有的C原子数为6×1/3=2。
22.(1)因为共价键键能H-F>H-Cl
(2)乙醇分子和水分子间能形成氢键
(3)
(4)+H2O +OH-
(5)C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) ΔH=2800kJ·mol-1
【分析】(1)
气态氢化物的稳定性与共价键的键能大小有关,故因为共价键键能H-F>H-Cl,所以气态氢化物热稳定性大于。
(2)
因为乙醇分子和水分子间能形成氢键,所以在水中的溶解度乙醇大于氯乙烷。
(3)
过氧化钠的电子式为。
(4)
溶液显碱性的原因是+H2O +OH-。
(5)
葡萄糖燃烧的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) ΔH=2800kJ·mol-1。
23. 6 P4O6 C6H12N4
【详解】试题分析:在白磷分子空间结构图中,分子内共有6个P—P键,由题意,可嵌入6个O原子,分子式为P4O6;同理4个N原子也可构成正四面体,在N—N之间嵌入6个C原子,因无C—C和C===C,为满足碳4价,化合物分子应由4个N原子和6个CH2组成,故分子式为C6H12N4。
考点:考查白磷分子的结构、分子式的判断
点评:该题是中等难度的试题,试题注重基础和能力的双向考查。有利于培养学生的逻辑思维能力和抽象思维能力,也有助于培养灵活运用基础知识解决实际问题的能力。
24.(1)
(2) 青蒿素难溶于水 由于乙醚沸点比较低,蒸馏提取所需温度较低,可保护—O—O—键不被破坏
(3)双青蒿素分子内有羟基,可以与水分子形成氢键,水溶性增强,疗效更好
(4) 溶解性 热稳定性、沸点
【解析】(1)
酯基的结构为:,则青蒿素分子中酯基的位置如图所示: ;
(2)
①观察青蒿素的分子结构,该分子中不含羟基、羧基、醛基等亲水基团,则该物质在水中的溶解能力很差;
②青蒿素分子中的醚键热稳定性较差,提取过程中不宜使用较高温度,而乙醚沸点比较低,蒸馏提取所需温度较低,可保护-O-O-键不被破坏;
(3)
相比于青蒿素,双氢青蒿素分子内有羟基,可以与水分子形成氢键,水溶性增强、疗效更好;
(4)
该过程中,应考虑物质的溶解性、热稳定性、沸点等性质。
答案第1页,共2页
答案第1页,共2页
