人教版九年级化学 第三单元课题2 原子的结构 课时1 原子的构成和相对原子质量课件(共17张PPT)
文档属性
| 名称 | 人教版九年级化学 第三单元课题2 原子的结构 课时1 原子的构成和相对原子质量课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 355.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-03 08:34:56 | ||
图片预览






文档简介
(共17张PPT)
第三单元 物质构成的奥秘
课题2 原子的结构
课时1 原子的构成和相对原子质量
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
1. 认识原子是由原子核和核外电子构成的。
2. 能根据原子的核电荷数判断核内质子数和核外电子数。
3. 认识相对原子质量的含义及其应用。
阅读课本P53“表3-1 几种原子的构成”,从中你可以得到哪些信息?
①不同原子种类的原子核内的质子数不同;②原子里,质子数=核外电子数;③并不是所有的原子都含有中子;④质子数与中子数不一定相等。
知识点1 原子的构成
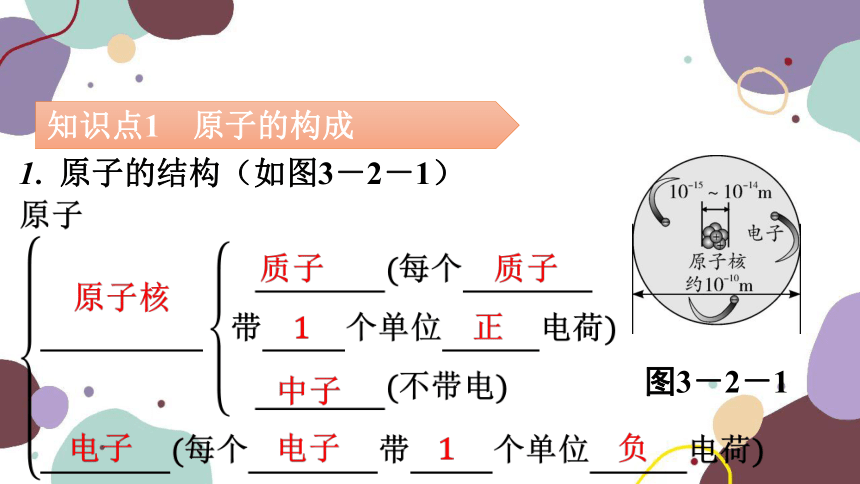
1. 原子的结构(如图3-2-1)
图3-2-1
2. 在原子里, 质子 数= 核电荷 数= 核外电子 数。
【结论】由于原子核内质子所带电荷和核外电子所带电荷数量相等,但电性相反,因此,原子不显电性。
【补充】①不带电的粒子:分子、原子、中子;②普通氢原子没有中子。
质子
核电荷
核外电
子
课堂练习
1. 原子是构成物质的基本微粒,下列有关原子的叙述错误的是( B )
A. 同种原子可能构成不同的分子
B. 原子中一定含有质子、中子、电子
C. 原子不显电性
D. 原子由原子核和核外电子构成
B
思路点拨 原子由原子核和核外电子构成,原子核由质子和中子构成(氢原子的原子核中只有一个质子,没有中子)。原子的核外电子数与核内质子数相等。
知识点2 相对原子质量
3. 相对原子质量:以一种碳原子(质子数、中子数都为6)质量的1/12为标准,其他原子的质量与它相比较所得到的比。
5. 相对原子质量的单位为“1”,通常省略不写。
6. 电子的质量很小,原子的质量集中在原子核上,所以相对原子质量≈ 质子数 + 中子数 。
质子数
中子数
课堂练习
2. 人类探月的重要目的之一是勘察、获取地球上蕴藏量很小而月球上却极为丰富的核聚变燃料,“C-13”是指原子核内含有6个质子、7个中子的碳原子,则“He-3”所指的氦原子核内( B )
A. 含有3个质子,没有中子
B. 含有2个质子,1个中子
C. 含有1个质子,2个中子
D. 含有3个中子,没有质子
B
3. 假设可作确定相对原子质量标准的碳原子的质量为b g,一个X原子的质量为m g,则X原子的相对原子质量为( D )
思路点拨 相对原子质量是该原子的实际质量与碳原子质量的1/12的比值,单位是“1”,通常省略不写。原子的相对原子质量约等于质子数加中子数。
D
1. (2021广东)在测定锌、铟等元素的相对原子质量方面做出卓越贡献的中国科学家是( D )
A. 杨振宁 B. 屠呦呦
C. 侯德榜 D. 张青莲
D
2. 如图3-2-2为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法不正确的是( C )
图3-2-2
C
A. 图中粒子a表示的是电子
B. 原子中粒子b与粒子c的数目不一定相同
C. 所有原子的原子核都由粒子b和粒子c两种粒子构成
D. 该原子核内有6个粒子c
3. 下列关于相对原子质量的说法正确的是( D )
A. 相对原子质量的单位是kg
B. 相对原子质量是一个比值,单位是g
C. 某原子的相对原子质量在数值上是该原子的实际质量的12倍
D. 相对原子质量越大,原子的实际质量也越大
D
4. 在分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称,填在相应的横线上。
(1)能直接构成纯净物的粒子是 分子、原子 。
(2)化学变化中的最小粒子是 原子 。
(3)带正电荷的粒子是 质子 。
(4)带负电荷的粒子是 电子 。
(5)不显电性的粒子是 分子、原子、中子 。
(6)决定原子质量大小的粒子是 质子和中子 。
分子、原子
原子
质子
电子
分子、原子、中子
质子和中子
(7)在同一原子中数目相等的粒子是 质子和电子 。
质子和电子
谢 谢!
第三单元 物质构成的奥秘
课题2 原子的结构
课时1 原子的构成和相对原子质量
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
1. 认识原子是由原子核和核外电子构成的。
2. 能根据原子的核电荷数判断核内质子数和核外电子数。
3. 认识相对原子质量的含义及其应用。
阅读课本P53“表3-1 几种原子的构成”,从中你可以得到哪些信息?
①不同原子种类的原子核内的质子数不同;②原子里,质子数=核外电子数;③并不是所有的原子都含有中子;④质子数与中子数不一定相等。
知识点1 原子的构成
1. 原子的结构(如图3-2-1)
图3-2-1
2. 在原子里, 质子 数= 核电荷 数= 核外电子 数。
【结论】由于原子核内质子所带电荷和核外电子所带电荷数量相等,但电性相反,因此,原子不显电性。
【补充】①不带电的粒子:分子、原子、中子;②普通氢原子没有中子。
质子
核电荷
核外电
子
课堂练习
1. 原子是构成物质的基本微粒,下列有关原子的叙述错误的是( B )
A. 同种原子可能构成不同的分子
B. 原子中一定含有质子、中子、电子
C. 原子不显电性
D. 原子由原子核和核外电子构成
B
思路点拨 原子由原子核和核外电子构成,原子核由质子和中子构成(氢原子的原子核中只有一个质子,没有中子)。原子的核外电子数与核内质子数相等。
知识点2 相对原子质量
3. 相对原子质量:以一种碳原子(质子数、中子数都为6)质量的1/12为标准,其他原子的质量与它相比较所得到的比。
5. 相对原子质量的单位为“1”,通常省略不写。
6. 电子的质量很小,原子的质量集中在原子核上,所以相对原子质量≈ 质子数 + 中子数 。
质子数
中子数
课堂练习
2. 人类探月的重要目的之一是勘察、获取地球上蕴藏量很小而月球上却极为丰富的核聚变燃料,“C-13”是指原子核内含有6个质子、7个中子的碳原子,则“He-3”所指的氦原子核内( B )
A. 含有3个质子,没有中子
B. 含有2个质子,1个中子
C. 含有1个质子,2个中子
D. 含有3个中子,没有质子
B
3. 假设可作确定相对原子质量标准的碳原子的质量为b g,一个X原子的质量为m g,则X原子的相对原子质量为( D )
思路点拨 相对原子质量是该原子的实际质量与碳原子质量的1/12的比值,单位是“1”,通常省略不写。原子的相对原子质量约等于质子数加中子数。
D
1. (2021广东)在测定锌、铟等元素的相对原子质量方面做出卓越贡献的中国科学家是( D )
A. 杨振宁 B. 屠呦呦
C. 侯德榜 D. 张青莲
D
2. 如图3-2-2为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法不正确的是( C )
图3-2-2
C
A. 图中粒子a表示的是电子
B. 原子中粒子b与粒子c的数目不一定相同
C. 所有原子的原子核都由粒子b和粒子c两种粒子构成
D. 该原子核内有6个粒子c
3. 下列关于相对原子质量的说法正确的是( D )
A. 相对原子质量的单位是kg
B. 相对原子质量是一个比值,单位是g
C. 某原子的相对原子质量在数值上是该原子的实际质量的12倍
D. 相对原子质量越大,原子的实际质量也越大
D
4. 在分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称,填在相应的横线上。
(1)能直接构成纯净物的粒子是 分子、原子 。
(2)化学变化中的最小粒子是 原子 。
(3)带正电荷的粒子是 质子 。
(4)带负电荷的粒子是 电子 。
(5)不显电性的粒子是 分子、原子、中子 。
(6)决定原子质量大小的粒子是 质子和中子 。
分子、原子
原子
质子
电子
分子、原子、中子
质子和中子
(7)在同一原子中数目相等的粒子是 质子和电子 。
质子和电子
谢 谢!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
