选择性必修2 3.3 金属晶体与离子晶体 同步练习题(含解析)
文档属性
| 名称 | 选择性必修2 3.3 金属晶体与离子晶体 同步练习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-03 14:14:02 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
选择性必修2 第三章 第三节 金属晶体与离子晶体 同步练习题
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 下图是金属晶体的“电子气”理论示意图。用该理论解释金属导电的原因是( )
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有的电子作无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
2. 下列有关金属键的叙述错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的自由电子属于整块晶体
D.金属的性质和金属固体的形成都与金属键有关
3. 氧化锌常作为金属缓蚀剂,其结构有很多种,其中一种立方晶胞结构如图,晶胞边长为a pm,下列说法错误的是( )
A.该晶体属于离子晶体
B.O原子与O原子的最短距离为a pm
C.Zn原子周围等距且最近的Zn原子数为6
D.该晶胞中含有4个O原子,4个Zn原子
4. 如下图,在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为( )
A.十二面体
B.正八面体
C.正六面体
D.正四面体
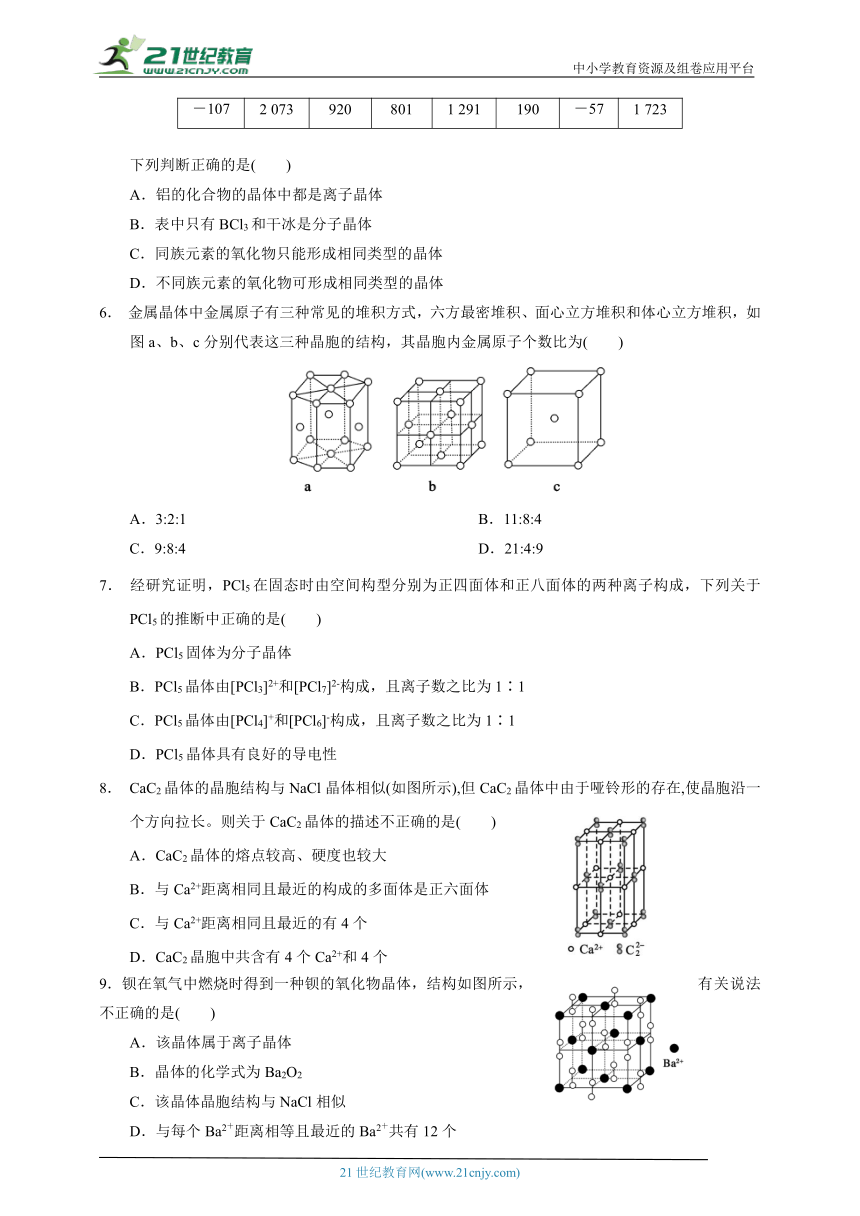
5.下表是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-107 2 073 920 801 1 291 190 -57 1 723
下列判断正确的是( )
A.铝的化合物的晶体中都是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物只能形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
6. 金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a、b、c分别代表这三种晶胞的结构,其晶胞内金属原子个数比为( )
A.3:2:1 B.11:8:4
C.9:8:4 D.21:4:9
7. 经研究证明,PCl5在固态时由空间构型分别为正四面体和正八面体的两种离子构成,下列关于PCl5的推断中正确的是( )
A.PCl5固体为分子晶体
B.PCl5晶体由[PCl3]2+和[PCl7]2-构成,且离子数之比为1∶1
C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数之比为1∶1
D.PCl5晶体具有良好的导电性
8. CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是( )
A.CaC2晶体的熔点较高、硬度也较大
B.与Ca2+距离相同且最近的构成的多面体是正六面体
C.与Ca2+距离相同且最近的有4个
D.CaC2晶胞中共含有4个Ca2+和4个
9.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
10.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法中错误的是( )
A.Xn+的核外电子数为19
B.该晶体中阳离子与阴离子个数比为3:1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
二、填空题(本题包括5个小题,共60分)
11.(12分)溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示
NaBr NaCl MgO
离子的核间距/pm 290 276 205
晶格能/kJ·mol 1 787 3 890
(1)溴化钠晶体的晶格能比氯化钠晶体的_____(填“大”或“小”),主要原因
___________。
(2)氧化镁晶体的晶格能比氯化钠晶体的大,主要原因是___________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是_________(填名称)。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是__________________________________。
12.(10分)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)Li2O是离子晶体,其晶格能可通过图(a)的 Born Haber循环计算得到。
可知,Li原子的第一电离能为 kJ·mol 1,O=O键键能为 kJ·mol 1,Li2O晶格能为 kJ·mol 1。
(2)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm 3(列出计算式)。
13.(12分)如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为________ cm。
14.(12分)A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电。试回答下列问题
(1)A、B的元素符号分别是________、________。
(2)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子个数之比为________。
(3)A、B形成的化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________。
15.(14分)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在离子。离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
1. 答案 B
解析:“电子气”理论可以很好地解释金属的一些现象,如金属的导电、导热、延展性等。金属中含有金属阳离子和自由电子,在外加电场的作用下,自由电子定向移动形成电流。
2. 答案 B
解析:A项,金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;B项,金属键是金属阳离子和自由电子之间的强烈作用,既包括金属阳离子与自由电子之间的静电吸引作用,也包括金属阳离子之间及自由电子之间的静电排斥作用;C项,金属键中的自由电子被所有原子共用,属于整块晶体。
3. 答案 C
解析:氧化锌晶体属于离子晶体,选项A正确;O原子与O原子的最短距离为面对角线的一半,即 a pm,选项B正确;由晶胞示意图,取顶角Zn原子来看,其周围等距且最近的Zn原子为面上的Zn原子,顶角Zn原子属于12个面,故Zn原子周围等距且最近的Zn原子数为12,选项C错误;由图可知,该晶胞含4个O原子(晶胞内),Zn原子位于晶胞的顶角和面上,故Zn原子的个数为8×+6×=4,选项D正确。
4. 答案 B
解析:首先要理解最近的离子在什么位置,以一个晶胞为例,处在中心位置上的Na+被六个面上的Cl-所包围,这6个Cl-离中心Na+最近将六个面心的Cl-连成一个图形即正八面体,如图,也可以有其它连接方法。
5. 答案 D
解析:AlCl3的熔点低,属于分子晶体,A项错误;表中BCl3、AlCl3和干冰均是分子晶体,B项错误;同族元素的氧化物可形成不同类型的晶体,如CO2是分子晶体,二氧化硅是共价晶体,C项错误;表中Al2O3与Na2O均是离子晶体,Na与Al位于不同主族,D项正确。
6 答案 D
解析:本题考查晶胞中微粒数的计算,用均摊法。晶胞a中所含原子=12×+2×+3=6个,晶胞b中所含原子=8×+6×=4个,晶胞c中所含原子=8×+1=2个。
7. 答案 C
解析:由题意知,晶体由空间构型分别为正四面体和正八面体的两种离子构成,所以PCl5晶体由[PCl4]+和[PCl6]-按1∶1构成,为离子化合物,A、B错误,C正确,离子晶体中虽含有离子,但不能自由移动,不能导电,只有在熔融状态或水中才能导电,D错误。
8. 答案 B
解析:CaC2晶体属于离子晶体,故有较高的熔点和较大的硬度,A正确;因为晶胞沿一个方向拉长,故和Ca2+距离相同且最近的只有4个(与拉长方向垂直的同一面上),4个构成的是正方形,B错;以Ca2+为中心,与之等距离且最近的是同一平面上的4个,C正确;该晶胞中含有Ca2+的个数=12×1/4+1=4,含有的个数=8×1/8+6×1/2=4,D正确。
9. 答案 B
解析:1个晶胞中Ba2+的个数为=4个,O个数为=4个,Ba2+与O个数之比为1?1,所以化学式应为BaO2。
10. 答案 A
解析:本题主要考查晶体的结构。利用均摊法可确定该晶体的化学式,N3-的个数为8×=1个, Xn+的个数为12×=3个,即晶体的化学式为X3N,根据电荷守恒可以确定Xn+中n=1,由Xn+中所有电子正好充满K、L、M三个电子层,知Xn+为Cu+,其核外电子数为28,晶体中与Cu+等距离的N3-有2个。综上分析可知A项错误。
11.答案(1)小 NaBr比NaCl离子的核间距大
(2)氧化镁晶体中的阴、阳离子的电荷数绝对值大,并且离子的核间距小
(3)氧化镁 氧化镁晶体比氯化镁晶体晶格能大,熔点高,电解时消耗电能多
解析:利用离子晶体中离子的核间距、电荷数与晶格能的关系,对离子晶体的性质进行分析。晶格能越大,则离子晶体越稳定,熔、沸点越高。
12.答案:(1)520 498 2908 (2)
解析:(1)根据示意图可知Li原子的第一电离能是1040 kJ/mol÷2=520 kJ/mol;0.5mol氧气转化为氧原子时吸热是249 kJ,所以O=O键能是249 kJ/mol×2=498 kJ/mol;根据晶格能的定义结合示意图可知Li2O的晶格能是2908 kJ/mol;
(2)根据晶胞结构可知锂全部在晶胞中,共计是8个,根据化学式可知氧原子个数是4个,则Li2O的密度是。
13.答案:(1)(答案不唯一,合理即可)
(2)12
(3)4 12×+1=4 4 8×+6×=4(答案不唯一,只要与第1问对应即可)
(4)·
解析:(1)如图所示。(2)从体心Na+看,与它最接近的且距离相等的Na+共有12个。(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。由此可知,如图NaCl晶胞中,含Na+:8×+6×=4个;含Cl-:12×+1=4个。(4)设Cl-与Na+的最近距离为a cm,则两个最近的Na+间的距离为a cm,又:·NA=Mr。即a=。所以Na+间的最近距离为:·。
14.答案 (1)Mg O (2)6 1?1
(3)高 离子半径差别不大,但MgO中离子所带电荷较多,离子键强
解析:该化合物熔融时能导电,说明A、B形成的化合物是离子化合物,A和B一种是活泼的金属元素,一种是活泼的非金属元素,再结合A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍,推断出A是Mg元素,B是O元素。MgO和NaF虽然离子半径差别不大,但MgO中离子所带电荷较多,离子键强。
15.答案(1)A (2)N 球形 K的原子半径较大且价电子数较少,金属键较弱
(3)V形 sp3 (4)0.315 12 (5)体心 棱心
解析:(1)紫色波长400 nm~435 nm,因此选项A正确。(2)K位于第四周期IA族,电子占据最高能层是第四层,即N层,最后一个电子填充在s能级上,电子云轮廓图为球形;K的原子半径大于Cr的半径,且价电子数较少,金属键较弱,因此K的熔点、沸点比Cr低。(3)I3+与OF2互为等电子体,OF2属于V形,因此I3+几何构型为V形,其中心原子的杂化类型为sp3。(4)根据晶胞结构,K与O间的最短距离是面对角线的一半,即为nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个。(5)根据KIO3的化学式,以及晶胞结构,可知K处于体心,O处于棱心。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
选择性必修2 第三章 第三节 金属晶体与离子晶体 同步练习题
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 下图是金属晶体的“电子气”理论示意图。用该理论解释金属导电的原因是( )
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有的电子作无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
2. 下列有关金属键的叙述错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的自由电子属于整块晶体
D.金属的性质和金属固体的形成都与金属键有关
3. 氧化锌常作为金属缓蚀剂,其结构有很多种,其中一种立方晶胞结构如图,晶胞边长为a pm,下列说法错误的是( )
A.该晶体属于离子晶体
B.O原子与O原子的最短距离为a pm
C.Zn原子周围等距且最近的Zn原子数为6
D.该晶胞中含有4个O原子,4个Zn原子
4. 如下图,在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为( )
A.十二面体
B.正八面体
C.正六面体
D.正四面体
5.下表是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-107 2 073 920 801 1 291 190 -57 1 723
下列判断正确的是( )
A.铝的化合物的晶体中都是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物只能形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
6. 金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a、b、c分别代表这三种晶胞的结构,其晶胞内金属原子个数比为( )
A.3:2:1 B.11:8:4
C.9:8:4 D.21:4:9
7. 经研究证明,PCl5在固态时由空间构型分别为正四面体和正八面体的两种离子构成,下列关于PCl5的推断中正确的是( )
A.PCl5固体为分子晶体
B.PCl5晶体由[PCl3]2+和[PCl7]2-构成,且离子数之比为1∶1
C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数之比为1∶1
D.PCl5晶体具有良好的导电性
8. CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是( )
A.CaC2晶体的熔点较高、硬度也较大
B.与Ca2+距离相同且最近的构成的多面体是正六面体
C.与Ca2+距离相同且最近的有4个
D.CaC2晶胞中共含有4个Ca2+和4个
9.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
10.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法中错误的是( )
A.Xn+的核外电子数为19
B.该晶体中阳离子与阴离子个数比为3:1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
二、填空题(本题包括5个小题,共60分)
11.(12分)溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示
NaBr NaCl MgO
离子的核间距/pm 290 276 205
晶格能/kJ·mol 1 787 3 890
(1)溴化钠晶体的晶格能比氯化钠晶体的_____(填“大”或“小”),主要原因
___________。
(2)氧化镁晶体的晶格能比氯化钠晶体的大,主要原因是___________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是_________(填名称)。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是__________________________________。
12.(10分)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)Li2O是离子晶体,其晶格能可通过图(a)的 Born Haber循环计算得到。
可知,Li原子的第一电离能为 kJ·mol 1,O=O键键能为 kJ·mol 1,Li2O晶格能为 kJ·mol 1。
(2)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm 3(列出计算式)。
13.(12分)如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为________ cm。
14.(12分)A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电。试回答下列问题
(1)A、B的元素符号分别是________、________。
(2)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子个数之比为________。
(3)A、B形成的化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________。
15.(14分)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在离子。离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
1. 答案 B
解析:“电子气”理论可以很好地解释金属的一些现象,如金属的导电、导热、延展性等。金属中含有金属阳离子和自由电子,在外加电场的作用下,自由电子定向移动形成电流。
2. 答案 B
解析:A项,金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;B项,金属键是金属阳离子和自由电子之间的强烈作用,既包括金属阳离子与自由电子之间的静电吸引作用,也包括金属阳离子之间及自由电子之间的静电排斥作用;C项,金属键中的自由电子被所有原子共用,属于整块晶体。
3. 答案 C
解析:氧化锌晶体属于离子晶体,选项A正确;O原子与O原子的最短距离为面对角线的一半,即 a pm,选项B正确;由晶胞示意图,取顶角Zn原子来看,其周围等距且最近的Zn原子为面上的Zn原子,顶角Zn原子属于12个面,故Zn原子周围等距且最近的Zn原子数为12,选项C错误;由图可知,该晶胞含4个O原子(晶胞内),Zn原子位于晶胞的顶角和面上,故Zn原子的个数为8×+6×=4,选项D正确。
4. 答案 B
解析:首先要理解最近的离子在什么位置,以一个晶胞为例,处在中心位置上的Na+被六个面上的Cl-所包围,这6个Cl-离中心Na+最近将六个面心的Cl-连成一个图形即正八面体,如图,也可以有其它连接方法。
5. 答案 D
解析:AlCl3的熔点低,属于分子晶体,A项错误;表中BCl3、AlCl3和干冰均是分子晶体,B项错误;同族元素的氧化物可形成不同类型的晶体,如CO2是分子晶体,二氧化硅是共价晶体,C项错误;表中Al2O3与Na2O均是离子晶体,Na与Al位于不同主族,D项正确。
6 答案 D
解析:本题考查晶胞中微粒数的计算,用均摊法。晶胞a中所含原子=12×+2×+3=6个,晶胞b中所含原子=8×+6×=4个,晶胞c中所含原子=8×+1=2个。
7. 答案 C
解析:由题意知,晶体由空间构型分别为正四面体和正八面体的两种离子构成,所以PCl5晶体由[PCl4]+和[PCl6]-按1∶1构成,为离子化合物,A、B错误,C正确,离子晶体中虽含有离子,但不能自由移动,不能导电,只有在熔融状态或水中才能导电,D错误。
8. 答案 B
解析:CaC2晶体属于离子晶体,故有较高的熔点和较大的硬度,A正确;因为晶胞沿一个方向拉长,故和Ca2+距离相同且最近的只有4个(与拉长方向垂直的同一面上),4个构成的是正方形,B错;以Ca2+为中心,与之等距离且最近的是同一平面上的4个,C正确;该晶胞中含有Ca2+的个数=12×1/4+1=4,含有的个数=8×1/8+6×1/2=4,D正确。
9. 答案 B
解析:1个晶胞中Ba2+的个数为=4个,O个数为=4个,Ba2+与O个数之比为1?1,所以化学式应为BaO2。
10. 答案 A
解析:本题主要考查晶体的结构。利用均摊法可确定该晶体的化学式,N3-的个数为8×=1个, Xn+的个数为12×=3个,即晶体的化学式为X3N,根据电荷守恒可以确定Xn+中n=1,由Xn+中所有电子正好充满K、L、M三个电子层,知Xn+为Cu+,其核外电子数为28,晶体中与Cu+等距离的N3-有2个。综上分析可知A项错误。
11.答案(1)小 NaBr比NaCl离子的核间距大
(2)氧化镁晶体中的阴、阳离子的电荷数绝对值大,并且离子的核间距小
(3)氧化镁 氧化镁晶体比氯化镁晶体晶格能大,熔点高,电解时消耗电能多
解析:利用离子晶体中离子的核间距、电荷数与晶格能的关系,对离子晶体的性质进行分析。晶格能越大,则离子晶体越稳定,熔、沸点越高。
12.答案:(1)520 498 2908 (2)
解析:(1)根据示意图可知Li原子的第一电离能是1040 kJ/mol÷2=520 kJ/mol;0.5mol氧气转化为氧原子时吸热是249 kJ,所以O=O键能是249 kJ/mol×2=498 kJ/mol;根据晶格能的定义结合示意图可知Li2O的晶格能是2908 kJ/mol;
(2)根据晶胞结构可知锂全部在晶胞中,共计是8个,根据化学式可知氧原子个数是4个,则Li2O的密度是。
13.答案:(1)(答案不唯一,合理即可)
(2)12
(3)4 12×+1=4 4 8×+6×=4(答案不唯一,只要与第1问对应即可)
(4)·
解析:(1)如图所示。(2)从体心Na+看,与它最接近的且距离相等的Na+共有12个。(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。由此可知,如图NaCl晶胞中,含Na+:8×+6×=4个;含Cl-:12×+1=4个。(4)设Cl-与Na+的最近距离为a cm,则两个最近的Na+间的距离为a cm,又:·NA=Mr。即a=。所以Na+间的最近距离为:·。
14.答案 (1)Mg O (2)6 1?1
(3)高 离子半径差别不大,但MgO中离子所带电荷较多,离子键强
解析:该化合物熔融时能导电,说明A、B形成的化合物是离子化合物,A和B一种是活泼的金属元素,一种是活泼的非金属元素,再结合A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍,推断出A是Mg元素,B是O元素。MgO和NaF虽然离子半径差别不大,但MgO中离子所带电荷较多,离子键强。
15.答案(1)A (2)N 球形 K的原子半径较大且价电子数较少,金属键较弱
(3)V形 sp3 (4)0.315 12 (5)体心 棱心
解析:(1)紫色波长400 nm~435 nm,因此选项A正确。(2)K位于第四周期IA族,电子占据最高能层是第四层,即N层,最后一个电子填充在s能级上,电子云轮廓图为球形;K的原子半径大于Cr的半径,且价电子数较少,金属键较弱,因此K的熔点、沸点比Cr低。(3)I3+与OF2互为等电子体,OF2属于V形,因此I3+几何构型为V形,其中心原子的杂化类型为sp3。(4)根据晶胞结构,K与O间的最短距离是面对角线的一半,即为nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个。(5)根据KIO3的化学式,以及晶胞结构,可知K处于体心,O处于棱心。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
