必修第二册 6.1 第2课时 化学反应与电能 同步练习题(含解析)
文档属性
| 名称 | 必修第二册 6.1 第2课时 化学反应与电能 同步练习题(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-03 14:14:11 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
6.1 第2课时 化学反应与电能 同步练习题
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
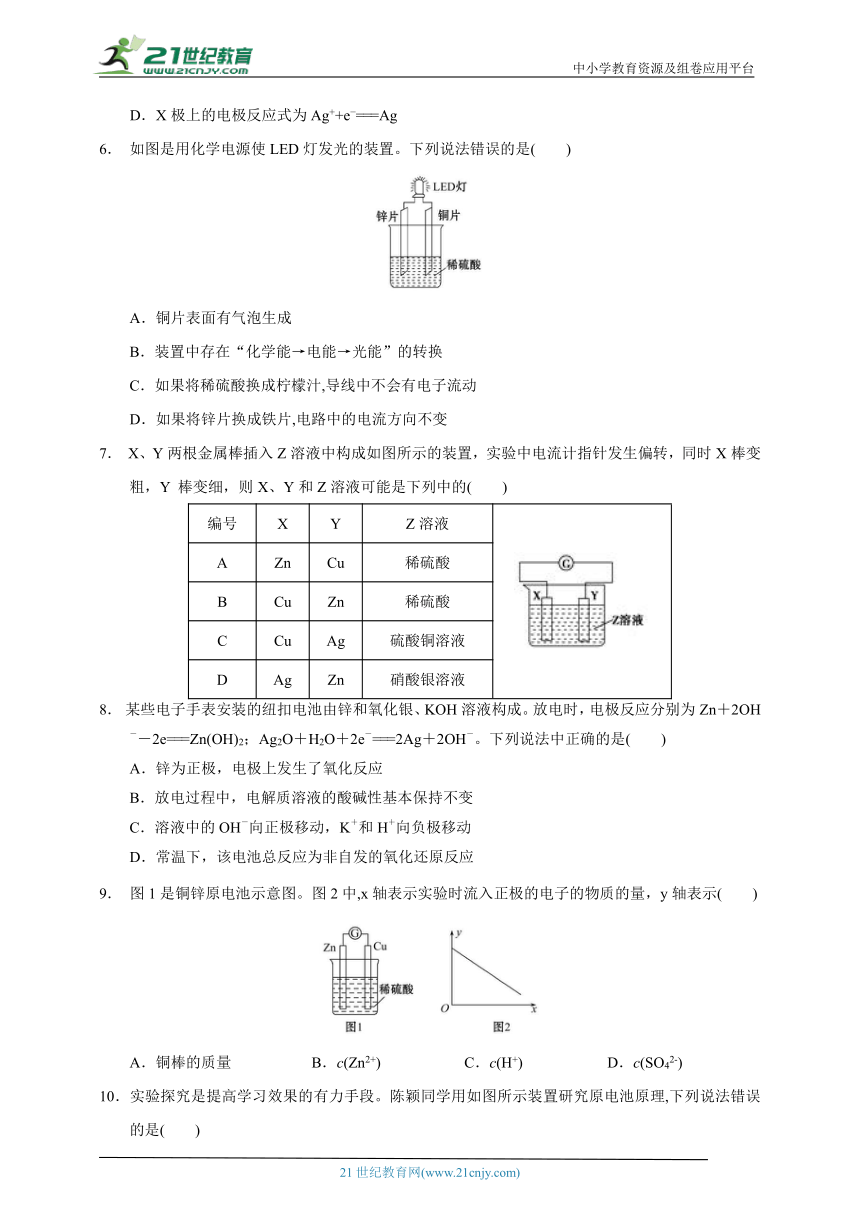
1.下列反应不可能作为原电池工作时发生的反应的是( )
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.2Fe+O2+2H2O===2Fe(OH)2
C.2H2+O2===2H2O
D.NaOH+HCl===NaCl+H2O
2.下列装置能构成原电池的是( )
3.已知空气—锌电池的电极反应式为
锌片:Zn+2OH 2e ===ZnO+H2O;碳棒:O2+H2O+2e ===2OH 。
据此判断,锌片为( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
4.向两份过量的锌粉a、b中分别加入一定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系正确的是( )
5. 根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
A.X可以是银或石墨
B.电子从铜电极经外电路流向X电极
C.Y是硫酸铜溶液
D.X极上的电极反应式为Ag++e ===Ag
6. 如图是用化学电源使LED灯发光的装置。下列说法错误的是( )
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
7. X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y 棒变细,则X、Y和Z溶液可能是下列中的( )
编号 X Y Z溶液
A Zn Cu 稀硫酸
B Cu Zn 稀硫酸
C Cu Ag 硫酸铜溶液
D Ag Zn 硝酸银溶液
8. 某些电子手表安装的纽扣电池由锌和氧化银、KOH溶液构成。放电时,电极反应分别为Zn+2OH--2e===Zn(OH)2;Ag2O+H2O+2e-===2Ag+2OH-。下列说法中正确的是( )
A.锌为正极,电极上发生了氧化反应
B.放电过程中,电解质溶液的酸碱性基本保持不变
C.溶液中的OH-向正极移动,K+和H+向负极移动
D.常温下,该电池总反应为非自发的氧化还原反应
9. 图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示 ( )
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-)
10.实验探究是提高学习效果的有力手段。陈颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
A.若将图1中的Zn、Cu下端接触,Zn片逐渐溶解,Cu片上能看到气泡产生
B.图2中H+向Zn片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中,Zn片减轻的质量相等时,正极产物的质量比为1∶32
11.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
A.若X为Fe,Y为Cu,则铁为正极
B.若X为Fe,Y为Cu,则电子由铜片流向铁片
C.若X为Fe,Y为C,则碳棒上有红色固体析出
D.若X为Cu,Y为Zn,则锌片发生还原反应
12.鱼雷是一种水中兵器。它可从舰艇、飞机上发射,它发射后可自己控制航行方向和深度,遇到舰船,只要一接触就可以爆炸。用于攻击敌方水面舰船和潜艇,也可以用于封锁港口和狭窄水道。鱼雷采用Al-Ag2O动力电池,以溶有氢氧化钾的流动海水为电解液,电池反应为2Al+3Ag2O+2KOH===6Ag+2KAlO2+H2O,下列说法错误的是( )
A.Ag2O为电池的正极
B.Al在电池反应中被氧化
C.电子由Ag2O极经外电路流向Al极
D.溶液中的OH-向Al极迁移
13.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
14.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
A.放电过程中OH 移向正极
B.电池的总反应式为Mg+ClO +H2O===Mg(OH)2↓+Cl
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e ===2H2O
15.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池, 某种锂离子电池的总反应为Li+MnO2===LiMnO2,下列说法中正确的是( )
A.Li是正极,电极反应式为Li e ===Li+
B.Li是负极,电极反应式为Li e ===Li+
C.MnO2是负极,电极反应式为MnO2+e ===MnO2
D.Li是负极,电极反应式为Li 2e ===Li2+
二、填空题(本题包括3个小题,共40分)
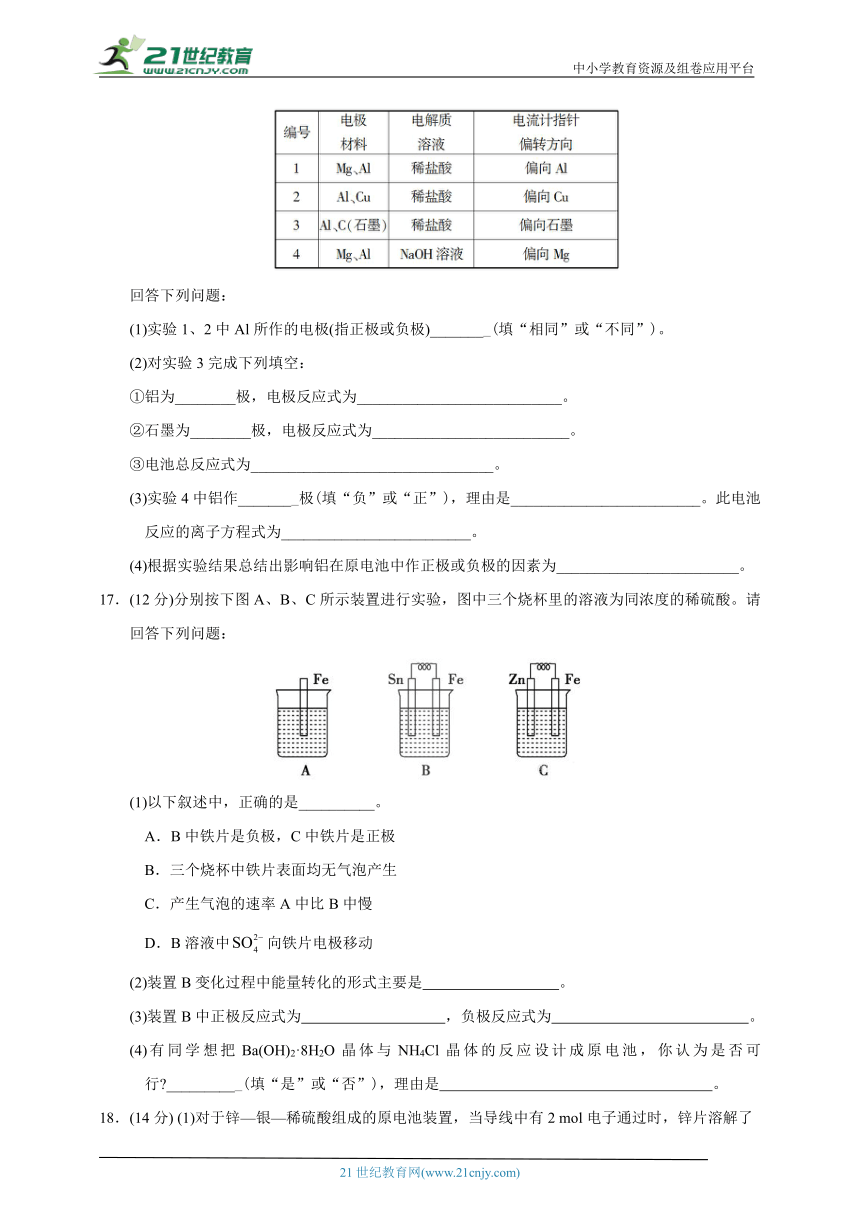
16.(14分)某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
回答下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)________(填“相同”或“不同”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式为___________________________。
②石墨为________极,电极反应式为__________________________。
③电池总反应式为________________________________。
(3)实验4中铝作________极(填“负”或“正”),理由是_________________________。此电池反应的离子方程式为_________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为________________________。
17.(12分)分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
(1)以下叙述中,正确的是__________。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是 。
(3)装置B中正极反应式为 ,负极反应式为 。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行 __________(填“是”或“否”),理由是 。
18.(14分) (1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2 mol电子通过时,锌片溶解了________g,银片上析出_____L H2(标准状况下)。电池总反应的化学方程式为 。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:
A、B两个电极均由多孔的碳块组成。该电池的正极反应式为 。若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为__________。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,则该电池的负极反应式为 。
1.答案:D
解析:A、属于氧化还原反应,能作为原电池工作时发生的反应,故A错误;B、属于氧化还原反应,能作为原电池工作时发生的反应,故B错误;C、属于氧化还原反应,能作为原电池(燃料电池)工作时发生的反应,故C错误;D、不属于氧化还原反应,不能作为原电池工作时发生的反应,故D正确;故选D。
2.答案:B
解析:根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。A、两个电极材料相同,所以不能构成原电池,A错误;B、两电极材料不同,锌较活泼能和稀硫酸能发生自发进行的氧化还原反应,且构成了闭合回路,所以能构成原电池,B正确;C、未构成闭合回路,所以不能构成原电池,C错误;D、无水乙醇是非电解质,所以不能构成原电池,D错误;答案选B。
3.答案:D
解析:Zn失去电子发生氧化反应,作负极。
4.答案:B
解析:加入CuSO4溶液,Zn置换出Cu,形成原电池,加快反应速率,由于锌粉过量、H2SO4定量,则产生H2的体积一样多,故选B。
5.答案:C
解析:A、X的活泼性应比铜差,能导电,故A正确;B、铜是负极,电子从铜电极经外电路流向X电极,故B正确;C、Y是硝酸银溶液,故C错误;D、X为正极氧化剂得电子,X极上的电极反应式为Ag++e ===Ag,故D正确;故选C。
6.答案:C
解析:铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A正确;原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;柠檬汁显酸性也能作电解质溶液,所以将稀硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动,故C错误;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确。
7.答案:D
解析:原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析。该原电池中,X极逐渐变粗,Y极逐渐变细,所以Y作负极,X作正极,Y的活泼性大于X的活泼性,所以排除AC选项;X极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意。答案选D。故选D。
8.答案:B
解析:由电极反应式可知,Zn失电子化合价升高,发生氧化反应,Zn作负极,故A错误;由正、负极的电极反应式可得原电池总反应为Ag2O+H2O+Zn===Zn(OH)2+2Ag,则电解质溶液的酸碱性基本保持不变,故B正确;原电池工作时,阴离子向负极移动,阳离子向正极移动,所以溶液中OH-向负极移动,K+、H+向正极移动,故C错误;原电池反应为自发的氧化还原反应,则常温下,该电池总反应为自发的氧化还原反应,故D错误。
9.答案:C
解析:该装置构成原电池,Zn是负极,Cu是正极。在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,A项错误;由于Zn是负极同,不断发生反应Zn-2e-Zn2+,所以溶液中c(Zn2+)逐渐增大,B项错误;由于反应不断消耗H+,所以溶液中c(H+)逐渐减小,C项正确; SO42-不参加反应,其浓度不变,D项错误。
10.答案:B
解析:Zn、Cu直接接触就能构成闭合回路而形成原电池,Zn片逐渐溶解,Cu片上可看到有气泡产生,A项正确;H+带正电荷,应该向正极Cu片移动,B项错误;由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C项正确;图2中假设消耗负极65 g Zn,则转移2 mol电子,正极产生2 g H2,而图3中消耗负极65 g Zn,也转移2 mol电子,则正极析出64 g Cu,正极产物的质量比为1∶32,D项正确。
11.答案:C
解析:Fe比Cu活泼,Fe作负极,电子由铁片流向铜片,故A、B错误;若X为Fe,Y为C,电解质为硫酸铜,则正极碳棒上析出Cu,故C正确;Zn比Cu活泼,Zn作负极,发生氧化反应,故D错误。
12.答案:C
解析:A项,根据原电池工作原理,化合价升高,失电子的作负极,即铝单质作负极,则Ag2O作电池的正极,正确;B项,根据电池总反应,铝的化合价升高,被氧化,正确;C项,根据原电池工作原理,外电路电子从负极流向正极,由铝流向氧化银,错误;D项同,根据原电池工作原理,阳离子移向正极,阴离子移向负极,即OH-移向Al极,正确。
13.答案:D
解析:放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,电极反应式为SO2+2H2O-2e-===SO+4H+,硫酸应当拆写成离子形式,B错误;酸性条件下,氧气得电子生成水, C错误;相同条件下,放电过程中:负极发生氧化反应:2SO2+4H2O-4e-===2SO+8H+,正极发生还原反应:O2+4e-+4H+===2H2O,根据转移电子数相等可知,放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
14.答案:A
解析:根据图像判断反应过程,判断正、负极,正确书写电极反应式。镁燃料电池,镁作负极失电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,若为碱性溶液生成Mg(OH)2。ClO 在正极反应,由图可知有Cl 和OH 生成,OH 向负极移动,生成Mg(OH)2。
15.答案:B
解析:根据总反应可判断Li被氧化,应为负极材料,其失电子成为Li+,正极放电的为MnO2。
16.答案: (1)不同
(2)①负 2Al 6e ===2Al3+ ②正 6H++6e ===3H2↑ ③2Al+6H+===2Al3++3H2↑
(3)负 铝与NaOH溶液可以发生自发的氧化还原反应 2Al+2OH +2H2O===2+3H2↑
(4)另一电极材料的活动性和电解质溶液能否与其发生氧化还原反应
解析:根据实验记录,不难看出实验1中Mg作负极,Al作正极;实验2中Al作负极,Cu作正极;实验3中,Al作负极,C作正极,总反应式是2Al+6H+===2Al3++3H2↑;实验4中,由于Al与NaOH溶液可以发生自发的氧化还原反应:2Al+2OH +2H2O===2+3H2↑,而Mg与NaOH溶液不反应,故Al作负极,Mg作正极,通过以上的实验可以看出:一般是活泼的金属作负极,但也有特殊情况,也要考虑电极与电解质溶液能否发生自发的氧化还原反应。
17.答案: (1)ACD (2)化学能转化为电能
(3)2H++2e ===H2↑ Fe 2e ===Fe2+
(4)否 不是氧化还原反应
解析:(1)活动性:Zn>Fe>Sn,活沷性强的金属易失电子作负极,故A正确;B、A烧杯中铁直接反应表面有气泡,C中铁作正极,烧杯中铁表面有气泡,故B错误;C、B形成原电池,比A中反应速率快,产生气泡的速率A中比B中慢,故C正确;D、原电池中阴离子移向负极,B中Fe是负极,B溶液中向铁片电极移动,故D正确;故选ACD。(2)装置B形成原电池,变化过程中能量转化的形式主要是化学能转化为电能。(3)Sn作正极,正极上氢离子得电子生成氢气装置B中正极反应式为 2H++2e ===H2↑,活泼金属锌作负极,电极反应为Fe,负极反应式为Fe 2e ===Fe2+。
(4)常温下自发进行的氧化还原反应,可设计成原电池,而Ba(OH)2·8H2O晶体与NH4Cl晶体的反应为非氧化还原反应,则不能设计成原电池。
18.答案:(1)65 22.4 Zn + H2SO4===ZnSO4 + H2 ↑
(2)O2+2H2O+4e ===4OH 2 mol
(3)CH4+10OH 8e ===+7H2O
解析:(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2 mol电子通过时,锌呈+2价,锌片溶解了65 g,银片上析出1 mol即22.4 L H2(标准状况下)。电池总反应的化学方程式为Zn+ H2SO4===ZnSO4 + H2 ↑。(2)该电池的正极通入氧气,正极反应式为O2+2H2O+4e ===4OH 。若该电池工作时增加了1 mol H2O,H2O~2e ,电路中转移电子的物质的量为2 mol。(3)如果将上述装置中通入的H2改成CH4气体,则该电池的负极反应式为:CH4+10OH 8e ===+7H2O。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
6.1 第2课时 化学反应与电能 同步练习题
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
1.下列反应不可能作为原电池工作时发生的反应的是( )
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.2Fe+O2+2H2O===2Fe(OH)2
C.2H2+O2===2H2O
D.NaOH+HCl===NaCl+H2O
2.下列装置能构成原电池的是( )
3.已知空气—锌电池的电极反应式为
锌片:Zn+2OH 2e ===ZnO+H2O;碳棒:O2+H2O+2e ===2OH 。
据此判断,锌片为( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
4.向两份过量的锌粉a、b中分别加入一定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系正确的是( )
5. 根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
A.X可以是银或石墨
B.电子从铜电极经外电路流向X电极
C.Y是硫酸铜溶液
D.X极上的电极反应式为Ag++e ===Ag
6. 如图是用化学电源使LED灯发光的装置。下列说法错误的是( )
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
7. X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y 棒变细,则X、Y和Z溶液可能是下列中的( )
编号 X Y Z溶液
A Zn Cu 稀硫酸
B Cu Zn 稀硫酸
C Cu Ag 硫酸铜溶液
D Ag Zn 硝酸银溶液
8. 某些电子手表安装的纽扣电池由锌和氧化银、KOH溶液构成。放电时,电极反应分别为Zn+2OH--2e===Zn(OH)2;Ag2O+H2O+2e-===2Ag+2OH-。下列说法中正确的是( )
A.锌为正极,电极上发生了氧化反应
B.放电过程中,电解质溶液的酸碱性基本保持不变
C.溶液中的OH-向正极移动,K+和H+向负极移动
D.常温下,该电池总反应为非自发的氧化还原反应
9. 图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示 ( )
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-)
10.实验探究是提高学习效果的有力手段。陈颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
A.若将图1中的Zn、Cu下端接触,Zn片逐渐溶解,Cu片上能看到气泡产生
B.图2中H+向Zn片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中,Zn片减轻的质量相等时,正极产物的质量比为1∶32
11.某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )
A.若X为Fe,Y为Cu,则铁为正极
B.若X为Fe,Y为Cu,则电子由铜片流向铁片
C.若X为Fe,Y为C,则碳棒上有红色固体析出
D.若X为Cu,Y为Zn,则锌片发生还原反应
12.鱼雷是一种水中兵器。它可从舰艇、飞机上发射,它发射后可自己控制航行方向和深度,遇到舰船,只要一接触就可以爆炸。用于攻击敌方水面舰船和潜艇,也可以用于封锁港口和狭窄水道。鱼雷采用Al-Ag2O动力电池,以溶有氢氧化钾的流动海水为电解液,电池反应为2Al+3Ag2O+2KOH===6Ag+2KAlO2+H2O,下列说法错误的是( )
A.Ag2O为电池的正极
B.Al在电池反应中被氧化
C.电子由Ag2O极经外电路流向Al极
D.溶液中的OH-向Al极迁移
13.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是( )
A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应为SO2+2H2O-2e-===H2SO4+2H+
C.Pt2电极附近发生的反应为O2+4e-+2H2O===4OH-
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
14.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
A.放电过程中OH 移向正极
B.电池的总反应式为Mg+ClO +H2O===Mg(OH)2↓+Cl
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e ===2H2O
15.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池, 某种锂离子电池的总反应为Li+MnO2===LiMnO2,下列说法中正确的是( )
A.Li是正极,电极反应式为Li e ===Li+
B.Li是负极,电极反应式为Li e ===Li+
C.MnO2是负极,电极反应式为MnO2+e ===MnO2
D.Li是负极,电极反应式为Li 2e ===Li2+
二、填空题(本题包括3个小题,共40分)
16.(14分)某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
回答下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)________(填“相同”或“不同”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式为___________________________。
②石墨为________极,电极反应式为__________________________。
③电池总反应式为________________________________。
(3)实验4中铝作________极(填“负”或“正”),理由是_________________________。此电池反应的离子方程式为_________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为________________________。
17.(12分)分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:
(1)以下叙述中,正确的是__________。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是 。
(3)装置B中正极反应式为 ,负极反应式为 。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行 __________(填“是”或“否”),理由是 。
18.(14分) (1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2 mol电子通过时,锌片溶解了________g,银片上析出_____L H2(标准状况下)。电池总反应的化学方程式为 。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:
A、B两个电极均由多孔的碳块组成。该电池的正极反应式为 。若该电池工作时增加了1 mol H2O,电路中转移电子的物质的量为__________。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,则该电池的负极反应式为 。
1.答案:D
解析:A、属于氧化还原反应,能作为原电池工作时发生的反应,故A错误;B、属于氧化还原反应,能作为原电池工作时发生的反应,故B错误;C、属于氧化还原反应,能作为原电池(燃料电池)工作时发生的反应,故C错误;D、不属于氧化还原反应,不能作为原电池工作时发生的反应,故D正确;故选D。
2.答案:B
解析:根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。A、两个电极材料相同,所以不能构成原电池,A错误;B、两电极材料不同,锌较活泼能和稀硫酸能发生自发进行的氧化还原反应,且构成了闭合回路,所以能构成原电池,B正确;C、未构成闭合回路,所以不能构成原电池,C错误;D、无水乙醇是非电解质,所以不能构成原电池,D错误;答案选B。
3.答案:D
解析:Zn失去电子发生氧化反应,作负极。
4.答案:B
解析:加入CuSO4溶液,Zn置换出Cu,形成原电池,加快反应速率,由于锌粉过量、H2SO4定量,则产生H2的体积一样多,故选B。
5.答案:C
解析:A、X的活泼性应比铜差,能导电,故A正确;B、铜是负极,电子从铜电极经外电路流向X电极,故B正确;C、Y是硝酸银溶液,故C错误;D、X为正极氧化剂得电子,X极上的电极反应式为Ag++e ===Ag,故D正确;故选C。
6.答案:C
解析:铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A正确;原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;柠檬汁显酸性也能作电解质溶液,所以将稀硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动,故C错误;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确。
7.答案:D
解析:原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析。该原电池中,X极逐渐变粗,Y极逐渐变细,所以Y作负极,X作正极,Y的活泼性大于X的活泼性,所以排除AC选项;X极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意。答案选D。故选D。
8.答案:B
解析:由电极反应式可知,Zn失电子化合价升高,发生氧化反应,Zn作负极,故A错误;由正、负极的电极反应式可得原电池总反应为Ag2O+H2O+Zn===Zn(OH)2+2Ag,则电解质溶液的酸碱性基本保持不变,故B正确;原电池工作时,阴离子向负极移动,阳离子向正极移动,所以溶液中OH-向负极移动,K+、H+向正极移动,故C错误;原电池反应为自发的氧化还原反应,则常温下,该电池总反应为自发的氧化还原反应,故D错误。
9.答案:C
解析:该装置构成原电池,Zn是负极,Cu是正极。在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,A项错误;由于Zn是负极同,不断发生反应Zn-2e-Zn2+,所以溶液中c(Zn2+)逐渐增大,B项错误;由于反应不断消耗H+,所以溶液中c(H+)逐渐减小,C项正确; SO42-不参加反应,其浓度不变,D项错误。
10.答案:B
解析:Zn、Cu直接接触就能构成闭合回路而形成原电池,Zn片逐渐溶解,Cu片上可看到有气泡产生,A项正确;H+带正电荷,应该向正极Cu片移动,B项错误;由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C项正确;图2中假设消耗负极65 g Zn,则转移2 mol电子,正极产生2 g H2,而图3中消耗负极65 g Zn,也转移2 mol电子,则正极析出64 g Cu,正极产物的质量比为1∶32,D项正确。
11.答案:C
解析:Fe比Cu活泼,Fe作负极,电子由铁片流向铜片,故A、B错误;若X为Fe,Y为C,电解质为硫酸铜,则正极碳棒上析出Cu,故C正确;Zn比Cu活泼,Zn作负极,发生氧化反应,故D错误。
12.答案:C
解析:A项,根据原电池工作原理,化合价升高,失电子的作负极,即铝单质作负极,则Ag2O作电池的正极,正确;B项,根据电池总反应,铝的化合价升高,被氧化,正确;C项,根据原电池工作原理,外电路电子从负极流向正极,由铝流向氧化银,错误;D项同,根据原电池工作原理,阳离子移向正极,阴离子移向负极,即OH-移向Al极,正确。
13.答案:D
解析:放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO2被氧化为硫酸,电极反应式为SO2+2H2O-2e-===SO+4H+,硫酸应当拆写成离子形式,B错误;酸性条件下,氧气得电子生成水, C错误;相同条件下,放电过程中:负极发生氧化反应:2SO2+4H2O-4e-===2SO+8H+,正极发生还原反应:O2+4e-+4H+===2H2O,根据转移电子数相等可知,放电过程中消耗的SO2和O2的体积比为2∶1,D正确。
14.答案:A
解析:根据图像判断反应过程,判断正、负极,正确书写电极反应式。镁燃料电池,镁作负极失电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,若为碱性溶液生成Mg(OH)2。ClO 在正极反应,由图可知有Cl 和OH 生成,OH 向负极移动,生成Mg(OH)2。
15.答案:B
解析:根据总反应可判断Li被氧化,应为负极材料,其失电子成为Li+,正极放电的为MnO2。
16.答案: (1)不同
(2)①负 2Al 6e ===2Al3+ ②正 6H++6e ===3H2↑ ③2Al+6H+===2Al3++3H2↑
(3)负 铝与NaOH溶液可以发生自发的氧化还原反应 2Al+2OH +2H2O===2+3H2↑
(4)另一电极材料的活动性和电解质溶液能否与其发生氧化还原反应
解析:根据实验记录,不难看出实验1中Mg作负极,Al作正极;实验2中Al作负极,Cu作正极;实验3中,Al作负极,C作正极,总反应式是2Al+6H+===2Al3++3H2↑;实验4中,由于Al与NaOH溶液可以发生自发的氧化还原反应:2Al+2OH +2H2O===2+3H2↑,而Mg与NaOH溶液不反应,故Al作负极,Mg作正极,通过以上的实验可以看出:一般是活泼的金属作负极,但也有特殊情况,也要考虑电极与电解质溶液能否发生自发的氧化还原反应。
17.答案: (1)ACD (2)化学能转化为电能
(3)2H++2e ===H2↑ Fe 2e ===Fe2+
(4)否 不是氧化还原反应
解析:(1)活动性:Zn>Fe>Sn,活沷性强的金属易失电子作负极,故A正确;B、A烧杯中铁直接反应表面有气泡,C中铁作正极,烧杯中铁表面有气泡,故B错误;C、B形成原电池,比A中反应速率快,产生气泡的速率A中比B中慢,故C正确;D、原电池中阴离子移向负极,B中Fe是负极,B溶液中向铁片电极移动,故D正确;故选ACD。(2)装置B形成原电池,变化过程中能量转化的形式主要是化学能转化为电能。(3)Sn作正极,正极上氢离子得电子生成氢气装置B中正极反应式为 2H++2e ===H2↑,活泼金属锌作负极,电极反应为Fe,负极反应式为Fe 2e ===Fe2+。
(4)常温下自发进行的氧化还原反应,可设计成原电池,而Ba(OH)2·8H2O晶体与NH4Cl晶体的反应为非氧化还原反应,则不能设计成原电池。
18.答案:(1)65 22.4 Zn + H2SO4===ZnSO4 + H2 ↑
(2)O2+2H2O+4e ===4OH 2 mol
(3)CH4+10OH 8e ===+7H2O
解析:(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2 mol电子通过时,锌呈+2价,锌片溶解了65 g,银片上析出1 mol即22.4 L H2(标准状况下)。电池总反应的化学方程式为Zn+ H2SO4===ZnSO4 + H2 ↑。(2)该电池的正极通入氧气,正极反应式为O2+2H2O+4e ===4OH 。若该电池工作时增加了1 mol H2O,H2O~2e ,电路中转移电子的物质的量为2 mol。(3)如果将上述装置中通入的H2改成CH4气体,则该电池的负极反应式为:CH4+10OH 8e ===+7H2O。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
