1.1 第二课时 物质的转化 课件(共27张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1 第二课时 物质的转化 课件(共27张PPT) 2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:41:31 | ||
图片预览






文档简介
(共27张PPT)
第一节 物质的分类及转化
第一章物质及其变化
第二课时 物质的转化
目录
CONTENT
一、酸碱盐的性质
二、物质的转化
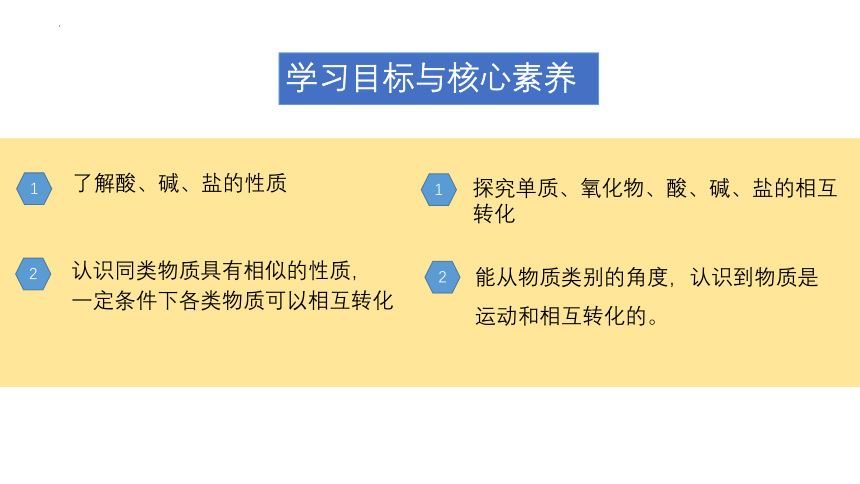
学习目标与核心素养
了解酸、碱、盐的性质
认识同类物质具有相似的性质,
一定条件下各类物质可以相互转化
1
2
探究单质、氧化物、酸、碱、盐的相互转化
能从物质类别的角度,认识到物质是运动和相互转化的。
1
2
课前回顾
按照氧化物的性质将氧化物分类
酸性氧化物
碱性氧化物
与碱反应只生成盐和水
与酸反应只生成盐和水
已知SO3是一种酸性氧化物,那么你能不能写出其与氢氧化钠溶液反应的化学反应方程式呢?
SO3 + 2NaOH = Na2SO4 + H2O
实现物质转化的基本依据化学反应前后元素种类不会改变。
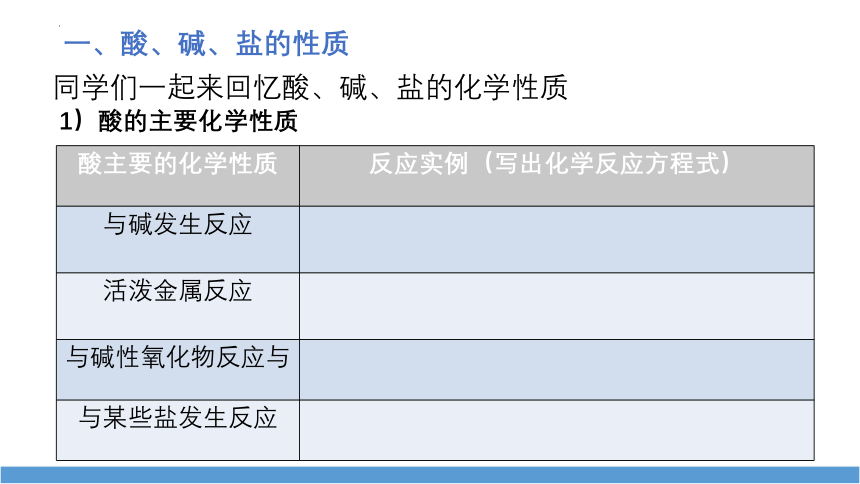
酸主要的化学性质 反应实例(写出化学反应方程式)
与碱发生反应
活泼金属反应
与碱性氧化物反应与
与某些盐发生反应
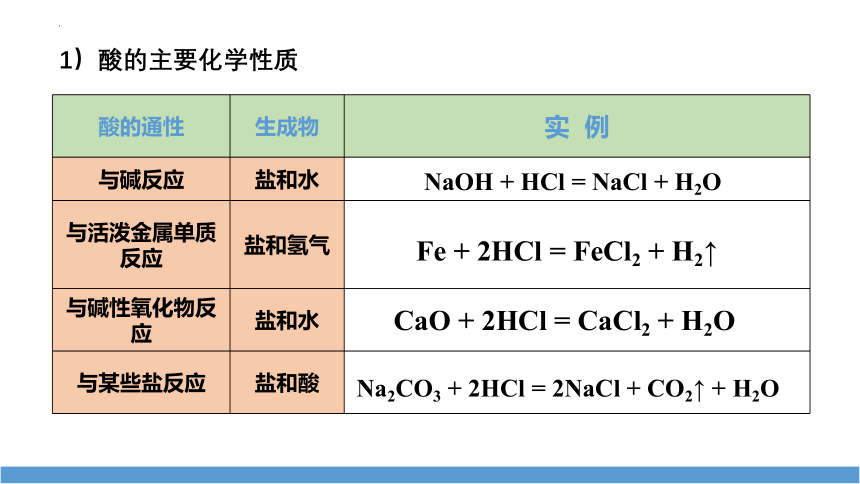
1)酸的主要化学性质
同学们一起来回忆酸、碱、盐的化学性质
一、酸、碱、盐的性质
酸的通性 生成物 实 例
与碱反应 盐和水
与活泼金属单质反应 盐和氢气
与碱性氧化物反应 盐和水
与某些盐反应 盐和酸
网
网
网
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2 + H2↑
CaO + 2HCl = CaCl2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
1)酸的主要化学性质
1)酸的通性
酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有____。
+酸碱指示剂,如使紫色石蕊溶液变红色
+活泼金属—→盐+氢气(置换反应)
+碱性氧化物—→盐+水
+碱—→盐+水
+盐—→新酸+新盐
酸
复分解反应
H+
碱的主要化学性质 反应实例(写出化学方程式)
碱与酸性氧化物反应 ________________________
碱与酸反应 ________________________
碱与某些盐反应 ________________________
2)碱的主要化学性质
2NaOH+CO2===Na2CO3+H2O
2KOH+CuSO4===K2SO4+Cu(OH)2↓
2NaOH+H2SO4===Na2SO4+2H2O
举例:
2)碱的通性
(1)碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有______。
(2)碱的通性
碱
+酸碱指示剂,如使酚酞溶液变红色
+酸性氧化物―→盐+水
+酸―→盐+水
+盐―→新碱+新盐
复分解反应
OH-
盐的主要化学性质 反应实例(写出化学方程式)
盐与单质反应 ________________________
盐与酸反应 ________________________
盐与碱反应 ________________________
盐与盐反应 ________________________
3)盐的主要化学性质
Zn+CuSO4===ZnSO4+Cu
BaCO3+2HCl===BaCl2+CO2↑+H2O
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
Na2CO3+BaCl2===2NaCl+BaCO3↓
举例:
结论:酸、碱、盐之间的反应属于复分解反应
3)盐的通性
(1)同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同阴离子或阳离子。
(2)盐的化学性质常涉及的化学反应
特别提醒 盐与盐、盐与碱能反应的条件一般要求二者都可溶。
(1)指出表中各物质的类别
小组思考
物质 NaOH HNO3 CO2 P4 Na2CO3 CuCl2 MgO
类别 ___ ___ _______ ____ ___ ___ _______
碱
酸
氧化物
单质
盐
盐
氧化物
(2)写出上述物质中能与氢氧化钡溶液反应的化学方程式:
①__________________________________;
②_____________________________________________________________;
③____________________________________;
④___________________________________。
2HNO3+Ba(OH)2===Ba(NO3)2+2H2O
CO2+Ba(OH)2===BaCO3↓+H2O[或2CO2+Ba(OH)2===Ba(HCO3)2]
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
CuCl2+Ba(OH)2===Cu(OH)2↓+BaCl2
1) 酸的分类:
① 按组成分
② 按电离出H+的个数分
含氧酸 :H2SO4、HNO3、H2CO3
无氧酸:HCl
一元酸:HCl、CH3COOH
二元酸 :H2SO4 、H2CO3
三元酸 :H3PO4
③按酸性强弱分
强酸:HCl、H2SO4、HNO3
弱酸:H2CO3、CH3COOH
物质分类的应用
2)碱的分类
① 按电离出OH-的个数分
② 按碱性强弱分
一元碱:KOH、NaOH
二元碱:Ba(OH)2
强碱: KOH、Ba(OH)2
弱碱:NH3·H2O
正盐: Na2SO4
酸式盐:NaHSO4
碱式盐:Cu2(OH)2CO3
3)盐的分类
按解离出的阴阳离子成分分类
金属单质
氧气
碱性氧化物
水
碱
酸
盐
二、物质的转化
非金属单质
氧气
酸性氧化物
水
酸
碱
盐
根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
钙转化为硫酸钙的流程:
二、物质的转化
碳转化为碳酸钙的流程:
Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
C+O2 CO2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
化合反应
化合反应
复分解反应
化合反应
化合反应
复分解反应
1.基本依据:化学变化过程中,_______是不会改变的。即化学反应中的_____守恒。
2.应用:确定制取某类物质的可能方法。
元素
质量
3.单质到盐的一般转化关系:
4.工业生产中的其他因素:原料来源、成本高低、设备要求和环保要求等。
酸、碱、盐之间主要的化学反应,涉及到哪些反应类型
认识单质、氧化物、酸、碱、盐之间的反应
(1)活泼金属(如钠等)与水剧烈反应,与水溶液反应时会置换出氢气而不是金属单质;置换其他金属时必须是与其熔融的盐反应。
(2)酸性氧化物、碱性氧化物不一定与水反应,如SiO2、CuO等既不溶于水,也不与水反应。
(3)盐和盐、碱和盐反应的条件,
除生成物中有沉淀或气体之外,
反应物必须是可溶性的。
二、物质的转化
根据上面的转化过程,写出非金属单质S到对应盐Na2SO3的转化过程。
硫和碳均为非金属单质,在性质上有一定的相似性,你能写出下列转化的化学方程式吗
古诗词中蕴含着丰富的化学变化,明朝的诗人于谦的《石灰吟》是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠、不怕牺牲的意愿和坚守高洁情操的决心。
(1)上述诗句中涉及了哪些化学物质 它们分别属于哪类物质
(2)以上述物质为例,描述各类化合物之间的转化关系。
提示:诗句中涉及了碳酸钙、氧化钙,分别属于盐和氧化物;常见含钙化合物的转化关系为
同学们告诉了转化关系,写出化学方程式
当堂训练
1.无色溶液X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量AgNO3溶液、CuO固体、NaOH溶液,产生的现象如下表。则物质X是下列选项中的( )
A.NaCl溶液 B.Ca(OH)2溶液 C.稀硝酸 D.稀盐酸
AgNO3溶液 CuO固体 NaOH溶液
现象 白色沉淀 溶解,溶液变蓝 无明显现象
D
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO C CuO
D Fe CuCl2 Zn HCl
2.如图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
D
3.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
D
1.单质到盐的一种转化关系
2.根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
课堂总结
谢谢
第一节 物质的分类及转化
第一章物质及其变化
第二课时 物质的转化
目录
CONTENT
一、酸碱盐的性质
二、物质的转化
学习目标与核心素养
了解酸、碱、盐的性质
认识同类物质具有相似的性质,
一定条件下各类物质可以相互转化
1
2
探究单质、氧化物、酸、碱、盐的相互转化
能从物质类别的角度,认识到物质是运动和相互转化的。
1
2
课前回顾
按照氧化物的性质将氧化物分类
酸性氧化物
碱性氧化物
与碱反应只生成盐和水
与酸反应只生成盐和水
已知SO3是一种酸性氧化物,那么你能不能写出其与氢氧化钠溶液反应的化学反应方程式呢?
SO3 + 2NaOH = Na2SO4 + H2O
实现物质转化的基本依据化学反应前后元素种类不会改变。
酸主要的化学性质 反应实例(写出化学反应方程式)
与碱发生反应
活泼金属反应
与碱性氧化物反应与
与某些盐发生反应
1)酸的主要化学性质
同学们一起来回忆酸、碱、盐的化学性质
一、酸、碱、盐的性质
酸的通性 生成物 实 例
与碱反应 盐和水
与活泼金属单质反应 盐和氢气
与碱性氧化物反应 盐和水
与某些盐反应 盐和酸
网
网
网
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2 + H2↑
CaO + 2HCl = CaCl2 + H2O
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
1)酸的主要化学性质
1)酸的通性
酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有____。
+酸碱指示剂,如使紫色石蕊溶液变红色
+活泼金属—→盐+氢气(置换反应)
+碱性氧化物—→盐+水
+碱—→盐+水
+盐—→新酸+新盐
酸
复分解反应
H+
碱的主要化学性质 反应实例(写出化学方程式)
碱与酸性氧化物反应 ________________________
碱与酸反应 ________________________
碱与某些盐反应 ________________________
2)碱的主要化学性质
2NaOH+CO2===Na2CO3+H2O
2KOH+CuSO4===K2SO4+Cu(OH)2↓
2NaOH+H2SO4===Na2SO4+2H2O
举例:
2)碱的通性
(1)碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有______。
(2)碱的通性
碱
+酸碱指示剂,如使酚酞溶液变红色
+酸性氧化物―→盐+水
+酸―→盐+水
+盐―→新碱+新盐
复分解反应
OH-
盐的主要化学性质 反应实例(写出化学方程式)
盐与单质反应 ________________________
盐与酸反应 ________________________
盐与碱反应 ________________________
盐与盐反应 ________________________
3)盐的主要化学性质
Zn+CuSO4===ZnSO4+Cu
BaCO3+2HCl===BaCl2+CO2↑+H2O
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
Na2CO3+BaCl2===2NaCl+BaCO3↓
举例:
结论:酸、碱、盐之间的反应属于复分解反应
3)盐的通性
(1)同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同阴离子或阳离子。
(2)盐的化学性质常涉及的化学反应
特别提醒 盐与盐、盐与碱能反应的条件一般要求二者都可溶。
(1)指出表中各物质的类别
小组思考
物质 NaOH HNO3 CO2 P4 Na2CO3 CuCl2 MgO
类别 ___ ___ _______ ____ ___ ___ _______
碱
酸
氧化物
单质
盐
盐
氧化物
(2)写出上述物质中能与氢氧化钡溶液反应的化学方程式:
①__________________________________;
②_____________________________________________________________;
③____________________________________;
④___________________________________。
2HNO3+Ba(OH)2===Ba(NO3)2+2H2O
CO2+Ba(OH)2===BaCO3↓+H2O[或2CO2+Ba(OH)2===Ba(HCO3)2]
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
CuCl2+Ba(OH)2===Cu(OH)2↓+BaCl2
1) 酸的分类:
① 按组成分
② 按电离出H+的个数分
含氧酸 :H2SO4、HNO3、H2CO3
无氧酸:HCl
一元酸:HCl、CH3COOH
二元酸 :H2SO4 、H2CO3
三元酸 :H3PO4
③按酸性强弱分
强酸:HCl、H2SO4、HNO3
弱酸:H2CO3、CH3COOH
物质分类的应用
2)碱的分类
① 按电离出OH-的个数分
② 按碱性强弱分
一元碱:KOH、NaOH
二元碱:Ba(OH)2
强碱: KOH、Ba(OH)2
弱碱:NH3·H2O
正盐: Na2SO4
酸式盐:NaHSO4
碱式盐:Cu2(OH)2CO3
3)盐的分类
按解离出的阴阳离子成分分类
金属单质
氧气
碱性氧化物
水
碱
酸
盐
二、物质的转化
非金属单质
氧气
酸性氧化物
水
酸
碱
盐
根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
钙转化为硫酸钙的流程:
二、物质的转化
碳转化为碳酸钙的流程:
Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
C+O2 CO2
CO2+H2O===H2CO3
H2CO3+Ca(OH)2===CaCO3↓+2H2O
化合反应
化合反应
复分解反应
化合反应
化合反应
复分解反应
1.基本依据:化学变化过程中,_______是不会改变的。即化学反应中的_____守恒。
2.应用:确定制取某类物质的可能方法。
元素
质量
3.单质到盐的一般转化关系:
4.工业生产中的其他因素:原料来源、成本高低、设备要求和环保要求等。
酸、碱、盐之间主要的化学反应,涉及到哪些反应类型
认识单质、氧化物、酸、碱、盐之间的反应
(1)活泼金属(如钠等)与水剧烈反应,与水溶液反应时会置换出氢气而不是金属单质;置换其他金属时必须是与其熔融的盐反应。
(2)酸性氧化物、碱性氧化物不一定与水反应,如SiO2、CuO等既不溶于水,也不与水反应。
(3)盐和盐、碱和盐反应的条件,
除生成物中有沉淀或气体之外,
反应物必须是可溶性的。
二、物质的转化
根据上面的转化过程,写出非金属单质S到对应盐Na2SO3的转化过程。
硫和碳均为非金属单质,在性质上有一定的相似性,你能写出下列转化的化学方程式吗
古诗词中蕴含着丰富的化学变化,明朝的诗人于谦的《石灰吟》是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠、不怕牺牲的意愿和坚守高洁情操的决心。
(1)上述诗句中涉及了哪些化学物质 它们分别属于哪类物质
(2)以上述物质为例,描述各类化合物之间的转化关系。
提示:诗句中涉及了碳酸钙、氧化钙,分别属于盐和氧化物;常见含钙化合物的转化关系为
同学们告诉了转化关系,写出化学方程式
当堂训练
1.无色溶液X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量AgNO3溶液、CuO固体、NaOH溶液,产生的现象如下表。则物质X是下列选项中的( )
A.NaCl溶液 B.Ca(OH)2溶液 C.稀硝酸 D.稀盐酸
AgNO3溶液 CuO固体 NaOH溶液
现象 白色沉淀 溶解,溶液变蓝 无明显现象
D
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO C CuO
D Fe CuCl2 Zn HCl
2.如图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
D
3.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
D
1.单质到盐的一种转化关系
2.根据物质的组成和性质,以及物质之间的转化关系,可以确定制取某类物质的可能方法。
课堂总结
谢谢
