第1章第3节电能转化为化学能——电解同步练习 (含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章第3节电能转化为化学能——电解同步练习 (含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1 | 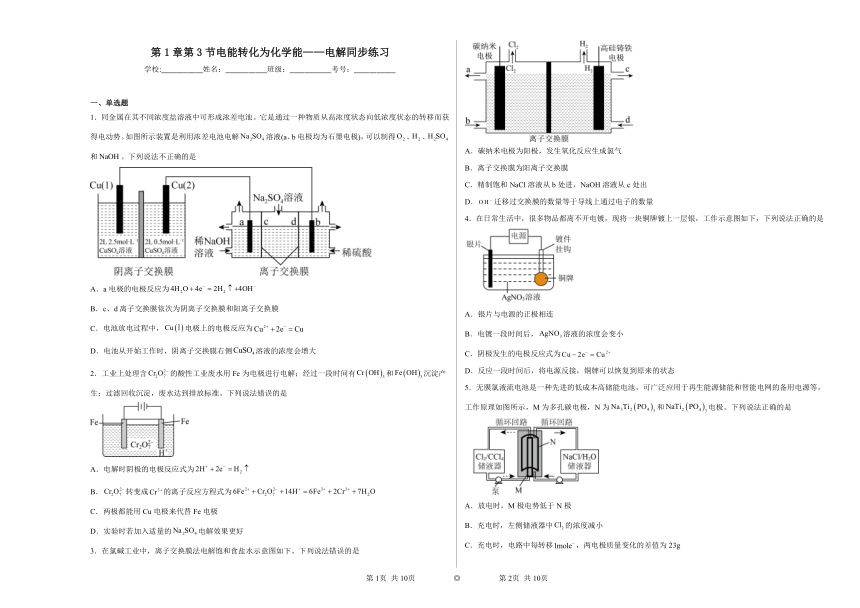 | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:16:44 | ||
图片预览



文档简介
第1章第3节电能转化为化学能——电解同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.同金属在其不同浓度盐溶液中可形成浓差电池。它是通过一种物质从高浓度状态向低浓度状态的转移而获得电动势。如图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法不正确的是
A.a电极的电极反应为
B.c、d离子交换膜依次为阴离子交换膜和阳离子交换膜
C.电池放电过程中,电极上的电极反应为
D.电池从开始工作时,阴离子交换膜右侧溶液的浓度会增大
2.工业上处理含的酸性工业废水用Fe为电极进行电解;经过一段时间有和沉淀产生;过滤回收沉淀,废水达到排放标准。下列说法错误的是
A.电解时阴极的电极反应式为
B.转变成的离子反应方程式为
C.两极都能用Cu电极来代替Fe电极
D.实验时若加入适量的电解效果更好
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
4.在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,工作示意图如下,下列说法正确的是
A.银片与电源的正极相连
B.电镀一段时间后,溶液的浓度会变小
C.阴极发生的电极反应式为
D.反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
5.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
6.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
7.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阴极附近溶液的pH升高
C.阳极反应方程式为:
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
8.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性)
A.阳极发生还原反应,其电极反应式为
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有和
9.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH- -4e- =O2↑+2H2O
B.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
C.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小
D.为了提高Ni的产率,电解过程中需要控制废水pH
10.下列图示中关于铜电极的连接错误的是
A.铜锌原电池 B.电解精炼铜 C.在镀件上镀铜 D.电解氯化铜溶液
A.A B.B C.C D.D
11.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是
A.电解池的阴极反应式为
B.通入空气(除)的电极为负极
C.电解池中产生2mol时,理论上燃料电池中消耗0.5mol
D.a、b、c的大小关系为
12.下列说法正确的是
A.电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
B.盐桥可以把负极区的阳离子转移到正极区,把正极区的阴离子转移到负极区
C.原电池的正极和电解池的阳极均发生失去电子的氧化反应
D.电解精炼铜时,阳极为粗铜,阴极为纯铜,电解液中c(Cu2+)保持不变
13.某电化学装置如图所示,A、B分别为两个电极。下列说法错误的是
A.若A、B均为相同的石墨电极,a、b之间接上电流计,则电流计指针不偏转
B.若A为锌片,B为铜片,a、b之间接上电流计,则电流计指针发生偏转
C.若A为锌片,B为铜片,a接电源负极、b接电源正极,则溶液中基本不变
D.若B为粗铜,A为精铜,a接电源正极、b接电源负极,则A减少的质量与B增加的质量不相等
14.关于如图所示各装置的叙述中,正确的是
A.图1是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.图2通电一段时间后石墨I电极附近溶液红褐色加深(已知氢氧化铁胶粒带正电荷)
C.若用图3精炼铜,则d极为纯铜,电子迁移方向为b→d→c→a
D.若用图4电镀,M为CuSO4溶液,可以实现在铁上镀铜
15.镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因此成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为。下列说法错误的是
A.放电时向正极移动
B.放电时正极反应式为
C.放电时发生氧化反应
D.充电时阴极的电极反应式为
二、填空题
16.粗铜提纯
(1)原理图
(2)电极材料:阳极为___________;阴极为___________。
(3)电解质溶液:___________。
(4)电极反应:
阳极:___________、___________;
阴极:___________;
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
17.电镀
(1)原理图
(2)含义:利用电解原理在某些金属表面再镀上一层其他金属或合金,增强金属的抗腐蚀、表面硬度或美观目的。
(3)电镀池构成:
①电极材料:待镀件作___________极,镀层金属作___________极。
②电解质溶液:___________。
(4)电极反应:阳极:X—ne—=Xn+;阴极:Ym++me-=Y。
(5)特点:当电路中转移1mol电子时,阳极质量减少质量与阴极质量增加质量相等,电镀液的浓度基本不变。
三、实验题
18.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置则可制得纯净的Fe(OH)2沉淀, 两极材料分别为石墨和铁。
①a电极材料为_______,该电极的电极反应式为________.
②若白色沉淀在电极周围生成,则电解液d是____(填序号,下同);若白色沉淀在两极之间的溶液中生成,则电解液d是____。
A.纯水 B.NaCl溶液 C.NaOH溶液D.CuCl2溶液
③液体c为苯,其作用是__________
④要想尽早在两极之间的溶液中看到白色沉淀, 可以采取的措施是( )
A.改用稀硫酸作电解 B.适当增大电源电压 C.适当降低电解液温度
19.某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质
(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U形管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验
①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成的总电极反应式是______。
③某同学推测生成的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
______
第3页 共4页 ◎ 第4页 共4页
第1页 共2页 ◎ 第2页 共2页
参考答案:
1.B
【分析】左侧的浓差电池中,Cu(1)电极为正极,电极反应为Cu2++2e =Cu,Cu(2)电极为负极,电极反应为Cu-2e =Cu2+;右侧的电解池中,NaOH在a电极处产生,获得浓NaOH溶液和H2,H2SO4在b电极处产生,获得较浓的硫酸和O2,则a电极为阴极,电极反应式为4H2O+4e-=2H2↑+4OH-,b电极为阳极,电极反应式为2H2O-4e-=4H++O2↑。
【详解】A.由分析可知,a电极为阴极,电极反应式为4H2O+4e-=2H2↑+4OH-,A正确;
B.由分析可知,OH-在a电极上产生,并获得浓NaOH溶液,H+在b电极上产生,并获得较浓的硫酸,则c、d离子交换膜依次为阳离子交换膜和阴离子交换膜,B错误;
C.由分析可知,电池放电过程中,Cu(1)电极为正极,电极反应为Cu2++2e =Cu,C正确;
D.电池放电过程中,左侧c(Cu2+)逐渐减小,右侧c(Cu2+)逐渐增大,右侧溶液的浓度会增大,D正确;
故选B。
2.C
【详解】A.阳极为Fe,为活泼电极,本身失去电子生成:,阴极上溶液中的得电子生成:,A正确;
B.阳极上生成的具有还原性,与在酸性中发生氧化还原反应生成和,离子方程式为:,B正确;
C.将Fe换为Cu,阳极上Cu失去电子生成,而无还原性,不能与发生氧化还原反应使之生成低价的,从而达不到处理废水的目的,C不正确;
D.离子浓度越大,溶液的导电性越强,若污水中离子浓度较小,导电能力较差,可加入适量的来增强溶液导电性,故D正确。
故选C。
3.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
4.A
【分析】本图为在铜牌表面镀银,银作阳极,与电源正极相连,铜作阴极,与电源负极相连,电镀过程中电镀液浓度不变。
【详解】A.银片与电源的正极相连,A正确;
B.电镀过程中溶液的浓度不变,B错误;
C.铜作阴极,阴极发生的电极反应式为,C错误;
D.Cu活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应式为,即Cu会溶于溶液中,铜牌不能恢复到原来的状态,D错误;
故选A。
5.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
6.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
7.A
【详解】A.由题意知电解过程中氯离子失电子生成氯气,该反应应在阳极发生,阳极:2Cl--2e-=Cl2↑,则阳极应为惰性电极,因此不能是铁,故A错误,
B.阴极:2H++2e-=H2↑,阴极溶液呈碱性,pH升高,故B正确;
C.由以上分析可知阳极反应为:,故C正确;
D.由Ni2+→Ni3+,失去1 mol e-,外电路中转移1 mol e-,即Cl-失去1 mol e-,H+得到1 mol e-,故D正确;
故选:A。
8.C
【分析】金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,电解时粗镍作阳极,发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,纯镍作阴极,电极反应为:Ni2++2e-=Ni,NiSO4溶液作电解质溶液,据此分析解题:
【详解】A.由分析可知,阳极发生氧化反应,其电极反应式为Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,A错误;
B.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,阴极发生的电极反应为:Ni2++2e-=Ni,根据电子守恒可知,阳极质量的减少量与阴极质量的增加量不一定相等,B错误;
C.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,故Cu、Pt不放电,则电解后,电解槽底部的阳极泥中含有Cu和Pt,C正确;
D.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,阴极发生的电极反应为:Ni2++2e-=Ni,NiSO4为电解质溶液,则电解后,溶液中存在的金属阳离子主要有Ni2+,还含有和,D错误;
故答案为:C。
9.C
【分析】碳棒与电源正极相连,为电解池的阳极,发生氧化反应,氢氧根放电生成氧气,镀镍铁棒与电源负极相连,为电解池阴极,发生还原反应,Ni2+放电生成Ni单质,由于溶液显酸性,H+也会放电生成氢气。
【详解】A.碳棒与电源正极相连,为电解池的阳极,发生氧化反应,氢氧根放电生成氧气,电极反应为4OH- -4e- =O2↑+2H2O,A正确;
B.若将图中阳离子膜去掉,氯离子进入阳极室,阳极会生成氯气,总反应发生改变,B正确;
C.由于C室中Ni2+、H+不断减少,Cl-通过阴离子膜从C室移向B室,A室中OH-不断减少,Na+通过阳离子膜从A室移向B室,所以B室中NaCl溶液的物质的量浓度不断增大,C错误;
D.由于H+氧化性大于Ni2+(低浓度)的氧化性,所以为了提高Ni的产率,电解过程中需要控制废水的pH,D正确;
综上所述答案为C。
10.C
【详解】A.锌、铜、稀硫酸原电池中,锌作负极,铜作正极,A正确;
B.电解精炼铜时,粗铜作阳极,与电源正极相连,精铜作阴极,与电源负极相连,B正确;
C.在镀件上镀铜时,镀件作阴极,与电源负极相连,镀层金属铜作阳极,与电源正极相连,C错误;
D.电解氯化铜溶液时,铜电极不参予电极反应,则铜作阴极,与电源负极相连,D正确;
故选C。
11.A
【分析】左边是电解池,电解饱和食盐水得到氢氧化钠溶液、氢气和氯气,右边是燃料电池,通入空气(除)的电极为正极,则Y为氢气。
【详解】A.由题图可知Y是氢气,生成氢气的一极为电解池的阴极,溶液中水电离出的氢离子得到电子生成氢气,阴极反应式为,A正确。
B.由燃料电池的工作原理可知,氧气得电子发生还原反应,故通入空气(除)的电极为正极,B错误。
C.根据得失电子守恒得关系式,则电解池中产生2mol时理论上燃料电池中消耗1mol,C错误。
D.阳离子交换膜只允许阳离子通过,燃料电池中通过阳离子交换膜从负极室移向正极室,正极上氧气得到电子产生,反应后正极室氢氧化钠的浓度升高,即小于;负极上氢气失电子生成的氢离子消耗氢氧根离子,且由负极室通过阳离子交换膜进入正极室,所以,因此,D错误。
故选A。
12.A
【详解】A.电镀时,含镀层金属阳离子的盐溶液作电解质溶液,两极通过电子数目相同,析出和消耗的金属相等,电镀液浓度不变,A正确;
B.盐桥靠内部离子定向移动导电和平衡两端电荷,不能让电解质溶液中离子通过,B错误;
C.原电池的正极得电子发生还原反应,电解池的阳极失电子发生氧化反应,C错误;
D.电解精炼铜时,阳极为粗铜,包括铜和比铜活泼的金属放电,阴极为纯铜,只有铜离子得电子,故电解液中c(Cu2+ )减小,D错误;
故选A。
13.D
【分析】自发的氧化还原反应可以设计成原电池;
【详解】A.若A、B均为相同的石墨电极,a、b之间接上电流计,不能构成原电池,电流计指针不偏转,A项正确;
B.若A为锌片,B为铜片,a、b之间接上电流计,构成铜锌、溶液原电池,电流计指针发生偏转,B项正确;
C.若A为锌片,B为铜片,a接电源负极、b接电源正极,构成电解池,阳极的电极反应式为、阴极的电极反应式为,溶液中基本不变,C项正确;
D.若B为粗铜,A为精铜,a接电源正极、b接电源负极,构成电解池,阳极的电极反应式为、阴极的电极反应式为,A减少的质量与B增加的质量相等,D项错误。
故选D。
14.D
【详解】A.根据形成原电池装置条件,图1为原电池装置,因为Fe比Cu活泼,且Fe能与Fe3+发生氧化还原反应,因此Fe作负极,总反应为Fe+2Fe3+=3Fe2+,故A错误;
B.氢氧化铁胶粒带正电荷,通电后向阴极移动,即向石墨Ⅱ电极移动,该电极附近溶液红褐色加深,故B错误;
C.根据图3电流方向,a为正极,b为负极,依据原电池工作原理,电子不通过电解质溶液,电子迁移方向是b→d,c→a,精炼铜时,纯铜作阴极,粗铜作阳极,即d电极为纯铜,故C错误;
D.电镀过程中,待镀金属作阴极,根据图4可知,铁作阴极,电解质溶液为硫酸铜溶液,根据原电池工作原理,阴极反应式为Cu2++2e-=Cu,可以实现在铁上镀铜,故D正确;
答案为D。
15.C
【分析】由二次电池的反应可知,放电时Mg为原电池的负极,电池反应为,为原电池的正极,电池反应为。
【详解】A.镁充电电池放电时是原电池,原电池反应中,电解质溶液中的阳离子移向正极,故A正确;
B.放电时,正极发生还原反应,电极反应式为,故B正确;
C.放电时在正极得电子发生还原反应,故C错误;
D. 充电时,原电池的负极与电源的负极相连,做阴极,发生还原反应,Mg2+变回Mg,电极反应式为,故D正确;
答案选C。
16. 粗铜 精铜 CuSO4(或CuCl2) Cu-2e-=Cu2+ Fe-2e-=Fe2+ Cu2++2e-=Cu
【详解】在粗铜提纯时,阳极材料是粗铜,阴极材料是精铜;电解质溶液是含有Cu2+的盐溶液,可以是CuSO4、CuCl2;在阳极上粗铜的主要成分Cu及活动性比Cu强的金属如Fe会失去电子发生氧化反应变为金属阳离子进入溶液,电极反应式为:Cu-2e-=Cu2+;Fe-2e-=Fe2+;而活动性比铜弱的金属,如Au、Ag则沉淀在阳极底部形成阳极泥;在阴极上只有Cu2+得到电子变为Cu单质,电极反应式为Cu2++2e-=Cu。由于在同一闭合回路中电子转移数目相等,所以当电路中转移2 mol电子时,由于Cu是+2价金属,在阴极上会析出1 mol Cu,其质量是64 g,但阳极上失去电子的物质为Cu及Fe、Zn等金属,同时有Au、Ag等沉淀在阳极底部,故阳极质量减少不等于64 g。
17. 阴 阳 含镀层金属阳离子的盐溶液
【详解】电镀时,待镀件作电解池的阴极,镀层金属作阳极,电解质溶液为含镀层金属阳离子的盐溶液,故答案为:阴;阳;含镀层金属阳离子的盐溶液。
18. Fe Fe-2e-=Fe2+ C B 隔绝空气,防止白色沉淀被氧化 B
【详解】①该装置为制备纯净Fe(OH)2沉淀的装置,则Fe作阳极,即a电极为Fe,发生的电极反应为:Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;
②A.纯水几乎不导电,不可作电解液,A不满足题意;
B.电解质液为NaCl溶液时,阳极反应为水电离的H+得电子产生OH-,OH-和Fe2+迁移后在两极之间的溶液产生白色Fe(OH)2沉淀,B满足白色沉淀在两极之间的溶液中生成;
C.电解质液为NaOH溶液,Fe电极附近有高浓度的OH-,白色沉淀在Fe电极负极产生,C满足色沉淀在电极周围生成;
D.电解质液为CuCl2溶液,阴极为Cu2+得电子得到Cu,不产生白色Fe(OH)2沉淀,D不满足题意;
故答案为:C;B;
③苯不溶于水,密度比水小,浮在电解液表面,可隔绝空气,防止白色沉淀被氧化,故答案为:隔绝空气,防止白色沉淀被氧化;
④A.改用稀硫酸作电解,稀硫酸为强酸,不会产生白色Fe(OH)2沉淀,A不满足题意;
B.适当增大电源电压,反应速率加快,可尽早在两极之间的溶液中看到白色沉淀,B满足题意;
C.降低电解液温度,反应速率减小,看到白色沉淀的时间变长,C不满足题意;
故答案为:B。
19. 2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑) 试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀 试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体 阻碍OH-向阳极迁移,避免灰绿色固体生成 本实验条件下铁在阳极区的产物主要为Fe2+,Fe2+在碱性条件下更容易被氧化为Fe3+ c(OH-)增大,反应速率加快(更容易放电) Fe -6e-+ 8OH-= FeO42-+4H2O 水;生成红褐色沉淀和无色气体
【详解】(1)①石墨电极为阴极,溶液中的氢离子放电生成氢气,电极反应式为2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑),故答案为2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑);
②灰绿色固体用盐酸溶解后的溶液中加入铁氰化钾溶液,生成蓝色沉淀,灰绿色悬浊液过滤后的溶液中加入铁氰化钾溶液,无蓝色沉淀生成,说明灰绿色悬浊液中含有Fe2+,故答案为试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀;
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾元素,是因为试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体,白色晶体为氯化钾晶体,故答案为试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体;
(2)①盐桥中的氯离子代替氢氧根离子向阳极移动,避免灰绿色固体生成,故答案为阻碍OH-向阳极迁移,避免灰绿色固体生成;
②根据实验I中vi、vii与ii~v中的现象比较可知,①vii中加入铁氰化钾溶液后生成大量蓝色沉淀,说明在使用盐桥的实验条件下铁在阳极区的产物主要为Fe2+,vi中溶液在加入KSCN溶液后呈浅红色,说明Fe2+在碱性条件下更容易被氧化为Fe3+,故答案为本实验条件下铁在阳极区的产物主要为Fe2+;Fe2+在碱性条件下更容易被氧化为Fe3+;
(3)①c(OH-)增大,反应速率加快,使得铁电极上OH-能够放电,故答案为c(OH-)增大,反应速率加快(更容易放电);
②阳极上生成的氧气能够将亚铁离子氧化生成FeO42-,反应的总电极反应式为Fe -6e-+ 8OH-= FeO42-+4H2O,故答案为Fe -6e-+ 8OH-= FeO42-+4H2O;
③要推测生成FeO42-的必要条件是浓碱环境,只需要改变溶液的碱性,看是否仍然生成FeO42-即可,实验方案为:将淡紫色(FeO42-)溶液加入水中稀释,使溶液的碱性减弱,4FeO42-+10H2O 4Fe(OH)3↓+8OH-+3O2↑,看到生成红褐色沉淀和无色气体,即可说明生成FeO42-的必要条件是浓碱环境,故答案为水;生成红褐色沉淀和无色气体。
点睛:本题以“铁作阳极”时发生反应的多样性探究实验考查了电解原理的应用。本题的难度中等,掌握铁及其化合物的性质和离子的检验是解题的关键。本题的易错点和难点为(3)③实验的设计,需要理解实验的目的并掌握高铁酸根离子的水解方程式。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.同金属在其不同浓度盐溶液中可形成浓差电池。它是通过一种物质从高浓度状态向低浓度状态的转移而获得电动势。如图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法不正确的是
A.a电极的电极反应为
B.c、d离子交换膜依次为阴离子交换膜和阳离子交换膜
C.电池放电过程中,电极上的电极反应为
D.电池从开始工作时,阴离子交换膜右侧溶液的浓度会增大
2.工业上处理含的酸性工业废水用Fe为电极进行电解;经过一段时间有和沉淀产生;过滤回收沉淀,废水达到排放标准。下列说法错误的是
A.电解时阴极的电极反应式为
B.转变成的离子反应方程式为
C.两极都能用Cu电极来代替Fe电极
D.实验时若加入适量的电解效果更好
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下。下列说法错误的是
A.碳纳米电极为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.精制饱和NaCl溶液从b处进,NaOH溶液从c处出
D.迁移过交换膜的数量等于导线上通过电子的数量
4.在日常生活中,很多物品都离不开电镀,现将一块铜牌镀上一层银,工作示意图如下,下列说法正确的是
A.银片与电源的正极相连
B.电镀一段时间后,溶液的浓度会变小
C.阴极发生的电极反应式为
D.反应一段时间后,将电源反接,铜牌可以恢复到原来的状态
5.无膜氯液流电池是一种先进的低成本高储能电池,可广泛应用于再生能源储能和智能电网的备用电源等,工作原理如图所示,M为多孔碳电极,N为和电极。下列说法正确的是
A.放电时,M极电势低于N极
B.充电时,左侧储液器中的浓度减小
C.充电时,电路中每转移,两电极质量变化的差值为23g
D.放电时,N极的电极反应式为
6.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.该装置是将电能转化为化学能的装置
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为2Cl-+2H+Cl2+2H2
D.装置中出口①处的物质是氯气,出口②处的物质是氢气
7.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阴极附近溶液的pH升高
C.阳极反应方程式为:
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
8.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性)
A.阳极发生还原反应,其电极反应式为
B.电解过程中,阳极质量的减少量与阴极质量的增加量一定相等
C.电解后,电解槽底部的阳极泥中含有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有和
9.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH- -4e- =O2↑+2H2O
B.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
C.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小
D.为了提高Ni的产率,电解过程中需要控制废水pH
10.下列图示中关于铜电极的连接错误的是
A.铜锌原电池 B.电解精炼铜 C.在镀件上镀铜 D.电解氯化铜溶液
A.A B.B C.C D.D
11.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是
A.电解池的阴极反应式为
B.通入空气(除)的电极为负极
C.电解池中产生2mol时,理论上燃料电池中消耗0.5mol
D.a、b、c的大小关系为
12.下列说法正确的是
A.电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
B.盐桥可以把负极区的阳离子转移到正极区,把正极区的阴离子转移到负极区
C.原电池的正极和电解池的阳极均发生失去电子的氧化反应
D.电解精炼铜时,阳极为粗铜,阴极为纯铜,电解液中c(Cu2+)保持不变
13.某电化学装置如图所示,A、B分别为两个电极。下列说法错误的是
A.若A、B均为相同的石墨电极,a、b之间接上电流计,则电流计指针不偏转
B.若A为锌片,B为铜片,a、b之间接上电流计,则电流计指针发生偏转
C.若A为锌片,B为铜片,a接电源负极、b接电源正极,则溶液中基本不变
D.若B为粗铜,A为精铜,a接电源正极、b接电源负极,则A减少的质量与B增加的质量不相等
14.关于如图所示各装置的叙述中,正确的是
A.图1是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.图2通电一段时间后石墨I电极附近溶液红褐色加深(已知氢氧化铁胶粒带正电荷)
C.若用图3精炼铜,则d极为纯铜,电子迁移方向为b→d→c→a
D.若用图4电镀,M为CuSO4溶液,可以实现在铁上镀铜
15.镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因此成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为。下列说法错误的是
A.放电时向正极移动
B.放电时正极反应式为
C.放电时发生氧化反应
D.充电时阴极的电极反应式为
二、填空题
16.粗铜提纯
(1)原理图
(2)电极材料:阳极为___________;阴极为___________。
(3)电解质溶液:___________。
(4)电极反应:
阳极:___________、___________;
阴极:___________;
(5)特点:当电路中转移2 mol电子时,阳极质量减少不等于64 g,阴极质量增加64 g,电解液的浓度铜离子减小。
17.电镀
(1)原理图
(2)含义:利用电解原理在某些金属表面再镀上一层其他金属或合金,增强金属的抗腐蚀、表面硬度或美观目的。
(3)电镀池构成:
①电极材料:待镀件作___________极,镀层金属作___________极。
②电解质溶液:___________。
(4)电极反应:阳极:X—ne—=Xn+;阴极:Ym++me-=Y。
(5)特点:当电路中转移1mol电子时,阳极质量减少质量与阴极质量增加质量相等,电镀液的浓度基本不变。
三、实验题
18.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置则可制得纯净的Fe(OH)2沉淀, 两极材料分别为石墨和铁。
①a电极材料为_______,该电极的电极反应式为________.
②若白色沉淀在电极周围生成,则电解液d是____(填序号,下同);若白色沉淀在两极之间的溶液中生成,则电解液d是____。
A.纯水 B.NaCl溶液 C.NaOH溶液D.CuCl2溶液
③液体c为苯,其作用是__________
④要想尽早在两极之间的溶液中看到白色沉淀, 可以采取的措施是( )
A.改用稀硫酸作电解 B.适当增大电源电压 C.适当降低电解液温度
19.某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质
(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U形管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验
①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成的总电极反应式是______。
③某同学推测生成的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
______
第3页 共4页 ◎ 第4页 共4页
第1页 共2页 ◎ 第2页 共2页
参考答案:
1.B
【分析】左侧的浓差电池中,Cu(1)电极为正极,电极反应为Cu2++2e =Cu,Cu(2)电极为负极,电极反应为Cu-2e =Cu2+;右侧的电解池中,NaOH在a电极处产生,获得浓NaOH溶液和H2,H2SO4在b电极处产生,获得较浓的硫酸和O2,则a电极为阴极,电极反应式为4H2O+4e-=2H2↑+4OH-,b电极为阳极,电极反应式为2H2O-4e-=4H++O2↑。
【详解】A.由分析可知,a电极为阴极,电极反应式为4H2O+4e-=2H2↑+4OH-,A正确;
B.由分析可知,OH-在a电极上产生,并获得浓NaOH溶液,H+在b电极上产生,并获得较浓的硫酸,则c、d离子交换膜依次为阳离子交换膜和阴离子交换膜,B错误;
C.由分析可知,电池放电过程中,Cu(1)电极为正极,电极反应为Cu2++2e =Cu,C正确;
D.电池放电过程中,左侧c(Cu2+)逐渐减小,右侧c(Cu2+)逐渐增大,右侧溶液的浓度会增大,D正确;
故选B。
2.C
【详解】A.阳极为Fe,为活泼电极,本身失去电子生成:,阴极上溶液中的得电子生成:,A正确;
B.阳极上生成的具有还原性,与在酸性中发生氧化还原反应生成和,离子方程式为:,B正确;
C.将Fe换为Cu,阳极上Cu失去电子生成,而无还原性,不能与发生氧化还原反应使之生成低价的,从而达不到处理废水的目的,C不正确;
D.离子浓度越大,溶液的导电性越强,若污水中离子浓度较小,导电能力较差,可加入适量的来增强溶液导电性,故D正确。
故选C。
3.D
【详解】A.电解饱和食盐时氯离子在阳极放电生成氯气,所以碳纳米电极为阳极,发生氧化反应生成氯气,故A正确;
B.为防止阳极生成的氯气与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,故B正确;
C.Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即b处进,NaOH在阴极生成,NaOH溶液的从c处出,故C正确;
D.由B可知,离子交换膜为阳离子交换膜,不迁移,钠离子迁移,故D错误;
故选:D。
4.A
【分析】本图为在铜牌表面镀银,银作阳极,与电源正极相连,铜作阴极,与电源负极相连,电镀过程中电镀液浓度不变。
【详解】A.银片与电源的正极相连,A正确;
B.电镀过程中溶液的浓度不变,B错误;
C.铜作阴极,阴极发生的电极反应式为,C错误;
D.Cu活泼性比Ag强,将电源反接,铜牌作阳极,发生的电极反应式为,即Cu会溶于溶液中,铜牌不能恢复到原来的状态,D错误;
故选A。
5.C
【分析】该装置为二次电池,由信息可知放电时M极氯气得电子,发生还原反应,M为正极,N为负极,充电时M为阳极,N为阴极。
【详解】A.放电时,M极为正极,N极为负极,M极电势高于N极,A错误;
B.充电时,充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,左侧储液器中的浓度增大,B错误;
C.充电时, M为阳极,电极反应2Cl—-2e-=Cl2↑,N为阴极,电极反应,电路中每转移时,M电极质量不变,N电极质量增加23g,两电极质量变化的差值为23g,C正确;
D.放电时,N极为负极,发生失电子的氧化反应,电极反应式为,D错误;
故答案选C。
6.C
【分析】装置是电解饱和食盐水,将电能转化为化学能;电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气;出口①是电解池的阳极,出口②是电解池的阴极;依据装置图可知,阳离子向电解池的阴极移动,故离子交换膜是阳离子交换膜。
【详解】A.装置是电解池,是将电能转化为化学能的装置,选项A正确;
B.依据装置图可知,离子交换膜是阳离子交换膜,只允许阳离子通过,不能让阴离子通过,选项B正确;
C.装置是电解饱和食盐水,电解过程是氯化钠和水反应生成氢氧化钠和氢气、氯气,反应的离子方程式为:2Cl-+2H2OCl2↑+2H2↑+2OH-,选项C不正确;
D.根据钠离子移向阴极确定②是阴极,出口①是电解池的阳极,溶液中的氯离子在阳极失电子生成氯气,出口②是电解池的阴极,溶液中的氢离子得到电子发生还原反应生成氢气,选项D正确;
答案选C。
7.A
【详解】A.由题意知电解过程中氯离子失电子生成氯气,该反应应在阳极发生,阳极:2Cl--2e-=Cl2↑,则阳极应为惰性电极,因此不能是铁,故A错误,
B.阴极:2H++2e-=H2↑,阴极溶液呈碱性,pH升高,故B正确;
C.由以上分析可知阳极反应为:,故C正确;
D.由Ni2+→Ni3+,失去1 mol e-,外电路中转移1 mol e-,即Cl-失去1 mol e-,H+得到1 mol e-,故D正确;
故选:A。
8.C
【分析】金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,电解时粗镍作阳极,发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,纯镍作阴极,电极反应为:Ni2++2e-=Ni,NiSO4溶液作电解质溶液,据此分析解题:
【详解】A.由分析可知,阳极发生氧化反应,其电极反应式为Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,A错误;
B.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,阴极发生的电极反应为:Ni2++2e-=Ni,根据电子守恒可知,阳极质量的减少量与阴极质量的增加量不一定相等,B错误;
C.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,故Cu、Pt不放电,则电解后,电解槽底部的阳极泥中含有Cu和Pt,C正确;
D.由分析可知,电解过程中,阳极发生的电极反应为:Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+,阴极发生的电极反应为:Ni2++2e-=Ni,NiSO4为电解质溶液,则电解后,溶液中存在的金属阳离子主要有Ni2+,还含有和,D错误;
故答案为:C。
9.C
【分析】碳棒与电源正极相连,为电解池的阳极,发生氧化反应,氢氧根放电生成氧气,镀镍铁棒与电源负极相连,为电解池阴极,发生还原反应,Ni2+放电生成Ni单质,由于溶液显酸性,H+也会放电生成氢气。
【详解】A.碳棒与电源正极相连,为电解池的阳极,发生氧化反应,氢氧根放电生成氧气,电极反应为4OH- -4e- =O2↑+2H2O,A正确;
B.若将图中阳离子膜去掉,氯离子进入阳极室,阳极会生成氯气,总反应发生改变,B正确;
C.由于C室中Ni2+、H+不断减少,Cl-通过阴离子膜从C室移向B室,A室中OH-不断减少,Na+通过阳离子膜从A室移向B室,所以B室中NaCl溶液的物质的量浓度不断增大,C错误;
D.由于H+氧化性大于Ni2+(低浓度)的氧化性,所以为了提高Ni的产率,电解过程中需要控制废水的pH,D正确;
综上所述答案为C。
10.C
【详解】A.锌、铜、稀硫酸原电池中,锌作负极,铜作正极,A正确;
B.电解精炼铜时,粗铜作阳极,与电源正极相连,精铜作阴极,与电源负极相连,B正确;
C.在镀件上镀铜时,镀件作阴极,与电源负极相连,镀层金属铜作阳极,与电源正极相连,C错误;
D.电解氯化铜溶液时,铜电极不参予电极反应,则铜作阴极,与电源负极相连,D正确;
故选C。
11.A
【分析】左边是电解池,电解饱和食盐水得到氢氧化钠溶液、氢气和氯气,右边是燃料电池,通入空气(除)的电极为正极,则Y为氢气。
【详解】A.由题图可知Y是氢气,生成氢气的一极为电解池的阴极,溶液中水电离出的氢离子得到电子生成氢气,阴极反应式为,A正确。
B.由燃料电池的工作原理可知,氧气得电子发生还原反应,故通入空气(除)的电极为正极,B错误。
C.根据得失电子守恒得关系式,则电解池中产生2mol时理论上燃料电池中消耗1mol,C错误。
D.阳离子交换膜只允许阳离子通过,燃料电池中通过阳离子交换膜从负极室移向正极室,正极上氧气得到电子产生,反应后正极室氢氧化钠的浓度升高,即小于;负极上氢气失电子生成的氢离子消耗氢氧根离子,且由负极室通过阳离子交换膜进入正极室,所以,因此,D错误。
故选A。
12.A
【详解】A.电镀时,含镀层金属阳离子的盐溶液作电解质溶液,两极通过电子数目相同,析出和消耗的金属相等,电镀液浓度不变,A正确;
B.盐桥靠内部离子定向移动导电和平衡两端电荷,不能让电解质溶液中离子通过,B错误;
C.原电池的正极得电子发生还原反应,电解池的阳极失电子发生氧化反应,C错误;
D.电解精炼铜时,阳极为粗铜,包括铜和比铜活泼的金属放电,阴极为纯铜,只有铜离子得电子,故电解液中c(Cu2+ )减小,D错误;
故选A。
13.D
【分析】自发的氧化还原反应可以设计成原电池;
【详解】A.若A、B均为相同的石墨电极,a、b之间接上电流计,不能构成原电池,电流计指针不偏转,A项正确;
B.若A为锌片,B为铜片,a、b之间接上电流计,构成铜锌、溶液原电池,电流计指针发生偏转,B项正确;
C.若A为锌片,B为铜片,a接电源负极、b接电源正极,构成电解池,阳极的电极反应式为、阴极的电极反应式为,溶液中基本不变,C项正确;
D.若B为粗铜,A为精铜,a接电源正极、b接电源负极,构成电解池,阳极的电极反应式为、阴极的电极反应式为,A减少的质量与B增加的质量相等,D项错误。
故选D。
14.D
【详解】A.根据形成原电池装置条件,图1为原电池装置,因为Fe比Cu活泼,且Fe能与Fe3+发生氧化还原反应,因此Fe作负极,总反应为Fe+2Fe3+=3Fe2+,故A错误;
B.氢氧化铁胶粒带正电荷,通电后向阴极移动,即向石墨Ⅱ电极移动,该电极附近溶液红褐色加深,故B错误;
C.根据图3电流方向,a为正极,b为负极,依据原电池工作原理,电子不通过电解质溶液,电子迁移方向是b→d,c→a,精炼铜时,纯铜作阴极,粗铜作阳极,即d电极为纯铜,故C错误;
D.电镀过程中,待镀金属作阴极,根据图4可知,铁作阴极,电解质溶液为硫酸铜溶液,根据原电池工作原理,阴极反应式为Cu2++2e-=Cu,可以实现在铁上镀铜,故D正确;
答案为D。
15.C
【分析】由二次电池的反应可知,放电时Mg为原电池的负极,电池反应为,为原电池的正极,电池反应为。
【详解】A.镁充电电池放电时是原电池,原电池反应中,电解质溶液中的阳离子移向正极,故A正确;
B.放电时,正极发生还原反应,电极反应式为,故B正确;
C.放电时在正极得电子发生还原反应,故C错误;
D. 充电时,原电池的负极与电源的负极相连,做阴极,发生还原反应,Mg2+变回Mg,电极反应式为,故D正确;
答案选C。
16. 粗铜 精铜 CuSO4(或CuCl2) Cu-2e-=Cu2+ Fe-2e-=Fe2+ Cu2++2e-=Cu
【详解】在粗铜提纯时,阳极材料是粗铜,阴极材料是精铜;电解质溶液是含有Cu2+的盐溶液,可以是CuSO4、CuCl2;在阳极上粗铜的主要成分Cu及活动性比Cu强的金属如Fe会失去电子发生氧化反应变为金属阳离子进入溶液,电极反应式为:Cu-2e-=Cu2+;Fe-2e-=Fe2+;而活动性比铜弱的金属,如Au、Ag则沉淀在阳极底部形成阳极泥;在阴极上只有Cu2+得到电子变为Cu单质,电极反应式为Cu2++2e-=Cu。由于在同一闭合回路中电子转移数目相等,所以当电路中转移2 mol电子时,由于Cu是+2价金属,在阴极上会析出1 mol Cu,其质量是64 g,但阳极上失去电子的物质为Cu及Fe、Zn等金属,同时有Au、Ag等沉淀在阳极底部,故阳极质量减少不等于64 g。
17. 阴 阳 含镀层金属阳离子的盐溶液
【详解】电镀时,待镀件作电解池的阴极,镀层金属作阳极,电解质溶液为含镀层金属阳离子的盐溶液,故答案为:阴;阳;含镀层金属阳离子的盐溶液。
18. Fe Fe-2e-=Fe2+ C B 隔绝空气,防止白色沉淀被氧化 B
【详解】①该装置为制备纯净Fe(OH)2沉淀的装置,则Fe作阳极,即a电极为Fe,发生的电极反应为:Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;
②A.纯水几乎不导电,不可作电解液,A不满足题意;
B.电解质液为NaCl溶液时,阳极反应为水电离的H+得电子产生OH-,OH-和Fe2+迁移后在两极之间的溶液产生白色Fe(OH)2沉淀,B满足白色沉淀在两极之间的溶液中生成;
C.电解质液为NaOH溶液,Fe电极附近有高浓度的OH-,白色沉淀在Fe电极负极产生,C满足色沉淀在电极周围生成;
D.电解质液为CuCl2溶液,阴极为Cu2+得电子得到Cu,不产生白色Fe(OH)2沉淀,D不满足题意;
故答案为:C;B;
③苯不溶于水,密度比水小,浮在电解液表面,可隔绝空气,防止白色沉淀被氧化,故答案为:隔绝空气,防止白色沉淀被氧化;
④A.改用稀硫酸作电解,稀硫酸为强酸,不会产生白色Fe(OH)2沉淀,A不满足题意;
B.适当增大电源电压,反应速率加快,可尽早在两极之间的溶液中看到白色沉淀,B满足题意;
C.降低电解液温度,反应速率减小,看到白色沉淀的时间变长,C不满足题意;
故答案为:B。
19. 2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑) 试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀 试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸, 增大c(Cl-),平衡逆向移动,析出KCl晶体 阻碍OH-向阳极迁移,避免灰绿色固体生成 本实验条件下铁在阳极区的产物主要为Fe2+,Fe2+在碱性条件下更容易被氧化为Fe3+ c(OH-)增大,反应速率加快(更容易放电) Fe -6e-+ 8OH-= FeO42-+4H2O 水;生成红褐色沉淀和无色气体
【详解】(1)①石墨电极为阴极,溶液中的氢离子放电生成氢气,电极反应式为2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑),故答案为2H++ 2e-= H2↑(或2H2O + 2e-= 2OH-+ H2↑);
②灰绿色固体用盐酸溶解后的溶液中加入铁氰化钾溶液,生成蓝色沉淀,灰绿色悬浊液过滤后的溶液中加入铁氰化钾溶液,无蓝色沉淀生成,说明灰绿色悬浊液中含有Fe2+,故答案为试管iii中生成蓝色沉淀,试管v中没有蓝色沉淀;
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾元素,是因为试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体,白色晶体为氯化钾晶体,故答案为试管i中存在溶解平衡:KCl(s)K+(aq)+ Cl-(aq),滴加12 mol/L的盐酸,增大c(Cl-),平衡逆向移动,析出KCl晶体;
(2)①盐桥中的氯离子代替氢氧根离子向阳极移动,避免灰绿色固体生成,故答案为阻碍OH-向阳极迁移,避免灰绿色固体生成;
②根据实验I中vi、vii与ii~v中的现象比较可知,①vii中加入铁氰化钾溶液后生成大量蓝色沉淀,说明在使用盐桥的实验条件下铁在阳极区的产物主要为Fe2+,vi中溶液在加入KSCN溶液后呈浅红色,说明Fe2+在碱性条件下更容易被氧化为Fe3+,故答案为本实验条件下铁在阳极区的产物主要为Fe2+;Fe2+在碱性条件下更容易被氧化为Fe3+;
(3)①c(OH-)增大,反应速率加快,使得铁电极上OH-能够放电,故答案为c(OH-)增大,反应速率加快(更容易放电);
②阳极上生成的氧气能够将亚铁离子氧化生成FeO42-,反应的总电极反应式为Fe -6e-+ 8OH-= FeO42-+4H2O,故答案为Fe -6e-+ 8OH-= FeO42-+4H2O;
③要推测生成FeO42-的必要条件是浓碱环境,只需要改变溶液的碱性,看是否仍然生成FeO42-即可,实验方案为:将淡紫色(FeO42-)溶液加入水中稀释,使溶液的碱性减弱,4FeO42-+10H2O 4Fe(OH)3↓+8OH-+3O2↑,看到生成红褐色沉淀和无色气体,即可说明生成FeO42-的必要条件是浓碱环境,故答案为水;生成红褐色沉淀和无色气体。
点睛:本题以“铁作阳极”时发生反应的多样性探究实验考查了电解原理的应用。本题的难度中等,掌握铁及其化合物的性质和离子的检验是解题的关键。本题的易错点和难点为(3)③实验的设计,需要理解实验的目的并掌握高铁酸根离子的水解方程式。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
