第1章第4节金属的腐蚀与防护同步练习 (含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章第4节金属的腐蚀与防护同步练习 (含解析)2022-2023学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 971.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:19:13 | ||
图片预览

文档简介
第1章第4节金属的腐蚀与防护同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
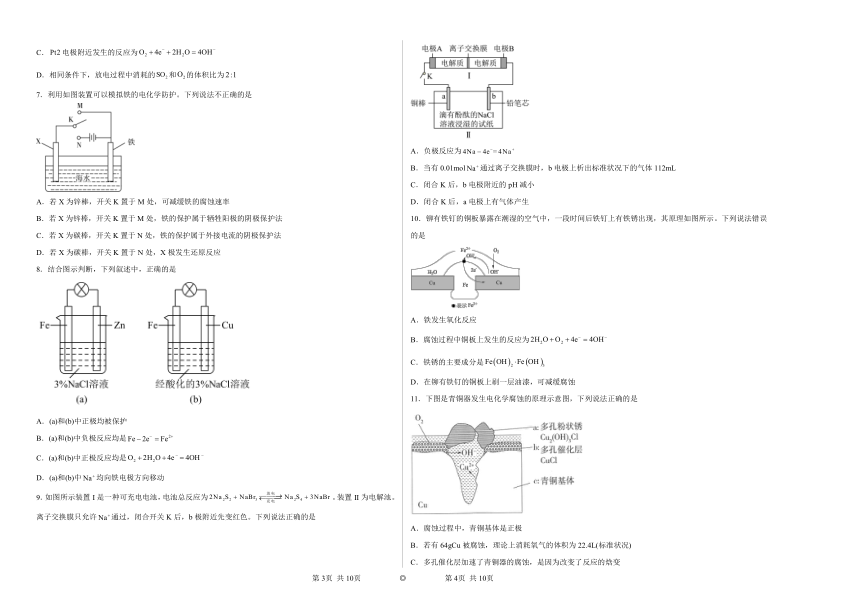
1.在如图所示的两个烧杯中分别插入形状和大小几乎一样的破损的镀铜铁片和破损的镀锌铁片,一段时间后,下列说法正确的是
A.甲和乙烧杯中的铁均被保护
B.甲中破损处的铁片溶解,铜层上会产生气泡
C.相比甲,乙中镀锌铁片中的铁被腐蚀得更严重
D.向两个烧杯中分别滴加KSCN溶液,溶液均变红
2.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使与反应生成,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
A.正极的电极反应式为
B.钢管腐蚀的直接产物中含有、
C.与的反应可表示为
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
3.钴()的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,I室和II室溶液的均增大
B.电解总反应:
C.移除两交换膜后,电极和石墨电极发生的反应均发生变化
D.生成,I室溶液质量理论上减少
4.下列说法错误的是
A.在钢铁设备上安装若干镁合金块或锌块,可保护设备不被腐蚀
B.将钢闸门通过导线与直流电源的正极相连,保护闸门不被腐蚀
C.厨房中炒完菜的铁锅应及时清洗并擦干,防止发生电化学腐蚀
D.镀锌铁表面的镀层如发生破损,被腐蚀的仍然是镀层
5.港珠澳大桥设计寿命为120年,桥体钢构件防腐是使用过程中面临的重要问题,下列说法错误的是
A.海水的pH一般在8.0~8.5,则钢构件的腐蚀主要是析氢腐蚀
B.钢构件可采用不锈钢材料以减缓腐蚀
C.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等
D.后期采用牺牲阳极的阴极保护法时,可使用铝作为负极
6.“打赢蓝天保卫战”,近年来对大气污染防治的要求日益提高。二氧化硫—空气质子交换膜燃料电池实现了制稀硫酸、发电、环保三位一体的结合,原理如图所示。下列说法错误的是
A.该电池放电时电子从电极经过外电路流到电极
B.电极附近发生的反应为
C.电极附近发生的反应为
D.相同条件下,放电过程中消耗的和的体积比为
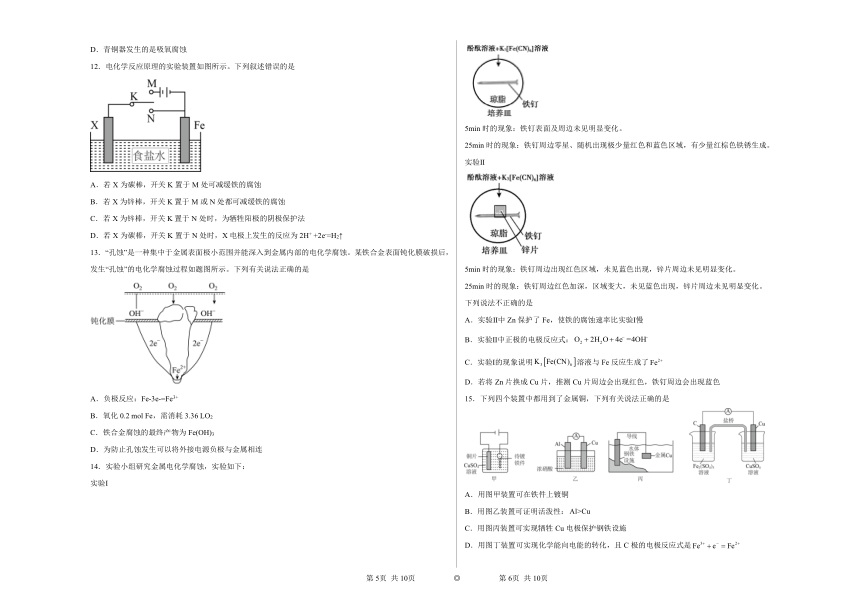
7.利用如图装置可以模拟铁的电化学防护。下列说法不正确的是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀速率
B.若X为锌棒,开关K置于M处,铁的保护属于牺牲阳极的阴极保护法
C.若X为碳棒,开关K置于N处,铁的保护属于外接电流的阴极保护法
D.若X为碳棒,开关K置于N处,X极发生还原反应
8.结合图示判断,下列叙述中,正确的是
A.(a)和(b)中正极均被保护
B.(a)和(b)中负极反应均是
C.(a)和(b)中正极反应均是
D.(a)和(b)中均向铁电极方向移动
9.如图所示装置I是一种可充电电池,电池总反应为。装置II为电解池。离子交换膜只允许通过,闭合开关K后,b极附近先变红色。下列说法正确的是
A.负极反应为
B.当有0.01mol通过离子交换膜时,b电极上析出标准状况下的气体112mL
C.闭合K后,b电极附近的pH减小
D.闭合K后,a电极上有气体产生
10.铆有铁钉的铜板暴露在潮湿的空气中,一段时间后铁钉上有铁锈出现,其原理如图所示。下列说法错误的是
A.铁发生氧化反应
B.腐蚀过程中铜板上发生的反应为
C.铁锈的主要成分是
D.在铆有铁钉的铜板上刷一层油漆,可减缓腐蚀
11.下图是青铜器发生电化学腐蚀的原理示意图,下列说法正确的是
A.腐蚀过程中,青铜基体是正极
B.若有64gCu被腐蚀,理论上消耗氧气的体积为22.4L(标准状况)
C.多孔催化层加速了青铜器的腐蚀,是因为改变了反应的焓变
D.青铜器发生的是吸氧腐蚀
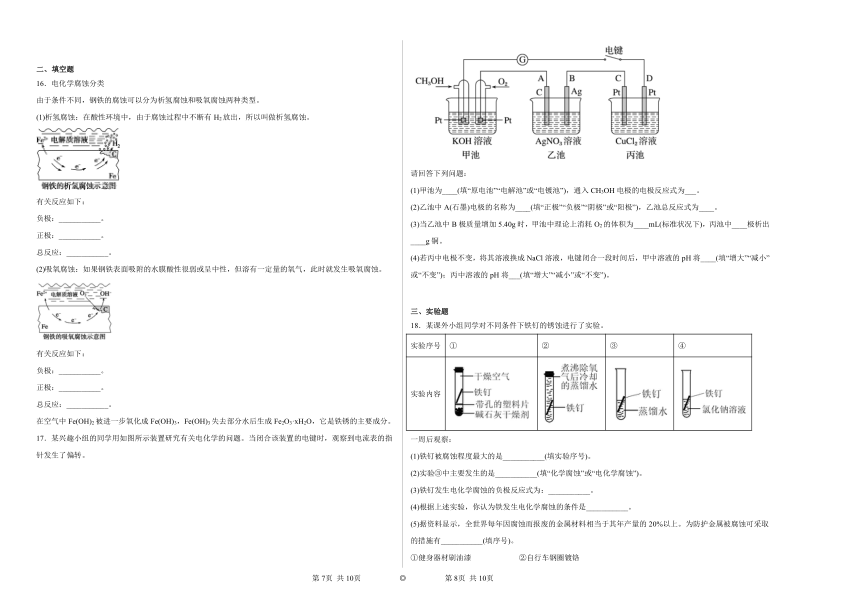
12.电化学反应原理的实验装置如图所示。下列叙述错误的是
A.若X为碳棒,开关K置于M处可减缓铁的腐蚀
B.若X为锌棒,开关K置于M或N处都可减缓铁的腐蚀
C.若X为锌棒,开关K置于N处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于N处时,X电极上发生的反应为2H+ +2e-=H2↑
13.“孔蚀”是一种集中于金属表面极小范围并能深入到金属内部的电化学腐蚀。某铁合金表面钝化膜破损后,发生“孔蚀”的电化学腐蚀过程如题图所示。下列有关说法正确的是
A.负极反应:Fe-3e-=Fe3+
B.氧化0.2 mol Fe,需消耗3.36 LO2
C.铁合金腐蚀的最终产物为Fe(OH)3
D.为防止孔蚀发生可以将外接电源负极与金属相连
14.实验小组研究金属电化学腐蚀,实验如下:
实验Ⅰ
5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
A.实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验Ⅰ慢
B.实验Ⅱ中正极的电极反应式:
C.实验Ⅰ的现象说明溶液与Fe反应生成了
D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色
15.下列四个装置中都用到了金属铜,下列有关说法正确的是
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
二、填空题
16.电化学腐蚀分类
由于条件不同,钢铁的腐蚀可以分为析氢腐蚀和吸氧腐蚀两种类型。
(1)析氢腐蚀:在酸性环境中,由于腐蚀过程中不断有H2放出,所以叫做析氢腐蚀。
有关反应如下:
负极:___________。
正极:___________。
总反应:___________。
(2)吸氧腐蚀:如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,此时就发生吸氧腐蚀。
有关反应如下:
负极:___________。
正极:___________。
总反应:___________。
在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分。
17.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___。
(2)乙池中A(石墨)电极的名称为____(填“正极”“负极”“阴极”或“阳极”),乙池总反应式为____。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为____mL(标准状况下),丙池中____极析出____g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将____(填“增大”“减小”或“不变”);丙中溶液的pH将___(填“增大”“减小”或“不变”)。
三、实验题
18.某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 ① ② ③ ④
实验内容
一周后观察:
(1)铁钉被腐蚀程度最大的是___________(填实验序号)。
(2)实验③中主要发生的是___________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:___________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是___________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
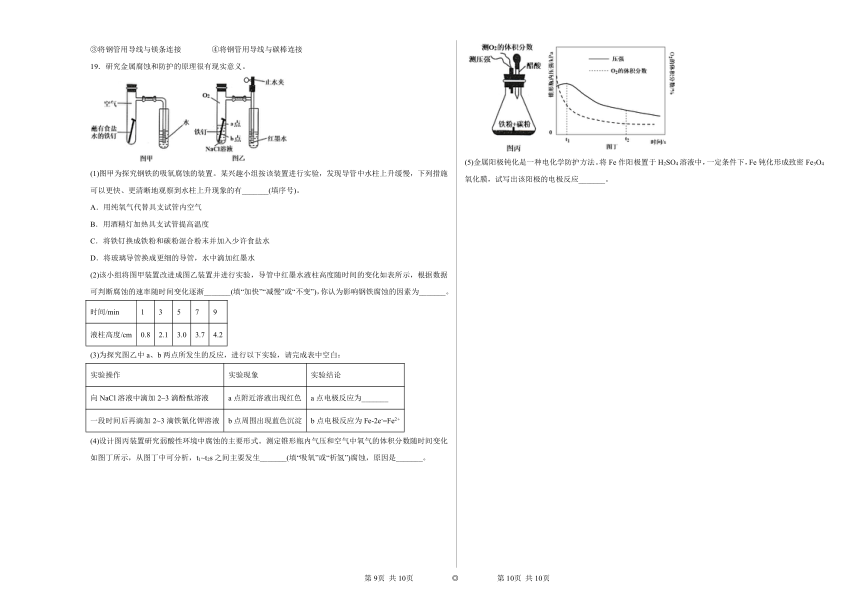
19.研究金属腐蚀和防护的原理很有现实意义。
(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
A.用纯氧气代替具支试管内空气
B.用酒精灯加热具支试管提高温度
C.将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水
D.将玻璃导管换成更细的导管,水中滴加红墨水
(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐_______(填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为_______。
时间/min 1 3 5 7 9
液柱高度/cm 0.8 2.1 3.0 3.7 4.2
(3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
实验操作 实验现象 实验结论
向NaCl溶液中滴加2~3滴酚酞溶液 a点附近溶液出现红色 a点电极反应为_______
一段时间后再滴加2~3滴铁氰化钾溶液 b点周围出现蓝色沉淀 b点电极反应为Fe-2e-=Fe2+
(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生_______(填“吸氧”或“析氢”)腐蚀,原因是_______。
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】根据分析,甲中铜作正极,铁作负极;乙中铁作正极,锌作负极;
【详解】A.甲中铁作负极,被腐蚀,A错误;
B.根据分析,甲中铁片为负极发生反应溶解,溶液中的氢离子在铜层上生成氢气,B正确;
C.甲中铁作负极,被腐蚀,乙中铁作正极,被保护,甲中铁腐蚀更严重,C错误;
D.乙中的铁被保护,溶液不会变红,D错误;
故答案为:B。
2.B
【详解】A.由题图可知,生成,H的化合价降低,得电子,故正极的电极反应式为,A项错误;
B.反应生成的、与可生成、,B项正确;
C.根据题中所给信息可知,与反应生成,根据元素守恒可知,生成物中还有,故反应式为,C项错误;
D.钢管表面镀锌,锌会与铁形成原电池,锌比铁活泼,铁作正极,可减缓钢管的腐蚀;钢管表面镀铜,铜会与铁形成原电池,铁比铜活泼,铁作负极,从而加速钢管的腐蚀,D项错误;
故选:B。
3.B
【分析】由图可知,该装置为电解池,石墨电极为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为,I室中阳离子电荷数大于阴离子电荷数,放电生成的氢离子通过阳离子交换膜由I室向II室移动,钴电极为阴极,钴离子在阴极得到电子发生还原反应生成钴,电极反应式为,III室中阴离子电荷数大于阳离子电荷数,氯离子通过阴离子交换膜由III室向II室移动,电解的总反应的离子方程式为。
【详解】A.由分析可知,放电生成的氢离子通过阳离子交换膜由I室向II室移动,使II室中氢离子浓度增大,溶液减小,A错误;
B.由分析可知,电解总反应为,B正确;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,电极发生的反应不变,C错误;
D.由分析可知,阴极生成钴,阳极有水放电生成,且氢离子通过阳离子交换膜由I室移向II室,则I室溶液质量减少,D错误;
故选:B。
4.B
【详解】A.在钢铁设备上安装若干镁合金或锌块,镁合金或锌块作原电池负极的金属加速被腐蚀,钢铁设备作正极的金属被保护,故A正确;
B.将钢闸门通过导线与直流电源的正极相连,钢闸门作阳极,加速了腐蚀,故B错误;
C.钢铁在有电解质溶液的环境中易发生电化学腐蚀,炒过菜的铁锅含有电解质溶液,不及时清洗会发生电化学腐蚀,故C正确;
D.Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故D正确;
故选B。
5.A
【详解】A.海水的pH一般在8.0~8.5,碱性条件下钢构件的腐蚀主要是吸氧腐蚀,A项错误;
B.通过改变钢构件材料的组成,可以减缓腐蚀速率,B项正确;
C.在钢构件表面喷涂环氧树脂涂层,可以防止钢构件与空气、水接触,C项正确;
D.铝与钢铁连接时,铝作原电池的负极,更容易被氧化,对桥体钢构件起到保护作用,D项正确;
故选A。
6.C
【分析】根据图示,电极通入SO2失电子生成,则电极为负极,电极反应为,电极为正极,酸性条件下,通入的氧气得电子生成水,发生的反应为,据此分析解答。
【详解】A.放电时,电子从负极流向正极,电极为负极,电极为正极,则该电池放电时电子从电极经过外电路流到电极,故A正确;
B.电极通入SO2,SO2在负极失电子生成,则电极反应为,故B正确;
C.酸性条件下,氧气得电子生成水,则电极附近发生的反应为,故C错误;
D.该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的和的体积比为,故D正确;
答案选C。
7.D
【详解】A.开关K置于M处,形成铁锌原电池,X为锌棒,为负极,铁为正极,可减缓铁的腐蚀速率,A正确;
B.开关K置于M处,形成铁锌原电池,X为锌棒,较活泼,为负极,铁为正极,利用牺牲阳极的阴极保护法保护铁,B正确;
C.开关K置于N处,形成电解池,铁接电源的负极形成电解池的阴极被保护,属于外接电流的阴极保护法,C正确;
D.开关K置于N处,X极接电源的正极,形成电解池的阳极,发生氧化反应,D错误;
故选D。
8.A
【分析】锌比铁活泼,装置(a)中锌做负极,负极反应为:Zn-2e-=Zn2+,铁做正极,溶液呈中性,发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-;铁比铜活泼,装置 (b)中铁为负极,反应式为:Fe-2e-=Fe2+,正极为铜,电解质溶液呈酸性,所以正极的反应式为:2H++2e-=H2↑;原电池中阳离子定向移动到正极。
【详解】A.题给装置(a)、 (b)都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护,选项A正确;
B.(a)中的负极反应式为:Zn-2e-=Zn2+,而 (b)中负极是铁,反应式为:Fe-2e-=Fe2+,选项B错误;
C.(a)溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而 (b)溶液显酸性,电极反应式为:2H++2e-=H2↑,选项C错误;
D.原电池中阳离子定向移动到正极,(a)中向铁电极方向移动, (b)中向铜电极方向移动,选项D错误;
答案选A。
9.B
【分析】当闭合K后,b极附近先变红,即b极水放电生成和,b极是阴极,a极是阳极,电极B是负极,电极A是正极,据此分析解答。
【详解】A.闭合K时,负极发生氧化反应,由放电时的总反应可知,负极反应式为,A错误;
B.有0.01mol通过离子交换膜,说明有0.01mol电子转移,阴极(b极)上生成0.005mol,标准状况下体积为,B正确;
C.闭合K后,b极附近先变红色,该电极上发生的反应为,即b极附近有生成,pH增大,C错误;
D.闭合K后,a极是阳极,金属铜作阳极,电极本身被氧化,电极反应式为,没有气体产生,D错误;
故答案选B。
10.C
【分析】铆有铁钉的铜板暴露在潮湿的空气中,形成原电池,铁为负极,失电子被氧化。
【详解】A.由图可知,Fe失电子,化合价升高,被氧化,选项A正确;
B.腐蚀过程中,铁钉作负极,铜板作正极,正极上发生还原反应,电极反应式为,选项B正确;
C.铁锈的主要成分是,选项C错误;
D.在铆有铁钉的铜板上刷一层油漆,可隔绝空气和水,减缓腐蚀,选项D正确;
答案选C。
11.D
【分析】由图可知,青铜基体失去电子,发生氧化反应,作负极,由氧气参加反应的电极为正极,以此解题。
【详解】A.根据图示可知,青铜基体电极有Cu2+产生,Cu化合价升高,发生氧化反应,作负极,A错误;
B.在该反应中,铜失去电子变成Cu2+,64g Cu腐蚀转移2mol电子,在标况下,理论上耗氧体积为,B错误;
C.反应的焓变只与反应物、生成物的状态有关,故反应焓变不变,C错误;
D.由题图可知,青铜器发生的是吸氧腐蚀,D正确;
故选D。
12.D
【分析】开关K置于M处,构成电解池,铁为阴极,被保护,属于为牺牲阳极的阴极保护法,开关K置于N处时,构成原电池,取决于X极的材料,若X极比铁活泼,则X极为负极,被氧化,失去电子,铁为正极,被保护,反之,铁为负极,被氧化,腐蚀,据此分析解答即可。
【详解】A.若X为碳棒,开关K置于M处可减缓铁的腐蚀,属于牺牲阳极的阴极保护,故A正确;
B.若X为锌棒,开关K置于M处可减缓铁的腐蚀,属于牺牲阳极的阴极保护,开关K置于N处,形成原电池,锌为负极,被氧化,铁为正极,被保护,故B正确;
C.若X为锌棒,开关K置于N处时,锌为负极,被氧化,属于为牺牲阳极的阴极保护法,故C正确;
D.若X为碳棒,开关K置于N处时,X电极上发生的反应为O2+2H2O+4e-=4OH-,故D错误;
答案选D。
13.D
【分析】在Fe原电池反应引起的腐蚀中,Fe为负极,失去电子发生氧化反应产生Fe2+,电极反应式为Fe-2e-=Fe2+;在合金中另外一种金属上溶解的O2得到电子发生还原反应产生OH-,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2再被氧化产生Fe(OH)3,Fe(OH)3部分失去水分变为铁锈Fe2O3 xH2O。
【详解】A.Fe易失电子作负极,另外的金属电极为正极,负极上Fe失电子生成Fe2+,则电极反应式为Fe-2e-=Fe2+,A错误;
B.温度和压强未知,气体摩尔体积无法确定,所以无法计算氧气的物质的量,B错误;
C.铁合金腐蚀时先生成Fe2+,Fe2+和OH-反应生成Fe(OH)2,Fe(OH)2再被氧化生成Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3 xH2O,所以最终产物为Fe2O3 xH2O,C错误;
D.为防止孔蚀发生,可以将被保护的金属作电解池阴极,所以应该将金属连接原电池的负极,D正确;
故合理选项是D。
14.C
【详解】A.实验Ⅰ中Fe作负极,碳作正极,实验Ⅱ中Zn作负极,Fe作正极,所以实验Ⅱ中Zn保护了Fe,铁的腐蚀速率比实验Ⅰ慢,A正确;
B.实验Ⅱ中Fe作正极,在正极氧气得电子发生还原反应,其电极反应式为,B正确;
C.实验Ⅰ的现象不能说明溶液与Fe反应生成了,25min时蓝色区域的出现也可能是因为Fe失去电子生成,溶液与发生反应生成蓝色沉淀,C错误;
D.若将Zn片换成Cu片,Fe比Cu活泼,Fe作负极,Cu作正极,可推测Cu片上氧气得电子发生还原反应生成氢氧根离子,Cu片周边出现红色,铁钉失电子发生氧化反应生成,与溶液反应,使其周边出现蓝色,D正确。
故选C。
15.D
【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
选D。
16.(1) Fe-2e-=Fe2+ 2H++2e-=H2↑ Fe+2H+=H2↑+Fe2+
(2) Fe-2e-=Fe2+ 2H2O+O2+4e-=4OH- 2Fe+2H2O+O2=2Fe(OH)2
【详解】(1)由题干图示信息可知,钢铁的析氢腐蚀时,Fe作负极,发生氧化反应,负极上电极反应式为:Fe-2e-=Fe2+,碳为正极,发生还原反应, 正极上的电极反应式为:2H++2e-=H2↑,故该过程的总反应为:Fe+2H+=Fe2++H2↑,故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;Fe+2H+=Fe2++H2↑;
(2)由题干图示信息可知,钢铁的析氢腐蚀时,Fe作负极,发生氧化反应,负极上电极反应式为:Fe-2e-=Fe2+,碳为正极,发生还原反应, 正极上的电极反应式为:O2+4e-+2H2O=4OH-,故该过程的总反应为:2Fe+2H2O+O2=2Fe(OH)2,在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分,故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;2Fe+2H2O+O2=2Fe(OH)2。
17.(1) 原电池 CH3OH-6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3) 280 D 1.60
(4) 减小 增大
【分析】由题干图示信息可知,甲池为甲醇燃料电池,通CH3OH的一极为负极,电极反应为:CH3OH+8OH--6e-=+6H2O,通O2的一极为正极,电极反应为:O2+2H2O+4e-=4OH-;乙池为电解池,石墨电极A为阳极,电极反应为:2H2O-4e-=4H++O2↑,Ag电极B为阴极,电极反应为:Ag++e-=Ag;丙池为电解池,电极C为阳极,电极反应为:2Cl- -2e-=Cl2↑,电极D为阴极,电极反应为:Cu2++2e-=Cu,据此分析解题。
【详解】(1)①由分析可知,甲池为原电池;
②通入CH3OH 电极的电极反应式为CH3OH+8OH--6e-=+6H2O;
(2)①由分析可知,乙池A(石墨)电极的名称为阳极;
②电极反应为:2H2O-4e-=4H++O2↑,Ag电极B为阴极,电极反应为:Ag++e-=Ag,则乙池中总反应式为:4AgNO3+2H2O4Ag+4HNO3+O2↑;
(3)①由分析可知,当乙池中B极质量增加 5.40g ,即析出5.40g的Ag时,n(Ag)==0.05mol,则电路中转移的电子的物质的量为0.05mol,故甲池中理论上消耗 O2的体积为=0.28L=280mL;
②丙池中阴极(即D极);
③析出铜的质量为=1.60g;
(4)①若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,甲池为甲醇燃料电池,通CH3OH的一极为负极,电极反应为:CH3OH+8OH--6e-=+6H2O,通O2的一极为正极,电极反应为:O2+2H2O+4e-=4OH-则溶液的 pH 将减小;
②若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,即用惰性电极电解NaCl溶液,丙中D极即阴极,电极反应为:2H2O+2e-=H2↑+2OH-,则阴极的产物为NaOH、H2,由于生成了NaOH,则溶液的 pH 将增大。
18.(1)④
(2)电化学腐蚀
(3)Fe-2e-=Fe2+
(4)铁接触空气和电解质溶液(铁与潮湿空气接触)
(5)①②③
【详解】(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子浓度大,导电性强,电化学腐蚀速率快,故答案为:④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为:电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为:Fe-2e-=Fe2+;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质溶液、闭合回路,金属腐蚀时还要有空气,故答案为:铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为:①②③。
19.(1)ACD
(2) 减慢 氧气的浓度
(3)O2+4e-+2H2O=4OH-
(4) 吸氧 容器内氧气含量和压强都降低,所以主要是发生吸氧腐蚀
(5)3Fe-8e-+4H2O=Fe3O4+8H+
【详解】(1)A.用纯氧气代替试管内空气,氧气的浓度增大,反应速率加快,故A正确;
B.用酒精灯加热试管提高温度,试管内气体受热压强增大,不能更快更清晰地观察到液柱上升,故B错误;
C.将铁钉换成铁粉和炭粉混合粉末,增大反应物的接触面积,反应速率加快,故C正确;
D.换成更细的导管,水中滴加红墨水,毛细尖嘴管上升的高度大于玻璃导管,且红墨水现象更明显,故D正确;
故答案为:ACD;
(2)液柱高度变化值与铁腐蚀的速率成正比,分析2min时间内液柱高度变化值即可判断腐蚀的速率变化,2min时间内:1min~3、3~5、5~7、7~9min时间段液柱上升高度分别为:1.3cm、0.9cm、0.6cm、0.5cm,则铁腐蚀的速率逐渐减慢;由于铁的锈蚀是铁与氧气、水的反应,反应过程中不断消耗氧气,容器内氧气的浓度不断减小,反应速率逐渐减慢,相同时间内液柱上升的高度逐渐减弱,故答案为:减慢;氧气的浓度;
(3)向NaCl溶液中滴加2~3滴酚酞溶液,并且a点附近溶液出现红色,说明a点电极上有OH-生成,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)由图可知,0~t1时间内锥形瓶内压强增大,则0~t1时间内发生析氢腐蚀生成氢气,随着反应进行,容器内气体的压强降低,则酸不断消耗,溶液的酸性减弱,容器内发生了吸氧腐蚀,消耗氧气使容器内气体的压强降低,故答案为:吸氧;容器内氧气含量和压强都降低,所以主要是发生吸氧腐蚀;
(5)Fe作阳极置于H2SO4溶液中,Fe钝化形成致密Fe3O4,阳极反应式为3Fe-8e-+4H2O=Fe3O4+8H+,故答案为:3Fe-8e-+4H2O=Fe3O4+8H+。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在如图所示的两个烧杯中分别插入形状和大小几乎一样的破损的镀铜铁片和破损的镀锌铁片,一段时间后,下列说法正确的是
A.甲和乙烧杯中的铁均被保护
B.甲中破损处的铁片溶解,铜层上会产生气泡
C.相比甲,乙中镀锌铁片中的铁被腐蚀得更严重
D.向两个烧杯中分别滴加KSCN溶液,溶液均变红
2.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使与反应生成,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
A.正极的电极反应式为
B.钢管腐蚀的直接产物中含有、
C.与的反应可表示为
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
3.钴()的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,I室和II室溶液的均增大
B.电解总反应:
C.移除两交换膜后,电极和石墨电极发生的反应均发生变化
D.生成,I室溶液质量理论上减少
4.下列说法错误的是
A.在钢铁设备上安装若干镁合金块或锌块,可保护设备不被腐蚀
B.将钢闸门通过导线与直流电源的正极相连,保护闸门不被腐蚀
C.厨房中炒完菜的铁锅应及时清洗并擦干,防止发生电化学腐蚀
D.镀锌铁表面的镀层如发生破损,被腐蚀的仍然是镀层
5.港珠澳大桥设计寿命为120年,桥体钢构件防腐是使用过程中面临的重要问题,下列说法错误的是
A.海水的pH一般在8.0~8.5,则钢构件的腐蚀主要是析氢腐蚀
B.钢构件可采用不锈钢材料以减缓腐蚀
C.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等
D.后期采用牺牲阳极的阴极保护法时,可使用铝作为负极
6.“打赢蓝天保卫战”,近年来对大气污染防治的要求日益提高。二氧化硫—空气质子交换膜燃料电池实现了制稀硫酸、发电、环保三位一体的结合,原理如图所示。下列说法错误的是
A.该电池放电时电子从电极经过外电路流到电极
B.电极附近发生的反应为
C.电极附近发生的反应为
D.相同条件下,放电过程中消耗的和的体积比为
7.利用如图装置可以模拟铁的电化学防护。下列说法不正确的是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀速率
B.若X为锌棒,开关K置于M处,铁的保护属于牺牲阳极的阴极保护法
C.若X为碳棒,开关K置于N处,铁的保护属于外接电流的阴极保护法
D.若X为碳棒,开关K置于N处,X极发生还原反应
8.结合图示判断,下列叙述中,正确的是
A.(a)和(b)中正极均被保护
B.(a)和(b)中负极反应均是
C.(a)和(b)中正极反应均是
D.(a)和(b)中均向铁电极方向移动
9.如图所示装置I是一种可充电电池,电池总反应为。装置II为电解池。离子交换膜只允许通过,闭合开关K后,b极附近先变红色。下列说法正确的是
A.负极反应为
B.当有0.01mol通过离子交换膜时,b电极上析出标准状况下的气体112mL
C.闭合K后,b电极附近的pH减小
D.闭合K后,a电极上有气体产生
10.铆有铁钉的铜板暴露在潮湿的空气中,一段时间后铁钉上有铁锈出现,其原理如图所示。下列说法错误的是
A.铁发生氧化反应
B.腐蚀过程中铜板上发生的反应为
C.铁锈的主要成分是
D.在铆有铁钉的铜板上刷一层油漆,可减缓腐蚀
11.下图是青铜器发生电化学腐蚀的原理示意图,下列说法正确的是
A.腐蚀过程中,青铜基体是正极
B.若有64gCu被腐蚀,理论上消耗氧气的体积为22.4L(标准状况)
C.多孔催化层加速了青铜器的腐蚀,是因为改变了反应的焓变
D.青铜器发生的是吸氧腐蚀
12.电化学反应原理的实验装置如图所示。下列叙述错误的是
A.若X为碳棒,开关K置于M处可减缓铁的腐蚀
B.若X为锌棒,开关K置于M或N处都可减缓铁的腐蚀
C.若X为锌棒,开关K置于N处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于N处时,X电极上发生的反应为2H+ +2e-=H2↑
13.“孔蚀”是一种集中于金属表面极小范围并能深入到金属内部的电化学腐蚀。某铁合金表面钝化膜破损后,发生“孔蚀”的电化学腐蚀过程如题图所示。下列有关说法正确的是
A.负极反应:Fe-3e-=Fe3+
B.氧化0.2 mol Fe,需消耗3.36 LO2
C.铁合金腐蚀的最终产物为Fe(OH)3
D.为防止孔蚀发生可以将外接电源负极与金属相连
14.实验小组研究金属电化学腐蚀,实验如下:
实验Ⅰ
5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
A.实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验Ⅰ慢
B.实验Ⅱ中正极的电极反应式:
C.实验Ⅰ的现象说明溶液与Fe反应生成了
D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色
15.下列四个装置中都用到了金属铜,下列有关说法正确的是
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
二、填空题
16.电化学腐蚀分类
由于条件不同,钢铁的腐蚀可以分为析氢腐蚀和吸氧腐蚀两种类型。
(1)析氢腐蚀:在酸性环境中,由于腐蚀过程中不断有H2放出,所以叫做析氢腐蚀。
有关反应如下:
负极:___________。
正极:___________。
总反应:___________。
(2)吸氧腐蚀:如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,此时就发生吸氧腐蚀。
有关反应如下:
负极:___________。
正极:___________。
总反应:___________。
在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分。
17.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为___。
(2)乙池中A(石墨)电极的名称为____(填“正极”“负极”“阴极”或“阳极”),乙池总反应式为____。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为____mL(标准状况下),丙池中____极析出____g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将____(填“增大”“减小”或“不变”);丙中溶液的pH将___(填“增大”“减小”或“不变”)。
三、实验题
18.某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 ① ② ③ ④
实验内容
一周后观察:
(1)铁钉被腐蚀程度最大的是___________(填实验序号)。
(2)实验③中主要发生的是___________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:___________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是___________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
19.研究金属腐蚀和防护的原理很有现实意义。
(1)图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有_______(填序号)。
A.用纯氧气代替具支试管内空气
B.用酒精灯加热具支试管提高温度
C.将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水
D.将玻璃导管换成更细的导管,水中滴加红墨水
(2)该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐_______(填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为_______。
时间/min 1 3 5 7 9
液柱高度/cm 0.8 2.1 3.0 3.7 4.2
(3)为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
实验操作 实验现象 实验结论
向NaCl溶液中滴加2~3滴酚酞溶液 a点附近溶液出现红色 a点电极反应为_______
一段时间后再滴加2~3滴铁氰化钾溶液 b点周围出现蓝色沉淀 b点电极反应为Fe-2e-=Fe2+
(4)设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生_______(填“吸氧”或“析氢”)腐蚀,原因是_______。
(5)金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】根据分析,甲中铜作正极,铁作负极;乙中铁作正极,锌作负极;
【详解】A.甲中铁作负极,被腐蚀,A错误;
B.根据分析,甲中铁片为负极发生反应溶解,溶液中的氢离子在铜层上生成氢气,B正确;
C.甲中铁作负极,被腐蚀,乙中铁作正极,被保护,甲中铁腐蚀更严重,C错误;
D.乙中的铁被保护,溶液不会变红,D错误;
故答案为:B。
2.B
【详解】A.由题图可知,生成,H的化合价降低,得电子,故正极的电极反应式为,A项错误;
B.反应生成的、与可生成、,B项正确;
C.根据题中所给信息可知,与反应生成,根据元素守恒可知,生成物中还有,故反应式为,C项错误;
D.钢管表面镀锌,锌会与铁形成原电池,锌比铁活泼,铁作正极,可减缓钢管的腐蚀;钢管表面镀铜,铜会与铁形成原电池,铁比铜活泼,铁作负极,从而加速钢管的腐蚀,D项错误;
故选:B。
3.B
【分析】由图可知,该装置为电解池,石墨电极为阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为,I室中阳离子电荷数大于阴离子电荷数,放电生成的氢离子通过阳离子交换膜由I室向II室移动,钴电极为阴极,钴离子在阴极得到电子发生还原反应生成钴,电极反应式为,III室中阴离子电荷数大于阳离子电荷数,氯离子通过阴离子交换膜由III室向II室移动,电解的总反应的离子方程式为。
【详解】A.由分析可知,放电生成的氢离子通过阳离子交换膜由I室向II室移动,使II室中氢离子浓度增大,溶液减小,A错误;
B.由分析可知,电解总反应为,B正确;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,电极发生的反应不变,C错误;
D.由分析可知,阴极生成钴,阳极有水放电生成,且氢离子通过阳离子交换膜由I室移向II室,则I室溶液质量减少,D错误;
故选:B。
4.B
【详解】A.在钢铁设备上安装若干镁合金或锌块,镁合金或锌块作原电池负极的金属加速被腐蚀,钢铁设备作正极的金属被保护,故A正确;
B.将钢闸门通过导线与直流电源的正极相连,钢闸门作阳极,加速了腐蚀,故B错误;
C.钢铁在有电解质溶液的环境中易发生电化学腐蚀,炒过菜的铁锅含有电解质溶液,不及时清洗会发生电化学腐蚀,故C正确;
D.Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故D正确;
故选B。
5.A
【详解】A.海水的pH一般在8.0~8.5,碱性条件下钢构件的腐蚀主要是吸氧腐蚀,A项错误;
B.通过改变钢构件材料的组成,可以减缓腐蚀速率,B项正确;
C.在钢构件表面喷涂环氧树脂涂层,可以防止钢构件与空气、水接触,C项正确;
D.铝与钢铁连接时,铝作原电池的负极,更容易被氧化,对桥体钢构件起到保护作用,D项正确;
故选A。
6.C
【分析】根据图示,电极通入SO2失电子生成,则电极为负极,电极反应为,电极为正极,酸性条件下,通入的氧气得电子生成水,发生的反应为,据此分析解答。
【详解】A.放电时,电子从负极流向正极,电极为负极,电极为正极,则该电池放电时电子从电极经过外电路流到电极,故A正确;
B.电极通入SO2,SO2在负极失电子生成,则电极反应为,故B正确;
C.酸性条件下,氧气得电子生成水,则电极附近发生的反应为,故C错误;
D.该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的和的体积比为,故D正确;
答案选C。
7.D
【详解】A.开关K置于M处,形成铁锌原电池,X为锌棒,为负极,铁为正极,可减缓铁的腐蚀速率,A正确;
B.开关K置于M处,形成铁锌原电池,X为锌棒,较活泼,为负极,铁为正极,利用牺牲阳极的阴极保护法保护铁,B正确;
C.开关K置于N处,形成电解池,铁接电源的负极形成电解池的阴极被保护,属于外接电流的阴极保护法,C正确;
D.开关K置于N处,X极接电源的正极,形成电解池的阳极,发生氧化反应,D错误;
故选D。
8.A
【分析】锌比铁活泼,装置(a)中锌做负极,负极反应为:Zn-2e-=Zn2+,铁做正极,溶液呈中性,发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-;铁比铜活泼,装置 (b)中铁为负极,反应式为:Fe-2e-=Fe2+,正极为铜,电解质溶液呈酸性,所以正极的反应式为:2H++2e-=H2↑;原电池中阳离子定向移动到正极。
【详解】A.题给装置(a)、 (b)都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护,选项A正确;
B.(a)中的负极反应式为:Zn-2e-=Zn2+,而 (b)中负极是铁,反应式为:Fe-2e-=Fe2+,选项B错误;
C.(a)溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而 (b)溶液显酸性,电极反应式为:2H++2e-=H2↑,选项C错误;
D.原电池中阳离子定向移动到正极,(a)中向铁电极方向移动, (b)中向铜电极方向移动,选项D错误;
答案选A。
9.B
【分析】当闭合K后,b极附近先变红,即b极水放电生成和,b极是阴极,a极是阳极,电极B是负极,电极A是正极,据此分析解答。
【详解】A.闭合K时,负极发生氧化反应,由放电时的总反应可知,负极反应式为,A错误;
B.有0.01mol通过离子交换膜,说明有0.01mol电子转移,阴极(b极)上生成0.005mol,标准状况下体积为,B正确;
C.闭合K后,b极附近先变红色,该电极上发生的反应为,即b极附近有生成,pH增大,C错误;
D.闭合K后,a极是阳极,金属铜作阳极,电极本身被氧化,电极反应式为,没有气体产生,D错误;
故答案选B。
10.C
【分析】铆有铁钉的铜板暴露在潮湿的空气中,形成原电池,铁为负极,失电子被氧化。
【详解】A.由图可知,Fe失电子,化合价升高,被氧化,选项A正确;
B.腐蚀过程中,铁钉作负极,铜板作正极,正极上发生还原反应,电极反应式为,选项B正确;
C.铁锈的主要成分是,选项C错误;
D.在铆有铁钉的铜板上刷一层油漆,可隔绝空气和水,减缓腐蚀,选项D正确;
答案选C。
11.D
【分析】由图可知,青铜基体失去电子,发生氧化反应,作负极,由氧气参加反应的电极为正极,以此解题。
【详解】A.根据图示可知,青铜基体电极有Cu2+产生,Cu化合价升高,发生氧化反应,作负极,A错误;
B.在该反应中,铜失去电子变成Cu2+,64g Cu腐蚀转移2mol电子,在标况下,理论上耗氧体积为,B错误;
C.反应的焓变只与反应物、生成物的状态有关,故反应焓变不变,C错误;
D.由题图可知,青铜器发生的是吸氧腐蚀,D正确;
故选D。
12.D
【分析】开关K置于M处,构成电解池,铁为阴极,被保护,属于为牺牲阳极的阴极保护法,开关K置于N处时,构成原电池,取决于X极的材料,若X极比铁活泼,则X极为负极,被氧化,失去电子,铁为正极,被保护,反之,铁为负极,被氧化,腐蚀,据此分析解答即可。
【详解】A.若X为碳棒,开关K置于M处可减缓铁的腐蚀,属于牺牲阳极的阴极保护,故A正确;
B.若X为锌棒,开关K置于M处可减缓铁的腐蚀,属于牺牲阳极的阴极保护,开关K置于N处,形成原电池,锌为负极,被氧化,铁为正极,被保护,故B正确;
C.若X为锌棒,开关K置于N处时,锌为负极,被氧化,属于为牺牲阳极的阴极保护法,故C正确;
D.若X为碳棒,开关K置于N处时,X电极上发生的反应为O2+2H2O+4e-=4OH-,故D错误;
答案选D。
13.D
【分析】在Fe原电池反应引起的腐蚀中,Fe为负极,失去电子发生氧化反应产生Fe2+,电极反应式为Fe-2e-=Fe2+;在合金中另外一种金属上溶解的O2得到电子发生还原反应产生OH-,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2再被氧化产生Fe(OH)3,Fe(OH)3部分失去水分变为铁锈Fe2O3 xH2O。
【详解】A.Fe易失电子作负极,另外的金属电极为正极,负极上Fe失电子生成Fe2+,则电极反应式为Fe-2e-=Fe2+,A错误;
B.温度和压强未知,气体摩尔体积无法确定,所以无法计算氧气的物质的量,B错误;
C.铁合金腐蚀时先生成Fe2+,Fe2+和OH-反应生成Fe(OH)2,Fe(OH)2再被氧化生成Fe(OH)3,Fe(OH)3脱去一部分水生成Fe2O3 xH2O,所以最终产物为Fe2O3 xH2O,C错误;
D.为防止孔蚀发生,可以将被保护的金属作电解池阴极,所以应该将金属连接原电池的负极,D正确;
故合理选项是D。
14.C
【详解】A.实验Ⅰ中Fe作负极,碳作正极,实验Ⅱ中Zn作负极,Fe作正极,所以实验Ⅱ中Zn保护了Fe,铁的腐蚀速率比实验Ⅰ慢,A正确;
B.实验Ⅱ中Fe作正极,在正极氧气得电子发生还原反应,其电极反应式为,B正确;
C.实验Ⅰ的现象不能说明溶液与Fe反应生成了,25min时蓝色区域的出现也可能是因为Fe失去电子生成,溶液与发生反应生成蓝色沉淀,C错误;
D.若将Zn片换成Cu片,Fe比Cu活泼,Fe作负极,Cu作正极,可推测Cu片上氧气得电子发生还原反应生成氢氧根离子,Cu片周边出现红色,铁钉失电子发生氧化反应生成,与溶液反应,使其周边出现蓝色,D正确。
故选C。
15.D
【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
选D。
16.(1) Fe-2e-=Fe2+ 2H++2e-=H2↑ Fe+2H+=H2↑+Fe2+
(2) Fe-2e-=Fe2+ 2H2O+O2+4e-=4OH- 2Fe+2H2O+O2=2Fe(OH)2
【详解】(1)由题干图示信息可知,钢铁的析氢腐蚀时,Fe作负极,发生氧化反应,负极上电极反应式为:Fe-2e-=Fe2+,碳为正极,发生还原反应, 正极上的电极反应式为:2H++2e-=H2↑,故该过程的总反应为:Fe+2H+=Fe2++H2↑,故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;Fe+2H+=Fe2++H2↑;
(2)由题干图示信息可知,钢铁的析氢腐蚀时,Fe作负极,发生氧化反应,负极上电极反应式为:Fe-2e-=Fe2+,碳为正极,发生还原反应, 正极上的电极反应式为:O2+4e-+2H2O=4OH-,故该过程的总反应为:2Fe+2H2O+O2=2Fe(OH)2,在空气中Fe(OH)2被进一步氧化成Fe(OH)3,Fe(OH)3失去部分水后生成Fe2O3·xH2O,它是铁锈的主要成分,故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;2Fe+2H2O+O2=2Fe(OH)2。
17.(1) 原电池 CH3OH-6e-+8OH-=CO+6H2O
(2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3) 280 D 1.60
(4) 减小 增大
【分析】由题干图示信息可知,甲池为甲醇燃料电池,通CH3OH的一极为负极,电极反应为:CH3OH+8OH--6e-=+6H2O,通O2的一极为正极,电极反应为:O2+2H2O+4e-=4OH-;乙池为电解池,石墨电极A为阳极,电极反应为:2H2O-4e-=4H++O2↑,Ag电极B为阴极,电极反应为:Ag++e-=Ag;丙池为电解池,电极C为阳极,电极反应为:2Cl- -2e-=Cl2↑,电极D为阴极,电极反应为:Cu2++2e-=Cu,据此分析解题。
【详解】(1)①由分析可知,甲池为原电池;
②通入CH3OH 电极的电极反应式为CH3OH+8OH--6e-=+6H2O;
(2)①由分析可知,乙池A(石墨)电极的名称为阳极;
②电极反应为:2H2O-4e-=4H++O2↑,Ag电极B为阴极,电极反应为:Ag++e-=Ag,则乙池中总反应式为:4AgNO3+2H2O4Ag+4HNO3+O2↑;
(3)①由分析可知,当乙池中B极质量增加 5.40g ,即析出5.40g的Ag时,n(Ag)==0.05mol,则电路中转移的电子的物质的量为0.05mol,故甲池中理论上消耗 O2的体积为=0.28L=280mL;
②丙池中阴极(即D极);
③析出铜的质量为=1.60g;
(4)①若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,甲池为甲醇燃料电池,通CH3OH的一极为负极,电极反应为:CH3OH+8OH--6e-=+6H2O,通O2的一极为正极,电极反应为:O2+2H2O+4e-=4OH-则溶液的 pH 将减小;
②若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,即用惰性电极电解NaCl溶液,丙中D极即阴极,电极反应为:2H2O+2e-=H2↑+2OH-,则阴极的产物为NaOH、H2,由于生成了NaOH,则溶液的 pH 将增大。
18.(1)④
(2)电化学腐蚀
(3)Fe-2e-=Fe2+
(4)铁接触空气和电解质溶液(铁与潮湿空气接触)
(5)①②③
【详解】(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子浓度大,导电性强,电化学腐蚀速率快,故答案为:④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为:电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为:Fe-2e-=Fe2+;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质溶液、闭合回路,金属腐蚀时还要有空气,故答案为:铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为:①②③。
19.(1)ACD
(2) 减慢 氧气的浓度
(3)O2+4e-+2H2O=4OH-
(4) 吸氧 容器内氧气含量和压强都降低,所以主要是发生吸氧腐蚀
(5)3Fe-8e-+4H2O=Fe3O4+8H+
【详解】(1)A.用纯氧气代替试管内空气,氧气的浓度增大,反应速率加快,故A正确;
B.用酒精灯加热试管提高温度,试管内气体受热压强增大,不能更快更清晰地观察到液柱上升,故B错误;
C.将铁钉换成铁粉和炭粉混合粉末,增大反应物的接触面积,反应速率加快,故C正确;
D.换成更细的导管,水中滴加红墨水,毛细尖嘴管上升的高度大于玻璃导管,且红墨水现象更明显,故D正确;
故答案为:ACD;
(2)液柱高度变化值与铁腐蚀的速率成正比,分析2min时间内液柱高度变化值即可判断腐蚀的速率变化,2min时间内:1min~3、3~5、5~7、7~9min时间段液柱上升高度分别为:1.3cm、0.9cm、0.6cm、0.5cm,则铁腐蚀的速率逐渐减慢;由于铁的锈蚀是铁与氧气、水的反应,反应过程中不断消耗氧气,容器内氧气的浓度不断减小,反应速率逐渐减慢,相同时间内液柱上升的高度逐渐减弱,故答案为:减慢;氧气的浓度;
(3)向NaCl溶液中滴加2~3滴酚酞溶液,并且a点附近溶液出现红色,说明a点电极上有OH-生成,电极反应式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)由图可知,0~t1时间内锥形瓶内压强增大,则0~t1时间内发生析氢腐蚀生成氢气,随着反应进行,容器内气体的压强降低,则酸不断消耗,溶液的酸性减弱,容器内发生了吸氧腐蚀,消耗氧气使容器内气体的压强降低,故答案为:吸氧;容器内氧气含量和压强都降低,所以主要是发生吸氧腐蚀;
(5)Fe作阳极置于H2SO4溶液中,Fe钝化形成致密Fe3O4,阳极反应式为3Fe-8e-+4H2O=Fe3O4+8H+,故答案为:3Fe-8e-+4H2O=Fe3O4+8H+。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
