第1章第2节原子结构与元素周期表同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第1章第2节原子结构与元素周期表同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 381.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:26:14 | ||
图片预览




文档简介
第1章第2节原子结构与元素周期表同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.错误,违反了泡利不相容原理
B.各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是构造原理
C.的电子排布式违反了洪特规则
D.电子排布式违反了泡利不相容原理
2.下列各项叙述中,错误的是
A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
B.基态C的电子排布式为1s22s22p 违反了洪特规则
C.基态Sc的电子排布式为1s22s22p63s23p64s3违反了泡利原理
D.硼原子由1s22s22p1s22s22p时,是由基态转化为激发态
3.下列说法正确的是
A.p-pσ键电子云轮廓图
B.基态铜原子的价层电子排布图:
C.的离子结构示意图为:
D.某原子核外电子排布式为,它违背了泡利原理
4.下列说法错误的是
A.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p…
B.1s22s12p1是激发态原子的电子排布式
C.基态溴原子的简化电子排布式是[Ar]3d104s24p5
D.Mg原子的电子排布式为1s22s22p63s2
5.元素周期表长周期共有18个纵列,从左到右排为18列,即碱金属是第1列,稀有气体是第18列。按这种规定,下列说法正确的是
A.第9列元素中可能有非金属元素
B.第15列元素的原子最外层的电子排布是ns2np5
C.最外层电子排布为ns2的元素可能在第2列
D.第11、12列为d区的元素
6.下列描述原子结构的化学用语正确的是
A.碳原子结构示意图:
B.基态铜原子()的价层电子排布式:
C.氧原子核外能量最高的电子云的形状:
D.碳原子核外电子的轨道表示式:
7.下列各基态原子或离子的电子排布式正确的是
A.Si B.Ca
C.Fe D.
8.下列各原子或离子的电子排布式错误的是
A.: B.F:
C.: D.:
9.下列各项叙述错误的是
A.若硫原子核外电子排布图为,则违反了泡利原理
B.若21号Sc元素的基态原子电子排布式为,则违反了构造原理
C.铍原子的核外电子排布图为,符合洪特规则和泡利原理
D.原子的电子排布式由能释放特定能量产生发射光谱
10.第N能层所含能级数、原子轨道数和最多容纳电子数分别为
A.3、32、2× 32 B.4、42、2× 32 C.5、42、5× 32 D.4、42、2× 42
11.下列各组原子中,彼此化学性质一定相似的是
A.最外层都只有一个电子的X、Y原子
B.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
C.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
D.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
12.下面是第二周期部分元素基态原子的电子排布图,据此下列说法错误的是
A.每个原子轨道里最多只能容纳2个电子
B.电子排在同一能级时,总是优先单独占据一个轨道
C.每个能层所具有的能级数等于能层的序数(n)
D.N原子中有5种电子运动状态
13.下列各原子或离子的电子排布式或电子排布图表示正确的是
A.Ca2+:1s22s22p63s23p6
B.F-:1s22s23p6
C.P:最外层电子排布图为
D.Cr:1s22s22p63s23p63d44s2
14.下列说法错误的是
A.电子的能量不一定高于p电子的能量
B.的电子排布式违反了洪特规则
C.电子排布式违反了构造原理
D.电子排布式违反了泡利原理
15.下列基态原子或离子的电子排布式错误的是
A.K:1s22s22p63s23p64s1 B.F-:1s22s22p6
C.S2-:1s22s22p63s23p4 D.Ar: 1s22s22p63s23p6
二、填空题
16.下表列出了①~④四种元素在周期表中的位置.
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ①
3 ② ③
4 ④
回答下列问题:
(1)①的元素符号为_____________。
(2)②的基态原子电子排布式为__________________________。
(3)③和④中原子半径较大的是_____________(填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________形;每个p能级都有_____________个相互垂直的电子云。
17.原子轨道
(1)概念:量子力学把电子在原子核外的一个_______称为一个原子轨道。
(2)形状
①s电子的原子轨道呈_______形,能层序数越_______,原子轨道的半径越_______。
②p电子的原子轨道呈_______形,能层序数越_______,原子轨道的半径越_______。
三、实验题
18.某学生在做同一主族元素性质的递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管。
药品:新制的氯水、新制的溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在表中横线处填写相关内容):
序号 实验方案 实验现象
① 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈__________色
② 向盛有少量碘化钠溶液的试管中滴加少量新制的溴水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈__________色
(4)实验结论:___________。
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为___________、__________。
②请用本章所学内容简单说明得出上述结论的原因_____________。
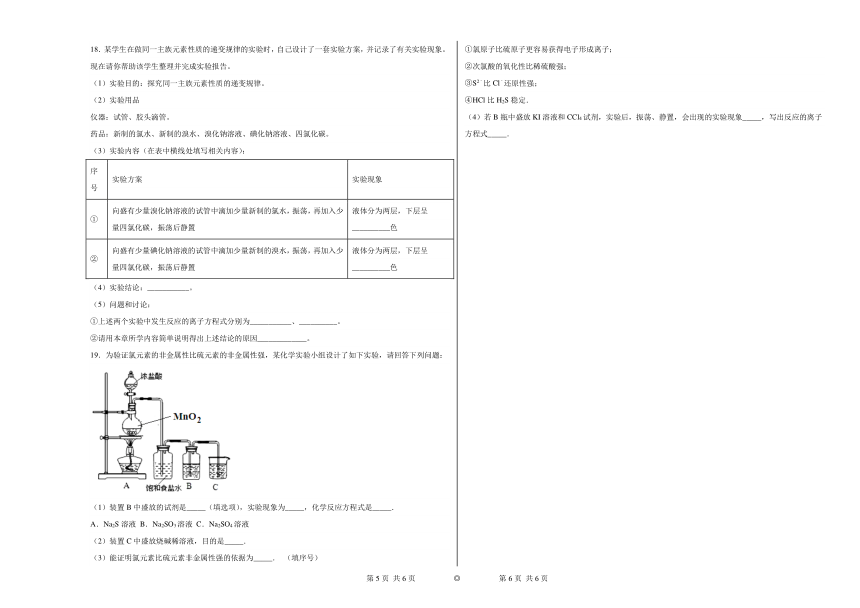
19.为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置B中盛放的试剂是_____(填选项),实验现象为_____,化学反应方程式是_____.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是_____.
(3)能证明氯元素比硫元素非金属性强的依据为_____. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2﹣比Cl﹣还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象_____,写出反应的离子方程式_____.
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.根据洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,因此违反了洪特规则,故A错误;
B.泡利原理是一个原子轨道中,最多只能容纳2个电子,它们自旋相反,因此各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是泡利原理,故B错误;
C.根据洪特规则,6C的电子排布式,题给电子排布式违反了洪特规则,故C正确;
D.电子排布式(22Ti)违反了能量最低原理,故D错误;
答案为C。
2.D
【详解】A.原子核外的电子总是尽先占有能量最低的轨道,然后依次排到能量较高的轨道,4s轨道能量比3d轨道能量低,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,A正确;
B.根据洪特规则,基态C的电子排布式中2p轨道上的两个电子应该排在不同的轨道上,故违反了洪特规则,B正确;
C.根据泡利原理,s能级只有一个轨道,最多只能放入2个电子,基态Sc的电子排布式1s22s22p63s23p64s3违反了泡利原理,C正确;
D.2p轨道能量相同,硼原子由1s22s22p1s22s22p时,并没有转化为激发态,D错误;
故答案为:D。
【点睛】洪特规则是指当电子排布在能量相同的各个轨道时,电子总是尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子能量最低;泡利原理是指不能有两个或两个以上的粒子处于完全相同的状态,也就是一个亚层中最多能有2个电子,其自旋相反。
3.D
【详解】A. 是p-pπ键电子云模型,以“肩并肩”方式形成,呈镜像对称,p-pσ键,原子轨道头碰头方式重叠,电子云图形为,故A错误;
B.Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,价层电子排布式为:3d104s1,电子排布图为:,故B错误;
C.Fe3+离子核内质子数为26,核外各层上电子数分别为2、8、13,结构示意图为,故C错误;
D.泡利原理是指每个轨道最多只能容纳两个自旋相反的电子,而ns2np7的np能级排布了7个电子,故违背了泡利原理,故D正确;
故选:D。
4.A
【详解】A.根据构造原理原子核外电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p,A错误;
B.1s22s2为基态,1s22s12p1为激发态,B正确;
C.基态溴原子的核外有35个电子,分4层排布,基态溴原子的简化电子排布式为[Ar]3d104s24p5,C正确;
D.Mg原子的核外电子数为12,电子排布式为1s22s22p63s2,D正确;
故选A。
5.C
【详解】第9列元素是过渡元素,没有非金属,A项错误;第15列元素的最外层电子排布是ns2np3,B项错误;最外层电子排布为ns2的元素可能为ⅡA族元素也可能是过渡元素或0族元素He,C项正确;11、12列为ds区元素,D项错误
6.C
【详解】A.在原子结构示意图中,圆圈内的质子数应带“+”,则碳原子结构示意图为,A不正确;
B.原子核外电子排布时,需遵循洪特规则,所以基态铜原子()的价层电子排布式不是,而是3d104s1,B不正确;
C.氧原子的电子排布式为1s22s22p4,则核外能量最高的电子云为p电子云,形状为:,C正确;
D.碳原子核外电子排布为1s22s22p2,轨道表示式为,D不正确;
故选C。
7.A
【详解】A.核外有14个电离,根据电子排布规律,电子排布式为:,A正确;
B.原子核外有20个电子,根据构造原理,排布式应该为,B错误;
C.原子有26个电子,根据构造原理,,C错误;
D.的电子排布式为,D错误;
故选B。
8.C
【详解】A.K原子核外电子排布式为,K原子失去最外层1个电子变为,因此核外电子排布式为,故A项正确;
B.F原子核外有9个电子,根据能量最低原理可知F原子核外电子排布式为,故B项正确;
C.S原子核外有16个电子,得到2个电子后变为,根据能量最低原理可知核外电子排布式为,故C项错误;
D.Ar原子核外有18个电子,根据能量最低原理可知原子核外电子排布式为,故D项正确;
综上所述,错误的是C项。
9.A
【详解】A.根据洪特规则,填入简并轨道的电子总是先单独分占且自旋平行,该排布图违反了洪特规则,A错误;
B.根据构造原理,最后两个能级的电子应先填入4s轨道再填入3d轨道,该排布式违反了构造原理,B正确;
C.铍元素原子序数为4,1s、2s能级均只有一个原子轨道,该排布图符合洪特规则与泡利原理,C正确;
D.该变化表示电子从较高能量的激发态跃迁到基态,释放出能量,故会产生发射光谱,D正确;
故选A。
10.D
【详解】第N能级为第4层,含有的轨道能级分别为s、p、 d、f的顺序依次为1、3, 5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子;
故选D。
11.B
【详解】A.最外层只有一个电子的原子的化学性质不一定相同,如H和Na,故A错误;
B.2p轨道上只有2个电子,应是Be,3p轨道上只有2个电子的,应是Mg,它们位于同一主族,化学性质具有相似性,故B正确;
C.原子核外电子排布式为1s2,该元素为He,属于稀有气体元素,原子核外电子排布式为1s22s2的Y原子,该元素为Be,属于金属元素,两者性质不相似,故C错误;
D.原子核外M层上仅有两个电子的X原子,核外电子排布式为1s22s22p63s2,该元素为Mg,原子核外N层上仅有两个电子的Y原子,价电子排布式,可以是4s2、3d64s2、3d74s2、3d84s2、3d104s2,分别是Ca、Fe、Co、Ni、Zn,它们化学性质不一定相似,故D错误;
答案为B。
12.D
【分析】观察题中四种元素的电子排布图,对原子轨道容纳的电子数做出判断,根据洪特规则,可知电子在同一能级的不同轨道时,优先占据一个轨道,任一能级总是从s轨道开始,能层数目即为轨道能级数。
【详解】A. 由题给的四种元素原子的电子排布图可知,在一个原子轨道里,最多能容纳2个电子,符合泡利原理,故A正确;
B. 电子排在同一能级的不同轨道时,总是优先单独占据一个轨道,符合洪特规则,故B正确;
C. 任意能层的能级总是从s能级开始,而且能级数等于该能层序数,故C正确;
D. 原子核外电子运动的能层、能级、轨道都代表电子的运动状态,即使在一个原子轨道的2个电子,其自旋状态相反,故N原子中有7种电子运动状态,故D错误;
答案为D。
13.A
【详解】A.Ca为20号元素,电子排布式为1s22s22p63s23p64s2,则Ca2+的电子排布式为1s22s22p63s23p6,A正确;
B.F为9号元素,F-的核外有10个电子,电子排布式为1s22s22p6,B不正确;
C.P的价电子排布为3s23p3,根据洪特规则,最外层电子排布图为,C不正确;
D.Cr为24号元素,电子排布式为:1s22s22p63s23p63d54s1(应符合洪特规则),D不正确;
故选A。
14.A
【分析】洪特规则:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,即为洪特规则,又称为最多轨道原理,一般电子总是尽先自旋平行地分占不同轨道。
泡利原理:不能有两个或两个以上的粒子处于完全相同的状态,也就是一个亚层中最多能有2个电子,其自旋相反。
【详解】
A.ns电子的能量一定高于(n-1)p电子的能量,A错误;
B.对于C 原子来说,2p能级有3个能量相同的原子轨道,最后2个电子应以自旋状态相同的方式分布在两个不同的2p轨道上,违反了洪特规则,B正确;
C.根据轨道能量高低顺序可知E4sD.对于22Ti原子来说,3p能级共有3个轨道,最多可以排6个电子,如果排10 个电子,则违反了泡利原理,D正确
故选A。
15.C
【详解】A.K原子核外有19个电子,其基态原子核外电子排布式为:1s22s22p63s23p64s1,故A正确;
B.氟离子核外有10个电子,其基态离子核外电子排布式为:1s22s22p6,故B正确;
C.S离子得到2个电子,核外有18个电子,其基态离子核外电子排布式为:1s22s22p63s23p6,故C错误;
D.Ar原子核外有18个电子,其基态原子核外电子排布式为:1s22s22p63s23p6,故D正确;
故选C。
16.(1)O
(2)[Ne]3s1
(3)Br
(4) 球 3
【分析】①是第二周期第VIA族元素,所以①是O;②是第三周期第IA族元素,所以②是Na;③是第三周期第VIIA族元素,所以③是Cl;④是第四周期第VIIA族元素,所以④是Br,依次作答。
【详解】(1)①是第二周期第VIA族元素,所以①是O;
(2)②是第三周期第IA族元素,所以②是Na,②的基态原子电子排布式[Ne]3s1;
(3)根据分析可知③是Cl,④是Br,根据同主族元素,从上到下,原子半径依次增加,所以Br>Cl;
(4)ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
17.(1)空间运动状态
(2) 球 大 大 哑铃 大 大
【解析】略
18. 橙 紫 同一主族元素从上到下元素原子的得电子能力逐渐减弱 同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱
【详解】向NaBr溶液中加入新制的氯水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈橙色。
向NaI溶液中加入新制的溴水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈紫色。
两个实验说明:同一主族元素从上到下元素原子的得电子能力逐渐减弱。
(3)氯气具有氧化性,能将溴离子氧化为溴单质,溴单质更易溶于四氯化碳中,在有机层显示橙红色;溴单质能将碘离子氧化为碘单质,碘单质单质更易溶于四氯化碳中,在有机层中显示紫红色;
(4)氯气具有氧化性,能将溴离子氧化为溴单质,所以氧化性是氯气强于溴单质,溴单质能将碘离子氧化为碘单质,所以氧化性是溴单质强于碘单质,氧化性越强,元素的非金属性越强,即非金属性:Cl>Br>I,得出同主族元素性质的递变规律:同主族元素性质相似,且从上到下,元素的非金属性逐渐减弱;
(5) ①氯气具有氧化性,能将溴离子氧化为溴单质,2Br-+Cl2=2Cl-+Br2,溴单质能将碘离子氧化为碘单质2I-+Br2=2Br-+I2;
②同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱。
19. A 产生淡黄色沉淀 Na2S+Cl2=2NaCl+S↓ 吸收氯气,防止污染大气 ①③④ 下层为紫色 2I﹣+Cl2=2Cl﹣+I2
【分析】可以从置换反应判断元素非金属性强弱分析,氯气能把硫元素从其硫化钠溶液中置换出来,也可以利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱;结合实验装置,A为氯气发生装置,饱和食盐水的洗气瓶为除去氯气中混有氯化氢的装置,B为性质实验装置,C为尾气吸收装置,据此解答。
【详解】(1)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2﹣═2Cl﹣+S↓;反应中有淡黄色沉淀生产;
故答案为A;产生淡黄色沉淀;Na2S+Cl2=2NaCl+S↓;
(2)氯气为有毒气体,要进行尾气处理,氯气能与氢氧化钠溶液反应,所以装置C中盛放烧碱溶液的作用是吸收氯气,防止污染大气;
故答案为吸收氯气,防止污染大气;
(3)能证明氯元素比硫元素非金属性强的依据①氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强,故正确;②通过最高价含氧酸的酸性可以比较非金属性,不能比较其氧化性,故错误;③S2﹣比Cl﹣还原性强,根据阴离子的还原性越弱非金属性越强来判断,故正确;④氢化物越稳定,非金属性越强,故正确,所以①③④,
故答案为①③④;
(4)氯气与碘化钾反应生成单质碘,加CCl4试剂,溶液会分层,下层为碘单质和CCl4,所以下层呈紫色,其反应的离子方程式为:2I﹣+Cl2=2Cl﹣+I2,
故答案为下层为紫色;2I﹣+Cl2=2Cl﹣+I2。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.错误,违反了泡利不相容原理
B.各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是构造原理
C.的电子排布式违反了洪特规则
D.电子排布式违反了泡利不相容原理
2.下列各项叙述中,错误的是
A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d
B.基态C的电子排布式为1s22s22p 违反了洪特规则
C.基态Sc的电子排布式为1s22s22p63s23p64s3违反了泡利原理
D.硼原子由1s22s22p1s22s22p时,是由基态转化为激发态
3.下列说法正确的是
A.p-pσ键电子云轮廓图
B.基态铜原子的价层电子排布图:
C.的离子结构示意图为:
D.某原子核外电子排布式为,它违背了泡利原理
4.下列说法错误的是
A.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p…
B.1s22s12p1是激发态原子的电子排布式
C.基态溴原子的简化电子排布式是[Ar]3d104s24p5
D.Mg原子的电子排布式为1s22s22p63s2
5.元素周期表长周期共有18个纵列,从左到右排为18列,即碱金属是第1列,稀有气体是第18列。按这种规定,下列说法正确的是
A.第9列元素中可能有非金属元素
B.第15列元素的原子最外层的电子排布是ns2np5
C.最外层电子排布为ns2的元素可能在第2列
D.第11、12列为d区的元素
6.下列描述原子结构的化学用语正确的是
A.碳原子结构示意图:
B.基态铜原子()的价层电子排布式:
C.氧原子核外能量最高的电子云的形状:
D.碳原子核外电子的轨道表示式:
7.下列各基态原子或离子的电子排布式正确的是
A.Si B.Ca
C.Fe D.
8.下列各原子或离子的电子排布式错误的是
A.: B.F:
C.: D.:
9.下列各项叙述错误的是
A.若硫原子核外电子排布图为,则违反了泡利原理
B.若21号Sc元素的基态原子电子排布式为,则违反了构造原理
C.铍原子的核外电子排布图为,符合洪特规则和泡利原理
D.原子的电子排布式由能释放特定能量产生发射光谱
10.第N能层所含能级数、原子轨道数和最多容纳电子数分别为
A.3、32、2× 32 B.4、42、2× 32 C.5、42、5× 32 D.4、42、2× 42
11.下列各组原子中,彼此化学性质一定相似的是
A.最外层都只有一个电子的X、Y原子
B.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
C.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
D.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
12.下面是第二周期部分元素基态原子的电子排布图,据此下列说法错误的是
A.每个原子轨道里最多只能容纳2个电子
B.电子排在同一能级时,总是优先单独占据一个轨道
C.每个能层所具有的能级数等于能层的序数(n)
D.N原子中有5种电子运动状态
13.下列各原子或离子的电子排布式或电子排布图表示正确的是
A.Ca2+:1s22s22p63s23p6
B.F-:1s22s23p6
C.P:最外层电子排布图为
D.Cr:1s22s22p63s23p63d44s2
14.下列说法错误的是
A.电子的能量不一定高于p电子的能量
B.的电子排布式违反了洪特规则
C.电子排布式违反了构造原理
D.电子排布式违反了泡利原理
15.下列基态原子或离子的电子排布式错误的是
A.K:1s22s22p63s23p64s1 B.F-:1s22s22p6
C.S2-:1s22s22p63s23p4 D.Ar: 1s22s22p63s23p6
二、填空题
16.下表列出了①~④四种元素在周期表中的位置.
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ①
3 ② ③
4 ④
回答下列问题:
(1)①的元素符号为_____________。
(2)②的基态原子电子排布式为__________________________。
(3)③和④中原子半径较大的是_____________(填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________形;每个p能级都有_____________个相互垂直的电子云。
17.原子轨道
(1)概念:量子力学把电子在原子核外的一个_______称为一个原子轨道。
(2)形状
①s电子的原子轨道呈_______形,能层序数越_______,原子轨道的半径越_______。
②p电子的原子轨道呈_______形,能层序数越_______,原子轨道的半径越_______。
三、实验题
18.某学生在做同一主族元素性质的递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管。
药品:新制的氯水、新制的溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在表中横线处填写相关内容):
序号 实验方案 实验现象
① 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈__________色
② 向盛有少量碘化钠溶液的试管中滴加少量新制的溴水,振荡,再加入少量四氯化碳,振荡后静置 液体分为两层,下层呈__________色
(4)实验结论:___________。
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为___________、__________。
②请用本章所学内容简单说明得出上述结论的原因_____________。
19.为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置B中盛放的试剂是_____(填选项),实验现象为_____,化学反应方程式是_____.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是_____.
(3)能证明氯元素比硫元素非金属性强的依据为_____. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2﹣比Cl﹣还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象_____,写出反应的离子方程式_____.
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.根据洪特规则:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,因此违反了洪特规则,故A错误;
B.泡利原理是一个原子轨道中,最多只能容纳2个电子,它们自旋相反,因此各能级最多容纳的电子数是该能级原子轨道数的二倍,支持这一结论的理论是泡利原理,故B错误;
C.根据洪特规则,6C的电子排布式,题给电子排布式违反了洪特规则,故C正确;
D.电子排布式(22Ti)违反了能量最低原理,故D错误;
答案为C。
2.D
【详解】A.原子核外的电子总是尽先占有能量最低的轨道,然后依次排到能量较高的轨道,4s轨道能量比3d轨道能量低,原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d,A正确;
B.根据洪特规则,基态C的电子排布式中2p轨道上的两个电子应该排在不同的轨道上,故违反了洪特规则,B正确;
C.根据泡利原理,s能级只有一个轨道,最多只能放入2个电子,基态Sc的电子排布式1s22s22p63s23p64s3违反了泡利原理,C正确;
D.2p轨道能量相同,硼原子由1s22s22p1s22s22p时,并没有转化为激发态,D错误;
故答案为:D。
【点睛】洪特规则是指当电子排布在能量相同的各个轨道时,电子总是尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子能量最低;泡利原理是指不能有两个或两个以上的粒子处于完全相同的状态,也就是一个亚层中最多能有2个电子,其自旋相反。
3.D
【详解】A. 是p-pπ键电子云模型,以“肩并肩”方式形成,呈镜像对称,p-pσ键,原子轨道头碰头方式重叠,电子云图形为,故A错误;
B.Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,价层电子排布式为:3d104s1,电子排布图为:,故B错误;
C.Fe3+离子核内质子数为26,核外各层上电子数分别为2、8、13,结构示意图为,故C错误;
D.泡利原理是指每个轨道最多只能容纳两个自旋相反的电子,而ns2np7的np能级排布了7个电子,故违背了泡利原理,故D正确;
故选:D。
4.A
【详解】A.根据构造原理原子核外电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p,A错误;
B.1s22s2为基态,1s22s12p1为激发态,B正确;
C.基态溴原子的核外有35个电子,分4层排布,基态溴原子的简化电子排布式为[Ar]3d104s24p5,C正确;
D.Mg原子的核外电子数为12,电子排布式为1s22s22p63s2,D正确;
故选A。
5.C
【详解】第9列元素是过渡元素,没有非金属,A项错误;第15列元素的最外层电子排布是ns2np3,B项错误;最外层电子排布为ns2的元素可能为ⅡA族元素也可能是过渡元素或0族元素He,C项正确;11、12列为ds区元素,D项错误
6.C
【详解】A.在原子结构示意图中,圆圈内的质子数应带“+”,则碳原子结构示意图为,A不正确;
B.原子核外电子排布时,需遵循洪特规则,所以基态铜原子()的价层电子排布式不是,而是3d104s1,B不正确;
C.氧原子的电子排布式为1s22s22p4,则核外能量最高的电子云为p电子云,形状为:,C正确;
D.碳原子核外电子排布为1s22s22p2,轨道表示式为,D不正确;
故选C。
7.A
【详解】A.核外有14个电离,根据电子排布规律,电子排布式为:,A正确;
B.原子核外有20个电子,根据构造原理,排布式应该为,B错误;
C.原子有26个电子,根据构造原理,,C错误;
D.的电子排布式为,D错误;
故选B。
8.C
【详解】A.K原子核外电子排布式为,K原子失去最外层1个电子变为,因此核外电子排布式为,故A项正确;
B.F原子核外有9个电子,根据能量最低原理可知F原子核外电子排布式为,故B项正确;
C.S原子核外有16个电子,得到2个电子后变为,根据能量最低原理可知核外电子排布式为,故C项错误;
D.Ar原子核外有18个电子,根据能量最低原理可知原子核外电子排布式为,故D项正确;
综上所述,错误的是C项。
9.A
【详解】A.根据洪特规则,填入简并轨道的电子总是先单独分占且自旋平行,该排布图违反了洪特规则,A错误;
B.根据构造原理,最后两个能级的电子应先填入4s轨道再填入3d轨道,该排布式违反了构造原理,B正确;
C.铍元素原子序数为4,1s、2s能级均只有一个原子轨道,该排布图符合洪特规则与泡利原理,C正确;
D.该变化表示电子从较高能量的激发态跃迁到基态,释放出能量,故会产生发射光谱,D正确;
故选A。
10.D
【详解】第N能级为第4层,含有的轨道能级分别为s、p、 d、f的顺序依次为1、3, 5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子;
故选D。
11.B
【详解】A.最外层只有一个电子的原子的化学性质不一定相同,如H和Na,故A错误;
B.2p轨道上只有2个电子,应是Be,3p轨道上只有2个电子的,应是Mg,它们位于同一主族,化学性质具有相似性,故B正确;
C.原子核外电子排布式为1s2,该元素为He,属于稀有气体元素,原子核外电子排布式为1s22s2的Y原子,该元素为Be,属于金属元素,两者性质不相似,故C错误;
D.原子核外M层上仅有两个电子的X原子,核外电子排布式为1s22s22p63s2,该元素为Mg,原子核外N层上仅有两个电子的Y原子,价电子排布式,可以是4s2、3d64s2、3d74s2、3d84s2、3d104s2,分别是Ca、Fe、Co、Ni、Zn,它们化学性质不一定相似,故D错误;
答案为B。
12.D
【分析】观察题中四种元素的电子排布图,对原子轨道容纳的电子数做出判断,根据洪特规则,可知电子在同一能级的不同轨道时,优先占据一个轨道,任一能级总是从s轨道开始,能层数目即为轨道能级数。
【详解】A. 由题给的四种元素原子的电子排布图可知,在一个原子轨道里,最多能容纳2个电子,符合泡利原理,故A正确;
B. 电子排在同一能级的不同轨道时,总是优先单独占据一个轨道,符合洪特规则,故B正确;
C. 任意能层的能级总是从s能级开始,而且能级数等于该能层序数,故C正确;
D. 原子核外电子运动的能层、能级、轨道都代表电子的运动状态,即使在一个原子轨道的2个电子,其自旋状态相反,故N原子中有7种电子运动状态,故D错误;
答案为D。
13.A
【详解】A.Ca为20号元素,电子排布式为1s22s22p63s23p64s2,则Ca2+的电子排布式为1s22s22p63s23p6,A正确;
B.F为9号元素,F-的核外有10个电子,电子排布式为1s22s22p6,B不正确;
C.P的价电子排布为3s23p3,根据洪特规则,最外层电子排布图为,C不正确;
D.Cr为24号元素,电子排布式为:1s22s22p63s23p63d54s1(应符合洪特规则),D不正确;
故选A。
14.A
【分析】洪特规则:在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,即为洪特规则,又称为最多轨道原理,一般电子总是尽先自旋平行地分占不同轨道。
泡利原理:不能有两个或两个以上的粒子处于完全相同的状态,也就是一个亚层中最多能有2个电子,其自旋相反。
【详解】
A.ns电子的能量一定高于(n-1)p电子的能量,A错误;
B.对于C 原子来说,2p能级有3个能量相同的原子轨道,最后2个电子应以自旋状态相同的方式分布在两个不同的2p轨道上,违反了洪特规则,B正确;
C.根据轨道能量高低顺序可知E4s
故选A。
15.C
【详解】A.K原子核外有19个电子,其基态原子核外电子排布式为:1s22s22p63s23p64s1,故A正确;
B.氟离子核外有10个电子,其基态离子核外电子排布式为:1s22s22p6,故B正确;
C.S离子得到2个电子,核外有18个电子,其基态离子核外电子排布式为:1s22s22p63s23p6,故C错误;
D.Ar原子核外有18个电子,其基态原子核外电子排布式为:1s22s22p63s23p6,故D正确;
故选C。
16.(1)O
(2)[Ne]3s1
(3)Br
(4) 球 3
【分析】①是第二周期第VIA族元素,所以①是O;②是第三周期第IA族元素,所以②是Na;③是第三周期第VIIA族元素,所以③是Cl;④是第四周期第VIIA族元素,所以④是Br,依次作答。
【详解】(1)①是第二周期第VIA族元素,所以①是O;
(2)②是第三周期第IA族元素,所以②是Na,②的基态原子电子排布式[Ne]3s1;
(3)根据分析可知③是Cl,④是Br,根据同主族元素,从上到下,原子半径依次增加,所以Br>Cl;
(4)ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
17.(1)空间运动状态
(2) 球 大 大 哑铃 大 大
【解析】略
18. 橙 紫 同一主族元素从上到下元素原子的得电子能力逐渐减弱 同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱
【详解】向NaBr溶液中加入新制的氯水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈橙色。
向NaI溶液中加入新制的溴水,发生反应,证明氧化性;
再加入后,振荡静置,溶液分层,上层近无色,下层呈紫色。
两个实验说明:同一主族元素从上到下元素原子的得电子能力逐渐减弱。
(3)氯气具有氧化性,能将溴离子氧化为溴单质,溴单质更易溶于四氯化碳中,在有机层显示橙红色;溴单质能将碘离子氧化为碘单质,碘单质单质更易溶于四氯化碳中,在有机层中显示紫红色;
(4)氯气具有氧化性,能将溴离子氧化为溴单质,所以氧化性是氯气强于溴单质,溴单质能将碘离子氧化为碘单质,所以氧化性是溴单质强于碘单质,氧化性越强,元素的非金属性越强,即非金属性:Cl>Br>I,得出同主族元素性质的递变规律:同主族元素性质相似,且从上到下,元素的非金属性逐渐减弱;
(5) ①氯气具有氧化性,能将溴离子氧化为溴单质,2Br-+Cl2=2Cl-+Br2,溴单质能将碘离子氧化为碘单质2I-+Br2=2Br-+I2;
②同一主族元素,各元素原子的最外层电子数相同,从上到下,电子层数依次增多,原子半径依次增大,原子得电子能力逐渐减弱。
19. A 产生淡黄色沉淀 Na2S+Cl2=2NaCl+S↓ 吸收氯气,防止污染大气 ①③④ 下层为紫色 2I﹣+Cl2=2Cl﹣+I2
【分析】可以从置换反应判断元素非金属性强弱分析,氯气能把硫元素从其硫化钠溶液中置换出来,也可以利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱;结合实验装置,A为氯气发生装置,饱和食盐水的洗气瓶为除去氯气中混有氯化氢的装置,B为性质实验装置,C为尾气吸收装置,据此解答。
【详解】(1)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,离子方程式为:Cl2+S2﹣═2Cl﹣+S↓;反应中有淡黄色沉淀生产;
故答案为A;产生淡黄色沉淀;Na2S+Cl2=2NaCl+S↓;
(2)氯气为有毒气体,要进行尾气处理,氯气能与氢氧化钠溶液反应,所以装置C中盛放烧碱溶液的作用是吸收氯气,防止污染大气;
故答案为吸收氯气,防止污染大气;
(3)能证明氯元素比硫元素非金属性强的依据①氯原子比硫原子更容易获得电子形成离子,得电子能力越强非金属性越强,故正确;②通过最高价含氧酸的酸性可以比较非金属性,不能比较其氧化性,故错误;③S2﹣比Cl﹣还原性强,根据阴离子的还原性越弱非金属性越强来判断,故正确;④氢化物越稳定,非金属性越强,故正确,所以①③④,
故答案为①③④;
(4)氯气与碘化钾反应生成单质碘,加CCl4试剂,溶液会分层,下层为碘单质和CCl4,所以下层呈紫色,其反应的离子方程式为:2I﹣+Cl2=2Cl﹣+I2,
故答案为下层为紫色;2I﹣+Cl2=2Cl﹣+I2。
答案第1页,共2页
答案第1页,共2页
