第2章第3节离子键、配位键与金属键同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章第3节离子键、配位键与金属键同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 431.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:26:50 | ||
图片预览




文档简介
第2章第3节离子键、配位键与金属键同步练习
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.Fe为过渡金属元素,在工业生产中具有重要的用途。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)n]SO4,该配合物的中心原子的最外层电子数与配体提供的电子总数之和为26。下列有关说法正确的是
A.该配合物的化学式为[Fe(NO)(H2O)5]SO4
B.该配合物中所含非金属元素均位于元素周期表p区
C.1 mol该配合物与足量Ba(OH)2溶液反应可生成1mol沉淀
D.该配合物中阴阳离子均呈正八面体构型
2.已知:呈粉红色,呈蓝色,为无色。现将溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A.由实验①可推知正反应为放热反应
B.等物质的量的和中σ键数之比为9:2
C.实验②是由于增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:
二、单选题
3.金属原子与形成的配合物称为金属羰基配合物,如羰基铁[化学式为,黄色油状液体,熔点为-21℃、沸点为102.8℃]。金属羰基配合物中每个提供一对电子与金属原子形成配位键,且金属原子的价电子和提供的电子总和等于18。下列说法错误的是
A.中铁的化合价为0 B.属于离子晶体
C.羰基镍的化学式为 D.羰基镍分子中含有配位键、共价键
4.配合物中,中心离子的化合价是
A.+1 B.+2 C.+3 D.无法确定
5.下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A. B.
C. D.
6.近些年来,随着电子信息化技术的不断发展,基于半导体硅晶体的集成电路已接近其物理极限,研究者们提出另一种新思路,即发展分子尺度的电子器件,其中分子导线引起了广泛的关注,下图钉配合物就是一种金属钉(Ru)分子导线,有关说法错误的是
A.该配合物中配位原子为、C、P,配位数为6
B.1mol该配合物有6mol配位键
C.该钌配合物中Si原子的杂化方式为
D.非金属元素电负性大小顺序为
7.二茂铁分子是一种金属有机配合物,二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.二茂铁中与环戊二烯离子()之间为配位键
B.1mol环戊二烯()中含有键的数目为
C.二茂铁分子中存在键
D.二茂铁是离子晶体
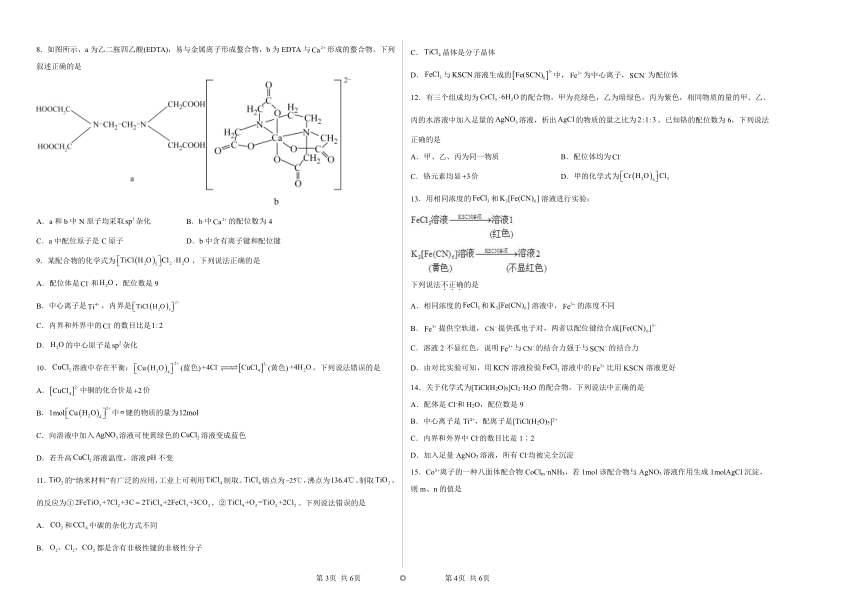
8.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
9.某配合物的化学式为,下列说法正确的是
A.配位体是和,配位数是9
B.中心离子是,内界是
C.内界和外界中的的数目比是
D.的中心原子是杂化
10.溶液中存在平衡:(蓝色)(黄色),下列说法错误的是
A.中铜的化合价是价
B.中键的物质的量为
C.向溶液中加入溶液可使黄绿色的溶液变成蓝色
D.若升高溶液温度,溶液不变
11.的“纳米材料”有广泛的应用,工业上可利用制取。熔点为,沸点为。制取,的反应为①,②。下列说法错误的是
A.和中碳的杂化方式不同
B.都是含有非极性键的非极性分子
C.晶体是分子晶体
D.与溶液生成的中,为中心离子,为配位体
12.有三个组成均为的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,相同物质的量的甲、乙、丙的水溶液中加入足量的溶液,析出的物质的量之比为。已知铬的配位数为6,下列说法正确的是
A.甲、乙、丙为同一物质 B.配位体均为
C.铬元素均显价 D.甲的化学式为
13.用相同浓度的和溶液进行实验:
下列说法不正确的是
A.相同浓度的和溶液中,的浓度不同
B.提供空轨道,提供孤电子对,两者以配位键结合成
C.溶液2不显红色,说明与的结合力强于与的结合力
D.由对比实验可知,用溶液检验溶液中的比用KSCN溶液更好
14.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是
A.配体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
15.Co3+离子的一种八面体配合物CoClm·nNH3,若1mol该配合物与AgNO3溶液作用生成1molAgCl沉淀,则m、n的值是
A.m=3,n=4 B.m=5,n=1 C.m=1,n=5 D.m=4,n=5
三、填空题
16.根据要求完成下列问题:
(1)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___。
(2)下列分子中若有手性原子,请用“*”标出其手性碳原子___、___。
(3)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)__。
(4)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4___H2SO3;HClO3__HClO4;
(5)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为__。
(76)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于__。
17.(1)若与通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤电子对的原子是______。
(2)硼砂是含结晶水的四硼酸钠,其阴离子(含B、O、H三种元素)的球棍模型如图所示:
在中,硼原子轨道的杂化类型有______;配位键存在于______原子之间(填原子的数字标号);______(填数字)。
(3)金属镍在电池、合金、催化剂等方面应用广泛。过渡金属配合物的中心原子价电子数与配位体提供电子总数之和为18,则______。
四、元素或物质推断题
18.元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 A B C D
性质或结构信息 单质制成的高压灯发出的黄光透雾力强、射程远 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 单质在常温、常压下是气体,原子的层有一个未成对的电子 2价阳离子的核外电子排布与氖原子相同
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成,则B为__________元素,中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。
19.现有a~g7种短周期元素,它们在元素周期表中的相对位置如表所示,请回答下列问题:
(1)下列选项中,元素的原子间最容易形成离子键的是___(填序号,下同),元素的原子间最容易形成共价键的是___。
A.c和f B.b和g C.d和g D.c和e
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是___(填序号)。
A.ea3 B.ag C.fg3 D.dg4
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为___。
(4)c与e可形成一种化合物,试写出该化合物的化学式:___,其含有的化学键类型为___,其与过量稀盐酸反应的化学方程式为___。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.AC
【分析】配合物[Fe(NO)(H2O)n]SO4的中心离子的最外层电子数与配体提供的电子总数之和为26,因为中心离子Fe2+的最外层有14个电子(3s23p63d6),配体为NO和H2O,每个配体只提供一对电子,因此,14+2+2n=26,所以n=5。
【详解】A. 由分析可知,n=5,故该配合物的化学式为[Fe(NO)(H2O)5]SO4,A正确;
B. 该配合物所含的非金属元素中,H位于位于元素周期表s区,N、O、S均位于p区,B不正确;
C. [Fe(NO)(H2O)5]SO4属于配合物,其内界[Fe(NO)(H2O)5]2+较稳定,不与Ba(OH)2发生反应,但是其外界中的硫酸根离子可以与Ba(OH)2反应,因此,1 mol该配合物与足量Ba(OH)2溶液反应只能生成1 mol硫酸钡沉淀,C正确;
D. 该配合物中阳离子为[Fe(NO)(H2O)5]2+,中心原子的配位数为6,但是,由于有两种不同的配体,因此其空间构型不可能是正八面体结构,D不正确。
综上所述,正确的是AC。
2.BD
【详解】A.由实验①可知,降低温度,平衡向生成的方向移动,表明逆反应为放热反应,则可推知正反应为吸热反应,A不正确;
B.共价单键和配位键都属于σ键,则等物质的量的和中σ键数之比为18:4=9:2,B正确;
C.因为水是溶剂,所以实验②中加水,不变,但、Cl-、的浓度都减小,平衡向离子浓度增大的方向移动,即平衡逆向移动,C不正确;
D.由实验③可知,加入ZnCl2后,转化为,则表明Zn2+结合Cl-的能力比Co2+ 强,即配离子的稳定性:,D正确;
故选BD。
3.B
【详解】A.在Fe(CO)5中碳是+2价,而氧是-2价,得出铁是0价,故A正确;
B.Fe(CO)5常温下呈液态,熔沸点较低,易溶于非极性溶剂,应为分子晶体,故B错误;
C.Ni是28号元素,价电子数为10,金属原子的价电子和提供的电子总和等于18,所以CO要提供8个电子,每个提供一对电子,则羰基镍的化学式为,故C正确;
D.羰基与镍之间形成配位键,配体中含有共价键,故D正确;
故选B。
4.C
【详解】由化学式可知,硝酸根离子化合价为-1,氯离子化合价为-1,根据化合价代数和为零可知,中心离子的化合价是+3;
故选C。
5.B
【详解】A.由化学式可知,配合物[Co(NH3)4Cl2]Cl的内界为[Co(NH3)4Cl2]+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故A不符合题意;
B.由化学式可知,配合物[Co(NH3)3Cl3]中氯离子与三价钴离子形成配位键,不易电离,则配合物的水溶液中加入硝酸银不能生成氯化银沉淀,故B符合题意;
C.由化学式可知,配合物[Co(NH3)6]Cl3中内界为[Co(NH3)6]3+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故C不符合题意;
D.由化学式可知,配合物[Co(NH3)4Cl]Cl2中内界为[Co(NH3)4Cl]2+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故D不符合题意;
故选B。
6.B
【详解】A.该配合物中配位原子为Cl、C、P,配位数为6,故A正确;
B.该配合物钌原子形成6个配位键,还有,C与O形成了配位键,1mol该物质中有7mol配位键,故B错误;
C.Si原子形成4个共价键,为杂化,故C正确;
D.该物质中,非金属元素电负性大小顺序为,故D正确;
故选:B。
7.D
【详解】A.由二茂铁的熔沸点较低可知二茂铁为分子晶体,亚铁离子提供空轨道,环戊二烯离子()提供孤电子,二者之间形成配位键,A正确;
B.1个环戊二烯()分子中含有键的数目为11,B正确;
C.由题给信息可知二茂铁分子中存在键,C正确;
D.由二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,可知其是分子晶体,D错误;
故选:D。
8.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
9.C
【详解】A.由化学式知,配位体是和,配位数是6,A项错误;
B.由化学式知中心离子是,内界是,B项错误;
C.内界有1个,外界有2个,故数目比是,C项正确;
D.中价电子对数为2+,故中心原子是杂化,D项错误;
故选C。
10.D
【详解】A.由化合价的代数和为0可知,四氯合铜离子中铜元素的化合价为价,故A正确;
B.四水合铜离子中配位键属于σ键,水分子中的氢氧键为σ键,则1mol四水合铜离子中含有σ键的物质的量为12mol,故B正确;
C.向氯化铜溶液中加入硝酸银溶液,氯离子与银离子反应生成氯化银沉淀,氯离子的浓度减小,平衡向逆反应方向移动,四水合铜离子的浓度增大,溶液由黄绿色变成蓝色,故C正确;
D.氯化铜在溶液中的水解反应是吸热反应,升高温度,平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故D错误;
故选D。
11.B
【详解】A.中的C为杂化,中的C为杂化,A项正确;
B.空间结构对称,正、负电荷重心重合,含有极性键,但是非极性分子,B项错误;
C.根据的熔、沸点判断其是分子晶体,C项正确;
D.与溶液生成的中,为中心离子,为配位体,D项正确;
故选:B。
12.C
【分析】已知:Cr3+可形成配位数为6的配合物。组成为CrCl3 6H2O的配合物有3种(甲乙丙),分别呈亮绿色、暗绿色和紫色,为确定这3种配合物的成键情况,分别取等物质的量的甲乙丙紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为2:1:3,则亮绿色配合物的化学式中配体有1个氯离子、5个水分子,则亮绿色配合物的化学式为[CrCl(H2O)5]Cl2 H2O,据此解答即可。
【详解】A.由题意知,甲乙丙分子式相同,结构不同,属于不同的物质,故A错误;
B.由题意知:此配合物中的配位数均是6,故配体除氯离子外,还有水,故B错误;
C.该化合物中铬元素化合价相同,均为+3,故C正确;
D.相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比分别为2:1:3,则绿色配合物的化学式中配体有1个氯离子、5个水分子,则亮绿色配合物的化学式为[CrCl(H2O)5]Cl2 H2O,故D错误;
故选:C。
13.D
【详解】A. 溶液1显红色而溶液2不显红色说明相同浓度的和溶液中的浓度不同,故A正确;
B. Fe的核外电子排布为1s22s22p63s23p63d64s2,Fe3+是失去4s上的电子和3d上的一个电子得到的,其存在空轨道,CN-的电子式为,碳原子提供孤电子对,两者以配位键结合成,故B正确;
C. 溶液2不显红色,说明[Fe(CN)6]3-不会转化为Fe(SCN)3,说明与的结合力强于与的结合力,故C正确;
D. FeCl3溶液为棕黄色,K3[Fe(CN)6]溶液为黄色,若用KCN检验FeCl3溶液现象不明显,因此用KCN溶液检验FeCl3溶液中的Fe3+不如用KSCN溶液好,故D错误;
故选:D。
14.C
【详解】A.配合物[TiCl(H2O)5]Cl2·H2O,配体是Cl-和H2O,配位数是6,故A错误;
B.配合物[TiCl(H2O)5]Cl2·H2O,配离子是[TiCl(H2O)5]2+,中心离子是Ti3+,故B错误;
C.配合物[TiCl(H2O)5]Cl2·H2O,内界配离子是Cl-为1个,外界离子是Cl-为2个,内界和外界中Cl-的数目比是1∶2,故C正确;
D.加入足量AgNO3溶液,外界离子Cl-与Ag+反应,内界配离子不与Ag+反应,故D错误;
答案选C。
15.A
【详解】由1mol配合物生成1molAgCl沉淀,知道1mol配合物电离出1molCl﹣,即配离子显+1价,又因为外界有一个Cl﹣,且Co显+3价,所以[CoClm﹣1 nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4,答案选A。
16. Co3+ CN- 6 第一种分子结构有手性碳原子, 第二种分子结构没有手性碳原子 ①③④⑦ > < sp3 正四面体 V形 水分子之间存在氢键
【详解】(1)由配合物K3[Co(CN)6]结构可知,中心离子为Co3+、配位体是CN-、配位数为6;。
(2)连接4个不同的原子团或原子的碳原子是手性碳原子,图中标“*”为手性碳原子,该结构中碳原子连有相同的原子团或原子,无手性碳原子;
(3)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,对称结构,正负重心重合,为非极性分子;
②NH3中N元素化合价为-3,N原子最外层5个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,对称结构,正负重心重合,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,对称结构,正负重心重合,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,对称结构,正负重心重合,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
由上述分析得,属于非极性分子的是①③④⑦;
(4)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,H2SO4中S元素化合价为+6价,H2SO3中S元素化合价为+4价,故酸性H2SO4>H2SO3,HClO3中Cl元素化合价为+5价,HClO4中Cl元素化合价为+7价,故酸性HClO3<HClO4;
(6)H2S分子价层电子对数=2+=4,有两对孤电子对,则中心原子S原子采取sp3杂化,VSEPR构型为正四面体型,分子的立体构型为V形;
(5)水分子之间存在氢键,沸点高于同族其它元素氢化物,所以H2O的沸点(100℃)比H2S的沸点(-61℃)高。
17. X 、 4、5(或5、4) 2 4
【详解】(1)在分子中B原子最外层的3个电子全部用于成键,所以在该配合物中提供孤电子对的应该是X原子,B原子提供空轨道。
(2)由球棍模型可以看出,2号、4号等半径较大的球为B原子,1号、3号、5号、6号等半径较小的球为O原子,半径最小的球为H原子。2号B原子形成3个键,采取杂化,4号B原子形成4个键,采取杂化;4号B原子的3个杂化轨道与除5号O原子外的3个O原子形成键后还有1个空轨道,而5号O原子能提供孤电子对,二者可以形成配位键;由图示可以看出该阴离子为,其中B为+3价,O为-2价,H为+1价,可知。
(3)基态的价电子排布式为,即中心原子价电子数为10,而每个配位体可提供1对孤电子对,显然。
18. 离子 离子 离子 2F2 + 2H2O=4HF + O2 bd N 共价键、配位键 Na 与水(或酸)反应的剧烈程度(或其它合理答案)
【分析】由四种元素为短周期元素可知,A、B、C、D的原子序数均不大于18。由A单质的用途可知,A为Na元素;由B单质的工业制法及原子结构特点可知,B为N元素或O元素;由C原子的电子排布特点可知C可能为B元素或F元素,又由其物理性质可推断出C为F元素;由D的+2价阳离子的结构特点可知,D为Mg元素。
【详解】(1)A(Na)与Cl形成的化合物为NaCl,是离子化合物,含有离子键。
答案为:离子;离子;
(2)D(Mg)和C(F)形成的化合物是MgF2,是离子化合物,含有离子键。C单质F2能置换水中的O,反应的化学方程式为:2F2 + 2H2O=4HF + O2。
答案为:2F2 + 2H2O=4HF + O2;
(3)a. O元素或N元素均无+6价,故a项错误;
b. 由于B的常见单质为N2或O2,O2、N2在常温常压下均难溶于水,故b项正确;
c. O2分子中含有16个电子,N2分子中含有14个电子,故c项错误;
d. 在一定条件下镁条能与B的常见单质反应:2Mg + O2 MgO,N2 + 3Mg Mg3N2,故d项正确。
答案为:bd;
(4)由意知B为N元素,NH4+中含有的化学键为共价键和配位键。
答案为:N;共价键、配位键;
(5)根据金属活动性顺序或元素周期表均可判断:A(Na)和D(Mg)两元素中金属性较强的是Na;比较金属性强弱的依据有:①与水(或酸)反应的剧烈程度;②最高价氧化物对应水化物的碱性强弱;金属间的置换反应等。
答案为:Na;与水(或酸)反应的剧烈程度(或其它合理答案)。
【点睛】金属性强弱的判断方法:
(1)根据金属活动性顺序进行判断;
(2)根据元素周期表进行判断,同周期元素从左向右金属性减弱,同主族元素自上而下金属性增强;
(3)根据金属阳离子的氧化性强弱判断,一般情况下,金属阳离子的氧化性越弱,对应元素的金属性越强。特例:三价铁离子的氧化性强于二价铜离子;
(4)根据金属间的置换反应判断。遵循强制弱的规律;
(5)根据最高价氧化物对应水化物的碱性强弱来判断,碱性越强,对应元素的金属性越强;
(6)根据原电池的正负极判断,一般情况下,金属性强的作负极。
19. B C CD Mg3N2 离子键 Mg3N2+8HCl=3MgCl2+2NH4Cl
【分析】首先确定a~g的7种元素具体是什么元素,
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(2)根据各分子中非金属元素的原子形成的共用电子对情况分析;
(3)3种非金属元素形成的AB型离子化合物是NH4Cl;
(4)根据化合物中的成键元素来判断化学键类型,并根据物质的性质来书写方程式。
【详解】根据元素在元素周期表中的相对位置可知a、b、c、d、e、f、g分别为H、Na、Mg、C、N、P、Cl,
(1)碱金属元素原子与卤素原子间最容易形成离子键,故Na与Cl最容易形成离子键,故B符合;c为金属元素,不容易与其他元素形成共价键,非金属元素间一般形成共价键,则C与Cl之间最容易形成共价键,故C符合,故答案为:B;C;
(2)各选项对应的分子分别为NH3、HCl、PCl3、CCl4,其中NH3、HCl中由于氢形成的是2电子稳定结构,故不符合题意;而PCl3中,磷原子核外最外层电子数为5,它与氯原子形成共价键时,构成PCl3中的磷原子、氯原子最外层都达到8电子结构,同理,CCl4亦符合题意,故答案为:CD;
(3)3种非金属元素形成的AB型离子化合物是NH4Cl,其电子式为 ,故答案为: ;
(4)Mg与N形成离子化合物Mg3N2,该物质与过量稀盐酸反应生成MgCl2和NH4Cl,故答案为:Mg3N2;离子键;Mg3N2+8HCl=3MgCl2+2NH4Cl。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.Fe为过渡金属元素,在工业生产中具有重要的用途。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)n]SO4,该配合物的中心原子的最外层电子数与配体提供的电子总数之和为26。下列有关说法正确的是
A.该配合物的化学式为[Fe(NO)(H2O)5]SO4
B.该配合物中所含非金属元素均位于元素周期表p区
C.1 mol该配合物与足量Ba(OH)2溶液反应可生成1mol沉淀
D.该配合物中阴阳离子均呈正八面体构型
2.已知:呈粉红色,呈蓝色,为无色。现将溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
A.由实验①可推知正反应为放热反应
B.等物质的量的和中σ键数之比为9:2
C.实验②是由于增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:
二、单选题
3.金属原子与形成的配合物称为金属羰基配合物,如羰基铁[化学式为,黄色油状液体,熔点为-21℃、沸点为102.8℃]。金属羰基配合物中每个提供一对电子与金属原子形成配位键,且金属原子的价电子和提供的电子总和等于18。下列说法错误的是
A.中铁的化合价为0 B.属于离子晶体
C.羰基镍的化学式为 D.羰基镍分子中含有配位键、共价键
4.配合物中,中心离子的化合价是
A.+1 B.+2 C.+3 D.无法确定
5.下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A. B.
C. D.
6.近些年来,随着电子信息化技术的不断发展,基于半导体硅晶体的集成电路已接近其物理极限,研究者们提出另一种新思路,即发展分子尺度的电子器件,其中分子导线引起了广泛的关注,下图钉配合物就是一种金属钉(Ru)分子导线,有关说法错误的是
A.该配合物中配位原子为、C、P,配位数为6
B.1mol该配合物有6mol配位键
C.该钌配合物中Si原子的杂化方式为
D.非金属元素电负性大小顺序为
7.二茂铁分子是一种金属有机配合物,二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.二茂铁中与环戊二烯离子()之间为配位键
B.1mol环戊二烯()中含有键的数目为
C.二茂铁分子中存在键
D.二茂铁是离子晶体
8.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
9.某配合物的化学式为,下列说法正确的是
A.配位体是和,配位数是9
B.中心离子是,内界是
C.内界和外界中的的数目比是
D.的中心原子是杂化
10.溶液中存在平衡:(蓝色)(黄色),下列说法错误的是
A.中铜的化合价是价
B.中键的物质的量为
C.向溶液中加入溶液可使黄绿色的溶液变成蓝色
D.若升高溶液温度,溶液不变
11.的“纳米材料”有广泛的应用,工业上可利用制取。熔点为,沸点为。制取,的反应为①,②。下列说法错误的是
A.和中碳的杂化方式不同
B.都是含有非极性键的非极性分子
C.晶体是分子晶体
D.与溶液生成的中,为中心离子,为配位体
12.有三个组成均为的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,相同物质的量的甲、乙、丙的水溶液中加入足量的溶液,析出的物质的量之比为。已知铬的配位数为6,下列说法正确的是
A.甲、乙、丙为同一物质 B.配位体均为
C.铬元素均显价 D.甲的化学式为
13.用相同浓度的和溶液进行实验:
下列说法不正确的是
A.相同浓度的和溶液中,的浓度不同
B.提供空轨道,提供孤电子对,两者以配位键结合成
C.溶液2不显红色,说明与的结合力强于与的结合力
D.由对比实验可知,用溶液检验溶液中的比用KSCN溶液更好
14.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是
A.配体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中Cl-的数目比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
15.Co3+离子的一种八面体配合物CoClm·nNH3,若1mol该配合物与AgNO3溶液作用生成1molAgCl沉淀,则m、n的值是
A.m=3,n=4 B.m=5,n=1 C.m=1,n=5 D.m=4,n=5
三、填空题
16.根据要求完成下列问题:
(1)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___。
(2)下列分子中若有手性原子,请用“*”标出其手性碳原子___、___。
(3)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填编号)__。
(4)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4___H2SO3;HClO3__HClO4;
(5)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为__。
(76)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于__。
17.(1)若与通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤电子对的原子是______。
(2)硼砂是含结晶水的四硼酸钠,其阴离子(含B、O、H三种元素)的球棍模型如图所示:
在中,硼原子轨道的杂化类型有______;配位键存在于______原子之间(填原子的数字标号);______(填数字)。
(3)金属镍在电池、合金、催化剂等方面应用广泛。过渡金属配合物的中心原子价电子数与配位体提供电子总数之和为18,则______。
四、元素或物质推断题
18.元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 A B C D
性质或结构信息 单质制成的高压灯发出的黄光透雾力强、射程远 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 单质在常温、常压下是气体,原子的层有一个未成对的电子 2价阳离子的核外电子排布与氖原子相同
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成,则B为__________元素,中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。
19.现有a~g7种短周期元素,它们在元素周期表中的相对位置如表所示,请回答下列问题:
(1)下列选项中,元素的原子间最容易形成离子键的是___(填序号,下同),元素的原子间最容易形成共价键的是___。
A.c和f B.b和g C.d和g D.c和e
(2)下列由a~g7种元素原子形成的各种分子中,所有原子最外层都满足8电子稳定结构的是___(填序号)。
A.ea3 B.ag C.fg3 D.dg4
(3)由题述元素中的3种非金属元素形成的AB型离子化合物的电子式为___。
(4)c与e可形成一种化合物,试写出该化合物的化学式:___,其含有的化学键类型为___,其与过量稀盐酸反应的化学方程式为___。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.AC
【分析】配合物[Fe(NO)(H2O)n]SO4的中心离子的最外层电子数与配体提供的电子总数之和为26,因为中心离子Fe2+的最外层有14个电子(3s23p63d6),配体为NO和H2O,每个配体只提供一对电子,因此,14+2+2n=26,所以n=5。
【详解】A. 由分析可知,n=5,故该配合物的化学式为[Fe(NO)(H2O)5]SO4,A正确;
B. 该配合物所含的非金属元素中,H位于位于元素周期表s区,N、O、S均位于p区,B不正确;
C. [Fe(NO)(H2O)5]SO4属于配合物,其内界[Fe(NO)(H2O)5]2+较稳定,不与Ba(OH)2发生反应,但是其外界中的硫酸根离子可以与Ba(OH)2反应,因此,1 mol该配合物与足量Ba(OH)2溶液反应只能生成1 mol硫酸钡沉淀,C正确;
D. 该配合物中阳离子为[Fe(NO)(H2O)5]2+,中心原子的配位数为6,但是,由于有两种不同的配体,因此其空间构型不可能是正八面体结构,D不正确。
综上所述,正确的是AC。
2.BD
【详解】A.由实验①可知,降低温度,平衡向生成的方向移动,表明逆反应为放热反应,则可推知正反应为吸热反应,A不正确;
B.共价单键和配位键都属于σ键,则等物质的量的和中σ键数之比为18:4=9:2,B正确;
C.因为水是溶剂,所以实验②中加水,不变,但、Cl-、的浓度都减小,平衡向离子浓度增大的方向移动,即平衡逆向移动,C不正确;
D.由实验③可知,加入ZnCl2后,转化为,则表明Zn2+结合Cl-的能力比Co2+ 强,即配离子的稳定性:,D正确;
故选BD。
3.B
【详解】A.在Fe(CO)5中碳是+2价,而氧是-2价,得出铁是0价,故A正确;
B.Fe(CO)5常温下呈液态,熔沸点较低,易溶于非极性溶剂,应为分子晶体,故B错误;
C.Ni是28号元素,价电子数为10,金属原子的价电子和提供的电子总和等于18,所以CO要提供8个电子,每个提供一对电子,则羰基镍的化学式为,故C正确;
D.羰基与镍之间形成配位键,配体中含有共价键,故D正确;
故选B。
4.C
【详解】由化学式可知,硝酸根离子化合价为-1,氯离子化合价为-1,根据化合价代数和为零可知,中心离子的化合价是+3;
故选C。
5.B
【详解】A.由化学式可知,配合物[Co(NH3)4Cl2]Cl的内界为[Co(NH3)4Cl2]+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故A不符合题意;
B.由化学式可知,配合物[Co(NH3)3Cl3]中氯离子与三价钴离子形成配位键,不易电离,则配合物的水溶液中加入硝酸银不能生成氯化银沉淀,故B符合题意;
C.由化学式可知,配合物[Co(NH3)6]Cl3中内界为[Co(NH3)6]3+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故C不符合题意;
D.由化学式可知,配合物[Co(NH3)4Cl]Cl2中内界为[Co(NH3)4Cl]2+、外界为氯离子,则配合物的水溶液中加入硝酸银能生成氯化银沉淀,故D不符合题意;
故选B。
6.B
【详解】A.该配合物中配位原子为Cl、C、P,配位数为6,故A正确;
B.该配合物钌原子形成6个配位键,还有,C与O形成了配位键,1mol该物质中有7mol配位键,故B错误;
C.Si原子形成4个共价键,为杂化,故C正确;
D.该物质中,非金属元素电负性大小顺序为,故D正确;
故选:B。
7.D
【详解】A.由二茂铁的熔沸点较低可知二茂铁为分子晶体,亚铁离子提供空轨道,环戊二烯离子()提供孤电子,二者之间形成配位键,A正确;
B.1个环戊二烯()分子中含有键的数目为11,B正确;
C.由题给信息可知二茂铁分子中存在键,C正确;
D.由二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,可知其是分子晶体,D错误;
故选:D。
8.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
9.C
【详解】A.由化学式知,配位体是和,配位数是6,A项错误;
B.由化学式知中心离子是,内界是,B项错误;
C.内界有1个,外界有2个,故数目比是,C项正确;
D.中价电子对数为2+,故中心原子是杂化,D项错误;
故选C。
10.D
【详解】A.由化合价的代数和为0可知,四氯合铜离子中铜元素的化合价为价,故A正确;
B.四水合铜离子中配位键属于σ键,水分子中的氢氧键为σ键,则1mol四水合铜离子中含有σ键的物质的量为12mol,故B正确;
C.向氯化铜溶液中加入硝酸银溶液,氯离子与银离子反应生成氯化银沉淀,氯离子的浓度减小,平衡向逆反应方向移动,四水合铜离子的浓度增大,溶液由黄绿色变成蓝色,故C正确;
D.氯化铜在溶液中的水解反应是吸热反应,升高温度,平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故D错误;
故选D。
11.B
【详解】A.中的C为杂化,中的C为杂化,A项正确;
B.空间结构对称,正、负电荷重心重合,含有极性键,但是非极性分子,B项错误;
C.根据的熔、沸点判断其是分子晶体,C项正确;
D.与溶液生成的中,为中心离子,为配位体,D项正确;
故选:B。
12.C
【分析】已知:Cr3+可形成配位数为6的配合物。组成为CrCl3 6H2O的配合物有3种(甲乙丙),分别呈亮绿色、暗绿色和紫色,为确定这3种配合物的成键情况,分别取等物质的量的甲乙丙紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为2:1:3,则亮绿色配合物的化学式中配体有1个氯离子、5个水分子,则亮绿色配合物的化学式为[CrCl(H2O)5]Cl2 H2O,据此解答即可。
【详解】A.由题意知,甲乙丙分子式相同,结构不同,属于不同的物质,故A错误;
B.由题意知:此配合物中的配位数均是6,故配体除氯离子外,还有水,故B错误;
C.该化合物中铬元素化合价相同,均为+3,故C正确;
D.相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比分别为2:1:3,则绿色配合物的化学式中配体有1个氯离子、5个水分子,则亮绿色配合物的化学式为[CrCl(H2O)5]Cl2 H2O,故D错误;
故选:C。
13.D
【详解】A. 溶液1显红色而溶液2不显红色说明相同浓度的和溶液中的浓度不同,故A正确;
B. Fe的核外电子排布为1s22s22p63s23p63d64s2,Fe3+是失去4s上的电子和3d上的一个电子得到的,其存在空轨道,CN-的电子式为,碳原子提供孤电子对,两者以配位键结合成,故B正确;
C. 溶液2不显红色,说明[Fe(CN)6]3-不会转化为Fe(SCN)3,说明与的结合力强于与的结合力,故C正确;
D. FeCl3溶液为棕黄色,K3[Fe(CN)6]溶液为黄色,若用KCN检验FeCl3溶液现象不明显,因此用KCN溶液检验FeCl3溶液中的Fe3+不如用KSCN溶液好,故D错误;
故选:D。
14.C
【详解】A.配合物[TiCl(H2O)5]Cl2·H2O,配体是Cl-和H2O,配位数是6,故A错误;
B.配合物[TiCl(H2O)5]Cl2·H2O,配离子是[TiCl(H2O)5]2+,中心离子是Ti3+,故B错误;
C.配合物[TiCl(H2O)5]Cl2·H2O,内界配离子是Cl-为1个,外界离子是Cl-为2个,内界和外界中Cl-的数目比是1∶2,故C正确;
D.加入足量AgNO3溶液,外界离子Cl-与Ag+反应,内界配离子不与Ag+反应,故D错误;
答案选C。
15.A
【详解】由1mol配合物生成1molAgCl沉淀,知道1mol配合物电离出1molCl﹣,即配离子显+1价,又因为外界有一个Cl﹣,且Co显+3价,所以[CoClm﹣1 nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4,答案选A。
16. Co3+ CN- 6 第一种分子结构有手性碳原子, 第二种分子结构没有手性碳原子 ①③④⑦ > < sp3 正四面体 V形 水分子之间存在氢键
【详解】(1)由配合物K3[Co(CN)6]结构可知,中心离子为Co3+、配位体是CN-、配位数为6;。
(2)连接4个不同的原子团或原子的碳原子是手性碳原子,图中标“*”为手性碳原子,该结构中碳原子连有相同的原子团或原子,无手性碳原子;
(3)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,对称结构,正负重心重合,为非极性分子;
②NH3中N元素化合价为-3,N原子最外层5个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,对称结构,正负重心重合,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,对称结构,正负重心重合,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,对称结构,正负重心重合,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,不对称结构,正负重心不重合,为极性分子;
由上述分析得,属于非极性分子的是①③④⑦;
(4)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,H2SO4中S元素化合价为+6价,H2SO3中S元素化合价为+4价,故酸性H2SO4>H2SO3,HClO3中Cl元素化合价为+5价,HClO4中Cl元素化合价为+7价,故酸性HClO3<HClO4;
(6)H2S分子价层电子对数=2+=4,有两对孤电子对,则中心原子S原子采取sp3杂化,VSEPR构型为正四面体型,分子的立体构型为V形;
(5)水分子之间存在氢键,沸点高于同族其它元素氢化物,所以H2O的沸点(100℃)比H2S的沸点(-61℃)高。
17. X 、 4、5(或5、4) 2 4
【详解】(1)在分子中B原子最外层的3个电子全部用于成键,所以在该配合物中提供孤电子对的应该是X原子,B原子提供空轨道。
(2)由球棍模型可以看出,2号、4号等半径较大的球为B原子,1号、3号、5号、6号等半径较小的球为O原子,半径最小的球为H原子。2号B原子形成3个键,采取杂化,4号B原子形成4个键,采取杂化;4号B原子的3个杂化轨道与除5号O原子外的3个O原子形成键后还有1个空轨道,而5号O原子能提供孤电子对,二者可以形成配位键;由图示可以看出该阴离子为,其中B为+3价,O为-2价,H为+1价,可知。
(3)基态的价电子排布式为,即中心原子价电子数为10,而每个配位体可提供1对孤电子对,显然。
18. 离子 离子 离子 2F2 + 2H2O=4HF + O2 bd N 共价键、配位键 Na 与水(或酸)反应的剧烈程度(或其它合理答案)
【分析】由四种元素为短周期元素可知,A、B、C、D的原子序数均不大于18。由A单质的用途可知,A为Na元素;由B单质的工业制法及原子结构特点可知,B为N元素或O元素;由C原子的电子排布特点可知C可能为B元素或F元素,又由其物理性质可推断出C为F元素;由D的+2价阳离子的结构特点可知,D为Mg元素。
【详解】(1)A(Na)与Cl形成的化合物为NaCl,是离子化合物,含有离子键。
答案为:离子;离子;
(2)D(Mg)和C(F)形成的化合物是MgF2,是离子化合物,含有离子键。C单质F2能置换水中的O,反应的化学方程式为:2F2 + 2H2O=4HF + O2。
答案为:2F2 + 2H2O=4HF + O2;
(3)a. O元素或N元素均无+6价,故a项错误;
b. 由于B的常见单质为N2或O2,O2、N2在常温常压下均难溶于水,故b项正确;
c. O2分子中含有16个电子,N2分子中含有14个电子,故c项错误;
d. 在一定条件下镁条能与B的常见单质反应:2Mg + O2 MgO,N2 + 3Mg Mg3N2,故d项正确。
答案为:bd;
(4)由意知B为N元素,NH4+中含有的化学键为共价键和配位键。
答案为:N;共价键、配位键;
(5)根据金属活动性顺序或元素周期表均可判断:A(Na)和D(Mg)两元素中金属性较强的是Na;比较金属性强弱的依据有:①与水(或酸)反应的剧烈程度;②最高价氧化物对应水化物的碱性强弱;金属间的置换反应等。
答案为:Na;与水(或酸)反应的剧烈程度(或其它合理答案)。
【点睛】金属性强弱的判断方法:
(1)根据金属活动性顺序进行判断;
(2)根据元素周期表进行判断,同周期元素从左向右金属性减弱,同主族元素自上而下金属性增强;
(3)根据金属阳离子的氧化性强弱判断,一般情况下,金属阳离子的氧化性越弱,对应元素的金属性越强。特例:三价铁离子的氧化性强于二价铜离子;
(4)根据金属间的置换反应判断。遵循强制弱的规律;
(5)根据最高价氧化物对应水化物的碱性强弱来判断,碱性越强,对应元素的金属性越强;
(6)根据原电池的正负极判断,一般情况下,金属性强的作负极。
19. B C CD Mg3N2 离子键 Mg3N2+8HCl=3MgCl2+2NH4Cl
【分析】首先确定a~g的7种元素具体是什么元素,
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(2)根据各分子中非金属元素的原子形成的共用电子对情况分析;
(3)3种非金属元素形成的AB型离子化合物是NH4Cl;
(4)根据化合物中的成键元素来判断化学键类型,并根据物质的性质来书写方程式。
【详解】根据元素在元素周期表中的相对位置可知a、b、c、d、e、f、g分别为H、Na、Mg、C、N、P、Cl,
(1)碱金属元素原子与卤素原子间最容易形成离子键,故Na与Cl最容易形成离子键,故B符合;c为金属元素,不容易与其他元素形成共价键,非金属元素间一般形成共价键,则C与Cl之间最容易形成共价键,故C符合,故答案为:B;C;
(2)各选项对应的分子分别为NH3、HCl、PCl3、CCl4,其中NH3、HCl中由于氢形成的是2电子稳定结构,故不符合题意;而PCl3中,磷原子核外最外层电子数为5,它与氯原子形成共价键时,构成PCl3中的磷原子、氯原子最外层都达到8电子结构,同理,CCl4亦符合题意,故答案为:CD;
(3)3种非金属元素形成的AB型离子化合物是NH4Cl,其电子式为 ,故答案为: ;
(4)Mg与N形成离子化合物Mg3N2,该物质与过量稀盐酸反应生成MgCl2和NH4Cl,故答案为:Mg3N2;离子键;Mg3N2+8HCl=3MgCl2+2NH4Cl。
答案第1页,共2页
答案第1页,共2页
