第3章不同聚集状态的物质与性质单元测试 (含解析)高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章不同聚集状态的物质与性质单元测试 (含解析)高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 914.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 13:52:57 | ||
图片预览


文档简介
第3章 不同聚集状态的物质与性质检测题
一、单选题
1.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
2.下列说法正确的是
A.铍原子最外层原子轨道的电子云图:
B.热稳定性:
C. ,该电子排布图违背了泡利原理
D. 该有机物的系统命名为:2—甲基—1—丙醇
3.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
4.下列排序正确的是
A.熔点:碳化硅>硅>锗
B.分解温度:
C.酸性:
D.键角:
5.下列物质具有自范性、各向异性的是
A.钢化玻璃 B.塑料 C.水晶 D.陶瓷
6.下列说法不正确的是
A.NaCl和晶体所含化学键的类型相同
B.和是同素异形体
C.干冰、二氧化硅均属于原子晶体
D.合成纤维是一类高分子化合物
7.三氟化氮()和六氟化硫()都是微电子工业中的优良蚀刻剂,随着纳米技术及电子工业的发展,它们的需求量日益增加。下列说法正确的是
A.是含有极性键的非极性分子 B.三氟化磷的沸点低于三氟化氮
C.第一电离能: D.三氟化氮和甲烷中N、C的杂化方式不同
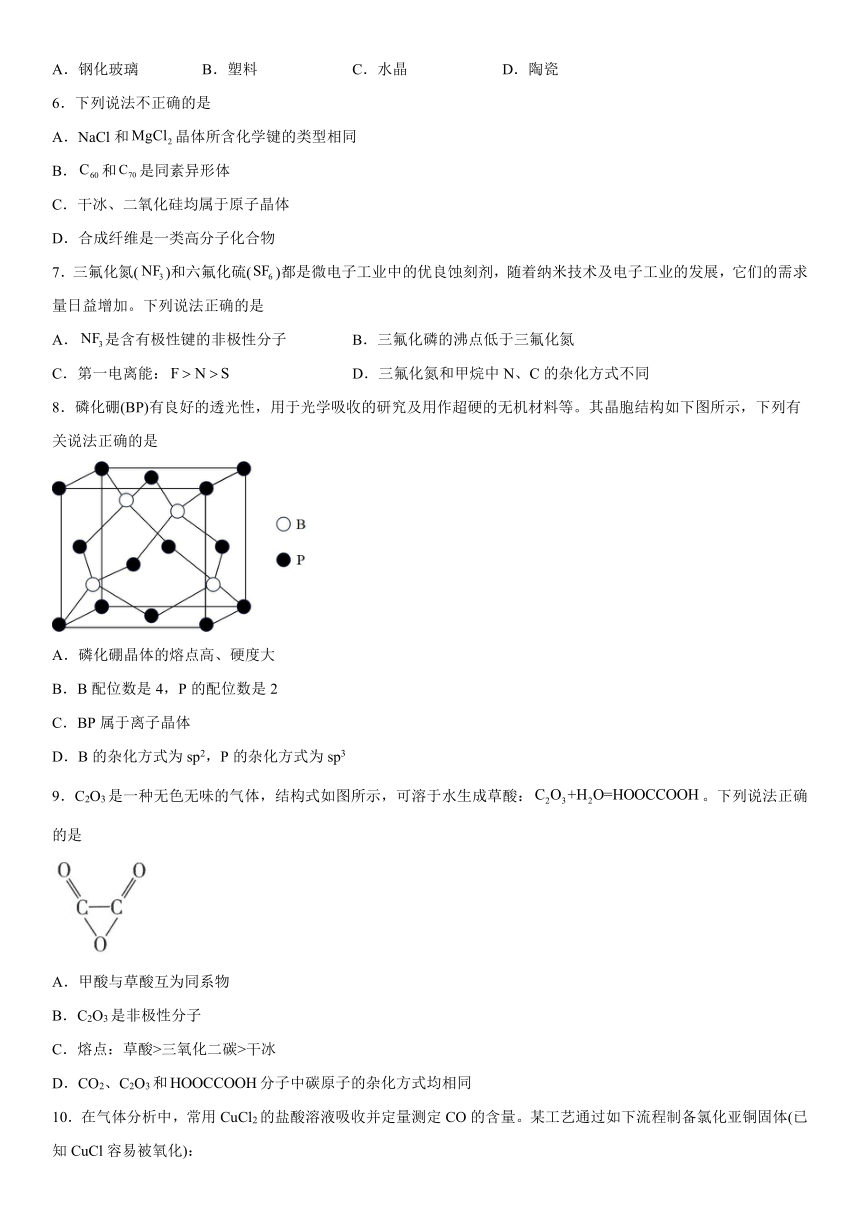
8.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
9.C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:。下列说法正确的是
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.熔点:草酸>三氧化二碳>干冰
D.CO2、C2O3和分子中碳原子的杂化方式均相同
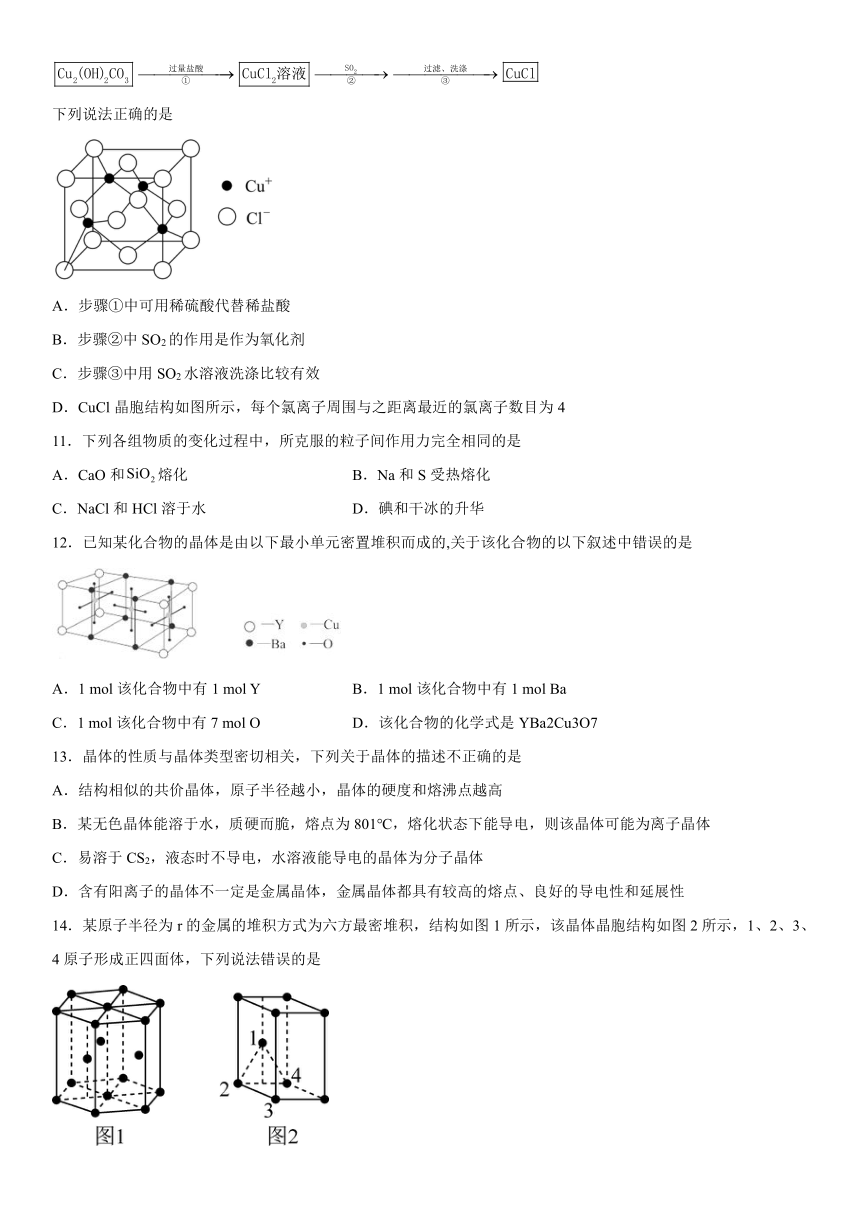
10.在气体分析中,常用CuCl2的盐酸溶液吸收并定量测定CO的含量。某工艺通过如下流程制备氯化亚铜固体(已知CuCl容易被氧化):
下列说法正确的是
A.步骤①中可用稀硫酸代替稀盐酸
B.步骤②中SO2的作用是作为氧化剂
C.步骤③中用SO2水溶液洗涤比较有效
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
11.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
12.已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是
A.1 mol该化合物中有1 mol Y B.1 mol该化合物中有1 mol Ba
C.1 mol该化合物中有7 mol O D.该化合物的化学式是YBa2Cu3O7
13.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
14.某原子半径为r的金属的堆积方式为六方最密堆积,结构如图1所示,该晶体晶胞结构如图2所示,1、2、3、4原子形成正四面体,下列说法错误的是
A.该晶胞中含有的金属原子数目为2 B.该晶胞的高为
C.图1结构中含3个晶胞 D.该晶胞的空间利用率为
15.几种物质的熔点和沸点的数据如表,下列有关判断错误的是
NaCl MgCl2 AlCl3 SiCl4 单质M
熔点/℃ 801 712 190 -70 2300
沸点/℃ 1465 1412 178 57.6 2500
注:AlCl3的熔点在2.02×105Pa条件下测定。A.常温下,SiCl4为液态 B.单质M可能是共价晶体
C.熔沸点:MgOMgCl2
二、填空题
16.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________,与K紧邻的O个数为___________。
(2)在晶胞结构的另一种表示中,Ⅰ处于各顶角位置,则K处于___________位置,O处于___________位置。
17.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
18.试从结构的角度分析下列问题的主要原因。
(1)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂________。
(2)离子晶体中不存在单个的分子_______________。
19.氮及其化合物与人类生产、生活息息相关,其中尿素()是人类最早合成的有机物。
(1)尿素分子中,C、N、O的第一电离能由大到小的顺序是_______(用元素符号表示),基态N原子的核外电子的空间运动状态有_______种。
(2)三氟化氨、四氟化碳是常见的芯片蚀刻剂。分子的空间构型为_______。
(3)的沸点由高到低的顺序为_______,键角由大到小的顺序为_______。
(4)叠氨化钠可以用于汽车安全气囊。与相比,的熔点_______的熔点(填“大于”或“小于”)。
20.某种含B和N两种元素的功能陶瓷,其晶胞结构示意图如图所示。请计算每个晶胞中含有B原子的个数_______,并确定该功能陶瓷的化学式_______。
21.Eu、Ti和O形成一种化合物,其晶胞为如图所示的立方体。
(1)Eu是镧系元素,位于元素周期表的_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)在该晶胞中,Eu、Ti、O的粒子个数比是_______。
(3)若将Ti原子置于立方体的体心,Eu原子置于立方体顶角,则O原子处于立方体的_______位置。
A.体心 B.面心 C.棱心 D.顶角
(4)1个Eu原子和_______个O原子相邻,1个Ti原子和_______个O原子相邻。1个O原子和_______个Eu原子相邻,1个O原子和_______个Ti原子相邻。
22.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为acm,为阿伏加德罗常数的值,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______。
23.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
24.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
25.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
参考答案:
1.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
2.B
【解析】A.铍原子最外层为2s能级,s能级的电子云图为球形为 ,故A错误;
B.三种物质的阴离子是相同的,均为碳酸根,Ca2+、Sr2+、Ba2+为同主族元素的金属阳离子,从上到下,离子半径逐渐增大,阳离子的半径越大,结合碳酸根中的氧离子越容易,分解温度越高,则热稳定性为,故B正确;
C.由洪特规则可知,在2p轨道上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则电子排布图违背了洪特规则,故C错误;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选B。
3.A
【解析】A.Al元素为13号元素,原子核外有13个电子,所以核外电子排布式为:1s22s22p63s23p1,故A错误;
B.晶体中Al位于顶点和面心,与Al距离最近且相等的Al有12个,故B正确;
C.该晶胞中,Li个数=12×+1=4,Al的个数=8×+6×=4,Si的个数=4,所以Li、Al、Si原子个数比为1:1:1,故C正确;
D.根据图知,每个Al原子连接4个相同的Si原子,Al原子与Si原子之间的最短距离为,故D正确;
故选:A。
4.A
【解析】A.因为原子半径C硅>锗,A正确;
B.碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,热分解温度: MgCO3C.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,故酸性,C错误;
D.为直线形结构,键角为1800,水为V型分子,键角为1050,氨气为三角锥型,键角为1070,所以键角大小,D错误;
故选A。
5.C
【解析】晶体具有自范性和各向异性,钢化玻璃、塑料、陶瓷均不属于晶体,水晶属于晶体,故选:C。
6.C
【解析】A.NaCl、MgCl2均为离子化合物,只含离子键,A正确;
B.C60、C70为碳元素的不同单质,互为同素异形体,B正确;
C.干冰(CO2)由分子构成,属于分子晶体,SiO2由原子构成,属于原子晶体,C错误;
D.合成纤维、合成树脂、合成橡胶属于三大合成高分子材料,D正确;
故答案选C。
7.C
【解析】A.的中心原子N原子的价层电子对数为3+=4,NF3为三角锥形结构,故为含有极性键的极性分子,而价层电子对数为6+=6,SF6是正八面体结构,其为含有极性键的非极性分子,A错误;
B.F3和PF3均为分子晶体,二者均为三角锥形构型,且NF3的相对分子质量小于PF3的相对分子质量,故NF3的分子间作用力小于PF3的,则三氟化氮的沸点低于三氟化磷,,B错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,第一电离能:,C正确;
D.的中心原子N原子的价层电子对数为3+=4,则N原子的杂化方式为sp3,CH4中心原子上价层电子对数为:4+=4,则C原子的杂化方式为sp3,故三氟化氮和甲烷中的N、C杂化方式相同,D错误;
故选C。
8.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
9.C
【解析】A.结构相似、分子组成上相差1个或若干个原子团的化合物互为同系物,甲酸()与草酸()不符合要求,不互为同系物,A错误;
B.由题图可知正电中心和负电中心不重合,是极性分子,B错误;
C.草酸分子间能形成氢键,而不能,故草酸熔点比高,相对分子质量比小,因此熔点低于,熔点:草酸>三氧化二碳>干冰,C正确;
D.中碳原子的杂化方式为,中碳原子的杂化方式为,分子中碳原子的杂化方式为,杂化方式不完全相同,D错误。
故选C。
10.C
【解析】Cu2(OH)2CO3与过量盐酸反应得到CuCl2的盐酸溶液,再通入SO2还原,过滤、洗涤得到CuCl固体。
【解析】A.步骤①中可用稀硫酸代替稀盐酸则得不到CuCl2的盐酸溶液,最终也得不到氯化亚铜固体,A错误;
B.根据Cu元素化合价的变化:从+2降低+1,可知其被还原,故步骤②中SO2的作用是作为还原剂,B错误;
C.由于CuCl容易被氧化,在步骤③中用SO2水溶液洗涤可防止CuCl被氧化,C正确;
D.从CuCl晶胞结构图可知,氯离子位于立方晶胞顶点和面心,故每个氯离子周围与之距离最近的氯离子数目为,D错误;
故选C。
11.D
【解析】A.氧化钙是离子晶体,熔化时所克服的粒子间作用力为离子键,二氧化硅是原子晶体,熔化时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故A错误;
B.钠是金属晶体,受热熔化时所克服的粒子间作用力为金属键,硫是分子晶体,受热熔化时所克服的粒子间作用力为分子间作用力,两者所克服的粒子间作用力不同,故B错误;
C.氯化钠是离子晶体,溶于水时所克服的粒子间作用力为离子键,氯化氢是分子晶体,溶于水时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故C错误;
D.碘和干冰都是分子晶体,升华时所克服的粒子间作用力都为分子间作用力,两者所克服的粒子间作用力完全相同,故D正确;
故选D。
12.B
【解析】由晶胞结构可以知道,Y原子位于顶点,Ba原子位于棱上,Cu原子位于晶胞内部,O原子晶胞内部与面上,利用均摊法计算原子数目,进而确定化学式。
【解析】由晶胞结构可以知道,Y原子位于顶点,晶胞中Y原子数目为8×=1,
Ba原子位于棱上,晶胞中Ba原子数目为8×=2,
Cu原子位于晶胞内部,晶胞中Cu原子数目为3,
O原子晶胞内部与面上,晶胞中O原子数目为2+10×=7,
故该晶体化学式为YBa2Cu3O7,
故答案选B。
13.D
【解析】A.结构相似的共价晶体,原子半径越小,则共价键的键长越短,键能越大,晶体的硬度和熔沸点越高,A正确;
B.某无色晶体能溶于水,则应不是金属晶体,质硬而脆,熔点为801℃,熔沸点较高,应不是分子晶体,熔化状态下能导电,应为离子晶体,B正确;
C.易溶于CS2,根据“相似相溶”原理推测应具有分子结构,液态时不导电,说明不是离子晶体或金属晶体,水溶液能导电,则应为分子晶体,C正确;
D.金属晶体不一定有较高的熔点,如金属晶体Hg,常温下为液体,熔点较低,D错误;
综上所述答案为D。
14.B
【解析】A.根据均摊原则,该晶胞中含有的金属原子数目为,故A正确;
B.原子半径为r,则底面边长为2r,则1、2、3、4原子形成正四面体的高为 ,晶胞的高为正四面体的高的2倍,则晶胞的高为,故B错误;
C.图1结构可分割为3个图2所示的3个晶胞,故C正确;
D.该晶胞中含有2个原子,2个原子的体积为,晶胞的体积为,空间利用率为=,故D正确;
选B。
15.C
【解析】A.由表格中的信息可知,SiCl4熔点为-70℃,沸点57.6℃,故常温的时候为液体,A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,B正确;
C.这两者都是离子晶体,其中镁离子的半径小,氧离子半径较小,故氧化镁的晶格能大,熔沸点高,C错误;
D.离子晶体的离子键越强,熔沸点越高,由表中数据可以知道,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,D正确;
故选C。
16. 0.315 12 体心 棱心
【解析】(1)二者间的最短距离为晶胞面对角线长的一半,即。O位于面心,K位于定点,则与钾紧邻的氧原子有12个。
(2)在KIO3晶胞结构的另一种表示中,I位于各顶角位置,个数为8=1,则K也为1个,应为于体心,O处于棱心。
17.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
【解析】(1)
A组熔点很高,为原子晶体,构成微粒是原子,原子晶体是由原子通过共价键形成的,熔化时克服的是共价键;
(2)
B组为金属晶体,根据金属晶体的特征可知,B组金属晶体具有①②③④四条共性;
(3)
HF的分子之间除存在范德华力外,分子之间还含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常;
(4)
D组属于离子晶体,离子晶体的构成微粒是阴、阳离子,离子之间通过离子键结合,离子键是一种比较强的相互作用,具有一定的硬度;一般能够溶于水,在水分子作用下电离产生自由移动的离子,因而能够导电;在固体时离子之间通过离子键结合,不能自由移动,因此固态时不能导电;在熔融状态时断裂离子键,产生自由移动的离子,因此在熔融状态下也可以导电,故②④两个性质符合;
(5)
D组属于离子晶体,其熔点与离子键键能有关。离子半径越小,离子之间作用力越强,离子键的键能越大,晶格能越大,物质的熔沸点就越高。由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
18. 金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构,当金属受外力作用时,金属晶体中各层会发生相对滑动,产生形变,自由电子使得各层之间始终保持金属键的作用。离子晶体中由于阴、阳离子之间存在着静电作用,使阴、阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。 使离子晶体中的阴、阳离子结合在一起的是离子键,离子键无饱和性和方向性.在离子晶体中,每个阳离子的周围都有一定数目的阴离子与之紧邻,每个阴离子的周围也有一定数目的阳离子与之紧邻,整个晶体通过这种方式在空间延伸,所以离子晶体不存在单个的分子。
【解析】(1)金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构,当金属受外力作用时,金属晶体中各层会发生相对滑动,产生形变,自由电子使得各层之间始终保持金属键的作用。离子晶体中由于阴、阳离子之间存在着静电作用,使阴、阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。
(2)使离子晶体中的阴、阳离子结合在一起的是离子键,离子键无饱和性和方向性.在离子晶体中,每个阳离子的周围都有一定数目的阴离子与之紧邻,每个阴离子的周围也有一定数目的阳离子与之紧邻,整个晶体通过这种方式在空间延伸,所以离子晶体不存在单个的分子。
19.(1) N>O>C 7
(2)正四面体形
(3) NH3>AsH3>PH3 NH3>PH3>AsH3
(4)大于
【解析】(1)
C、N、O元素处于第二周期,同周期主族元素从左到右第一电离能呈增大趋势,但N原子2p轨道处于半充满稳定状态,不易失去电子,其第一电离能大于同周期相邻主族元素,故第一电离能:N>O>C,基态N原子核外有7个电子,原子核外电子的运动状态各不相同,故基态N原子核外电子的运动状态有7种;
(2)
分子的中心原子的价电子对数为,不含有孤对电子,因此分子的空间构型为正四面体形;
(3)
NH3、PH3、AsH3的结构相似,结构相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,相对分子质量大小比较:AsH3>PH3>NH3,但是NH3分子间能形成氢键,所以沸点比AsH3更高,故这三种物质的沸点由高到低的顺序为:NH3>AsH3>PH3;
NH3、PH3、AsH3的中心原子都是sp3杂化,均形成3对共用电子对和一对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,键角越小,电负性大小比较:N>As>P,且原子半径:As>P>N,键长:As-H>P-H>N-H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,所以这三种物质的键角由大到小的顺序为NH3>PH3>AsH3;
(4)
NaN3与KN3结构相似,均为离子晶体,Na+比K+半径小,相同电荷时,离子半径越小,晶格能越大,离子半径:Na+<K+,故NaN3晶格能大,熔点更高。
20. 2 BN
【解析】B原子位于顶点和内部,顶点贡献,所以B原子的个数为8×+1=2,N原子位于棱心和内部,棱心贡献,所以N原子的个数为4×+1=2,B和N原子的个数比为1∶1,所以化学式为BN。
21. E 1:1:3 B 12 6 4 2
【解析】(1)Eu是镧系元素,位于元素周期表的第六周期,物质在参加反应时,原子核外电子最外层、次外层及倒数第三层的电子都会发生变化,因此属于f区的元素,故合理选项是E;
(2)在该晶胞中,Eu原子个数为:1,Ti原子个数为:8×=1,含有的O原子个数为12×=3,则晶胞中Eu、Ti、O的粒子个数比是1:1:3;
(3)若将Ti原子置于立方体的体心,在一个晶胞中含有1个Ti原子,通过该Ti原子的8个晶胞中含有8个Eu原子,将8个Eu原子相连,形成一个立方体,Eu位于立方体的顶角上, O原子处于立方体的面心上,故合理选项是B;
(4)根据图示可知:在晶胞中与Eu原子距离相等且最近的O原子有12个,距离为晶胞面对角线的一半;以晶胞顶点Ti原子为研究对象,在晶胞中与Ti原子距离相等且最近的O原子有6个,分别位于Ti原子上下、前后、左右6个方向,距离为晶胞边长的一半;O原子位于晶胞棱边上,通过该棱边可以形成4个晶胞,每个晶胞中有一个Ti原子,因此与1个O原子和4个Eu原子距离相等且最近,距离是晶胞面对角线的一半;在1个O原子周围有2个Ti原子与O原子距离相等且最近,距离是晶胞边长的一半。
22. (或)
【解析】通过分析晶胞结构,可知Fe原子处在面心和顶点的位置,Mg原子处在内部,根据均摊法计算铁镁合金的晶胞中含有铁原子个数为,镁原子个数为8,所以化学式为(或);经过分析可知,该铁镁合金晶胞结构与晶体相似,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最短距离即晶胞体对角线长的,即;晶胞的密度。
23. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
24. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
25.TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
【解析】F的电负性强,故TiF4属于离子化合物,形成离子晶体,熔点较高,而自TiCl4至TiI4均为共价化合物,形成分子晶体,熔沸点很低,且随相对分子质量的增大分子间作用力增大,熔点逐渐升高
一、单选题
1.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
2.下列说法正确的是
A.铍原子最外层原子轨道的电子云图:
B.热稳定性:
C. ,该电子排布图违背了泡利原理
D. 该有机物的系统命名为:2—甲基—1—丙醇
3.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
4.下列排序正确的是
A.熔点:碳化硅>硅>锗
B.分解温度:
C.酸性:
D.键角:
5.下列物质具有自范性、各向异性的是
A.钢化玻璃 B.塑料 C.水晶 D.陶瓷
6.下列说法不正确的是
A.NaCl和晶体所含化学键的类型相同
B.和是同素异形体
C.干冰、二氧化硅均属于原子晶体
D.合成纤维是一类高分子化合物
7.三氟化氮()和六氟化硫()都是微电子工业中的优良蚀刻剂,随着纳米技术及电子工业的发展,它们的需求量日益增加。下列说法正确的是
A.是含有极性键的非极性分子 B.三氟化磷的沸点低于三氟化氮
C.第一电离能: D.三氟化氮和甲烷中N、C的杂化方式不同
8.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
9.C2O3是一种无色无味的气体,结构式如图所示,可溶于水生成草酸:。下列说法正确的是
A.甲酸与草酸互为同系物
B.C2O3是非极性分子
C.熔点:草酸>三氧化二碳>干冰
D.CO2、C2O3和分子中碳原子的杂化方式均相同
10.在气体分析中,常用CuCl2的盐酸溶液吸收并定量测定CO的含量。某工艺通过如下流程制备氯化亚铜固体(已知CuCl容易被氧化):
下列说法正确的是
A.步骤①中可用稀硫酸代替稀盐酸
B.步骤②中SO2的作用是作为氧化剂
C.步骤③中用SO2水溶液洗涤比较有效
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
11.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
12.已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是
A.1 mol该化合物中有1 mol Y B.1 mol该化合物中有1 mol Ba
C.1 mol该化合物中有7 mol O D.该化合物的化学式是YBa2Cu3O7
13.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
14.某原子半径为r的金属的堆积方式为六方最密堆积,结构如图1所示,该晶体晶胞结构如图2所示,1、2、3、4原子形成正四面体,下列说法错误的是
A.该晶胞中含有的金属原子数目为2 B.该晶胞的高为
C.图1结构中含3个晶胞 D.该晶胞的空间利用率为
15.几种物质的熔点和沸点的数据如表,下列有关判断错误的是
NaCl MgCl2 AlCl3 SiCl4 单质M
熔点/℃ 801 712 190 -70 2300
沸点/℃ 1465 1412 178 57.6 2500
注:AlCl3的熔点在2.02×105Pa条件下测定。A.常温下,SiCl4为液态 B.单质M可能是共价晶体
C.熔沸点:MgO
二、填空题
16.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________,与K紧邻的O个数为___________。
(2)在晶胞结构的另一种表示中,Ⅰ处于各顶角位置,则K处于___________位置,O处于___________位置。
17.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃
硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃
硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃
二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
18.试从结构的角度分析下列问题的主要原因。
(1)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂________。
(2)离子晶体中不存在单个的分子_______________。
19.氮及其化合物与人类生产、生活息息相关,其中尿素()是人类最早合成的有机物。
(1)尿素分子中,C、N、O的第一电离能由大到小的顺序是_______(用元素符号表示),基态N原子的核外电子的空间运动状态有_______种。
(2)三氟化氨、四氟化碳是常见的芯片蚀刻剂。分子的空间构型为_______。
(3)的沸点由高到低的顺序为_______,键角由大到小的顺序为_______。
(4)叠氨化钠可以用于汽车安全气囊。与相比,的熔点_______的熔点(填“大于”或“小于”)。
20.某种含B和N两种元素的功能陶瓷,其晶胞结构示意图如图所示。请计算每个晶胞中含有B原子的个数_______,并确定该功能陶瓷的化学式_______。
21.Eu、Ti和O形成一种化合物,其晶胞为如图所示的立方体。
(1)Eu是镧系元素,位于元素周期表的_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)在该晶胞中,Eu、Ti、O的粒子个数比是_______。
(3)若将Ti原子置于立方体的体心,Eu原子置于立方体顶角,则O原子处于立方体的_______位置。
A.体心 B.面心 C.棱心 D.顶角
(4)1个Eu原子和_______个O原子相邻,1个Ti原子和_______个O原子相邻。1个O原子和_______个Eu原子相邻,1个O原子和_______个Ti原子相邻。
22.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为acm,为阿伏加德罗常数的值,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______。
23.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
24.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
25.Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 ﹣24.12 38.3 155
参考答案:
1.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
2.B
【解析】A.铍原子最外层为2s能级,s能级的电子云图为球形为 ,故A错误;
B.三种物质的阴离子是相同的,均为碳酸根,Ca2+、Sr2+、Ba2+为同主族元素的金属阳离子,从上到下,离子半径逐渐增大,阳离子的半径越大,结合碳酸根中的氧离子越容易,分解温度越高,则热稳定性为,故B正确;
C.由洪特规则可知,在2p轨道上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则电子排布图违背了洪特规则,故C错误;
D.属于饱和一元醇,名称为2—丁醇,故D错误;
故选B。
3.A
【解析】A.Al元素为13号元素,原子核外有13个电子,所以核外电子排布式为:1s22s22p63s23p1,故A错误;
B.晶体中Al位于顶点和面心,与Al距离最近且相等的Al有12个,故B正确;
C.该晶胞中,Li个数=12×+1=4,Al的个数=8×+6×=4,Si的个数=4,所以Li、Al、Si原子个数比为1:1:1,故C正确;
D.根据图知,每个Al原子连接4个相同的Si原子,Al原子与Si原子之间的最短距离为,故D正确;
故选:A。
4.A
【解析】A.因为原子半径C
B.碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,热分解温度: MgCO3
D.为直线形结构,键角为1800,水为V型分子,键角为1050,氨气为三角锥型,键角为1070,所以键角大小,D错误;
故选A。
5.C
【解析】晶体具有自范性和各向异性,钢化玻璃、塑料、陶瓷均不属于晶体,水晶属于晶体,故选:C。
6.C
【解析】A.NaCl、MgCl2均为离子化合物,只含离子键,A正确;
B.C60、C70为碳元素的不同单质,互为同素异形体,B正确;
C.干冰(CO2)由分子构成,属于分子晶体,SiO2由原子构成,属于原子晶体,C错误;
D.合成纤维、合成树脂、合成橡胶属于三大合成高分子材料,D正确;
故答案选C。
7.C
【解析】A.的中心原子N原子的价层电子对数为3+=4,NF3为三角锥形结构,故为含有极性键的极性分子,而价层电子对数为6+=6,SF6是正八面体结构,其为含有极性键的非极性分子,A错误;
B.F3和PF3均为分子晶体,二者均为三角锥形构型,且NF3的相对分子质量小于PF3的相对分子质量,故NF3的分子间作用力小于PF3的,则三氟化氮的沸点低于三氟化磷,,B错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,第一电离能:,C正确;
D.的中心原子N原子的价层电子对数为3+=4,则N原子的杂化方式为sp3,CH4中心原子上价层电子对数为:4+=4,则C原子的杂化方式为sp3,故三氟化氮和甲烷中的N、C杂化方式相同,D错误;
故选C。
8.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
9.C
【解析】A.结构相似、分子组成上相差1个或若干个原子团的化合物互为同系物,甲酸()与草酸()不符合要求,不互为同系物,A错误;
B.由题图可知正电中心和负电中心不重合,是极性分子,B错误;
C.草酸分子间能形成氢键,而不能,故草酸熔点比高,相对分子质量比小,因此熔点低于,熔点:草酸>三氧化二碳>干冰,C正确;
D.中碳原子的杂化方式为,中碳原子的杂化方式为,分子中碳原子的杂化方式为,杂化方式不完全相同,D错误。
故选C。
10.C
【解析】Cu2(OH)2CO3与过量盐酸反应得到CuCl2的盐酸溶液,再通入SO2还原,过滤、洗涤得到CuCl固体。
【解析】A.步骤①中可用稀硫酸代替稀盐酸则得不到CuCl2的盐酸溶液,最终也得不到氯化亚铜固体,A错误;
B.根据Cu元素化合价的变化:从+2降低+1,可知其被还原,故步骤②中SO2的作用是作为还原剂,B错误;
C.由于CuCl容易被氧化,在步骤③中用SO2水溶液洗涤可防止CuCl被氧化,C正确;
D.从CuCl晶胞结构图可知,氯离子位于立方晶胞顶点和面心,故每个氯离子周围与之距离最近的氯离子数目为,D错误;
故选C。
11.D
【解析】A.氧化钙是离子晶体,熔化时所克服的粒子间作用力为离子键,二氧化硅是原子晶体,熔化时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故A错误;
B.钠是金属晶体,受热熔化时所克服的粒子间作用力为金属键,硫是分子晶体,受热熔化时所克服的粒子间作用力为分子间作用力,两者所克服的粒子间作用力不同,故B错误;
C.氯化钠是离子晶体,溶于水时所克服的粒子间作用力为离子键,氯化氢是分子晶体,溶于水时所克服的粒子间作用力为共价键,两者所克服的粒子间作用力不同,故C错误;
D.碘和干冰都是分子晶体,升华时所克服的粒子间作用力都为分子间作用力,两者所克服的粒子间作用力完全相同,故D正确;
故选D。
12.B
【解析】由晶胞结构可以知道,Y原子位于顶点,Ba原子位于棱上,Cu原子位于晶胞内部,O原子晶胞内部与面上,利用均摊法计算原子数目,进而确定化学式。
【解析】由晶胞结构可以知道,Y原子位于顶点,晶胞中Y原子数目为8×=1,
Ba原子位于棱上,晶胞中Ba原子数目为8×=2,
Cu原子位于晶胞内部,晶胞中Cu原子数目为3,
O原子晶胞内部与面上,晶胞中O原子数目为2+10×=7,
故该晶体化学式为YBa2Cu3O7,
故答案选B。
13.D
【解析】A.结构相似的共价晶体,原子半径越小,则共价键的键长越短,键能越大,晶体的硬度和熔沸点越高,A正确;
B.某无色晶体能溶于水,则应不是金属晶体,质硬而脆,熔点为801℃,熔沸点较高,应不是分子晶体,熔化状态下能导电,应为离子晶体,B正确;
C.易溶于CS2,根据“相似相溶”原理推测应具有分子结构,液态时不导电,说明不是离子晶体或金属晶体,水溶液能导电,则应为分子晶体,C正确;
D.金属晶体不一定有较高的熔点,如金属晶体Hg,常温下为液体,熔点较低,D错误;
综上所述答案为D。
14.B
【解析】A.根据均摊原则,该晶胞中含有的金属原子数目为,故A正确;
B.原子半径为r,则底面边长为2r,则1、2、3、4原子形成正四面体的高为 ,晶胞的高为正四面体的高的2倍,则晶胞的高为,故B错误;
C.图1结构可分割为3个图2所示的3个晶胞,故C正确;
D.该晶胞中含有2个原子,2个原子的体积为,晶胞的体积为,空间利用率为=,故D正确;
选B。
15.C
【解析】A.由表格中的信息可知,SiCl4熔点为-70℃,沸点57.6℃,故常温的时候为液体,A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,B正确;
C.这两者都是离子晶体,其中镁离子的半径小,氧离子半径较小,故氧化镁的晶格能大,熔沸点高,C错误;
D.离子晶体的离子键越强,熔沸点越高,由表中数据可以知道,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,D正确;
故选C。
16. 0.315 12 体心 棱心
【解析】(1)二者间的最短距离为晶胞面对角线长的一半,即。O位于面心,K位于定点,则与钾紧邻的氧原子有12个。
(2)在KIO3晶胞结构的另一种表示中,I位于各顶角位置,个数为8=1,则K也为1个,应为于体心,O处于棱心。
17.(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
【解析】(1)
A组熔点很高,为原子晶体,构成微粒是原子,原子晶体是由原子通过共价键形成的,熔化时克服的是共价键;
(2)
B组为金属晶体,根据金属晶体的特征可知,B组金属晶体具有①②③④四条共性;
(3)
HF的分子之间除存在范德华力外,分子之间还含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常;
(4)
D组属于离子晶体,离子晶体的构成微粒是阴、阳离子,离子之间通过离子键结合,离子键是一种比较强的相互作用,具有一定的硬度;一般能够溶于水,在水分子作用下电离产生自由移动的离子,因而能够导电;在固体时离子之间通过离子键结合,不能自由移动,因此固态时不能导电;在熔融状态时断裂离子键,产生自由移动的离子,因此在熔融状态下也可以导电,故②④两个性质符合;
(5)
D组属于离子晶体,其熔点与离子键键能有关。离子半径越小,离子之间作用力越强,离子键的键能越大,晶格能越大,物质的熔沸点就越高。由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
18. 金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构,当金属受外力作用时,金属晶体中各层会发生相对滑动,产生形变,自由电子使得各层之间始终保持金属键的作用。离子晶体中由于阴、阳离子之间存在着静电作用,使阴、阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。 使离子晶体中的阴、阳离子结合在一起的是离子键,离子键无饱和性和方向性.在离子晶体中,每个阳离子的周围都有一定数目的阴离子与之紧邻,每个阴离子的周围也有一定数目的阳离子与之紧邻,整个晶体通过这种方式在空间延伸,所以离子晶体不存在单个的分子。
【解析】(1)金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构,当金属受外力作用时,金属晶体中各层会发生相对滑动,产生形变,自由电子使得各层之间始终保持金属键的作用。离子晶体中由于阴、阳离子之间存在着静电作用,使阴、阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。
(2)使离子晶体中的阴、阳离子结合在一起的是离子键,离子键无饱和性和方向性.在离子晶体中,每个阳离子的周围都有一定数目的阴离子与之紧邻,每个阴离子的周围也有一定数目的阳离子与之紧邻,整个晶体通过这种方式在空间延伸,所以离子晶体不存在单个的分子。
19.(1) N>O>C 7
(2)正四面体形
(3) NH3>AsH3>PH3 NH3>PH3>AsH3
(4)大于
【解析】(1)
C、N、O元素处于第二周期,同周期主族元素从左到右第一电离能呈增大趋势,但N原子2p轨道处于半充满稳定状态,不易失去电子,其第一电离能大于同周期相邻主族元素,故第一电离能:N>O>C,基态N原子核外有7个电子,原子核外电子的运动状态各不相同,故基态N原子核外电子的运动状态有7种;
(2)
分子的中心原子的价电子对数为,不含有孤对电子,因此分子的空间构型为正四面体形;
(3)
NH3、PH3、AsH3的结构相似,结构相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,相对分子质量大小比较:AsH3>PH3>NH3,但是NH3分子间能形成氢键,所以沸点比AsH3更高,故这三种物质的沸点由高到低的顺序为:NH3>AsH3>PH3;
NH3、PH3、AsH3的中心原子都是sp3杂化,均形成3对共用电子对和一对孤电子对,中心原子的电负性越小,成键电子对之间的斥力越小,键角越小,电负性大小比较:N>As>P,且原子半径:As>P>N,键长:As-H>P-H>N-H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,所以这三种物质的键角由大到小的顺序为NH3>PH3>AsH3;
(4)
NaN3与KN3结构相似,均为离子晶体,Na+比K+半径小,相同电荷时,离子半径越小,晶格能越大,离子半径:Na+<K+,故NaN3晶格能大,熔点更高。
20. 2 BN
【解析】B原子位于顶点和内部,顶点贡献,所以B原子的个数为8×+1=2,N原子位于棱心和内部,棱心贡献,所以N原子的个数为4×+1=2,B和N原子的个数比为1∶1,所以化学式为BN。
21. E 1:1:3 B 12 6 4 2
【解析】(1)Eu是镧系元素,位于元素周期表的第六周期,物质在参加反应时,原子核外电子最外层、次外层及倒数第三层的电子都会发生变化,因此属于f区的元素,故合理选项是E;
(2)在该晶胞中,Eu原子个数为:1,Ti原子个数为:8×=1,含有的O原子个数为12×=3,则晶胞中Eu、Ti、O的粒子个数比是1:1:3;
(3)若将Ti原子置于立方体的体心,在一个晶胞中含有1个Ti原子,通过该Ti原子的8个晶胞中含有8个Eu原子,将8个Eu原子相连,形成一个立方体,Eu位于立方体的顶角上, O原子处于立方体的面心上,故合理选项是B;
(4)根据图示可知:在晶胞中与Eu原子距离相等且最近的O原子有12个,距离为晶胞面对角线的一半;以晶胞顶点Ti原子为研究对象,在晶胞中与Ti原子距离相等且最近的O原子有6个,分别位于Ti原子上下、前后、左右6个方向,距离为晶胞边长的一半;O原子位于晶胞棱边上,通过该棱边可以形成4个晶胞,每个晶胞中有一个Ti原子,因此与1个O原子和4个Eu原子距离相等且最近,距离是晶胞面对角线的一半;在1个O原子周围有2个Ti原子与O原子距离相等且最近,距离是晶胞边长的一半。
22. (或)
【解析】通过分析晶胞结构,可知Fe原子处在面心和顶点的位置,Mg原子处在内部,根据均摊法计算铁镁合金的晶胞中含有铁原子个数为,镁原子个数为8,所以化学式为(或);经过分析可知,该铁镁合金晶胞结构与晶体相似,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最短距离即晶胞体对角线长的,即;晶胞的密度。
23. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
24. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
25.TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
【解析】F的电负性强,故TiF4属于离子化合物,形成离子晶体,熔点较高,而自TiCl4至TiI4均为共价化合物,形成分子晶体,熔沸点很低,且随相对分子质量的增大分子间作用力增大,熔点逐渐升高
