人教版九年级化学 第九单元 课题3 溶液的浓度 课时1 溶质的质量分数 溶液的稀释或浓缩课件(共28张PPT)
文档属性
| 名称 | 人教版九年级化学 第九单元 课题3 溶液的浓度 课时1 溶质的质量分数 溶液的稀释或浓缩课件(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 478.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
第九单元 溶 液
课题3 溶液的浓度
课时1 溶质的质量分数 溶液的稀释或浓缩
目录
01
课程要求
02
03
04
知识点精讲
课堂检测
课前预习
知道溶质质量分数可以表示浓度,认识溶质质量分数的含义,学习计算溶质质量分数,初步感受定量研究的意义。
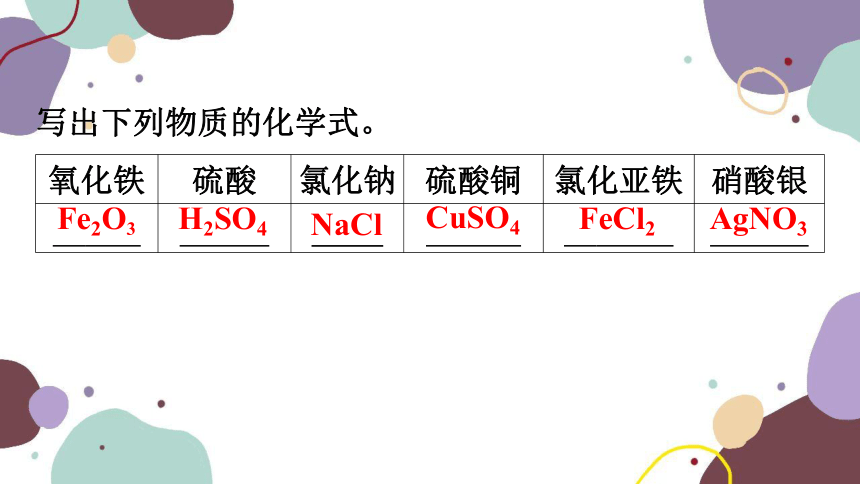
写出下列物质的化学式。
氧化铁 硫酸 氯化钠 硫酸铜 氯化亚铁 硝酸银
Fe23 H2SO4 NaCl CuSO4 FeCl2 AgNO3
Fe2O3
H2SO4
NaCl
CuSO4
FeCl2
AgNO3
知识点1 溶质的质量分数
1. 观察课本P42“实验9-7”,填写下表。
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(1)20 mL水+0.1 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
淡蓝
20
0.1
20.1
0.50%
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(2)20 mL水+0.5 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
浅蓝
20
0.5
20.5
2.44%
续表
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(3)20 mL水+2 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
蓝
20
2
22
9.09%
【归纳】(1)对于有色溶液来说,根据颜色的深浅可以判断溶液是浓还是稀。颜色越深,溶质的质量分数越 大 ,溶液越 浓 。
大
浓
续表
(2)将溶液分为浓溶液和稀溶液,这种方法比较粗略, 不能 准确地表明一定量的溶液里究竟含有多少溶质。在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。溶液的浓度可以用溶质的质量分数来表示。溶剂质量相同时,所溶解的溶质质量越大,溶质的质量分数 越大 ,溶液越 浓 (填“浓”或“稀”)。
不能
越大
浓
2. 观察课本P43“实验9-8”,填写下表。
溶质 质量/g 溶剂(水) 质量/g 现 象 溶质的质量
分数
10 90 完全溶解 10%
20 80 完全溶解 20%
完全溶解
10%
完全溶解
20%
课堂练习
1. 现配制50 g质量分数为10%的氢氧化钠溶液,需称量氢氧化钠的质量为( B )
A. 10 g B. 5 g C. 0.5 g D. 15 g
B
思路点拨 根据溶质的质量分数的计算公式以及变式公式进行计算,同时注意,当向某种浓度的溶液中加入一定量的溶质或溶剂时,其溶液的量也会发生相应的改变。
知识点2 溶质的质量分数与溶解度的关系
不对,应为
课堂练习
2. 甲、乙两种物质的溶解度曲线如图9-3-1所示。
图9-3-1
(1)20 ℃时,甲的饱和溶液中溶质的质量分数 < (填“>”“=”或“<”)乙的饱和溶液中溶质的质量分数。
(2)60 ℃时,甲的饱和溶液中溶质的质量分数为 20% 。
<
20%
(3)60 ℃时,将15 g甲加入50 g水中,充分溶解后,溶液中溶质的质量分数为 20% 。
(4)将60 ℃时甲、乙的饱和溶液分别降温至t ℃,有晶体析出的是 甲 ,溶质的质量分数不变的是 乙 ,此时甲、乙两种溶液中溶质的质量分数大小关系为 甲>乙 。
20%
甲
乙
甲>乙
思路点拨 (1)溶解度曲线上溶液状态对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。(2)饱和溶液溶质的溶解度变小时,有晶体析出,溶质的质量分数减小;饱和溶液溶质的溶解度变大时,溶液变为不饱和溶液,若不增加溶质,溶质的质量分数不变。
知识点3 溶液的稀释或浓缩
4. 计算原理:稀释前 溶质 的质量=稀释后 溶质 的质量。
5. 溶液的稀释方法:① 加入溶剂 ;② 加入低浓度溶液 。
6. 计算公式: 浓溶液的质量 ×浓溶液中溶质的质量分数=稀溶液的质量× 稀溶液中溶质的质量分数 。
7. 溶液稀释时需要加水的质量= 稀溶液 的质量- 浓溶液 的质量。
溶质
溶质
加入溶剂
加入低浓度
溶液
浓溶液的质量
稀溶液中溶质的质量分数
稀溶液
浓溶液
课堂练习
3. 向某氯化钠饱和溶液中加入一定量的水后,该溶液一定不发生变化的是( A )
A. 溶质的质量 B. 溶剂的质量分数
C. 溶液的质量 D. 溶质的质量分数
A
4. 过氧乙酸(C2H4O3)是常见的消毒剂,教室等空间可用2%的过氧乙酸溶液喷洒,关闭门窗一小时后通风。某校要配制100 kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液为多少千克?需要加水的质量为多少千克?
解:设需要10%的过氧乙酸溶液的质量为x。
10%×x=100 kg×0.2%
x=2 kg
需要加水的质量为100 kg-2 kg=98 kg
答:需要10%的过氧乙酸溶液的质量为2 kg;需要加水的质量为98 kg。
思路点拨 在进行溶液的稀释(或浓缩)的计算时要注意,在稀释(或浓缩)前后,溶质的总质量不变。
1. 下列关于“溶质质量分数为10%的硝酸钾溶液”含义的说法中,错误的是( A )
A.100 g水中溶解了10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1 ∶9的质量比配制的溶液
A
2. 下列溶液中,溶质质量分数最大的是( D )
A. t ℃时,溶解度为20 g的物质的饱和溶液
B. 20 g溶质配制成100 mL溶液,该溶液的密度是1.5 g/cm3
C. 100 g 20%的某溶液,加水稀释到200 g
D. 100 g 10%的某溶液再溶解10 g溶质
D
3. 现有100 g NaCl饱和溶液,保持温度不变,下列方法可以改变溶液溶质的质量分数的是( C )
A. 取出10 g溶液 B. 蒸发10 g水
C. 加入10 g水 D. 加入10 g NaCl固体
C
4. (2021广东)如图9-3-2是硼酸的溶解度曲线,下列说法正确的是( C )
图9-3-2
C
A. a点的硼酸溶液中溶质的质量分数为10%
B. 将a点的硼酸溶液升温至t2 ℃时,仍是饱和溶液
C. 将b点的硼酸溶液降温至t1 ℃时,有晶体析出
D. t2 ℃时,向50 g水中加入20 g硼酸后充分搅拌,可得70 g溶液
5. 25 ℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( D )
实验编号 ① ② ③ ④
水的质量/g 50 50 50 50
加入固体质量/g 5 10 15 20
现 象 固体完全溶解 固体完全溶解 剩余少量固体 剩余较多固体
D
A. 实验①所得溶液质量分数为10%
B. 实验②说明25 ℃时该物质的溶解度是20 g
C. 实验④所得溶液中含溶质20 g
D. 实验③、④所得溶液溶质质量分数相同
6. 现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题。(写出计算过程)
(1)若向上述溶液中加入20 g硝酸钠,则完全溶解后所得溶液中溶质质量分数为多少?
答:(1)完全溶解后所得溶液中溶质质量分数为28%。
(2)若使上述溶液中溶质质量分数变为5%,则应加水的质量是多少?
答:(2)应加水的质量是80 g。
谢 谢!
第九单元 溶 液
课题3 溶液的浓度
课时1 溶质的质量分数 溶液的稀释或浓缩
目录
01
课程要求
02
03
04
知识点精讲
课堂检测
课前预习
知道溶质质量分数可以表示浓度,认识溶质质量分数的含义,学习计算溶质质量分数,初步感受定量研究的意义。
写出下列物质的化学式。
氧化铁 硫酸 氯化钠 硫酸铜 氯化亚铁 硝酸银
Fe23 H2SO4 NaCl CuSO4 FeCl2 AgNO3
Fe2O3
H2SO4
NaCl
CuSO4
FeCl2
AgNO3
知识点1 溶质的质量分数
1. 观察课本P42“实验9-7”,填写下表。
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(1)20 mL水+0.1 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
淡蓝
20
0.1
20.1
0.50%
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(2)20 mL水+0.5 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
浅蓝
20
0.5
20.5
2.44%
续表
物 质 溶液 颜色 溶剂 质量/g 溶质 质量/g 溶液 质量/g 溶质的
质量分数
(3)20 mL水+2 g无水硫酸铜 淡蓝 20 0.1 2 0.1 0.50%
蓝
20
2
22
9.09%
【归纳】(1)对于有色溶液来说,根据颜色的深浅可以判断溶液是浓还是稀。颜色越深,溶质的质量分数越 大 ,溶液越 浓 。
大
浓
续表
(2)将溶液分为浓溶液和稀溶液,这种方法比较粗略, 不能 准确地表明一定量的溶液里究竟含有多少溶质。在实际应用中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。溶液的浓度可以用溶质的质量分数来表示。溶剂质量相同时,所溶解的溶质质量越大,溶质的质量分数 越大 ,溶液越 浓 (填“浓”或“稀”)。
不能
越大
浓
2. 观察课本P43“实验9-8”,填写下表。
溶质 质量/g 溶剂(水) 质量/g 现 象 溶质的质量
分数
10 90 完全溶解 10%
20 80 完全溶解 20%
完全溶解
10%
完全溶解
20%
课堂练习
1. 现配制50 g质量分数为10%的氢氧化钠溶液,需称量氢氧化钠的质量为( B )
A. 10 g B. 5 g C. 0.5 g D. 15 g
B
思路点拨 根据溶质的质量分数的计算公式以及变式公式进行计算,同时注意,当向某种浓度的溶液中加入一定量的溶质或溶剂时,其溶液的量也会发生相应的改变。
知识点2 溶质的质量分数与溶解度的关系
不对,应为
课堂练习
2. 甲、乙两种物质的溶解度曲线如图9-3-1所示。
图9-3-1
(1)20 ℃时,甲的饱和溶液中溶质的质量分数 < (填“>”“=”或“<”)乙的饱和溶液中溶质的质量分数。
(2)60 ℃时,甲的饱和溶液中溶质的质量分数为 20% 。
<
20%
(3)60 ℃时,将15 g甲加入50 g水中,充分溶解后,溶液中溶质的质量分数为 20% 。
(4)将60 ℃时甲、乙的饱和溶液分别降温至t ℃,有晶体析出的是 甲 ,溶质的质量分数不变的是 乙 ,此时甲、乙两种溶液中溶质的质量分数大小关系为 甲>乙 。
20%
甲
乙
甲>乙
思路点拨 (1)溶解度曲线上溶液状态对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。(2)饱和溶液溶质的溶解度变小时,有晶体析出,溶质的质量分数减小;饱和溶液溶质的溶解度变大时,溶液变为不饱和溶液,若不增加溶质,溶质的质量分数不变。
知识点3 溶液的稀释或浓缩
4. 计算原理:稀释前 溶质 的质量=稀释后 溶质 的质量。
5. 溶液的稀释方法:① 加入溶剂 ;② 加入低浓度溶液 。
6. 计算公式: 浓溶液的质量 ×浓溶液中溶质的质量分数=稀溶液的质量× 稀溶液中溶质的质量分数 。
7. 溶液稀释时需要加水的质量= 稀溶液 的质量- 浓溶液 的质量。
溶质
溶质
加入溶剂
加入低浓度
溶液
浓溶液的质量
稀溶液中溶质的质量分数
稀溶液
浓溶液
课堂练习
3. 向某氯化钠饱和溶液中加入一定量的水后,该溶液一定不发生变化的是( A )
A. 溶质的质量 B. 溶剂的质量分数
C. 溶液的质量 D. 溶质的质量分数
A
4. 过氧乙酸(C2H4O3)是常见的消毒剂,教室等空间可用2%的过氧乙酸溶液喷洒,关闭门窗一小时后通风。某校要配制100 kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液为多少千克?需要加水的质量为多少千克?
解:设需要10%的过氧乙酸溶液的质量为x。
10%×x=100 kg×0.2%
x=2 kg
需要加水的质量为100 kg-2 kg=98 kg
答:需要10%的过氧乙酸溶液的质量为2 kg;需要加水的质量为98 kg。
思路点拨 在进行溶液的稀释(或浓缩)的计算时要注意,在稀释(或浓缩)前后,溶质的总质量不变。
1. 下列关于“溶质质量分数为10%的硝酸钾溶液”含义的说法中,错误的是( A )
A.100 g水中溶解了10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1 ∶9的质量比配制的溶液
A
2. 下列溶液中,溶质质量分数最大的是( D )
A. t ℃时,溶解度为20 g的物质的饱和溶液
B. 20 g溶质配制成100 mL溶液,该溶液的密度是1.5 g/cm3
C. 100 g 20%的某溶液,加水稀释到200 g
D. 100 g 10%的某溶液再溶解10 g溶质
D
3. 现有100 g NaCl饱和溶液,保持温度不变,下列方法可以改变溶液溶质的质量分数的是( C )
A. 取出10 g溶液 B. 蒸发10 g水
C. 加入10 g水 D. 加入10 g NaCl固体
C
4. (2021广东)如图9-3-2是硼酸的溶解度曲线,下列说法正确的是( C )
图9-3-2
C
A. a点的硼酸溶液中溶质的质量分数为10%
B. 将a点的硼酸溶液升温至t2 ℃时,仍是饱和溶液
C. 将b点的硼酸溶液降温至t1 ℃时,有晶体析出
D. t2 ℃时,向50 g水中加入20 g硼酸后充分搅拌,可得70 g溶液
5. 25 ℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( D )
实验编号 ① ② ③ ④
水的质量/g 50 50 50 50
加入固体质量/g 5 10 15 20
现 象 固体完全溶解 固体完全溶解 剩余少量固体 剩余较多固体
D
A. 实验①所得溶液质量分数为10%
B. 实验②说明25 ℃时该物质的溶解度是20 g
C. 实验④所得溶液中含溶质20 g
D. 实验③、④所得溶液溶质质量分数相同
6. 现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题。(写出计算过程)
(1)若向上述溶液中加入20 g硝酸钠,则完全溶解后所得溶液中溶质质量分数为多少?
答:(1)完全溶解后所得溶液中溶质质量分数为28%。
(2)若使上述溶液中溶质质量分数变为5%,则应加水的质量是多少?
答:(2)应加水的质量是80 g。
谢 谢!
同课章节目录
