1.3.2氧化剂还原剂 课件(共40张PPT) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化剂还原剂 课件(共40张PPT) 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 14:11:32 | ||
图片预览










文档简介
(共40张PPT)
氧化剂、还原剂
第二课时
知识回顾
1、从物质得氧失氧、化合价的升降、电子转移三个角度给氧化还原反应定义。氧化还原反应的特征、本质以及规律分别是什么?
答:物质得氧失氧的反应是氧化还原反应,有元素化合价升降的反应是氧化还原反应,有电子转移的反应是氧化还原反应 。
其特征和判据是元素的化合价升降,
本质是电子的转移。
C
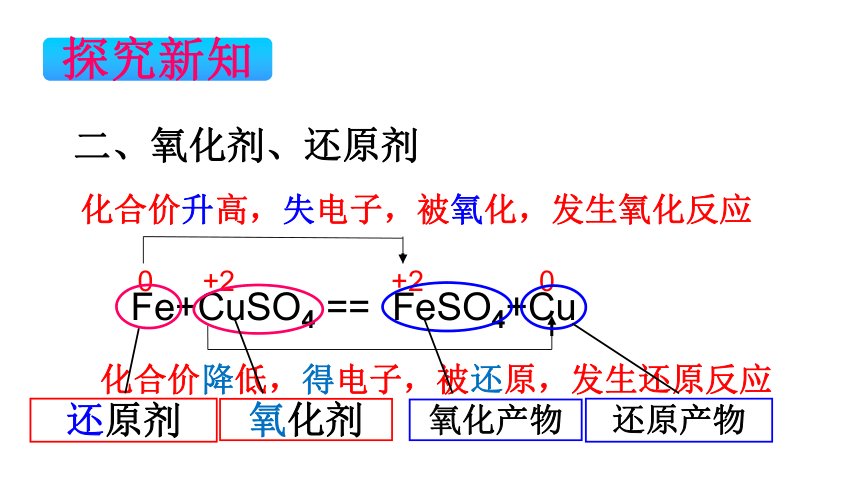
探究新知
Fe+CuSO4 == FeSO4+Cu
0
+2
+2
0
化合价升高,失电子,被氧化,发生氧化反应
化合价降低,得电子,被还原,发生还原反应
二、氧化剂、还原剂
还原剂
氧化剂
还原产物
氧化产物
氧化反应
(被氧化)
还原产物
还原反应
(被还原)
还原剂
氧化产物
失电子
得电子
化合价
升高
化合价
降低
氧化剂
氧化还原反应的基本概念及关系
得失电子数 相等
化合价升降数相等
还、失、升、氧氧、得、降、还
守恒律
----计算
氧化剂和还原剂在氧化还原反应中分别表现什么性质?起什么作用?
答:氧化剂具有氧化性,即得电子的性质;
还原剂具有还原性,即失电子的性质。
注:氧化性、还原性的强弱是指得失电子的难易程度,
不是指得失电子的多少(数目)
① Fe2O3 + 3CO == 2Fe + 3CO2
② Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③SO2 + 2H2S == 2H2O + 3S↓
④2KClO3 == 2KCl+3O2↑
MnO2
【做一做】
1、请找出下列反应中氧化剂、还原剂、氧化产物和还原产物
⑤Cl2+2NaOH=NaCl+NaClO+H2O
⑥4 FeS2 + 11O2 == 2Fe2O3 + 8SO2
高温
3、在反应: 3Cl2 + 6NaOH =5NaCl + NaClO3+3H2O中,___元素被氧化, ___元素被还原,氧化剂是_____,还原剂是_____,氧化产物是_______,还原产物是_____, NaOH是既不是氧化剂也不是还原剂; 氧化剂与还原剂质量比= 。
2、3Cl2 + 8NH3 = 6NH4Cl+N2 ,氧化剂是_____, 还原剂是_____,氧化产物是_______,还原产物是_______,8个 NH3参加反应时,被Cl2氧化的NH3 的数目为____,氧化剂与还原剂分子个数比= 。
Cl
Cl
Cl2
Cl2
NaClO3
NaCl
NH3
N2
NH4Cl
2
Cl2
5:1
3:2
4、SO2 + 2H2S == 2H2O + 3S↓,氧化剂 ,还原剂是 ,氧化产物是 ,还原产物是 ,氧化产物与还原产物质量比= 。
SO2
H2S
S
S
2:1
5、3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,被还原的HNO3和未被还原的HNO3的质量之比为_____,该反应体现了HNO3的 ______性和 ____性。
1:3
氧化
酸
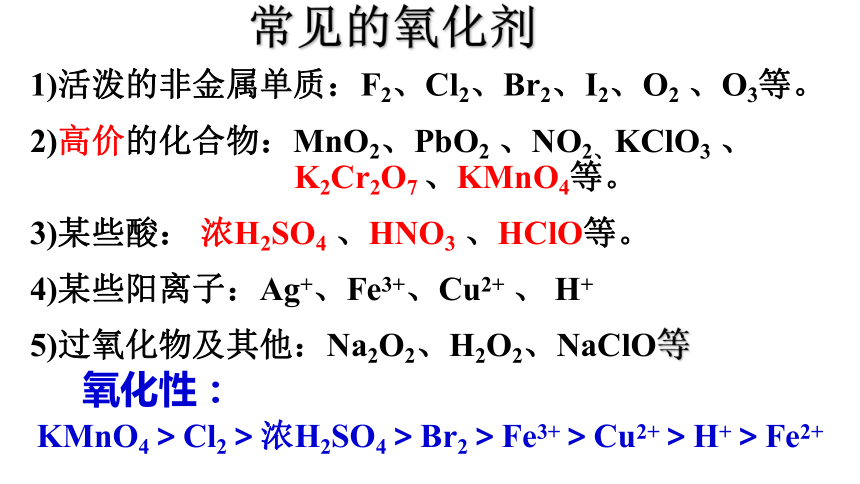
常见的氧化剂
1)活泼的非金属单质:F2、Cl2、Br2、I2、O2 、O3等。
2)高价的化合物:MnO2、PbO2 、NO2、KClO3 、 K2Cr2O7 、KMnO4等。
3)某些酸: 浓H2SO4 、HNO3 、HClO等。
4)某些阳离子:Ag+、Fe3+、Cu2+ 、 H+
5)过氧化物及其他:Na2O2、H2O2、NaClO等
氧化性:
KMnO4>Cl2>浓H2SO4>Br2>Fe3+>Cu2+>H+>Fe2+
(1)活泼的金属单质:K 、Na 、 Mg 、 Fe 、 Al
(2)某些非金属单质:H2 、C、P、Si
(3)含有较低化合价元素的化合物:H2S、Na2S、HI、NH3、CO、SO2、Na2SO3 、FeCl2等。
(4)某些离子: I-、S2-、Fe2+
常见的还原剂
还原性: S2- > SO32-(或HSO3-) > I- > Fe2+ > Br- > Cl-
硫:
―2
0
+4
+6
S的化合价可以 ,所以具有 。
+6
S的化合价可以 ,所以具有 。
-2
S、S的化合价可以 ,所以具有 。
0
+4
一般能从价态判断物质的氧化性、还原性:
具有低价态的化合物有还原性,具有高价态的化合物有氧化性,具有中间价态的化合物,既有氧化性又有还原性。
练习:分析下列变化过程是否氧化还原反应
①Fe→FeCl2 需加 剂,如 。
②CuO → Cu 需加 剂,如 。
③HCl → Cl2 需加 剂,如 。
④HCl → H2 需加 剂,如 。
氧化
氧化
还原
HCl
H2
KMnO4
还原
Zn
氧化剂 Cl2 O2 浓H2SO4 HNO3 KMnO4(H+)、MnO2 Fe3+ KClO3 H2O2
还原产物 Cl- O2- SO2 NO或NO2 Mn2+ Fe2+ Cl- H2O
还原剂 M (金属) I-(HI) S2-(H2S) CO、C H2 NH3 SO2、 SO32- H2O2
氧化产物 Mn+ I2 S CO2 H+ NO SO42- O2
常见氧化剂和还原剂及对应产物
同一元素相邻价态转化最容易。
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化性、还原性强弱的判断
方法1.根据氧化还原方程式判断:两强生两弱
规律:强氧化剂+强还原剂=弱还原剂+弱氧化剂
练习1.
已知反应:Fe+CuSO4=Cu+FeSO4,请找出该反应的氧化剂、还原剂、氧化产物、还原产物 ,并比较氧化剂与氧化产物的氧化性强弱,还原剂与还原产物的还原性强弱。
还原性:
还原剂
还原产物
氧化性:
Fe > Cu
Cu2+ > Fe2+
氧化剂
氧化产物
2.己知反应:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
D
试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是( )
Cl2 > Fe3+ > I2 > SO2
判断反应进行的方向
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
金属活泼性依次减弱,
单质的还原性依次减弱
金属
Na-e-=Na+
Al-3e-=Al3+
氧化性和还原性的强弱关系和得失电子的数目无关,只与物质得失电子的能力有关。
阳离子的氧化性逐渐增强
F
Cl
Br
I
S
F-
Cl-
Br-
I-
S2-
单质的氧化性依次减弱
非金属
阴离子的还原性依次增强
方法2.根据物质活动性顺序比较:
方法3.根据反应结果(产物的价态)判断:
同一物质在相同条件下,被氧化(被还原)的程度越大,氧化剂(还原剂)的氧化性(还原性)越强。
如: 2Fe+3Cl2=2FeCl3
Fe+S=FeS,
则氧化性:Cl2>S。
方法4.从反应难易程度(温度、浓度、酸碱性)和反应的剧烈程度判断:
一般反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 5Cl2↑+8H2O,
氧化性:KMnO4>MnO2。
△
注意:同种元素,一般价态越高,氧化性越强;价态越低,还原性越强。如氧化性:Fe3+>Fe2+、HNO3>NO2、KMnO4>MnO2;还原性:I->I2、H2S>SO2。
但也有一些例外,如HClO的氧化性比HClO3和HClO4都强。
G、Q、X、Y、Z五种物质均为氯的含氧化合物,现在不了解它们的化学式,但知道它们在一定条件下具有如下转化关系:
⑴G — Q + NaCl ⑵Q + H2O — X + H2
⑶Y + NaOH — G + Q + H2O
⑷Z + NaOH — X + Q + H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A、Q、G、Z、Y、X B、G、Y、Q、Z、X
C、G、Y、Z、Q、X D、Z、X、G、Y、Q
B
AD
已知三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
分析:氧化性:MnO4- > Cl2 > Fe3+ > I2
还原性:Mn2+应用规律技巧:“上左下右可反应”“两强可反应”,即强的氧化剂与强的还原剂可发生反应。
1、价态规律
元素处于最低价:只有还原性
元素处于最高价:只有氧化性
元素处于中间价态:既有氧化性,又有还原性
如:KMnO4 、HNO3、F2(无正价)、O2(一般不显正价)
如:HCl、 HBr 、 HI 、 H2S
如:Cl2 、 SO2 、Fe2+
氧化还原反应的规律
若某物质由多种元素组成,其性质由这些元素性质综合体现,如HCl中H处于最高价态(+1价),Cl处于最低价态(-1价),故HCl既有氧化性,又有还原性。
2、归中规律
同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉” 。
-2
0
+6
+4
同一元素相邻价态之间不发生氧化还原反应。
浓H2SO4具有强氧化性,SO2具有强还原性,为什么浓H2SO4可干燥SO2 ?
3、先后规律
同一氧化剂与多种还原剂反应时,还原性强的物质先反应;
同一还原剂与多种氧化剂反应时,氧化性强的物质先反应。
例:在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A、Mg B、Cu C、Ag D、H2
C
强者优先,有序进行,依次完成
例如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,
若氯气量不足时首先氧化Fe2+;
把氯气通入FeI2溶液时,还原性I->Fe2+,
若氯气量不足时首先氧化 I-。
记住氧化性: Cl2 > Br2 > Fe3+ > I2
记住还原性: Cl- < Br- < Fe2+ < I-
1、向含FeI2的溶液中通入Cl2 :
当通入少量Cl2时,反应的离子方程式为 ,
当通入足量Cl2时,反应的离子方程式为
。
2I- +Cl2= I2 +2Cl-
2Fe2+ + 4I- + 3Cl2 = 2Fe3+ + 2I2 +6Cl-
【已知:还原性:I->Fe2+>Br->Cl-】
2、向含FeBr2的溶液中通入Cl2 :
当通入少量Cl2时,反应的离子方程式为
,
当通入足量Cl2时,反应的离子方程式为
。
2Fe2+ + Cl2 = 2Fe3+ +2Cl-
2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 +6Cl-
【已知:还原性:I->Fe2+>Br->Cl-】
4、守恒规律
还原剂失电子总数=氧化剂得电子总数=反应中电子转移数
【例】在酸性条件下,可发生反应:
ClO3-+2M3++4H2O===M2O7n-+Cl-+8H+, M2O7n-中M的化合价是( )
A.+4 B.+5 C.+6 D.+7
C
即:化合价升高总数 = 化合价降低总数
解法2:根据离子方程式两端电荷总数相等有:
2×3-1=8-1-n,n=2,在M2O72-中M的化合价为+6价。应选C。
解法1:根据氧化还原反应中的电子得失相等有:
设M2O7n-中M的化合价为x,2 × (x–3) =[5–(–1)],所以x=6。应选C。
练习:在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是 ( )
A +4 B +5 C +6 D +7
B
2、用含3×103个Na2SO3的溶液,恰好将2×103个的XO4-离子还原,则元素X在还原产物中的化合价是( )
(A) +1 (B) +2 (C) +3 (D) +4
D
1、硫代硫酸钠可作为脱氯剂,已知含25个Na2S2O3的溶液恰好把100个Cl2完全转化为Cl-,则S2O32-将转化成( )
A.S2- B.S C.SO32- D.SO42-
D
3、在一定温度下,向KOH溶液中通入0.5mol氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是( )
A.0.1 mol KClO3 B.0.2 mol KClO3
C.0.1 mol KClO4 D.0.2 mol KClO4
A
计算牢记三守恒:元素守恒、
电荷守恒、
得失电子守恒
A、0.9 mol B、1 mol C、1.6 mol D、2.2 mol
解:Cu2S失电子总数为0.3×(2+8)=3mol
4、0.3 molCu2S 与足量的硝酸反应,生成硝酸铜,硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸物质的量为( ),参加反应的硝酸物质的量为( )
B
由于HNO3 NO得3e-,则被还原的HNO3为1mol
参加反应的的HNO3为: 1+ 0.6×2 =2.2 mol
D
C
【典型例题】从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O==7Cu2S+5FeSO4+12H2SO4 。
下列说法正确的是( )
A.CuSO4是氧化剂,FeS2是还原剂
B.产物中的SO42-一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为17: 7
F.1mol FeS2发生反应,有2mol电子转移
B
+2 -1 +1 -2 +6 +6
氧化剂、还原剂
第二课时
知识回顾
1、从物质得氧失氧、化合价的升降、电子转移三个角度给氧化还原反应定义。氧化还原反应的特征、本质以及规律分别是什么?
答:物质得氧失氧的反应是氧化还原反应,有元素化合价升降的反应是氧化还原反应,有电子转移的反应是氧化还原反应 。
其特征和判据是元素的化合价升降,
本质是电子的转移。
C
探究新知
Fe+CuSO4 == FeSO4+Cu
0
+2
+2
0
化合价升高,失电子,被氧化,发生氧化反应
化合价降低,得电子,被还原,发生还原反应
二、氧化剂、还原剂
还原剂
氧化剂
还原产物
氧化产物
氧化反应
(被氧化)
还原产物
还原反应
(被还原)
还原剂
氧化产物
失电子
得电子
化合价
升高
化合价
降低
氧化剂
氧化还原反应的基本概念及关系
得失电子数 相等
化合价升降数相等
还、失、升、氧氧、得、降、还
守恒律
----计算
氧化剂和还原剂在氧化还原反应中分别表现什么性质?起什么作用?
答:氧化剂具有氧化性,即得电子的性质;
还原剂具有还原性,即失电子的性质。
注:氧化性、还原性的强弱是指得失电子的难易程度,
不是指得失电子的多少(数目)
① Fe2O3 + 3CO == 2Fe + 3CO2
② Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③SO2 + 2H2S == 2H2O + 3S↓
④2KClO3 == 2KCl+3O2↑
MnO2
【做一做】
1、请找出下列反应中氧化剂、还原剂、氧化产物和还原产物
⑤Cl2+2NaOH=NaCl+NaClO+H2O
⑥4 FeS2 + 11O2 == 2Fe2O3 + 8SO2
高温
3、在反应: 3Cl2 + 6NaOH =5NaCl + NaClO3+3H2O中,___元素被氧化, ___元素被还原,氧化剂是_____,还原剂是_____,氧化产物是_______,还原产物是_____, NaOH是既不是氧化剂也不是还原剂; 氧化剂与还原剂质量比= 。
2、3Cl2 + 8NH3 = 6NH4Cl+N2 ,氧化剂是_____, 还原剂是_____,氧化产物是_______,还原产物是_______,8个 NH3参加反应时,被Cl2氧化的NH3 的数目为____,氧化剂与还原剂分子个数比= 。
Cl
Cl
Cl2
Cl2
NaClO3
NaCl
NH3
N2
NH4Cl
2
Cl2
5:1
3:2
4、SO2 + 2H2S == 2H2O + 3S↓,氧化剂 ,还原剂是 ,氧化产物是 ,还原产物是 ,氧化产物与还原产物质量比= 。
SO2
H2S
S
S
2:1
5、3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,被还原的HNO3和未被还原的HNO3的质量之比为_____,该反应体现了HNO3的 ______性和 ____性。
1:3
氧化
酸
常见的氧化剂
1)活泼的非金属单质:F2、Cl2、Br2、I2、O2 、O3等。
2)高价的化合物:MnO2、PbO2 、NO2、KClO3 、 K2Cr2O7 、KMnO4等。
3)某些酸: 浓H2SO4 、HNO3 、HClO等。
4)某些阳离子:Ag+、Fe3+、Cu2+ 、 H+
5)过氧化物及其他:Na2O2、H2O2、NaClO等
氧化性:
KMnO4>Cl2>浓H2SO4>Br2>Fe3+>Cu2+>H+>Fe2+
(1)活泼的金属单质:K 、Na 、 Mg 、 Fe 、 Al
(2)某些非金属单质:H2 、C、P、Si
(3)含有较低化合价元素的化合物:H2S、Na2S、HI、NH3、CO、SO2、Na2SO3 、FeCl2等。
(4)某些离子: I-、S2-、Fe2+
常见的还原剂
还原性: S2- > SO32-(或HSO3-) > I- > Fe2+ > Br- > Cl-
硫:
―2
0
+4
+6
S的化合价可以 ,所以具有 。
+6
S的化合价可以 ,所以具有 。
-2
S、S的化合价可以 ,所以具有 。
0
+4
一般能从价态判断物质的氧化性、还原性:
具有低价态的化合物有还原性,具有高价态的化合物有氧化性,具有中间价态的化合物,既有氧化性又有还原性。
练习:分析下列变化过程是否氧化还原反应
①Fe→FeCl2 需加 剂,如 。
②CuO → Cu 需加 剂,如 。
③HCl → Cl2 需加 剂,如 。
④HCl → H2 需加 剂,如 。
氧化
氧化
还原
HCl
H2
KMnO4
还原
Zn
氧化剂 Cl2 O2 浓H2SO4 HNO3 KMnO4(H+)、MnO2 Fe3+ KClO3 H2O2
还原产物 Cl- O2- SO2 NO或NO2 Mn2+ Fe2+ Cl- H2O
还原剂 M (金属) I-(HI) S2-(H2S) CO、C H2 NH3 SO2、 SO32- H2O2
氧化产物 Mn+ I2 S CO2 H+ NO SO42- O2
常见氧化剂和还原剂及对应产物
同一元素相邻价态转化最容易。
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应
失ne-,化合价升高,被氧化,发生氧化反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化性、还原性强弱的判断
方法1.根据氧化还原方程式判断:两强生两弱
规律:强氧化剂+强还原剂=弱还原剂+弱氧化剂
练习1.
已知反应:Fe+CuSO4=Cu+FeSO4,请找出该反应的氧化剂、还原剂、氧化产物、还原产物 ,并比较氧化剂与氧化产物的氧化性强弱,还原剂与还原产物的还原性强弱。
还原性:
还原剂
还原产物
氧化性:
Fe > Cu
Cu2+ > Fe2+
氧化剂
氧化产物
2.己知反应:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
D
试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是( )
Cl2 > Fe3+ > I2 > SO2
判断反应进行的方向
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
金属活泼性依次减弱,
单质的还原性依次减弱
金属
Na-e-=Na+
Al-3e-=Al3+
氧化性和还原性的强弱关系和得失电子的数目无关,只与物质得失电子的能力有关。
阳离子的氧化性逐渐增强
F
Cl
Br
I
S
F-
Cl-
Br-
I-
S2-
单质的氧化性依次减弱
非金属
阴离子的还原性依次增强
方法2.根据物质活动性顺序比较:
方法3.根据反应结果(产物的价态)判断:
同一物质在相同条件下,被氧化(被还原)的程度越大,氧化剂(还原剂)的氧化性(还原性)越强。
如: 2Fe+3Cl2=2FeCl3
Fe+S=FeS,
则氧化性:Cl2>S。
方法4.从反应难易程度(温度、浓度、酸碱性)和反应的剧烈程度判断:
一般反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 5Cl2↑+8H2O,
氧化性:KMnO4>MnO2。
△
注意:同种元素,一般价态越高,氧化性越强;价态越低,还原性越强。如氧化性:Fe3+>Fe2+、HNO3>NO2、KMnO4>MnO2;还原性:I->I2、H2S>SO2。
但也有一些例外,如HClO的氧化性比HClO3和HClO4都强。
G、Q、X、Y、Z五种物质均为氯的含氧化合物,现在不了解它们的化学式,但知道它们在一定条件下具有如下转化关系:
⑴G — Q + NaCl ⑵Q + H2O — X + H2
⑶Y + NaOH — G + Q + H2O
⑷Z + NaOH — X + Q + H2O
这五种化合物中氯的化合价由低到高的顺序为( )
A、Q、G、Z、Y、X B、G、Y、Q、Z、X
C、G、Y、Z、Q、X D、Z、X、G、Y、Q
B
AD
已知三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
分析:氧化性:MnO4- > Cl2 > Fe3+ > I2
还原性:Mn2+
1、价态规律
元素处于最低价:只有还原性
元素处于最高价:只有氧化性
元素处于中间价态:既有氧化性,又有还原性
如:KMnO4 、HNO3、F2(无正价)、O2(一般不显正价)
如:HCl、 HBr 、 HI 、 H2S
如:Cl2 、 SO2 、Fe2+
氧化还原反应的规律
若某物质由多种元素组成,其性质由这些元素性质综合体现,如HCl中H处于最高价态(+1价),Cl处于最低价态(-1价),故HCl既有氧化性,又有还原性。
2、归中规律
同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,不交叉” 。
-2
0
+6
+4
同一元素相邻价态之间不发生氧化还原反应。
浓H2SO4具有强氧化性,SO2具有强还原性,为什么浓H2SO4可干燥SO2 ?
3、先后规律
同一氧化剂与多种还原剂反应时,还原性强的物质先反应;
同一还原剂与多种氧化剂反应时,氧化性强的物质先反应。
例:在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A、Mg B、Cu C、Ag D、H2
C
强者优先,有序进行,依次完成
例如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,
若氯气量不足时首先氧化Fe2+;
把氯气通入FeI2溶液时,还原性I->Fe2+,
若氯气量不足时首先氧化 I-。
记住氧化性: Cl2 > Br2 > Fe3+ > I2
记住还原性: Cl- < Br- < Fe2+ < I-
1、向含FeI2的溶液中通入Cl2 :
当通入少量Cl2时,反应的离子方程式为 ,
当通入足量Cl2时,反应的离子方程式为
。
2I- +Cl2= I2 +2Cl-
2Fe2+ + 4I- + 3Cl2 = 2Fe3+ + 2I2 +6Cl-
【已知:还原性:I->Fe2+>Br->Cl-】
2、向含FeBr2的溶液中通入Cl2 :
当通入少量Cl2时,反应的离子方程式为
,
当通入足量Cl2时,反应的离子方程式为
。
2Fe2+ + Cl2 = 2Fe3+ +2Cl-
2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 +6Cl-
【已知:还原性:I->Fe2+>Br->Cl-】
4、守恒规律
还原剂失电子总数=氧化剂得电子总数=反应中电子转移数
【例】在酸性条件下,可发生反应:
ClO3-+2M3++4H2O===M2O7n-+Cl-+8H+, M2O7n-中M的化合价是( )
A.+4 B.+5 C.+6 D.+7
C
即:化合价升高总数 = 化合价降低总数
解法2:根据离子方程式两端电荷总数相等有:
2×3-1=8-1-n,n=2,在M2O72-中M的化合价为+6价。应选C。
解法1:根据氧化还原反应中的电子得失相等有:
设M2O7n-中M的化合价为x,2 × (x–3) =[5–(–1)],所以x=6。应选C。
练习:在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是 ( )
A +4 B +5 C +6 D +7
B
2、用含3×103个Na2SO3的溶液,恰好将2×103个的XO4-离子还原,则元素X在还原产物中的化合价是( )
(A) +1 (B) +2 (C) +3 (D) +4
D
1、硫代硫酸钠可作为脱氯剂,已知含25个Na2S2O3的溶液恰好把100个Cl2完全转化为Cl-,则S2O32-将转化成( )
A.S2- B.S C.SO32- D.SO42-
D
3、在一定温度下,向KOH溶液中通入0.5mol氯气恰好完全反应生成三种含氯盐:0.7 mol KCl、0.2 mol KClO和X。则X是( )
A.0.1 mol KClO3 B.0.2 mol KClO3
C.0.1 mol KClO4 D.0.2 mol KClO4
A
计算牢记三守恒:元素守恒、
电荷守恒、
得失电子守恒
A、0.9 mol B、1 mol C、1.6 mol D、2.2 mol
解:Cu2S失电子总数为0.3×(2+8)=3mol
4、0.3 molCu2S 与足量的硝酸反应,生成硝酸铜,硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸物质的量为( ),参加反应的硝酸物质的量为( )
B
由于HNO3 NO得3e-,则被还原的HNO3为1mol
参加反应的的HNO3为: 1+ 0.6×2 =2.2 mol
D
C
【典型例题】从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O==7Cu2S+5FeSO4+12H2SO4 。
下列说法正确的是( )
A.CuSO4是氧化剂,FeS2是还原剂
B.产物中的SO42-一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为17: 7
F.1mol FeS2发生反应,有2mol电子转移
B
+2 -1 +1 -2 +6 +6
