第四章 物质结构元素周期律 单元同步训练卷 (含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律 单元同步训练卷 (含解析)2022-2023学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 492.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-04 16:04:28 | ||
图片预览



文档简介
第四章 物质结构 元素周期律 单元同步训练卷
一、单选题
1.根据下列“实验操作及现象”能得出对应“实验结论”的一组是
选项 实验操作及现象 实验结论
A 用盐酸洗净的铁丝蘸取某溶液在火焰上灼烧,观察到火焰为黄色 该溶液中含Na+、不含K+
B 向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解 铝元素表现出一定的非金属性
C 向2mLKI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液,溶液变蓝色 Br2还原性比I2的强
D 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中一定含有Cl-
A.A B.B C.C D.D
2.下列关于离子键、共价键的叙述中正确的是
A.所有物质中都存在化学键
B.由非金属元素组成的物质中只含有共价键,不存在离子键
C.化学反应的实质是旧键的断裂和新键的形成
D.离子键就是阴离子与阳离子之间的静电吸引力
3.下列化学用语书写不正确的是
A.N2的电子式:
B.HClO的结构式为H-Cl-O
C.KNO3的电离方程式:KNO3=K++NO
D.用电子式表示NaCl的形成过程:
4.下列说法一定错误的是
A.某些花岗石产生氡(Rn),从而对人体产生伤害,Rn元素的相对原子质量是222
B.Se是人体必需的微量元素,Se和Se互为同位素,是两种不同的核素
C.U的浓缩一直被国际社会关注,其中子数和质子数之差为51
D.115号元素在元素周期表中的位置为第七周期VA族
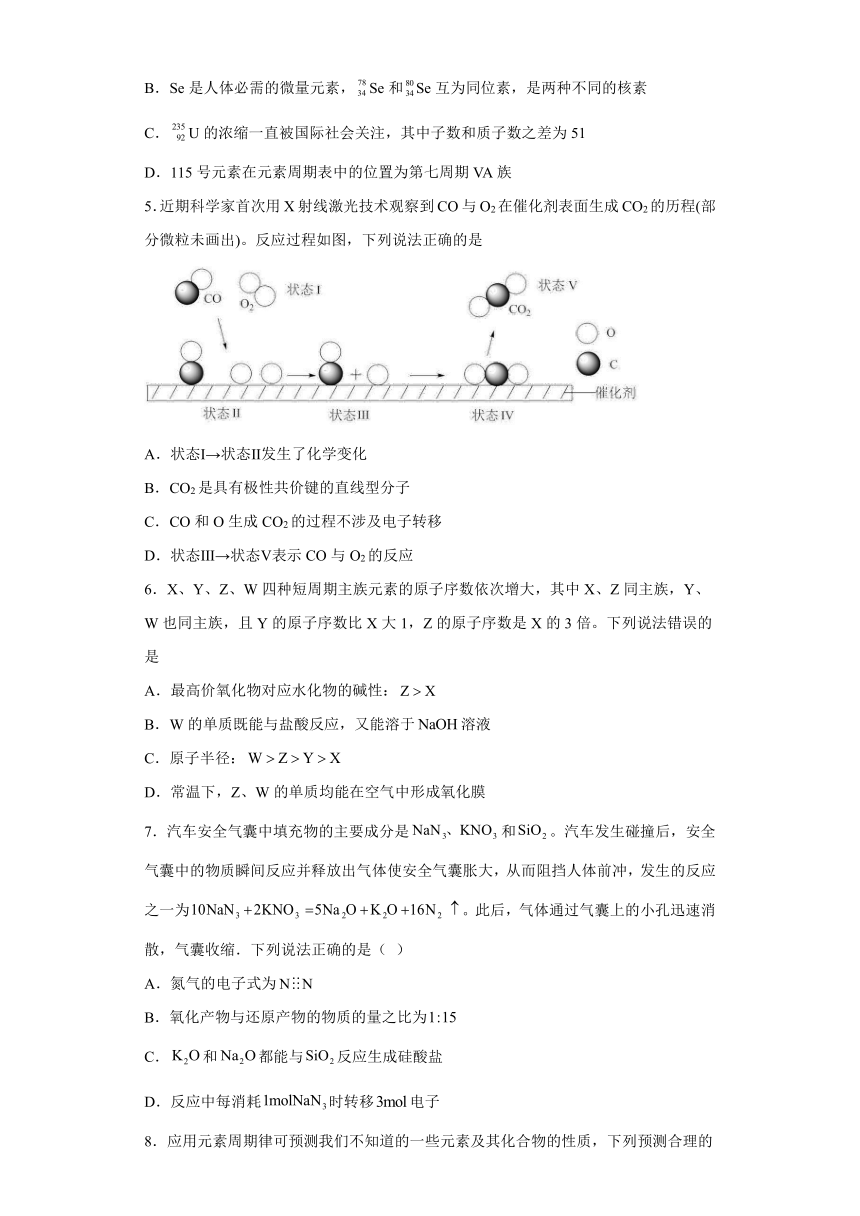
5.近期科学家首次用X射线激光技术观察到CO与O2在催化剂表面生成CO2的历程(部分微粒未画出)。反应过程如图,下列说法正确的是
A.状态Ⅰ→状态Ⅱ发生了化学变化
B.CO2是具有极性共价键的直线型分子
C.CO和O生成CO2的过程不涉及电子转移
D.状态Ⅲ→状态Ⅴ表示CO与O2的反应
6.X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Y、W也同主族,且Y的原子序数比X大1,Z的原子序数是X的3倍。下列说法错误的是
A.最高价氧化物对应水化物的碱性:
B.W的单质既能与盐酸反应,又能溶于溶液
C.原子半径:
D.常温下,Z、W的单质均能在空气中形成氧化膜
7.汽车安全气囊中填充物的主要成分是和。汽车发生碰撞后,安全气囊中的物质瞬间反应并释放出气体使安全气囊胀大,从而阻挡人体前冲,发生的反应之一为。此后,气体通过气囊上的小孔迅速消散,气囊收缩.下列说法正确的是( )
A.氮气的电子式为
B.氧化产物与还原产物的物质的量之比为
C.和都能与反应生成硅酸盐
D.反应中每消耗时转移电子
8.应用元素周期律可预测我们不知道的一些元素及其化合物的性质,下列预测合理的是
A.S与Se同主族,无色,有毒,比稳定
B.At与Cl同主族,AgAt可溶于水
C.Be的氧化物可能具有两性
D.Li在氧气中剧烈燃烧,产物是
9.短周期主族元素R、X、Y、Z的原子序数依次增大,R的氧化物是形成酸雨的“元凶”之一,在短周期主族元素中X的金属性最强,Y的简单氢化物的化学式为H2Y。下列推断正确的是
A.简单氢化物的稳定性:Y>Z B.简单离子半径:X<Y<Z
C.常见单质的熔点:R<Z<Y D.R最多可以形成五种不同的氧化物
10.如图表示(g)和(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
A.中的化学键属于离子键
B.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
C.通常情况下,(g)和(g)混合能直接生成NO
D.当高温的汽车尾气通过净化装置时,其中的催化剂可以将氧化成
11.短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,C是空气中含量最多的元素,D是地壳中含量最多的元素,E、F和G同周期,E在该周期中原子半径最大,F的单质中有一种是淡黄色的固体。下列说法错误的是
A.原子半径:E>F>G>C>D>A
B.氧化物对应的水化物酸性:FC.D与E、E与G均可形成离子化合物
D.A与E形成的化合物电子式为
12.短周期主族元素X、Y、Z在元素周期表中的位置如图所示,Z的最外层电子数是电子层数的2倍。下列说法正确的是
A.Y的原子半径比Z的小
B.常温下Y不与X单质反应
C.X的气态氢化物稳定性比Z强
D.Y的最高价氧化物对应水化物是强碱
13.短周期元素X、Y、Z、W的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中金属性最大,二元化合物E中元素Y和W的质量比为23∶16,元素Z是地壳中含量第二多的元素。下列说法正确的是
A.简单离子的半径Y >W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和Cu的单质混合加热可得化合物
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
二、多选题
14.短周期元素W、X、Y、Z的原子序数依次增大,W、Z位于同主族,四种元素组成的一种化合物的结构式如图。下列说法不正确的是
A.可用焰色反应鉴别该物质中Y元素的存在
B.W的最简单氢化物的稳定性比X的强
C.原子半径:Y>Z>X>W
D.W与Y形成的化合物中一定含有离子键
三、非选择题
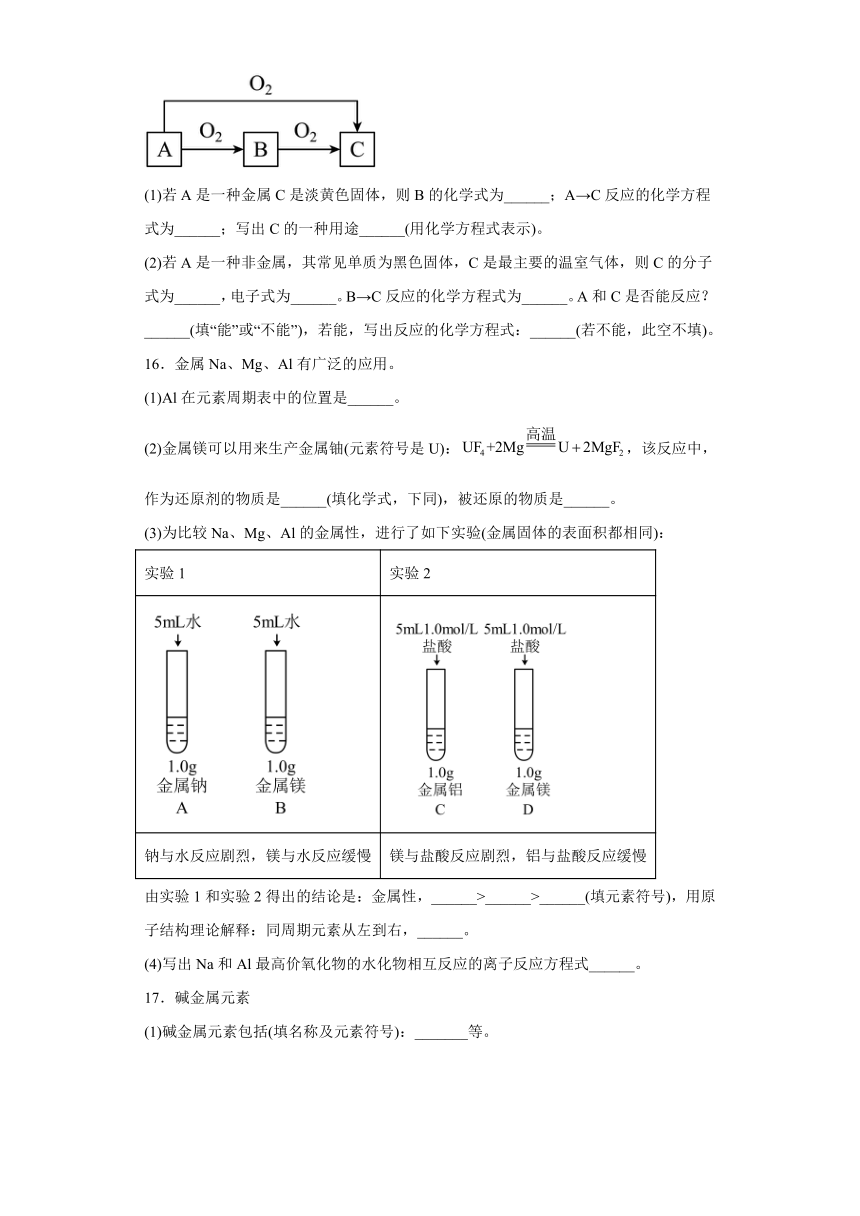
15.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属C是淡黄色固体,则B的化学式为______;A→C反应的化学方程式为______;写出C的一种用途______(用化学方程式表示)。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为______,电子式为______。B→C反应的化学方程式为______。A和C是否能反应?______(填“能”或“不能”),若能,写出反应的化学方程式:______(若不能,此空不填)。
16.金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是______。
(2)金属镁可以用来生产金属铀(元素符号是U):,该反应中,作为还原剂的物质是______(填化学式,下同),被还原的物质是______。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 实验2
钠与水反应剧烈,镁与水反应缓慢 镁与盐酸反应剧烈,铝与盐酸反应缓慢
由实验1和实验2得出的结论是:金属性,______>______>______(填元素符号),用原子结构理论解释:同周期元素从左到右,______。
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式______。
17.碱金属元素
(1)碱金属元素包括(填名称及元素符号):_______等。
(2)碱金属的原子结构(Li→Cs)
①相似性:最外层均有_______个电子。
②递变性:电子层数逐渐增多,原子半径逐渐_______。
(3)碱金属的化学性质
①钠、钾与氧气反应比较实验
a.实验现象:都能在空气中燃烧,钠产生_______色火焰,钾产生_______色火焰(透过蓝色钴玻璃观察),钾燃烧更剧烈。
b.反应方程式_______、_______。
②钾与水反应的实验
a.现象:浮于水面上,并熔化为闪亮的小球四处游动,发出嘶嘶的响声,并伴有燃烧,溶液呈红色。
b.化学方程式:_______。
c.与Na和水反应相比现象不同的有_______,结论:活泼性K比Na_______。
③锂与氧气(加热)、H2O反应的化学方程式分别为_______;_______。
(4)碱金属性质的递变规律及原因
从Li→Cs,电子层数逐渐_______,原子半径逐渐_______,原子核对最外层电子的引力逐渐_______,原子失去电子的能力逐渐_______,金属性逐渐_______。
(5)碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈_______色,它们都比较软,有延展性,密度较_______,熔点较_______,导电、导热性强
递变规律 密度 逐渐_______(钠、钾反常)
熔、沸点 逐渐_______
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
18.请利用元素周期律和元素周期表的有关知识回答下列问题。
(1)下列关于元素性质或原子结构递变情况的叙述中,错误的是______
A.Li、Be、B原子的最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.N、O、F原子的半径依次增大
D.Na、K、Rb原子核外的电子层数依次增多
(2)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素。______
A.一定是第2周期元素 B.一定是同一周期元素
C.一定分别位于第2、3周期 D.可以相互化合形成化合物
(3)短周期元素A、B、C在元素周期表中的位置如图所示。已知B、C两元素的原子序数之和是A元素的原子序数的4倍,则A、B、C分别是______
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
(4)X、Y、Z是相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是_________
A.Mg、Al、Si B.Li、Be、Mg C.N、O、S D.P、S、O
试卷第1页,共3页
参考答案:
1.B
【详解】A.钠的焰色试验呈黄色,而要检验溶液中是否含钾离子时,应透过蓝色的钴玻璃观察火焰是否呈紫色,透过蓝色的钴玻璃未观察到紫色火焰时才能确定不含钾离子,A错误;
B.向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解,因为发生了反应:,氢氧化铝表现出了酸性,则铝元素表现出一定的非金属性,B正确
C.向2mLKI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液,溶液变蓝色,说明发生反应,Br2 为氧化剂,I2为氧化产物,则Br2氧化性比I2的强,C错误;
D.向某溶液中滴加AgNO3溶液,产生的白色沉淀可以为氯化银、或碳酸银等,则该溶液中不一定含有Cl-,D错误;
答案选B。
2.C
【详解】A. 稀有气体由原子直接构成,其中不存在化学键,A错误;
B.铵盐由非金属元素组成,铵盐内有离子键、还有共价键,B错误;
C.物质(除了稀有气体外)内都存在化学键, 化学反应中物质发生了变化,有新的物质生成,则化学反应的实质是旧键的断裂和新键的形成,C正确;
D. 离子键就是阴离子与阳离子之间强烈的静电作用,既有静电吸引力又有斥力,D错误;
答案选C。
3.B
【详解】A. N2是共价分子,分子内氮原子间共用三对电子对,则电子式:,A正确;
B. HClO是共价分子,分子内氧原子分别与氢、氯原子共用一对电子对,结构式为H-O-Cl,B错误;
C. KNO3完全电离为钾离子和硝酸根,电离方程式:KNO3=K++NO,C正确;
D.钠原子失去电子形成钠离子,氯原子得到电子形成氯离子,钠离子和氯离子结合成氯化钠, 氯化钠是离子化合物,用电子式表示NaCl的形成过程:,D正确;
答案选B。
4.A
【详解】A. Rn的质量数、该核素的相对近似原子质量为222,但不知该元素的其它同位素的相对原子质量以及原子个数百分比,所以无法计算元素的相对原子质量,A项错误;
B. Se和Se的质子数相同都为34,中子数分别为44、46,是两种不同的核素,互为同位素,B项正确;
C.U的浓缩一直被国际社会关注,其质子数为92,中子数为235-92=143,两者之差为51,C项正确;
D.第七周期稀有气体原子序数=86+32=118,118号是第七周期最后一种元素,位于18列,115号元素处于第15列,故115号元素在元素周期表中的位置为第七周期VA族,D项正确;
答案选A。
5.B
【详解】A.状态Ⅰ→状态Ⅱ只是氧氧双键 ,没有发生化学变化,故A错误;
B.CO2含有碳双双键,是具有极性共价键的直线型分子,故B正确;
C.CO和O生成CO2的过程,碳化合价升高,涉及电子转移,故C错误;
D.状态Ⅲ→状态Ⅴ表示CO与O的反应,不是与O2反应,故D错误。
综上所述,答案为B。
6.C
【分析】由题干信息可知,X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Z的原子序数是X的3倍,则 X为1、Z为3、则Y为He不是主族元素(舍去),X为Be、Z为Mg,且Y的原子序数比X大1,故Y为B,Y、W也同主族,W为Al,据此分析解题。
【详解】A.由分析可知,X为Be、Z为Mg,则金属性Be<Mg,故最高价氧化物对应水化物的碱性Mg(OH)2>Be(OH)2,即,A正确;
B.由分析可知,W为Al,故W的单质既能与盐酸反应,又能溶于溶液,反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B正确;
C.由分析可知,X、Y、Z、W分别为Be、B、Mg、Al,则原子半径相对大小为:Mg>Al>Be>B即,C错误;
D.由分析可知,Z为Mg,W为Al,故常温下,Z、W的单质均能在空气中形成氧化膜,D正确;
故答案为:C。
7.C
【详解】A.氮气的电子式为: ,A错误;
B.在该反应中被氧化生成氧化产物,因此氧化产物与还原产物的物质的量之比为,B错误;
C.和都为碱性氧化物,能与酸性氧化物反应生成硅酸盐,C正确;
D.反应中每消耗时转移电子,D错误;
故选C。
8.C
【详解】A.S与Se同主族,从上往下非金属性减弱,气态氢化物的稳定性减弱,故无色,有毒,不如稳定,A错误;
B.At与Cl同主族,AgCl、AgBr、AgI的溶解度越来越小,故AgAt难溶于水,B错误;
C.Be与Al处于对角线的位置,Al的氧化物具有两性,根据对角线规则,Be的氧化物可能具有两性,C正确;
D.Li在氧气中剧烈燃烧,产物是,D错误;
故选C。
9.C
【分析】短周期主族元素R、X、Y、Z的原子序数依次增大,在短周期主族元素中X的金属性最强,X是Na;R的氧化物是形成酸雨的“元凶”之一,R是N元素;Y的简单氢化物的化学式为H2Y,Y的化合价为-2,Y是S元素,则Z是Cl元素。
【详解】A.同周期元素从左到右非金属性增强,气态氢化物稳定性增强,简单氢化物的稳定性:HCl>H2S,故A错误;
B.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,简单离子半径:Na+<Cl-<S2-,故B错误;
C.常温下,硫是固体,N2、Cl2是气体,硫的熔点最高,N2的相对分子质量小于Cl2,Cl2的熔点大于N2,常见单质的熔点:N2<Cl2<S,故C正确;
D.N形成的氧化物有N2O、NO、N2O3、NO2、N2O4、N2O5,故D错误;
选C。
10.B
【详解】A.中的化学键属于共价键,A错误;
B.1mol (g)和1mol (g)反应生成2mol NO(g)的反应热为:,为吸热反应,故1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量,B正确;
C.通常情况下,(g)和(g)混合不能直接生成NO,需要在放电条件下进行,C错误;
D.氮元素化合价降低,故催化剂将还原成,D错误;
故选B。
11.B
【分析】短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,则A为H,C是空气中含量最多的元素,则C为N,D是地壳中含量最多的元素,则D为O,E、F和G同周期,E在该周期中原子半径最大,则E为Na,F的单质中有一种是淡黄色的固体,则F为S,G为Cl。
【详解】A.根据层多径大,同电子层结构核多径小,则原子半径:E>F>G>C>D>A,故A正确;
B.氧化物对应的水化物酸性不一定是F<G,比如硫酸酸性大于次氯酸酸性,若是最高价氧化物对应的水化物酸性,则有F<G,故B错误;
C.D与E形成氧化钠或过氧化钠,E与G形成氯化钠,都为离子化合物,故C正确;
D.A与E形成的化合物NaH,NaH是离子化合物,其电子式为,故D正确。
综上所述,答案为B。
12.C
【分析】由图可知Z位于元素周期表第三周期,电子层数为3,又因为Z的最外层电子数是电子层数的2倍,所以Z最外层电子数为6,Z为S;结合X、Y与Z的相对位置可知,X为O,Y为Al,据此解答该题。
【详解】A.Al与S位于同一周期,电子层数相同,S的核电荷数大,半径小,因此Y的半径比Z的大,A错误;
B.Al性质活泼,常温下极易与氧气反应生成氧化铝,B错误;
C.O的非金属性比S强,O的气态氢化物更稳定,因此X的气态氢化物的稳定性比Z强,C正确;
D.Y为Al,最高价氧化物对应水化物为氢氧化铝,为两性氢氧化物,是弱碱,D错误;
故选C。
13.C
【分析】短周期元素X、Y、Z、W的原子序数依次增大,元素Z是地壳中含量第二多的元素,Z是Si元素,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,X是C元素;Y在同周期中金属性最大,Y是Na元素;二元化合物E中元素Y和W的质量比为23∶16,W是S元素。
【详解】A.电子层数越多半径越大,简单离子的半径S2->Na+,故A错误;
B.最高价氧化物对应水化物的酸性H2SO4>H2CO3>H2SiO3,故B错误;
C.S的氧化性较弱,S和Cu的单质混合加热可得化合物,故C正确;
D.S在足量的氧气中燃烧生成SO2,SO2溶于水生成H2SO3,H2SO3是弱酸,故D错误;
选C。
14.BC
【分析】短周期元素W、X、Y、Z的原子序数依次增大,由结构图可知,W能形成2个共价键,Z能形成6个共价键,且W、Z位于同主族,则W为O,Z为S;X能形成1个共价键,则X为F;Y能形成+1价阳离子,则Y为Na,据此分析解答。
【详解】A.Na的焰色为黄色,因此可用焰色反应鉴别该物质中Na元素的存在,A正确;
B.非金属性越强,其简单氢化物的稳定性越强,非金属性:F>O,则最简单氢化物的稳定性:HF>H2O,B错误;
C.同周期元素从左至右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则原子半径:Na>S>O>F,C错误;
D.W与Y形成的化合物为Na2O或Na2O2,两种化合物中均含有离子键,D正确;
故选BC。
15.(1) Na2O 2Na+O2Na2O2 2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑
(2) CO2 2CO+O22CO2 能 C+CO22CO
【分析】(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O ,C为Na2O2;(2)A是一种非金属,其单质为黑色固体,C是最主要的温室气体,则A为C,B为CO,C为CO2。
【详解】(1)由分析可知B为Na2O;Na在氧气中燃烧生成,则A→C反应的化学方程式为2Na+O2Na2O2;C为,可以在呼吸面具和潜水艇里作为供氧剂,化学方程式为2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑;
(2)由分析可知C的分子式为CO2,其电子式为;CO在O2中燃烧生成CO2,则B→C反应的化学方程式为2CO+O22CO2;C能和CO2发生归中反应生成CO,所以 A和C反应的化学方程式为: C+CO22CO。
16.(1)第三周期IIIA族
(2) Mg UF4
(3) Na Mg Al 原子半径逐渐减小,失电子能力逐渐减弱
(4)Al(OH)3+OH-=AlO+2H2O
【详解】(1)Al是13号元素,在元素周期表中的位置是第三周期IIIA族;
(2)反应UF4+2MgU+2MgF2中,Mg由0价变为+2价,作为还原剂的物质是Mg,U由+4价变为0价,作为氧化剂被还原,故被还原的物质是UF4;
(3)实验1:取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢,说明钠比镁活泼;实验2:取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈,说明镁比铝活泼,综上可得结论:金属的活泼性Na>Mg>Al;从原子结构理论解释上述现象是:同周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱;
(4)Na和Al最高价氧化物的水化物分别为NaOH和Al(OH)3,两者相互反应的离子反应方程式为Al(OH)3+OH-=AlO+2H2O。
17.(1)锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等
(2) 1 增大
(3) 黄 紫 2Na+O2Na2O2 K+O2KO2 2K+2H2O=2KOH+H2↑ 反应比钠和水剧烈,并伴有燃烧 活泼 4Li+O22Li2O Li+2H2O=2LiOH+H2↑
(4) 增多 增大 减弱 增强 增强
(5) 银白 小 低 增大 降低
【详解】(1)碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等,故答案为:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等;
(2)①碱金属元素的原子最外电子层上都只有1个电子,故答案为:1;
②碱金属元素从上到下电子层数逐渐增多,原子半径逐渐增大,故答案为:增大;
(3)①钠的焰色反应为黄色,钾的焰色反应为紫色,钠与氧气在加热条件在反应生成过氧化钠,反应的化学方程式为2Na+O2Na2O2,钾与氧气在加热条件在反应生成KO2,反应的化学方程式为K+O2KO2,故答案为:黄;紫;2Na+O2Na2O2;K+O2KO2;
②钾与水反应生成氢氧化钾和氢气,反应的化学方程式为2K+2H2O=2KOH+H2↑;与Na和水反应相比,钾与水反应比钠和水剧烈,并伴有燃烧,从而可知K比Na活泼,故答案为:2K+2H2O=2KOH+H2↑;反应比钠和水剧烈,并伴有燃烧;活泼;
③锂与氧气在加热条件下反应生成氧化锂,反应的化学方程式为4Li+O22Li2O;锂与水反应生成氢氧化锂和氢气,反应的化学方程式为Li+2H2O=2LiOH+H2↑,故答案为:4Li+O22Li2O;Li+2H2O=2LiOH+H2↑;
(4)同主族元素从上到下核电荷数逐渐增多,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力逐渐增强,因此金属性逐渐增强,故答案为:增多;增大;减弱;增强;增强;
(5)碱金属元素,除铯外其余都呈银白色,它们都比较软,有延展性,密度较小,熔点较低;随核电荷数递增,碱金属单质的密度逐渐增大,但Na、K反常;碱金属从上到下原子半径依次增大,金属键依次减弱,熔沸点逐渐降低,故答案为:银白;小;低;增大;降低。
18.(1)C
(2)CD
(3)D
(4)C
【详解】(1)A.Li、Be、B原子的最外层电子数依次增多,A项正确;
B.P、S、Cl元素的最高正化合价依次是+5、+6、+7,B项正确;
C.同一周期,原子半径逐渐减小,所以N、O、F原子的半径依次减小,C项错误;
D.Na、K、Rb是第ⅠA族原子,所以原子核外的电子层数依次增多,D项正确;
故答案选C。
(2)A元素原子最外层电子数是次外层电子数的3倍,则A 可以是氧元素,B元素原子次外层电子数是最外层电子数的2倍,则B可以是磷元素。故答案选CD。
(3)根据位置关系,设B的原子序数是x,则C为x+2,A为x-8+1,则根据题目信息可知x+ x+2=( x-8+1)×4,解得x=13,则A、B、C分别是C、Al、P,故答案选D。
(4)根据题目信息,三种元素相邻,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是N、O、S,故答案是C
一、单选题
1.根据下列“实验操作及现象”能得出对应“实验结论”的一组是
选项 实验操作及现象 实验结论
A 用盐酸洗净的铁丝蘸取某溶液在火焰上灼烧,观察到火焰为黄色 该溶液中含Na+、不含K+
B 向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解 铝元素表现出一定的非金属性
C 向2mLKI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液,溶液变蓝色 Br2还原性比I2的强
D 向某溶液中滴加AgNO3溶液,产生白色沉淀 该溶液中一定含有Cl-
A.A B.B C.C D.D
2.下列关于离子键、共价键的叙述中正确的是
A.所有物质中都存在化学键
B.由非金属元素组成的物质中只含有共价键,不存在离子键
C.化学反应的实质是旧键的断裂和新键的形成
D.离子键就是阴离子与阳离子之间的静电吸引力
3.下列化学用语书写不正确的是
A.N2的电子式:
B.HClO的结构式为H-Cl-O
C.KNO3的电离方程式:KNO3=K++NO
D.用电子式表示NaCl的形成过程:
4.下列说法一定错误的是
A.某些花岗石产生氡(Rn),从而对人体产生伤害,Rn元素的相对原子质量是222
B.Se是人体必需的微量元素,Se和Se互为同位素,是两种不同的核素
C.U的浓缩一直被国际社会关注,其中子数和质子数之差为51
D.115号元素在元素周期表中的位置为第七周期VA族
5.近期科学家首次用X射线激光技术观察到CO与O2在催化剂表面生成CO2的历程(部分微粒未画出)。反应过程如图,下列说法正确的是
A.状态Ⅰ→状态Ⅱ发生了化学变化
B.CO2是具有极性共价键的直线型分子
C.CO和O生成CO2的过程不涉及电子转移
D.状态Ⅲ→状态Ⅴ表示CO与O2的反应
6.X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Y、W也同主族,且Y的原子序数比X大1,Z的原子序数是X的3倍。下列说法错误的是
A.最高价氧化物对应水化物的碱性:
B.W的单质既能与盐酸反应,又能溶于溶液
C.原子半径:
D.常温下,Z、W的单质均能在空气中形成氧化膜
7.汽车安全气囊中填充物的主要成分是和。汽车发生碰撞后,安全气囊中的物质瞬间反应并释放出气体使安全气囊胀大,从而阻挡人体前冲,发生的反应之一为。此后,气体通过气囊上的小孔迅速消散,气囊收缩.下列说法正确的是( )
A.氮气的电子式为
B.氧化产物与还原产物的物质的量之比为
C.和都能与反应生成硅酸盐
D.反应中每消耗时转移电子
8.应用元素周期律可预测我们不知道的一些元素及其化合物的性质,下列预测合理的是
A.S与Se同主族,无色,有毒,比稳定
B.At与Cl同主族,AgAt可溶于水
C.Be的氧化物可能具有两性
D.Li在氧气中剧烈燃烧,产物是
9.短周期主族元素R、X、Y、Z的原子序数依次增大,R的氧化物是形成酸雨的“元凶”之一,在短周期主族元素中X的金属性最强,Y的简单氢化物的化学式为H2Y。下列推断正确的是
A.简单氢化物的稳定性:Y>Z B.简单离子半径:X<Y<Z
C.常见单质的熔点:R<Z<Y D.R最多可以形成五种不同的氧化物
10.如图表示(g)和(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
A.中的化学键属于离子键
B.1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量
C.通常情况下,(g)和(g)混合能直接生成NO
D.当高温的汽车尾气通过净化装置时,其中的催化剂可以将氧化成
11.短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,C是空气中含量最多的元素,D是地壳中含量最多的元素,E、F和G同周期,E在该周期中原子半径最大,F的单质中有一种是淡黄色的固体。下列说法错误的是
A.原子半径:E>F>G>C>D>A
B.氧化物对应的水化物酸性:F
D.A与E形成的化合物电子式为
12.短周期主族元素X、Y、Z在元素周期表中的位置如图所示,Z的最外层电子数是电子层数的2倍。下列说法正确的是
A.Y的原子半径比Z的小
B.常温下Y不与X单质反应
C.X的气态氢化物稳定性比Z强
D.Y的最高价氧化物对应水化物是强碱
13.短周期元素X、Y、Z、W的原子序数依次增大,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,Y在同周期中金属性最大,二元化合物E中元素Y和W的质量比为23∶16,元素Z是地壳中含量第二多的元素。下列说法正确的是
A.简单离子的半径Y >W
B.最高价氧化物对应水化物的酸性W>Z>X
C.W和Cu的单质混合加热可得化合物
D.W的单质在足量的氧气中燃烧,所得产物溶于水可得强酸
二、多选题
14.短周期元素W、X、Y、Z的原子序数依次增大,W、Z位于同主族,四种元素组成的一种化合物的结构式如图。下列说法不正确的是
A.可用焰色反应鉴别该物质中Y元素的存在
B.W的最简单氢化物的稳定性比X的强
C.原子半径:Y>Z>X>W
D.W与Y形成的化合物中一定含有离子键
三、非选择题
15.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属C是淡黄色固体,则B的化学式为______;A→C反应的化学方程式为______;写出C的一种用途______(用化学方程式表示)。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为______,电子式为______。B→C反应的化学方程式为______。A和C是否能反应?______(填“能”或“不能”),若能,写出反应的化学方程式:______(若不能,此空不填)。
16.金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是______。
(2)金属镁可以用来生产金属铀(元素符号是U):,该反应中,作为还原剂的物质是______(填化学式,下同),被还原的物质是______。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 实验2
钠与水反应剧烈,镁与水反应缓慢 镁与盐酸反应剧烈,铝与盐酸反应缓慢
由实验1和实验2得出的结论是:金属性,______>______>______(填元素符号),用原子结构理论解释:同周期元素从左到右,______。
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式______。
17.碱金属元素
(1)碱金属元素包括(填名称及元素符号):_______等。
(2)碱金属的原子结构(Li→Cs)
①相似性:最外层均有_______个电子。
②递变性:电子层数逐渐增多,原子半径逐渐_______。
(3)碱金属的化学性质
①钠、钾与氧气反应比较实验
a.实验现象:都能在空气中燃烧,钠产生_______色火焰,钾产生_______色火焰(透过蓝色钴玻璃观察),钾燃烧更剧烈。
b.反应方程式_______、_______。
②钾与水反应的实验
a.现象:浮于水面上,并熔化为闪亮的小球四处游动,发出嘶嘶的响声,并伴有燃烧,溶液呈红色。
b.化学方程式:_______。
c.与Na和水反应相比现象不同的有_______,结论:活泼性K比Na_______。
③锂与氧气(加热)、H2O反应的化学方程式分别为_______;_______。
(4)碱金属性质的递变规律及原因
从Li→Cs,电子层数逐渐_______,原子半径逐渐_______,原子核对最外层电子的引力逐渐_______,原子失去电子的能力逐渐_______,金属性逐渐_______。
(5)碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈_______色,它们都比较软,有延展性,密度较_______,熔点较_______,导电、导热性强
递变规律 密度 逐渐_______(钠、钾反常)
熔、沸点 逐渐_______
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
18.请利用元素周期律和元素周期表的有关知识回答下列问题。
(1)下列关于元素性质或原子结构递变情况的叙述中,错误的是______
A.Li、Be、B原子的最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.N、O、F原子的半径依次增大
D.Na、K、Rb原子核外的电子层数依次增多
(2)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素。______
A.一定是第2周期元素 B.一定是同一周期元素
C.一定分别位于第2、3周期 D.可以相互化合形成化合物
(3)短周期元素A、B、C在元素周期表中的位置如图所示。已知B、C两元素的原子序数之和是A元素的原子序数的4倍,则A、B、C分别是______
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
(4)X、Y、Z是相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是_________
A.Mg、Al、Si B.Li、Be、Mg C.N、O、S D.P、S、O
试卷第1页,共3页
参考答案:
1.B
【详解】A.钠的焰色试验呈黄色,而要检验溶液中是否含钾离子时,应透过蓝色的钴玻璃观察火焰是否呈紫色,透过蓝色的钴玻璃未观察到紫色火焰时才能确定不含钾离子,A错误;
B.向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解,因为发生了反应:,氢氧化铝表现出了酸性,则铝元素表现出一定的非金属性,B正确
C.向2mLKI溶液中滴加几滴溴水,振荡,再滴加2滴淀粉溶液,溶液变蓝色,说明发生反应,Br2 为氧化剂,I2为氧化产物,则Br2氧化性比I2的强,C错误;
D.向某溶液中滴加AgNO3溶液,产生的白色沉淀可以为氯化银、或碳酸银等,则该溶液中不一定含有Cl-,D错误;
答案选B。
2.C
【详解】A. 稀有气体由原子直接构成,其中不存在化学键,A错误;
B.铵盐由非金属元素组成,铵盐内有离子键、还有共价键,B错误;
C.物质(除了稀有气体外)内都存在化学键, 化学反应中物质发生了变化,有新的物质生成,则化学反应的实质是旧键的断裂和新键的形成,C正确;
D. 离子键就是阴离子与阳离子之间强烈的静电作用,既有静电吸引力又有斥力,D错误;
答案选C。
3.B
【详解】A. N2是共价分子,分子内氮原子间共用三对电子对,则电子式:,A正确;
B. HClO是共价分子,分子内氧原子分别与氢、氯原子共用一对电子对,结构式为H-O-Cl,B错误;
C. KNO3完全电离为钾离子和硝酸根,电离方程式:KNO3=K++NO,C正确;
D.钠原子失去电子形成钠离子,氯原子得到电子形成氯离子,钠离子和氯离子结合成氯化钠, 氯化钠是离子化合物,用电子式表示NaCl的形成过程:,D正确;
答案选B。
4.A
【详解】A. Rn的质量数、该核素的相对近似原子质量为222,但不知该元素的其它同位素的相对原子质量以及原子个数百分比,所以无法计算元素的相对原子质量,A项错误;
B. Se和Se的质子数相同都为34,中子数分别为44、46,是两种不同的核素,互为同位素,B项正确;
C.U的浓缩一直被国际社会关注,其质子数为92,中子数为235-92=143,两者之差为51,C项正确;
D.第七周期稀有气体原子序数=86+32=118,118号是第七周期最后一种元素,位于18列,115号元素处于第15列,故115号元素在元素周期表中的位置为第七周期VA族,D项正确;
答案选A。
5.B
【详解】A.状态Ⅰ→状态Ⅱ只是氧氧双键 ,没有发生化学变化,故A错误;
B.CO2含有碳双双键,是具有极性共价键的直线型分子,故B正确;
C.CO和O生成CO2的过程,碳化合价升高,涉及电子转移,故C错误;
D.状态Ⅲ→状态Ⅴ表示CO与O的反应,不是与O2反应,故D错误。
综上所述,答案为B。
6.C
【分析】由题干信息可知,X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Z的原子序数是X的3倍,则 X为1、Z为3、则Y为He不是主族元素(舍去),X为Be、Z为Mg,且Y的原子序数比X大1,故Y为B,Y、W也同主族,W为Al,据此分析解题。
【详解】A.由分析可知,X为Be、Z为Mg,则金属性Be<Mg,故最高价氧化物对应水化物的碱性Mg(OH)2>Be(OH)2,即,A正确;
B.由分析可知,W为Al,故W的单质既能与盐酸反应,又能溶于溶液,反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B正确;
C.由分析可知,X、Y、Z、W分别为Be、B、Mg、Al,则原子半径相对大小为:Mg>Al>Be>B即,C错误;
D.由分析可知,Z为Mg,W为Al,故常温下,Z、W的单质均能在空气中形成氧化膜,D正确;
故答案为:C。
7.C
【详解】A.氮气的电子式为: ,A错误;
B.在该反应中被氧化生成氧化产物,因此氧化产物与还原产物的物质的量之比为,B错误;
C.和都为碱性氧化物,能与酸性氧化物反应生成硅酸盐,C正确;
D.反应中每消耗时转移电子,D错误;
故选C。
8.C
【详解】A.S与Se同主族,从上往下非金属性减弱,气态氢化物的稳定性减弱,故无色,有毒,不如稳定,A错误;
B.At与Cl同主族,AgCl、AgBr、AgI的溶解度越来越小,故AgAt难溶于水,B错误;
C.Be与Al处于对角线的位置,Al的氧化物具有两性,根据对角线规则,Be的氧化物可能具有两性,C正确;
D.Li在氧气中剧烈燃烧,产物是,D错误;
故选C。
9.C
【分析】短周期主族元素R、X、Y、Z的原子序数依次增大,在短周期主族元素中X的金属性最强,X是Na;R的氧化物是形成酸雨的“元凶”之一,R是N元素;Y的简单氢化物的化学式为H2Y,Y的化合价为-2,Y是S元素,则Z是Cl元素。
【详解】A.同周期元素从左到右非金属性增强,气态氢化物稳定性增强,简单氢化物的稳定性:HCl>H2S,故A错误;
B.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,简单离子半径:Na+<Cl-<S2-,故B错误;
C.常温下,硫是固体,N2、Cl2是气体,硫的熔点最高,N2的相对分子质量小于Cl2,Cl2的熔点大于N2,常见单质的熔点:N2<Cl2<S,故C正确;
D.N形成的氧化物有N2O、NO、N2O3、NO2、N2O4、N2O5,故D错误;
选C。
10.B
【详解】A.中的化学键属于共价键,A错误;
B.1mol (g)和1mol (g)反应生成2mol NO(g)的反应热为:,为吸热反应,故1mol (g)和1mol (g)具有的总能量小于2mol NO(g)具有的总能量,B正确;
C.通常情况下,(g)和(g)混合不能直接生成NO,需要在放电条件下进行,C错误;
D.氮元素化合价降低,故催化剂将还原成,D错误;
故选B。
11.B
【分析】短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,则A为H,C是空气中含量最多的元素,则C为N,D是地壳中含量最多的元素,则D为O,E、F和G同周期,E在该周期中原子半径最大,则E为Na,F的单质中有一种是淡黄色的固体,则F为S,G为Cl。
【详解】A.根据层多径大,同电子层结构核多径小,则原子半径:E>F>G>C>D>A,故A正确;
B.氧化物对应的水化物酸性不一定是F<G,比如硫酸酸性大于次氯酸酸性,若是最高价氧化物对应的水化物酸性,则有F<G,故B错误;
C.D与E形成氧化钠或过氧化钠,E与G形成氯化钠,都为离子化合物,故C正确;
D.A与E形成的化合物NaH,NaH是离子化合物,其电子式为,故D正确。
综上所述,答案为B。
12.C
【分析】由图可知Z位于元素周期表第三周期,电子层数为3,又因为Z的最外层电子数是电子层数的2倍,所以Z最外层电子数为6,Z为S;结合X、Y与Z的相对位置可知,X为O,Y为Al,据此解答该题。
【详解】A.Al与S位于同一周期,电子层数相同,S的核电荷数大,半径小,因此Y的半径比Z的大,A错误;
B.Al性质活泼,常温下极易与氧气反应生成氧化铝,B错误;
C.O的非金属性比S强,O的气态氢化物更稳定,因此X的气态氢化物的稳定性比Z强,C正确;
D.Y为Al,最高价氧化物对应水化物为氢氧化铝,为两性氢氧化物,是弱碱,D错误;
故选C。
13.C
【分析】短周期元素X、Y、Z、W的原子序数依次增大,元素Z是地壳中含量第二多的元素,Z是Si元素,Y、Z、W位于同一周期,X的最简单氢化物分子的空间结构为正四面体,X是C元素;Y在同周期中金属性最大,Y是Na元素;二元化合物E中元素Y和W的质量比为23∶16,W是S元素。
【详解】A.电子层数越多半径越大,简单离子的半径S2->Na+,故A错误;
B.最高价氧化物对应水化物的酸性H2SO4>H2CO3>H2SiO3,故B错误;
C.S的氧化性较弱,S和Cu的单质混合加热可得化合物,故C正确;
D.S在足量的氧气中燃烧生成SO2,SO2溶于水生成H2SO3,H2SO3是弱酸,故D错误;
选C。
14.BC
【分析】短周期元素W、X、Y、Z的原子序数依次增大,由结构图可知,W能形成2个共价键,Z能形成6个共价键,且W、Z位于同主族,则W为O,Z为S;X能形成1个共价键,则X为F;Y能形成+1价阳离子,则Y为Na,据此分析解答。
【详解】A.Na的焰色为黄色,因此可用焰色反应鉴别该物质中Na元素的存在,A正确;
B.非金属性越强,其简单氢化物的稳定性越强,非金属性:F>O,则最简单氢化物的稳定性:HF>H2O,B错误;
C.同周期元素从左至右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则原子半径:Na>S>O>F,C错误;
D.W与Y形成的化合物为Na2O或Na2O2,两种化合物中均含有离子键,D正确;
故选BC。
15.(1) Na2O 2Na+O2Na2O2 2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑
(2) CO2 2CO+O22CO2 能 C+CO22CO
【分析】(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O ,C为Na2O2;(2)A是一种非金属,其单质为黑色固体,C是最主要的温室气体,则A为C,B为CO,C为CO2。
【详解】(1)由分析可知B为Na2O;Na在氧气中燃烧生成,则A→C反应的化学方程式为2Na+O2Na2O2;C为,可以在呼吸面具和潜水艇里作为供氧剂,化学方程式为2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑;
(2)由分析可知C的分子式为CO2,其电子式为;CO在O2中燃烧生成CO2,则B→C反应的化学方程式为2CO+O22CO2;C能和CO2发生归中反应生成CO,所以 A和C反应的化学方程式为: C+CO22CO。
16.(1)第三周期IIIA族
(2) Mg UF4
(3) Na Mg Al 原子半径逐渐减小,失电子能力逐渐减弱
(4)Al(OH)3+OH-=AlO+2H2O
【详解】(1)Al是13号元素,在元素周期表中的位置是第三周期IIIA族;
(2)反应UF4+2MgU+2MgF2中,Mg由0价变为+2价,作为还原剂的物质是Mg,U由+4价变为0价,作为氧化剂被还原,故被还原的物质是UF4;
(3)实验1:取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢,说明钠比镁活泼;实验2:取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈,说明镁比铝活泼,综上可得结论:金属的活泼性Na>Mg>Al;从原子结构理论解释上述现象是:同周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱;
(4)Na和Al最高价氧化物的水化物分别为NaOH和Al(OH)3,两者相互反应的离子反应方程式为Al(OH)3+OH-=AlO+2H2O。
17.(1)锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等
(2) 1 增大
(3) 黄 紫 2Na+O2Na2O2 K+O2KO2 2K+2H2O=2KOH+H2↑ 反应比钠和水剧烈,并伴有燃烧 活泼 4Li+O22Li2O Li+2H2O=2LiOH+H2↑
(4) 增多 增大 减弱 增强 增强
(5) 银白 小 低 增大 降低
【详解】(1)碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等,故答案为:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等;
(2)①碱金属元素的原子最外电子层上都只有1个电子,故答案为:1;
②碱金属元素从上到下电子层数逐渐增多,原子半径逐渐增大,故答案为:增大;
(3)①钠的焰色反应为黄色,钾的焰色反应为紫色,钠与氧气在加热条件在反应生成过氧化钠,反应的化学方程式为2Na+O2Na2O2,钾与氧气在加热条件在反应生成KO2,反应的化学方程式为K+O2KO2,故答案为:黄;紫;2Na+O2Na2O2;K+O2KO2;
②钾与水反应生成氢氧化钾和氢气,反应的化学方程式为2K+2H2O=2KOH+H2↑;与Na和水反应相比,钾与水反应比钠和水剧烈,并伴有燃烧,从而可知K比Na活泼,故答案为:2K+2H2O=2KOH+H2↑;反应比钠和水剧烈,并伴有燃烧;活泼;
③锂与氧气在加热条件下反应生成氧化锂,反应的化学方程式为4Li+O22Li2O;锂与水反应生成氢氧化锂和氢气,反应的化学方程式为Li+2H2O=2LiOH+H2↑,故答案为:4Li+O22Li2O;Li+2H2O=2LiOH+H2↑;
(4)同主族元素从上到下核电荷数逐渐增多,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力逐渐增强,因此金属性逐渐增强,故答案为:增多;增大;减弱;增强;增强;
(5)碱金属元素,除铯外其余都呈银白色,它们都比较软,有延展性,密度较小,熔点较低;随核电荷数递增,碱金属单质的密度逐渐增大,但Na、K反常;碱金属从上到下原子半径依次增大,金属键依次减弱,熔沸点逐渐降低,故答案为:银白;小;低;增大;降低。
18.(1)C
(2)CD
(3)D
(4)C
【详解】(1)A.Li、Be、B原子的最外层电子数依次增多,A项正确;
B.P、S、Cl元素的最高正化合价依次是+5、+6、+7,B项正确;
C.同一周期,原子半径逐渐减小,所以N、O、F原子的半径依次减小,C项错误;
D.Na、K、Rb是第ⅠA族原子,所以原子核外的电子层数依次增多,D项正确;
故答案选C。
(2)A元素原子最外层电子数是次外层电子数的3倍,则A 可以是氧元素,B元素原子次外层电子数是最外层电子数的2倍,则B可以是磷元素。故答案选CD。
(3)根据位置关系,设B的原子序数是x,则C为x+2,A为x-8+1,则根据题目信息可知x+ x+2=( x-8+1)×4,解得x=13,则A、B、C分别是C、Al、P,故答案选D。
(4)根据题目信息,三种元素相邻,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是N、O、S,故答案是C
