第2章第4节分子间作用力同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章第4节分子间作用力同步练习 (含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 501.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 14:34:25 | ||
图片预览



文档简介
第2章第4节分子间作用力同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.键的极性: N- H 键>O- H 键>F-H键
B.热稳定性: HF>H2O>NH3
C.强度:氢键>化学键>范德华力
D.沸点:
2.下列说法中正确的是
A.范德华力存在于所有分子之间
B.范德华力是影响所有物质物理性质的因素
C.相对于其他气体来说,是易液化的气体,由此得出范德华力属于强作用力
D.范德华力属于既没有方向性也没有饱和性的静电作用
3.与甲基咪唑( )反应可以得到,其结构如图所示,下列说法不正确的是
A.甲基咪唑中碳原子的杂化方式为
B.甲基咪唑易溶于水的主要原因是能与水形成氢键
C.1个离子中含有42个键
D.离子中的配位数为6
4.二甘醇的结构简式是。下列有关二甘醇的叙述正确的是
A.二甘醇分子中有一个手性碳原子 B.分子间能形成氢键
C.分子间不存在范德华力 D.能溶于水,不溶于乙醇
5.化合物在生物化学和分子生物学中用作缓冲剂。对于该物质的下列说法错误的是
A.该物质属于极性分子
B.该物质可与水形成分子间氢键
C.该物质属于有机物,在水中的溶解度较小
D.从结构分析,该物质在水中溶解度较大
6.下列叙述中正确的有
①沸点:HI>HBr>HCl
②COCl2、BF3中各原子均达到8电子稳定结构
③一般分子的极性越大,范德华力越大
④氢键是一种分子间作用力,所以氢键只存在于分子与分子之间
⑤CH3CH=CH2分子中,σ键与π键数目之比为6:1
⑥平面三角形分子一定是非极性分子
A.2个 B.3个 C.4个 D.5个
7.下列对分子的性质的解释中,正确的是
A.氨气很稳定(很高温度才会部分分解)是因为氨分子中含有大量的氢键所致
B.和HF均易溶于水,原因之一是它们都是极性分子
C.为正八面体结构,该物质可能难溶于苯,易溶于水
D.物质的沸点:,分子的稳定性
8.利用超分子可分离和。将、混合物加入一种空腔大小适配的杯酚中进行分离的流程如图所示。
下列说法错误的是
A.该流程体现了超分子具有“分子识别”的特征
B.杯酚分子中存在大键
C.杯酚与形成氢键
D.与金刚石晶体类型不同
9.下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,其中正确的是
A. B. C. D.
10.如图是一种四面体“金字塔”魔方。若魔方的四个面分别代表短周期中原子序数依次增大的四种元素W、X、Y、Z,且每个顶点代表由三个面的元素形成的一种化合物,其中W、Z分别是短周期主族元素中原子半径最小和最大的元素,X的氢化物与其最高价氧化物的水化物能反应生成盐,Y的最外层电子数是其电子层数的3倍。下列说法错误的是
A.X、Y的简单氢化物的沸点:
B.X、Y、Z的原子半径大小顺序:
C.和在一定条件下能发生化学反应
D.四种化合物中只有酸和碱,没有盐类物质
11.比较下列化合物的沸点,前者低于后者的是
A.乙醇与氯乙烷
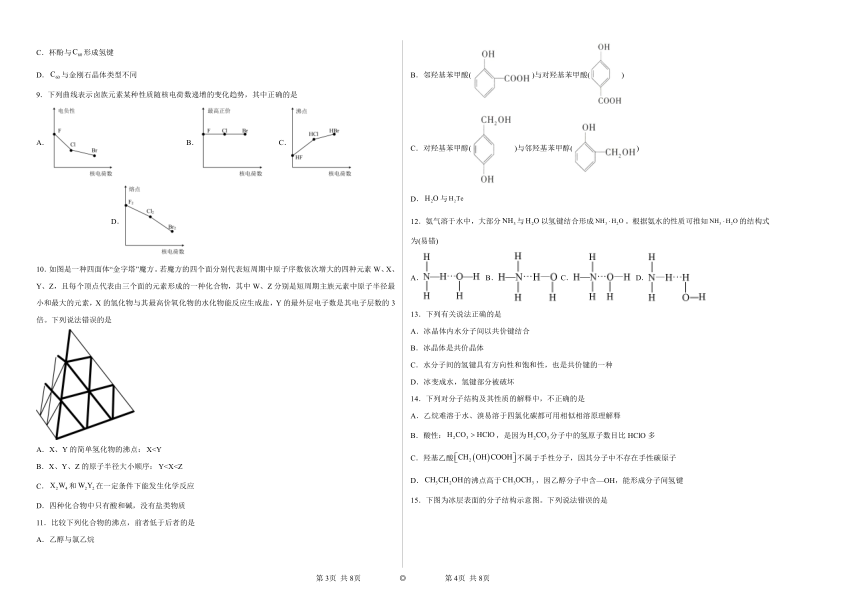
B.邻羟基苯甲酸()与对羟基苯甲酸()
C.对羟基苯甲醇()与邻羟基苯甲醇()
D.与
12.氨气溶于水中,大部分与以氢键结合形成。根据氨水的性质可推知的结构式为(易错)
A. B. C. D.
13.下列有关说法正确的是
A.冰晶体内水分子间以共价键结合
B.冰晶体是共价晶体
C.水分子间的氢键具有方向性和饱和性,也是共价键的一种
D.冰变成水,氢键部分被破坏
14.下列对分子结构及其性质的解释中,不正确的是
A.乙烷难溶于水、溴易溶于四氯化碳都可用相似相溶原理解释
B.酸性:,是因为分子中的氢原子数目比HClO多
C.羟基乙酸不属于手性分子,因其分子中不存在手性碳原子
D.的沸点高于,因乙醇分子中含—OH,能形成分子间氢键
15.下图为冰层表面的分子结构示意图。下列说法错误的是
A.温度升高时,“准液体”中水分子与下层冰连接的氢键断裂,使冰面变滑
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成的氢键比固态冰中少
D.由于氢键的存在,水分子的稳定性好,高温下也很难分解
二、填空题
16.水分子间存在氢键,彼此结合形成(H2O)n。在冰中,每个水分子被四个水分子包围形成变形的正四面体,继而通过氢键相互连接成固态冰。其结构示意图如图所示,请回答下列问题。
(1)假设冰是所有水分子都被包围在四面体中的理想结构,请分析1mol冰中有多少氢键____。
(2)在冰晶体中除氢键外,还存在范德华力(11kJ mol-1)。已知冰的升华热是51kJ mol-1,请估算冰中氢键的作用能为多少____。
17.水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间),彼此结合而形成(H2O)2。在冰中每个水分子被4个水分子包围形成变形四面体,通过“氢键”相互连接成庞大的分子晶体。
(1)1 mol冰中有_______mol“氢键”。
(2)水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是_______。
A.标准状况下把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.标准状况下把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子个数比
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为_______。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是_______。
(4)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是_______kJ·mol-1。
三、元素或物质推断题
18.A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C的常见离子不含电子,D元素原子的最外层电子数是其次外层电子数的,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的简单离子结构示意图为___________,E元素在周期表的位置是___________。
(2)用电子式表示C的氧化物的形成过程:___________。
(3)B、D、E的简单氢化物的沸点由高到低的顺序为___________。
(4)化合物甲由元素A、B组成,具有绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:___________。
(5)化学家鲍林在研究含氧酸的酸性强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱有关。设含氧酸化学式为HnROm,则非羟基氧原子数为m-n,其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
①根据规则判断H2CrO4、HMnO4酸性由强到弱的顺序为___________。
②As为第VA族元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3分子的结构简式为___________,H3PO3分子的结构简式为___________。
19.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为_____________________。
(2)B的氢化物的结构式_____________,其空间构型为_________________________。
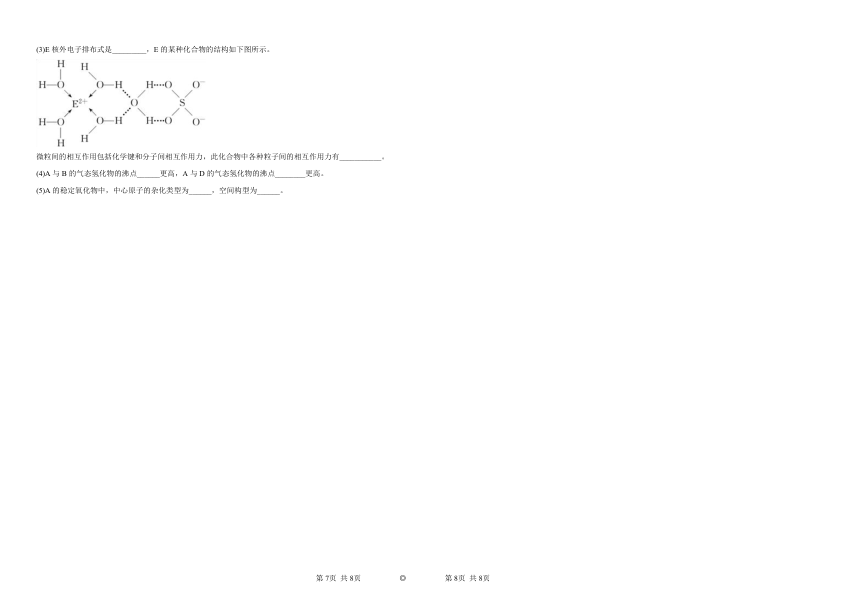
(3)E核外电子排布式是_________,E的某种化合物的结构如下图所示。
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有___________。
(4)A与B的气态氢化物的沸点______更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为______,空间构型为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.已知电负性F>O>N,则键的极性: N- H 键<O- H 键<F-H键,A错误;
B.已知电负性F>O>N,即非金属性F>O>N,简单气态氢化物的热稳定性与其非金属性一致即 HF>H2O>NH3,B正确;
C.氢键是一种分子间作用力,其强度介于化学键和范德华力之间,其强度:化学键>氢键>范德华力,C错误;
D.由于邻羟基苯甲酸能够形成分子内氢键,沸点降低,而对羟基苯甲酸只能形成分子间氢键,导致沸点升高,故沸点:邻羟基苯甲酸小于对羟基苯甲酸,D错误;
故答案为:B。
2.D
【详解】A.只有分子间距离很近时才存在范德华力,A错误;
B.范德华力只是影响由分子构成的物质的物理性质,B错误;
C.范德华力相当于化学键,属于弱作用力,C错误;
D.范德华力为分子间作用力,属于既没有方向性也没有饱和性的静电作用,D正确;
故选D。
3.C
【详解】A.甲基咪唑中单键碳原子的杂化方式为、双键碳原子的杂化方式为,故A正确;
B.甲基咪唑易溶于水的主要原因是N原子与水中的H原子形成氢键,故B正确;
C.单键全是键、配位键是键、双键中有1个键,1个甲基咪唑中有12个键,1个离子中含有个键,故C错误;
D.2个Cl-、4个甲基咪唑均为Si原子的配体,离子中的配位数为6,故D正确;
选C。
4.B
【详解】A.二甘醇中不存在连接4个不同原子或者原子团的碳原子,故分子中没有手性碳原子,A错误;
B.通过二甘醇结构可知,分子中含有氢氧键,故分子之间能形成氢键,B正确;
C.二甘醇属于分子晶体,故其分子间存在范德华力,C错误;
D.二甘醇属于极性分子,水和乙醇也属于极性分子,由“相似相溶”规律可知,二甘醇能溶于水和乙醇,D错误。
故选B。
5.C
【详解】A.根据该有机物的结构可知,其分子结构不对称,属于极性分子,A正确;
B.该物质中含羟基,能与水形成分子间氢键,B正确;
C.该物质属于有机物,结构中含羟基,能与水形成分子间氢键,在水中的溶解度较大,C错误;
D.该物质中含羟基,能与水形成分子间氢键,在水中的溶解度较大,D正确;
答案选C。
6.A
【详解】①对于组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔沸点就越高,所以沸点:HI>HBr>HCl,正确;②COCl2中各原子均达到8电子稳定结构,BF3中的B最外层只有6个电子,没有达到8电子稳定结构,错误;③一般相对分子质量相近的情况下,分子的极性越大,范德华力越大,正确;④氢键是一种分子间作用力,但氢键可以存在于分子内部,如邻羟基苯甲醛分子内就存在氢键,错误;⑤CH3CH=CH2分子中,有6个C-Hσ键和两个C-Cσ键,有1个π键,所以σ键与π键数目之比为8:1,错误;⑥平面三角形分子不一定是非极性分子,如甲醛,分子内正负电荷中心不重合,是极性分子,故错误;
综上所述,正确的是①③,故选A。
7.B
【详解】A.氨分子稳定的原因是氨分子中键键能大,与氢键无关,A错误;
B.和都是极性分子,水也是极性分子,故和均易溶于水,B正确;
C.为正八面体结构,为非极性分子,根据“相似相溶”规律可知其可能易溶于苯,难溶于水,C错误;
D.HF分子之间存在氢键,HF的沸点最高,D错误;
答案选B。
【点睛】对物质熔、沸点高低判断及分子的稳定性容易混淆,判断物质熔、沸点高低时,首先看分子之间是否存在氢键,存在氢键的熔、沸点较高;对不存在氢键、结构相似的物质,相对分子质量大的熔、沸点较高;分子的稳定性与分子内的共价键的牢固程度有关。
8.C
【详解】A.利用杯酚分离和体现了超分子具有“分子识别”的特征,A项正确;
B.杯酚分子中含有苯环结构,存在大键,B项正确;
C.杯酚与形成的不是氢键,C项错误;
D.金刚石是共价晶体,为分子晶体,二者晶体类型不同,D项正确;
故选C。
9.A
【详解】A.F、Cl、Br是同一主族元素,元素的非金属性逐渐减弱,元素的非金属性越强,其电负性就越大,因此F、Cl、Br三种元素的电负性随原子序数的增大而减小,A正确;
B.F元素的非金属性很强,原子半径很小小,导致其在发生化学反应时容易获得电子变为F-,在与其它元素形成共价键时,共用电子对偏向F元素,也使最外层达到8个电子的稳定结构,因此没有与族序数相等、与原子最外层电子数相等的最高化合价,B错误;
C.HCl、HBr结构相似,分子的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,物质的沸点:HBr>HCl。但HF分子之间除存在分子间作用力外,还存在氢键,增加了HF分子之间的吸引作用,导致其熔沸点比HCl、HBr的高,故物质的熔沸点由高到低的顺序为:HF>HBr>HCl,C错误;
D.F2、Cl2、Br2都是由分子构成的物质,它们结构相似,分子的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,所以物质的沸点:F2<Cl2<Br2,D错误;
故合理选项是A。
10.D
【分析】若魔方的四个面分别代表短周期中原子序数依次增大的四种元素W、X、Y、Z,其中W、Z分别是短周期主族元素中原子半径最小和最大的元素,则W为H元素、Z为Na元素;X的氢化物与其最高价氧化物的水化物能反应生成盐,则X为N元素;Y的最外层电子数是其电子层数的3倍,则Y为O元素;每个顶点代表由三个面的元素形成的一种化合物,则四种化合物如下图所示:
【详解】A.X、Y的简单氢化物分别为氨气和水,水分子形成的氢键数目多于氨分子,分子间作用力高于氨分子,沸点高于氨分子,故A正确;
B.钠原子的原子半径是短周期主族元素中最大的,同周期元素,从左到右原子半径依次减小,则氧、氮、钠三种原子的原子半径依次减小,故B正确;
C.联氨具有还原性,过氧化氢具有氧化性,一定条件下联氨和过氧化氢反应生成氮气和水,故C正确;
D.由分析可知,四种物质中硝酸钠、亚硝酸钠属于盐类,故D错误;
故选D。
11.B
【分析】氢键分为两种:存在于分子之间时,称为分子间氢键:存在于分子内部时,称为分子内氢键。
【详解】A.由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点,A错误;
B.邻羟基苯甲酸形成分子内氢键,沸点较低,而对羟基苯甲酸形成分子间氢键,沸点较高,B正确;
C.邻羟基苯甲醇等形成分子内氢键,沸点较低,而对羟基苯甲醇则形成分子间氢键,沸点较高,C错误;
D.由于存在分子间氢键,而不存在氢键,所以的沸点高于的沸点,D错误;
故选B。
12.B
【详解】①从氢键的形成原理上讲,A、B都成立;②但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以以B方式结合空间阻碍最小,结构最稳定;③从氨水的性质讲,依据,只有B成立;
故答案选B。
13.D
【详解】A.冰晶体内水分子间主要以氢键结合,A项错误;
B.构成冰晶体的微粒是分子,属于分子晶体,B项错误;
C.水分子间的氢键具有方向性和饱和性,但氢键不属于化学键,属于分子间作用力,C项错误;
D.冰变为液态水时只是破坏了一部分氢键,液态水中仍存在氢键,D项正确;
答案选D。
14.B
【详解】A.水为极性分子,乙烷、溴、四氯化碳都为非极性分子,所以乙烷难溶于水、溴易溶于四氯化碳都可用相似相溶原理解释,A正确;
B.酸性的强弱与分子中氢原子数目的多少无关,酸性:,是因为分子中的非羟基氧原子数目比HClO多,B不正确;
C.羟基乙酸分子中没有手性碳原子,所以不属于手性分子,C正确;
D.分子中含有-OH,能形成分子间的氢键,而分子间不能形成氢键,所以的沸点高于,D正确;
故选B。
15.D
【详解】A.温度升高时,从图中可以看出,“准液体”中水分子与下层丙连接的氢键断裂,从而使冰面变滑,A正确;
B.从图中看出,第一层固态冰中,水分子之间通过形成分子间氢键形成空间网络结构,B正确;
C.对比固态冰和“准液体”可知,第二层“准液体”中,水分子间形成的氢键比固态冰中少,C正确;
D.水分子的稳定性与氢键无关,O的非金属性强,导致H-O键稳定,高温下也很难分解,D错误;
故选D。
16.(1)2mol
(2)20kJ mol-1
【详解】(1)由图可知,平均1个水分子可以形成2个氢键,则1mol冰中有2mol氢键;
(2)1mol冰中有2mol氢键,已知冰的升华热是51kJ mol-1,则冰中氢键的作用能为(51kJ mol-1-11kJ mol-1)÷2=20kJ mol-1。
17.(1)2
(2)AB
(3) H2O+H2OH3O++OH- 双氧水分子之间存在更强烈的氢键作用
(4)20
【详解】(1)冰中每个水分子被4个水分子包围形成变形四面体,1 mol冰中含有氢键的物质的量为,故答案:2。
(2)A.该物质也能与金属钠反应产生氢气,1 L水蒸气冷凝后与足量金属钠反应,若混有该物质,由于(H2O)2也能生成氢气,且一分子(H2O)2生成2分子氢气,所以产生氢气体积多,故A正确;
B.该物质也能被浓硫酸吸收,若1 L水蒸气通过浓硫酸后,由于相对H2O而言,(H2O)2的相对分子质量大,所以分子数目相同时,浓硫酸增重的质量大,说明存在该物质,故B正确;C.该物质的pH也等于7,无论该物质是否存在,pH都等于7,故C错误;
D.该物质的分子中氢氧原子个数比仍为2∶1,无论是否存在,氢氧原子个数比不变,故D错误;故答案:AB。
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为H2O+H2OH3O++OH-,已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是双氧水的相对分子质量比水的相对分子质量稍大,但题中强调双氧水的沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键作用。故答案:H2O+H2OH3O++OH-;双氧水分子之间存在更强烈的氢键作用。
(4)1 mol冰吸收的总能量为51 kJ,克服范德华力吸收的能量为11 kJ,故克服氢键吸收的总能量为40 kJ,而1 mol 冰中含有2 mol氢键,故冰晶体中氢键的能量是20 kJ·mol-1,故答案:20。
18. 第二周期VIA族 H2O>NH3>H2S HMnO4>H2CrO4
【分析】A、B、C、D、E五种短周期元素,A的单质既可与盐酸反应,又可与NaOH溶液反应,则A为Al;A与D同周期,D元素原子的最外层电子数是其次外层电子数的,则最外层电子数为6,次外层电子数为8,故D为S;B的单质在放电条件下能与氧气反应,则B为N;C的常见离子不含电子,则C为H;E元素原子的最外层电子数是其次外层电子数的3倍,E原子只能有2个电子层,最外层电子数为6,故E为O。
【详解】(1)A为Al,原子核外有3个电子层,失去3个电子后其离子结构示意图为;E为O,在周期表的位置是第二周期VIA族;
(2)C的氧化物为H2O,为共价化合物,用电子式表示C的氧化物的形成过程为;
(3)B、D、E分别为N、S、O,简单氢化物(为分子晶体)的沸点一般由分子的相对分子质量决定,相对分子质量越大,沸点越高,但是HF、H2O、NH3的沸点比同族元素氢化物的沸点高,原因是这些分子间易形成氢键,故N、S、O的简单氢化物的沸点由高到低的顺序为H2O>NH3>H2S;
(4)化合物甲由元素Al、N组成,具有绝缘性,甲为AlN,能与水缓慢反应生成含N的化合物乙,乙分子中含有10个电子,则乙为NH3,同时生成Al(OH)3,反应的化学方程式为;
(5)①H2CrO4的非羟基氧原子有2个,HMnO4的非羟基氧原子有3个,所以酸性由强到弱的顺序为HMnO4>H2CrO4;
②因为H3AsO3为弱酸,所以其分子中不存在非羟基氧原子,故其分子的结构简式应为;由于H3PO3为中强酸,由题表可知其非羟基氧原子有一个,而分子中却有三个氢原子,说明必有一个氢原子是直接与P原子结合,该分子的结构简式为。
19. N>C>Si>Na 三角锥形 1s22s22p63s23p63d104s1或[Ar]3d104s1 离子键、共价键、配位键、氢键 NH3 SiH4 sp杂化 直线形
【详解】A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,其中A与B、A与D在周期表中位置相邻,A、B、D的相对位置为,A原子核外有两个未成对电子,B的第一电离能比同周期相邻的两种元素大,B为半充满结构,B为N、A为C、D为Si;C原子在同周期原子中半径最大(稀有气体除外),C为Na;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满,则E的电子排布式为ls22s22p63s23p63d104s1,E为Cu。
(1)A、B、C、D分别为C、N、Na、Si,同周期从左到右元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,则电负性由大到小的顺序为N>C>Si>Na。
(2)B的气态氢化物为NH3,NH3的结构式为;中心原子N的孤电子对数为,σ键电子对数为3,价层电子对数为1+3=4,故N采取 sp3杂化,NH3空间构型为三角锥形。
(3)E为Cu,其核外电子排布式为1s22s22p63s23p63d104s1;根据图示可判断H2O分子和Cu2+间存在配位键,同时水分子之间还存在氢键,H2O分子内存在共价键;该化合物还含有阴、阳离子间的离子键。
(4)A与B的气态氢化物分别为CH4和NH3,其沸点高低为NH3>CH4(因NH3分子之间存在氢键),A与D的气态氢化物分别为CH4和SiH4,由于其组成和结构相似,SiH4的相对分子质量大于CH4,故沸点SiH4>CH4。
(5)A的稳定氧化物为CO2,CO2中C原子的孤电子对数为,σ键电子对数为2,价层电子对数为0+2=2,C原子采取sp杂化,CO2分子呈直线形。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.键的极性: N- H 键>O- H 键>F-H键
B.热稳定性: HF>H2O>NH3
C.强度:氢键>化学键>范德华力
D.沸点:
2.下列说法中正确的是
A.范德华力存在于所有分子之间
B.范德华力是影响所有物质物理性质的因素
C.相对于其他气体来说,是易液化的气体,由此得出范德华力属于强作用力
D.范德华力属于既没有方向性也没有饱和性的静电作用
3.与甲基咪唑( )反应可以得到,其结构如图所示,下列说法不正确的是
A.甲基咪唑中碳原子的杂化方式为
B.甲基咪唑易溶于水的主要原因是能与水形成氢键
C.1个离子中含有42个键
D.离子中的配位数为6
4.二甘醇的结构简式是。下列有关二甘醇的叙述正确的是
A.二甘醇分子中有一个手性碳原子 B.分子间能形成氢键
C.分子间不存在范德华力 D.能溶于水,不溶于乙醇
5.化合物在生物化学和分子生物学中用作缓冲剂。对于该物质的下列说法错误的是
A.该物质属于极性分子
B.该物质可与水形成分子间氢键
C.该物质属于有机物,在水中的溶解度较小
D.从结构分析,该物质在水中溶解度较大
6.下列叙述中正确的有
①沸点:HI>HBr>HCl
②COCl2、BF3中各原子均达到8电子稳定结构
③一般分子的极性越大,范德华力越大
④氢键是一种分子间作用力,所以氢键只存在于分子与分子之间
⑤CH3CH=CH2分子中,σ键与π键数目之比为6:1
⑥平面三角形分子一定是非极性分子
A.2个 B.3个 C.4个 D.5个
7.下列对分子的性质的解释中,正确的是
A.氨气很稳定(很高温度才会部分分解)是因为氨分子中含有大量的氢键所致
B.和HF均易溶于水,原因之一是它们都是极性分子
C.为正八面体结构,该物质可能难溶于苯,易溶于水
D.物质的沸点:,分子的稳定性
8.利用超分子可分离和。将、混合物加入一种空腔大小适配的杯酚中进行分离的流程如图所示。
下列说法错误的是
A.该流程体现了超分子具有“分子识别”的特征
B.杯酚分子中存在大键
C.杯酚与形成氢键
D.与金刚石晶体类型不同
9.下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,其中正确的是
A. B. C. D.
10.如图是一种四面体“金字塔”魔方。若魔方的四个面分别代表短周期中原子序数依次增大的四种元素W、X、Y、Z,且每个顶点代表由三个面的元素形成的一种化合物,其中W、Z分别是短周期主族元素中原子半径最小和最大的元素,X的氢化物与其最高价氧化物的水化物能反应生成盐,Y的最外层电子数是其电子层数的3倍。下列说法错误的是
A.X、Y的简单氢化物的沸点:
B.X、Y、Z的原子半径大小顺序:
C.和在一定条件下能发生化学反应
D.四种化合物中只有酸和碱,没有盐类物质
11.比较下列化合物的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.邻羟基苯甲酸()与对羟基苯甲酸()
C.对羟基苯甲醇()与邻羟基苯甲醇()
D.与
12.氨气溶于水中,大部分与以氢键结合形成。根据氨水的性质可推知的结构式为(易错)
A. B. C. D.
13.下列有关说法正确的是
A.冰晶体内水分子间以共价键结合
B.冰晶体是共价晶体
C.水分子间的氢键具有方向性和饱和性,也是共价键的一种
D.冰变成水,氢键部分被破坏
14.下列对分子结构及其性质的解释中,不正确的是
A.乙烷难溶于水、溴易溶于四氯化碳都可用相似相溶原理解释
B.酸性:,是因为分子中的氢原子数目比HClO多
C.羟基乙酸不属于手性分子,因其分子中不存在手性碳原子
D.的沸点高于,因乙醇分子中含—OH,能形成分子间氢键
15.下图为冰层表面的分子结构示意图。下列说法错误的是
A.温度升高时,“准液体”中水分子与下层冰连接的氢键断裂,使冰面变滑
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成的氢键比固态冰中少
D.由于氢键的存在,水分子的稳定性好,高温下也很难分解
二、填空题
16.水分子间存在氢键,彼此结合形成(H2O)n。在冰中,每个水分子被四个水分子包围形成变形的正四面体,继而通过氢键相互连接成固态冰。其结构示意图如图所示,请回答下列问题。
(1)假设冰是所有水分子都被包围在四面体中的理想结构,请分析1mol冰中有多少氢键____。
(2)在冰晶体中除氢键外,还存在范德华力(11kJ mol-1)。已知冰的升华热是51kJ mol-1,请估算冰中氢键的作用能为多少____。
17.水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间),彼此结合而形成(H2O)2。在冰中每个水分子被4个水分子包围形成变形四面体,通过“氢键”相互连接成庞大的分子晶体。
(1)1 mol冰中有_______mol“氢键”。
(2)水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是_______。
A.标准状况下把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.标准状况下把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子个数比
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为_______。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是_______。
(4)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是_______kJ·mol-1。
三、元素或物质推断题
18.A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C的常见离子不含电子,D元素原子的最外层电子数是其次外层电子数的,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的简单离子结构示意图为___________,E元素在周期表的位置是___________。
(2)用电子式表示C的氧化物的形成过程:___________。
(3)B、D、E的简单氢化物的沸点由高到低的顺序为___________。
(4)化合物甲由元素A、B组成,具有绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:___________。
(5)化学家鲍林在研究含氧酸的酸性强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱有关。设含氧酸化学式为HnROm,则非羟基氧原子数为m-n,其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(m-n)有如下关系:
m-n 0 1 2 3
含氧酸强度 弱 中强 强 很强
实例 HClO H3PO4 HNO3 HClO4
①根据规则判断H2CrO4、HMnO4酸性由强到弱的顺序为___________。
②As为第VA族元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3分子的结构简式为___________,H3PO3分子的结构简式为___________。
19.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为_____________________。
(2)B的氢化物的结构式_____________,其空间构型为_________________________。
(3)E核外电子排布式是_________,E的某种化合物的结构如下图所示。
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有___________。
(4)A与B的气态氢化物的沸点______更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为______,空间构型为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.已知电负性F>O>N,则键的极性: N- H 键<O- H 键<F-H键,A错误;
B.已知电负性F>O>N,即非金属性F>O>N,简单气态氢化物的热稳定性与其非金属性一致即 HF>H2O>NH3,B正确;
C.氢键是一种分子间作用力,其强度介于化学键和范德华力之间,其强度:化学键>氢键>范德华力,C错误;
D.由于邻羟基苯甲酸能够形成分子内氢键,沸点降低,而对羟基苯甲酸只能形成分子间氢键,导致沸点升高,故沸点:邻羟基苯甲酸小于对羟基苯甲酸,D错误;
故答案为:B。
2.D
【详解】A.只有分子间距离很近时才存在范德华力,A错误;
B.范德华力只是影响由分子构成的物质的物理性质,B错误;
C.范德华力相当于化学键,属于弱作用力,C错误;
D.范德华力为分子间作用力,属于既没有方向性也没有饱和性的静电作用,D正确;
故选D。
3.C
【详解】A.甲基咪唑中单键碳原子的杂化方式为、双键碳原子的杂化方式为,故A正确;
B.甲基咪唑易溶于水的主要原因是N原子与水中的H原子形成氢键,故B正确;
C.单键全是键、配位键是键、双键中有1个键,1个甲基咪唑中有12个键,1个离子中含有个键,故C错误;
D.2个Cl-、4个甲基咪唑均为Si原子的配体,离子中的配位数为6,故D正确;
选C。
4.B
【详解】A.二甘醇中不存在连接4个不同原子或者原子团的碳原子,故分子中没有手性碳原子,A错误;
B.通过二甘醇结构可知,分子中含有氢氧键,故分子之间能形成氢键,B正确;
C.二甘醇属于分子晶体,故其分子间存在范德华力,C错误;
D.二甘醇属于极性分子,水和乙醇也属于极性分子,由“相似相溶”规律可知,二甘醇能溶于水和乙醇,D错误。
故选B。
5.C
【详解】A.根据该有机物的结构可知,其分子结构不对称,属于极性分子,A正确;
B.该物质中含羟基,能与水形成分子间氢键,B正确;
C.该物质属于有机物,结构中含羟基,能与水形成分子间氢键,在水中的溶解度较大,C错误;
D.该物质中含羟基,能与水形成分子间氢键,在水中的溶解度较大,D正确;
答案选C。
6.A
【详解】①对于组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔沸点就越高,所以沸点:HI>HBr>HCl,正确;②COCl2中各原子均达到8电子稳定结构,BF3中的B最外层只有6个电子,没有达到8电子稳定结构,错误;③一般相对分子质量相近的情况下,分子的极性越大,范德华力越大,正确;④氢键是一种分子间作用力,但氢键可以存在于分子内部,如邻羟基苯甲醛分子内就存在氢键,错误;⑤CH3CH=CH2分子中,有6个C-Hσ键和两个C-Cσ键,有1个π键,所以σ键与π键数目之比为8:1,错误;⑥平面三角形分子不一定是非极性分子,如甲醛,分子内正负电荷中心不重合,是极性分子,故错误;
综上所述,正确的是①③,故选A。
7.B
【详解】A.氨分子稳定的原因是氨分子中键键能大,与氢键无关,A错误;
B.和都是极性分子,水也是极性分子,故和均易溶于水,B正确;
C.为正八面体结构,为非极性分子,根据“相似相溶”规律可知其可能易溶于苯,难溶于水,C错误;
D.HF分子之间存在氢键,HF的沸点最高,D错误;
答案选B。
【点睛】对物质熔、沸点高低判断及分子的稳定性容易混淆,判断物质熔、沸点高低时,首先看分子之间是否存在氢键,存在氢键的熔、沸点较高;对不存在氢键、结构相似的物质,相对分子质量大的熔、沸点较高;分子的稳定性与分子内的共价键的牢固程度有关。
8.C
【详解】A.利用杯酚分离和体现了超分子具有“分子识别”的特征,A项正确;
B.杯酚分子中含有苯环结构,存在大键,B项正确;
C.杯酚与形成的不是氢键,C项错误;
D.金刚石是共价晶体,为分子晶体,二者晶体类型不同,D项正确;
故选C。
9.A
【详解】A.F、Cl、Br是同一主族元素,元素的非金属性逐渐减弱,元素的非金属性越强,其电负性就越大,因此F、Cl、Br三种元素的电负性随原子序数的增大而减小,A正确;
B.F元素的非金属性很强,原子半径很小小,导致其在发生化学反应时容易获得电子变为F-,在与其它元素形成共价键时,共用电子对偏向F元素,也使最外层达到8个电子的稳定结构,因此没有与族序数相等、与原子最外层电子数相等的最高化合价,B错误;
C.HCl、HBr结构相似,分子的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,物质的沸点:HBr>HCl。但HF分子之间除存在分子间作用力外,还存在氢键,增加了HF分子之间的吸引作用,导致其熔沸点比HCl、HBr的高,故物质的熔沸点由高到低的顺序为:HF>HBr>HCl,C错误;
D.F2、Cl2、Br2都是由分子构成的物质,它们结构相似,分子的相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,所以物质的沸点:F2<Cl2<Br2,D错误;
故合理选项是A。
10.D
【分析】若魔方的四个面分别代表短周期中原子序数依次增大的四种元素W、X、Y、Z,其中W、Z分别是短周期主族元素中原子半径最小和最大的元素,则W为H元素、Z为Na元素;X的氢化物与其最高价氧化物的水化物能反应生成盐,则X为N元素;Y的最外层电子数是其电子层数的3倍,则Y为O元素;每个顶点代表由三个面的元素形成的一种化合物,则四种化合物如下图所示:
【详解】A.X、Y的简单氢化物分别为氨气和水,水分子形成的氢键数目多于氨分子,分子间作用力高于氨分子,沸点高于氨分子,故A正确;
B.钠原子的原子半径是短周期主族元素中最大的,同周期元素,从左到右原子半径依次减小,则氧、氮、钠三种原子的原子半径依次减小,故B正确;
C.联氨具有还原性,过氧化氢具有氧化性,一定条件下联氨和过氧化氢反应生成氮气和水,故C正确;
D.由分析可知,四种物质中硝酸钠、亚硝酸钠属于盐类,故D错误;
故选D。
11.B
【分析】氢键分为两种:存在于分子之间时,称为分子间氢键:存在于分子内部时,称为分子内氢键。
【详解】A.由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点,A错误;
B.邻羟基苯甲酸形成分子内氢键,沸点较低,而对羟基苯甲酸形成分子间氢键,沸点较高,B正确;
C.邻羟基苯甲醇等形成分子内氢键,沸点较低,而对羟基苯甲醇则形成分子间氢键,沸点较高,C错误;
D.由于存在分子间氢键,而不存在氢键,所以的沸点高于的沸点,D错误;
故选B。
12.B
【详解】①从氢键的形成原理上讲,A、B都成立;②但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以以B方式结合空间阻碍最小,结构最稳定;③从氨水的性质讲,依据,只有B成立;
故答案选B。
13.D
【详解】A.冰晶体内水分子间主要以氢键结合,A项错误;
B.构成冰晶体的微粒是分子,属于分子晶体,B项错误;
C.水分子间的氢键具有方向性和饱和性,但氢键不属于化学键,属于分子间作用力,C项错误;
D.冰变为液态水时只是破坏了一部分氢键,液态水中仍存在氢键,D项正确;
答案选D。
14.B
【详解】A.水为极性分子,乙烷、溴、四氯化碳都为非极性分子,所以乙烷难溶于水、溴易溶于四氯化碳都可用相似相溶原理解释,A正确;
B.酸性的强弱与分子中氢原子数目的多少无关,酸性:,是因为分子中的非羟基氧原子数目比HClO多,B不正确;
C.羟基乙酸分子中没有手性碳原子,所以不属于手性分子,C正确;
D.分子中含有-OH,能形成分子间的氢键,而分子间不能形成氢键,所以的沸点高于,D正确;
故选B。
15.D
【详解】A.温度升高时,从图中可以看出,“准液体”中水分子与下层丙连接的氢键断裂,从而使冰面变滑,A正确;
B.从图中看出,第一层固态冰中,水分子之间通过形成分子间氢键形成空间网络结构,B正确;
C.对比固态冰和“准液体”可知,第二层“准液体”中,水分子间形成的氢键比固态冰中少,C正确;
D.水分子的稳定性与氢键无关,O的非金属性强,导致H-O键稳定,高温下也很难分解,D错误;
故选D。
16.(1)2mol
(2)20kJ mol-1
【详解】(1)由图可知,平均1个水分子可以形成2个氢键,则1mol冰中有2mol氢键;
(2)1mol冰中有2mol氢键,已知冰的升华热是51kJ mol-1,则冰中氢键的作用能为(51kJ mol-1-11kJ mol-1)÷2=20kJ mol-1。
17.(1)2
(2)AB
(3) H2O+H2OH3O++OH- 双氧水分子之间存在更强烈的氢键作用
(4)20
【详解】(1)冰中每个水分子被4个水分子包围形成变形四面体,1 mol冰中含有氢键的物质的量为,故答案:2。
(2)A.该物质也能与金属钠反应产生氢气,1 L水蒸气冷凝后与足量金属钠反应,若混有该物质,由于(H2O)2也能生成氢气,且一分子(H2O)2生成2分子氢气,所以产生氢气体积多,故A正确;
B.该物质也能被浓硫酸吸收,若1 L水蒸气通过浓硫酸后,由于相对H2O而言,(H2O)2的相对分子质量大,所以分子数目相同时,浓硫酸增重的质量大,说明存在该物质,故B正确;C.该物质的pH也等于7,无论该物质是否存在,pH都等于7,故C错误;
D.该物质的分子中氢氧原子个数比仍为2∶1,无论是否存在,氢氧原子个数比不变,故D错误;故答案:AB。
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为H2O+H2OH3O++OH-,已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是双氧水的相对分子质量比水的相对分子质量稍大,但题中强调双氧水的沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键作用。故答案:H2O+H2OH3O++OH-;双氧水分子之间存在更强烈的氢键作用。
(4)1 mol冰吸收的总能量为51 kJ,克服范德华力吸收的能量为11 kJ,故克服氢键吸收的总能量为40 kJ,而1 mol 冰中含有2 mol氢键,故冰晶体中氢键的能量是20 kJ·mol-1,故答案:20。
18. 第二周期VIA族 H2O>NH3>H2S HMnO4>H2CrO4
【分析】A、B、C、D、E五种短周期元素,A的单质既可与盐酸反应,又可与NaOH溶液反应,则A为Al;A与D同周期,D元素原子的最外层电子数是其次外层电子数的,则最外层电子数为6,次外层电子数为8,故D为S;B的单质在放电条件下能与氧气反应,则B为N;C的常见离子不含电子,则C为H;E元素原子的最外层电子数是其次外层电子数的3倍,E原子只能有2个电子层,最外层电子数为6,故E为O。
【详解】(1)A为Al,原子核外有3个电子层,失去3个电子后其离子结构示意图为;E为O,在周期表的位置是第二周期VIA族;
(2)C的氧化物为H2O,为共价化合物,用电子式表示C的氧化物的形成过程为;
(3)B、D、E分别为N、S、O,简单氢化物(为分子晶体)的沸点一般由分子的相对分子质量决定,相对分子质量越大,沸点越高,但是HF、H2O、NH3的沸点比同族元素氢化物的沸点高,原因是这些分子间易形成氢键,故N、S、O的简单氢化物的沸点由高到低的顺序为H2O>NH3>H2S;
(4)化合物甲由元素Al、N组成,具有绝缘性,甲为AlN,能与水缓慢反应生成含N的化合物乙,乙分子中含有10个电子,则乙为NH3,同时生成Al(OH)3,反应的化学方程式为;
(5)①H2CrO4的非羟基氧原子有2个,HMnO4的非羟基氧原子有3个,所以酸性由强到弱的顺序为HMnO4>H2CrO4;
②因为H3AsO3为弱酸,所以其分子中不存在非羟基氧原子,故其分子的结构简式应为;由于H3PO3为中强酸,由题表可知其非羟基氧原子有一个,而分子中却有三个氢原子,说明必有一个氢原子是直接与P原子结合,该分子的结构简式为。
19. N>C>Si>Na 三角锥形 1s22s22p63s23p63d104s1或[Ar]3d104s1 离子键、共价键、配位键、氢键 NH3 SiH4 sp杂化 直线形
【详解】A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,其中A与B、A与D在周期表中位置相邻,A、B、D的相对位置为,A原子核外有两个未成对电子,B的第一电离能比同周期相邻的两种元素大,B为半充满结构,B为N、A为C、D为Si;C原子在同周期原子中半径最大(稀有气体除外),C为Na;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满,则E的电子排布式为ls22s22p63s23p63d104s1,E为Cu。
(1)A、B、C、D分别为C、N、Na、Si,同周期从左到右元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,则电负性由大到小的顺序为N>C>Si>Na。
(2)B的气态氢化物为NH3,NH3的结构式为;中心原子N的孤电子对数为,σ键电子对数为3,价层电子对数为1+3=4,故N采取 sp3杂化,NH3空间构型为三角锥形。
(3)E为Cu,其核外电子排布式为1s22s22p63s23p63d104s1;根据图示可判断H2O分子和Cu2+间存在配位键,同时水分子之间还存在氢键,H2O分子内存在共价键;该化合物还含有阴、阳离子间的离子键。
(4)A与B的气态氢化物分别为CH4和NH3,其沸点高低为NH3>CH4(因NH3分子之间存在氢键),A与D的气态氢化物分别为CH4和SiH4,由于其组成和结构相似,SiH4的相对分子质量大于CH4,故沸点SiH4>CH4。
(5)A的稳定氧化物为CO2,CO2中C原子的孤电子对数为,σ键电子对数为2,价层电子对数为0+2=2,C原子采取sp杂化,CO2分子呈直线形。
答案第1页,共2页
答案第1页,共2页
