2022-2023学年鲁科版(2019)高中化学选择性必修一 1.2化学能转化为电能——电池 课件 (共22张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版(2019)高中化学选择性必修一 1.2化学能转化为电能——电池 课件 (共22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
选择性必修1
《化学反应与能量变化 》
素养目标
重点难点
课标要求 核心素养
1.认识化学能与电能相互转化的实际意义及其重要应用。
2.理解原电池的工作原理,认识从单液原电池发展到双液原电池、隔膜电池的过程变化,并能理解原电池设计的实用性。 1. 宏观辨识与微观探析 以锌铜原电池为例,从宏观和微观相结合的角度讨论分析,理解原电池的工作原理。
2. 证据推理与模型认知 通过单液、双液电池、膜电池进行证据推理与模型构建。
3. 科学探究与创新意识 在实验过程、学习过程中发现问题、敢于质疑、勇于创新。
4. 科学态度与社会责任 培养严谨求实的科学态度,体会化学来源于生活、服务于生活。
理解原电池的工作原理,认识从单液原电池发展到双液原电池、隔膜电池、实用电池的变化 。
普通干电池
手机电池
钮扣电池
新能源车载电池
航空用
太阳能电池
电池究竟是一种什么样的装置?工作时,装置中发生了什么反应?工作原理是什么?
1.什么样的反应可以设计为原电池?
2.如何将反应中的电子引出?
氧化反应、还原反应两端分开进行,导线引出
3. 如何形成闭合回路?
氧化反应和还原反应两端之间应有导电微粒(离子)的定向移动。
氧化还原反应;放热反应
√
√
HCl+NaOH==NaCl +H2O
Zn+CuSO4 ==ZnSO4+Cu
H2 +CuO== Cu+H2O
2H2 + O2==2H2O
小组讨论
还原剂
e-
失电子
得电子
e-
e-
还原剂
氧化剂
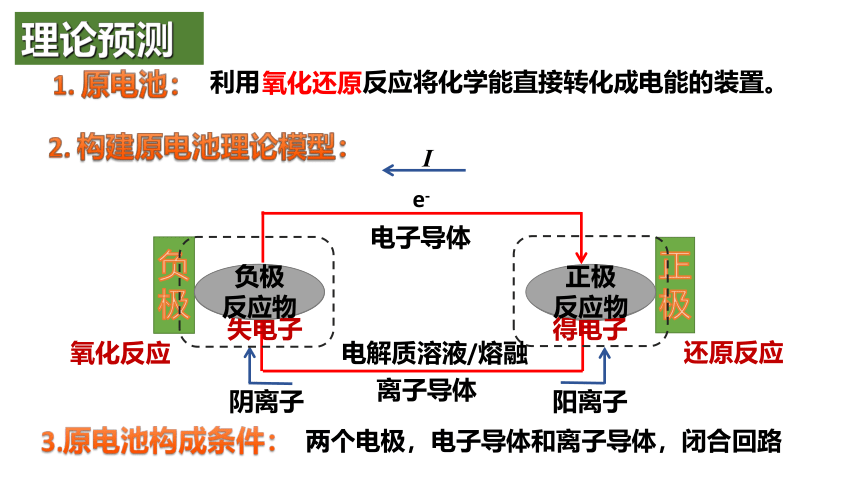
电子导体
失电子
得电子
电解质溶液/熔融
离子导体
阳离子
阴离子
负极
反应物
正极
反应物
氧化反应
还原反应
利用 反应将化学能直接转化成电能的装置。
氧化还原
理论预测
两个电极,电子导体和离子导体,闭合回路
I
实验材料:
铜片、锌片、1mol·L-1CuSO4溶液、烧杯、导线、检流计
设计装置,将反应Zn+CuSO4 ==ZnSO4+Cu产生的化学能转化为电能
※资料卡片
原电池中电流强度的大小与电极材料、两极距离、电解质浓度、电极与溶液的接触面积等因素有关
实验验证
Zn
A
Cu
Cu2+
Zn2+
e-
Zn
Cu2+
Cu
SO42-
SO42-
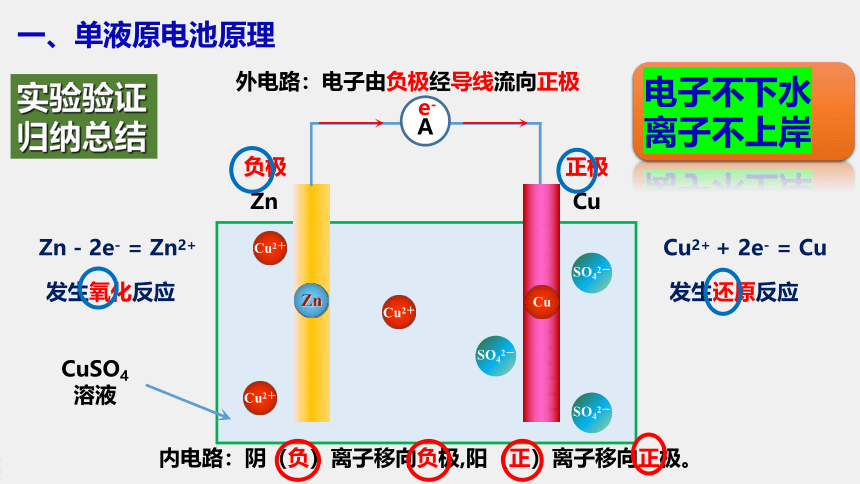
内电路:阴(负)离子移向负极,阳(正)离子移向正极。
外电路:电子由负极经导线流向正极
Cu2+
SO42-
e-
负极
正极
Zn - 2e- = Zn2+
发生氧化反应
Cu2+ + 2e- = Cu
发生还原反应
CuSO4
溶液
Zn
一、单液原电池原理
实验验证
归纳总结
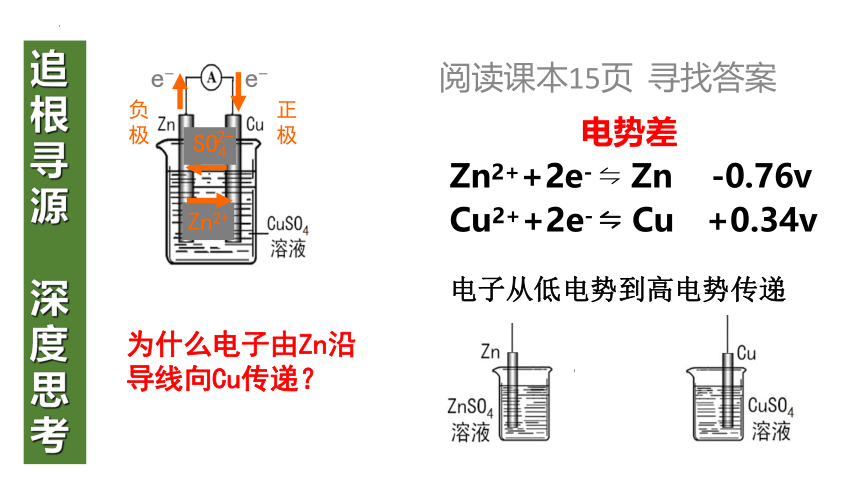
阅读课本15页 寻找答案
追
根
寻
源
深
度
思
考
负极
正极
e-
e-
Zn2+
SO4
2-
电势差
为什么电子由Zn沿
导线向Cu传递?
Zn2++2e- Zn -0.76v
Cu2++2e- Cu +0.34v
电子从低电势到高电势传递
理论上的现象
锌片逐渐溶解
铜片上有红色物质析出
电流表指针发生偏转
为
什
么
?
发
现
问
题
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
解决问题
实验材料: 铜片、锌片、1mol·L-1CuSO4溶液、1mol·L-1ZnSO4溶液 、烧杯、导线、检流计、滤纸条、脱脂棉条、KCl溶液
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
二、双液原电池原理
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
盐桥的作用:
1、使整个装置构成通路。(离子通路)
2、平衡电荷。
盐桥
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
归纳总结
转化效率:
电流稳定性:
电流大小:
高
转化效率:
电流稳定性:电流大小:
较小
较大
低
传感器实验对比
稳定
衰减快
发现问题
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
双液原电池电流弱的原因?
1.离子运动的距离长 2.离子运动的通道窄 3.离子容量小
Cu
CuSO4 溶液
CuSO4 溶液
解决问题
实验材料: 铜片、锌片、桔子(瓣) 、导线、检流计
隔膜电池
离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的高分子膜。
实验材料: 一毛硬币(镀镍)若干枚、五毛硬币(镀铜)若干枚、滤纸片、1mol·L-1NaCl溶液、培养皿、玻璃片、镊子、导线、检流计、发光二极管
意大利博物馆的伏打电堆
Volta,A (1745-1827)
课堂总结
单液原电池
双液原电池
隔膜原电池
原电池微型化实用化
原电池四要素
1.放热的氧化还原反应
2.两个电极
3.电子导体
4.离子导体
作业布置
随手关灯一小步
节约能源一大步
选择性必修1
《化学反应与能量变化 》
素养目标
重点难点
课标要求 核心素养
1.认识化学能与电能相互转化的实际意义及其重要应用。
2.理解原电池的工作原理,认识从单液原电池发展到双液原电池、隔膜电池的过程变化,并能理解原电池设计的实用性。 1. 宏观辨识与微观探析 以锌铜原电池为例,从宏观和微观相结合的角度讨论分析,理解原电池的工作原理。
2. 证据推理与模型认知 通过单液、双液电池、膜电池进行证据推理与模型构建。
3. 科学探究与创新意识 在实验过程、学习过程中发现问题、敢于质疑、勇于创新。
4. 科学态度与社会责任 培养严谨求实的科学态度,体会化学来源于生活、服务于生活。
理解原电池的工作原理,认识从单液原电池发展到双液原电池、隔膜电池、实用电池的变化 。
普通干电池
手机电池
钮扣电池
新能源车载电池
航空用
太阳能电池
电池究竟是一种什么样的装置?工作时,装置中发生了什么反应?工作原理是什么?
1.什么样的反应可以设计为原电池?
2.如何将反应中的电子引出?
氧化反应、还原反应两端分开进行,导线引出
3. 如何形成闭合回路?
氧化反应和还原反应两端之间应有导电微粒(离子)的定向移动。
氧化还原反应;放热反应
√
√
HCl+NaOH==NaCl +H2O
Zn+CuSO4 ==ZnSO4+Cu
H2 +CuO== Cu+H2O
2H2 + O2==2H2O
小组讨论
还原剂
e-
失电子
得电子
e-
e-
还原剂
氧化剂
电子导体
失电子
得电子
电解质溶液/熔融
离子导体
阳离子
阴离子
负极
反应物
正极
反应物
氧化反应
还原反应
利用 反应将化学能直接转化成电能的装置。
氧化还原
理论预测
两个电极,电子导体和离子导体,闭合回路
I
实验材料:
铜片、锌片、1mol·L-1CuSO4溶液、烧杯、导线、检流计
设计装置,将反应Zn+CuSO4 ==ZnSO4+Cu产生的化学能转化为电能
※资料卡片
原电池中电流强度的大小与电极材料、两极距离、电解质浓度、电极与溶液的接触面积等因素有关
实验验证
Zn
A
Cu
Cu2+
Zn2+
e-
Zn
Cu2+
Cu
SO42-
SO42-
内电路:阴(负)离子移向负极,阳(正)离子移向正极。
外电路:电子由负极经导线流向正极
Cu2+
SO42-
e-
负极
正极
Zn - 2e- = Zn2+
发生氧化反应
Cu2+ + 2e- = Cu
发生还原反应
CuSO4
溶液
Zn
一、单液原电池原理
实验验证
归纳总结
阅读课本15页 寻找答案
追
根
寻
源
深
度
思
考
负极
正极
e-
e-
Zn2+
SO4
2-
电势差
为什么电子由Zn沿
导线向Cu传递?
Zn2++2e- Zn -0.76v
Cu2++2e- Cu +0.34v
电子从低电势到高电势传递
理论上的现象
锌片逐渐溶解
铜片上有红色物质析出
电流表指针发生偏转
为
什
么
?
发
现
问
题
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
解决问题
实验材料: 铜片、锌片、1mol·L-1CuSO4溶液、1mol·L-1ZnSO4溶液 、烧杯、导线、检流计、滤纸条、脱脂棉条、KCl溶液
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
二、双液原电池原理
Zn - 2e- = Zn2+
Cu2+ + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
盐桥的作用:
1、使整个装置构成通路。(离子通路)
2、平衡电荷。
盐桥
※资料卡片
盐桥:装有含KCl饱和溶液的琼胶,Cl-、K+可在其中自由移动。
归纳总结
转化效率:
电流稳定性:
电流大小:
高
转化效率:
电流稳定性:电流大小:
较小
较大
低
传感器实验对比
稳定
衰减快
发现问题
改进
增大电流呢?
缩短盐桥的长度,增大盐桥的横截面积
能否用一张薄薄的隔膜代替盐桥呢?
双液原电池电流弱的原因?
1.离子运动的距离长 2.离子运动的通道窄 3.离子容量小
Cu
CuSO4 溶液
CuSO4 溶液
解决问题
实验材料: 铜片、锌片、桔子(瓣) 、导线、检流计
隔膜电池
离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的高分子膜。
实验材料: 一毛硬币(镀镍)若干枚、五毛硬币(镀铜)若干枚、滤纸片、1mol·L-1NaCl溶液、培养皿、玻璃片、镊子、导线、检流计、发光二极管
意大利博物馆的伏打电堆
Volta,A (1745-1827)
课堂总结
单液原电池
双液原电池
隔膜原电池
原电池微型化实用化
原电池四要素
1.放热的氧化还原反应
2.两个电极
3.电子导体
4.离子导体
作业布置
随手关灯一小步
节约能源一大步
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
