2022-2023学年鲁科版(2019)高中化学选择性必修一 1.3电能转化为化学能-电解(第一课时)课件(共34张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版(2019)高中化学选择性必修一 1.3电能转化为化学能-电解(第一课时)课件(共34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 95.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
电能转化为化学能-电解(第一课时)
自制“84”消毒机
随着疫情防控常态化,“84” 消毒液成为居家必需品,有时会缺货和限购。居家制作84消毒机成为应急之选。
“84”消毒液有效成分为NaClO
“84”消毒液有效成分是什么?
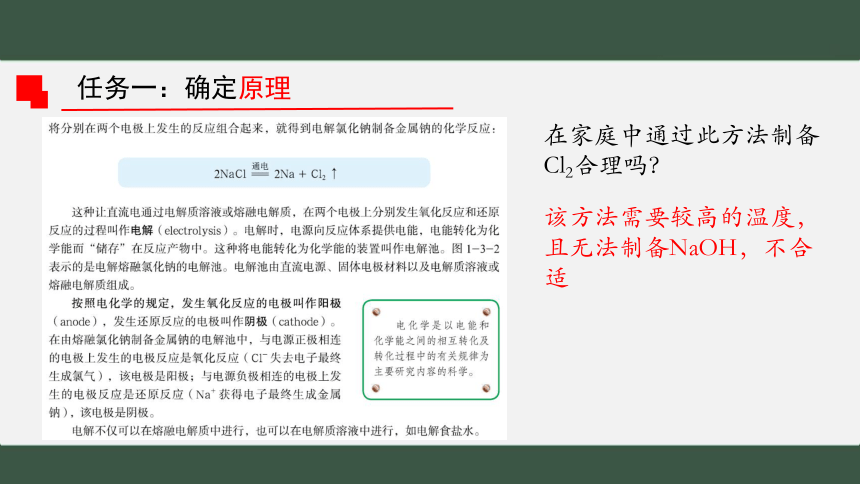
任务一:确定原理
【思考】制备“84”消毒液,利用哪些原理?
将氯气通入氢氧化钠溶液中
Cl2 +2NaOH=NaCl+NaClO+H2O
【思考1】在家里能直接找到Cl2和NaOH吗?
如果直接找不到Cl2和NaOH,能否通过化学反应间接找到并制备呢?
家中有NaCl和H2O,能否通过NaCl和H2O制备Cl2和NaOH,再将Cl2通入NaOH溶液中?
任务一:确定原理
家中无Cl2和NaOH
【思考1】 NaCl中存在Na+和Cl-,如何由NaCl制备Cl2?
【质疑】回顾氯化钠导电性实验
高一:从离子视角认识,通电→灯泡亮→离子定向移动→NaCl=Na++Cl-
高二:从物质视角认识,通电→有无新物质产生? Na+与Cl-发生了何种变化?
任务一:确定原理
依据“价-类”二维图,如何实现 2Cl— —2e—=Cl2↑?
任务一:确定原理
任务一:确定原理
在家庭中通过此方法制备Cl2合理吗?
该方法需要较高的温度,且无法制备NaOH,不合适
NaCl=Na++Cl—
如何将Cl—转化为Cl2 ,实现2Cl— —2e—=Cl2↑?
如何消除H+?H2O→OH— 从而生成OH— ?
【思考2】NaCl 水溶液中存在Na+、Cl—、OH—、H+,根据电解相关知识,如何转化成Cl2 和NaOH?
任务一:确定原理
H2O OH—+H+
结合初中电解水的实验 2 H2O=2H2↑+O2↑
H2O H++OH— 2H++2e—=H2↑
根据相关资料,也可写作 2H2O+2e—=2OH—+H2↑
通电
确定电解NaCl 水溶液的电极反应
阳极:2Cl— —2e—=Cl2↑
阴极:2H2O+2e—=2OH—+H2↑
总反应:2H2O+2NaCl=2NaOH+Cl2↑+H2↑
通电
任务一:确定原理
【思考3 】相比于熔融氯化钠,NaCl溶液为多微粒体系,体系中的其他微粒,如Na+、OH—会不会也放电?
饱和食盐水中放电顺序 Cl— >OH—,同理 H+ >Na+
经过分析,Na+不会影响H+放电,
OH—不会影响Cl—放电
任务一:确定原理
【评价任务】实验室中通过该装置,电解饱和食盐水制备NaOH H2 Cl2,产物在哪一极产生?
阴极产物:NaOH H2
阳极产物:Cl2
【思考】该装置可否用于大规模工业化生产?
任务一:确定原理
氯碱工业 可以分别制得Cl2 NaOH H2
工业大规模电解食盐水的装置是怎样的?
可以制得哪些产品?
任务一:确定原理
1.防止Cl2与NaOH和H2接触,防止防止副反应发生影响产品质量,防止引发不安全因素
2.用于物质的分离、提纯等
【评价任务】阳离子交换膜的作用有哪些?
任务一:确定原理
阳离子交换膜只允许阳离子通过,例如Na+;阴离子不能通过,例如OH-
【思考4】利用电解原理制备Cl2 和NaOH,需要哪些居家原材料?
由电解池的构成要素可知,电解池包括:
电源,电子导体,离子导体,电极材料
任务二:寻找原料
电源:220V交流电 、充电宝(5V直流电)
从安全性和电解池电流方向稳定性考虑,哪种电源合适?
选择充电宝(5V直流电)
电子导体:铜导线
任务二:寻找原料
离子导体:食盐水
电极材料:由电解熔融NaCl装置可知, 选择石墨棒,从废旧5号电池中取出正极
从实验安全性考虑,还要注意哪些问题?
Cl2 有毒,注意防止泄漏污染空气
防止Cl2 与H2混合爆炸
用橡皮筋将铜导线捆扎在石墨棒上
任务三:设计原创
①先制备Cl2和NaOH
制备NaOH
收集Cl2
②再将Cl2通入NaOH中
【评价方案】该装置存在哪些优点?从安全性角度分析,存在哪些缺点?
任务三:设计原创
制备NaOH
收集Cl2
缺点:步骤繁琐,收集Cl2的过程容易泄漏污染空气
优点:可以分别制备Cl2 H2 NaOH
【改进方案】如何改进?
任务三:设计原创
将阳极生成的Cl2通过上方导管插入阴极生成的NaOH溶液中
【学习借鉴】现在市面上有很多“84”消毒液制备机,老师也购买了一部,这些消毒机为何省略了将Cl2通入NaOH溶液中呢?
拆解购买的“84”消毒液制备机,发现阳极和阴极距离较小,让阳极产物Cl2与阴极产物NaOH直接接触反应,省略将Cl2通入NaOH
任务三:设计原创
【改进方案】参照市面上的“84”消毒液制备机,
如何改进该装置呢?
任务三:设计原创
缩短电极间距离
【思考】这个装置的优点有哪些?
棕色瓶,
防止H2与Cl2光照爆炸
任务三:设计原创
【思考】这个装置的优点有哪些?
阳极在阴极的下方,
Cl2在底部生成后,往上冒出,
增加与NaOH溶液接触时间
任务三:设计原创
实验验证
为何产生蓝色沉淀?
任务四:查找原因
预期现象 实际现象
阳极
阴极
产生蓝色沉淀
产生无色气体
产生黄绿色气体
产生无色气体
【思考】有的同学制作完电解食盐水装置后,阳极产生气体极少,未制得84消毒液且瓶中产生蓝色沉淀,为何阳极附近产生蓝色沉淀?
阳极没有产生氯气 蓝色为Cu2+
连接石墨电极的铜丝裸露在NaCl溶液中
Cu—2e—=Cu2+
Cu2++2OH—=Cu(OH)2↓
【归纳总结】
放电顺序:活性金属电极(如Cu Fe Zn)>Cl—>OH—>含氧酸根
任务四:查找原因
Cu
【思考】如何设计实验验证你的猜想?
【改进方案】如何进一步改进实验装置?
将铜导线连接在瓶子外部
铜导线不插入NaCl溶液中,观测到预期现象,
缺点:
①两个电极接触容易短路
②电解质溶液较少,制备消毒液量少
任务四:查找原因
任务四:查找原因
【思考】在电解工艺发明之前,通常将Cl2通入NaOH溶液中制备84消毒液。
电解NaCl溶液制备NaClO,原料利用率高
Cl2 +2NaOH=NaCl+NaClO+H2O
电解工艺发明之后,电解总反应为:2H2O+2NaCl=2NaOH+Cl2↑+H2↑
Cl2+2NaOH=NaCl+NaClO+H2O
通电
任务四:查找原因
请分析电解工艺优点
【拓展】从增大电流和离子浓度角度考虑,采取哪些改进措施,制备“84”消毒液效率更高一些?
①提高食盐水浓度,可用饱和食盐水
②增大电极接触面积,换用更粗的碳棒
③减小两电极距离
④提高电源电压
⑤加入导电性物质,如小苏打,但不能加入酸性物质
任务四:查找原因
【思考】加入小苏打NaHCO3溶液会不会改变电极反应,产生杂质?
不会,在水溶液中,含氧酸根HCO3—不会放电
任务四:查找原因
【改进措施】
③减小电极间距离
任务四:查找原因
②换用更粗的碳棒
(从1号废旧电池中取出)
①增加电极数目
4.制作“84消毒机”使用说明书
①100mL水中加入5g左右NaCl
②常温电解
③通电时间10min左右
④84消毒机使用时不能加入酸性物质
⑤反应容器不能为金属
任务四:查找原因
1.构建设计电化学装置的思路模型
1.原理
2.原料
3.原创
4.原因
5.原型
装置维度
任务五:总结原型
制备Cl2和NaOH
充电宝,石墨棒,食盐水
未制得84消毒液,蓝色沉淀如何产生?
设计电解食盐水制备Cl2和NaOH装置
原理维度
现象
电极产物
过程
电极
反应物
失电子场所
电子导体
离子导体
得电子场所
还原剂
氧化剂
氧化产物
还原产物
电子移动方向
阳离子移动方向
阴离子移动方向
失电子
得电子
阳极材料
阴极材料
装置维度
原理维度
2.构建电化学分析模型
疫情防控期间,每天用84消毒液擦拭门把手,久而久之,门把手表面的铜镀层被腐蚀出现破损,如何修补铜镀层呢?需要哪些原料?
电能转化为化学能-电解(第一课时)
自制“84”消毒机
随着疫情防控常态化,“84” 消毒液成为居家必需品,有时会缺货和限购。居家制作84消毒机成为应急之选。
“84”消毒液有效成分为NaClO
“84”消毒液有效成分是什么?
任务一:确定原理
【思考】制备“84”消毒液,利用哪些原理?
将氯气通入氢氧化钠溶液中
Cl2 +2NaOH=NaCl+NaClO+H2O
【思考1】在家里能直接找到Cl2和NaOH吗?
如果直接找不到Cl2和NaOH,能否通过化学反应间接找到并制备呢?
家中有NaCl和H2O,能否通过NaCl和H2O制备Cl2和NaOH,再将Cl2通入NaOH溶液中?
任务一:确定原理
家中无Cl2和NaOH
【思考1】 NaCl中存在Na+和Cl-,如何由NaCl制备Cl2?
【质疑】回顾氯化钠导电性实验
高一:从离子视角认识,通电→灯泡亮→离子定向移动→NaCl=Na++Cl-
高二:从物质视角认识,通电→有无新物质产生? Na+与Cl-发生了何种变化?
任务一:确定原理
依据“价-类”二维图,如何实现 2Cl— —2e—=Cl2↑?
任务一:确定原理
任务一:确定原理
在家庭中通过此方法制备Cl2合理吗?
该方法需要较高的温度,且无法制备NaOH,不合适
NaCl=Na++Cl—
如何将Cl—转化为Cl2 ,实现2Cl— —2e—=Cl2↑?
如何消除H+?H2O→OH— 从而生成OH— ?
【思考2】NaCl 水溶液中存在Na+、Cl—、OH—、H+,根据电解相关知识,如何转化成Cl2 和NaOH?
任务一:确定原理
H2O OH—+H+
结合初中电解水的实验 2 H2O=2H2↑+O2↑
H2O H++OH— 2H++2e—=H2↑
根据相关资料,也可写作 2H2O+2e—=2OH—+H2↑
通电
确定电解NaCl 水溶液的电极反应
阳极:2Cl— —2e—=Cl2↑
阴极:2H2O+2e—=2OH—+H2↑
总反应:2H2O+2NaCl=2NaOH+Cl2↑+H2↑
通电
任务一:确定原理
【思考3 】相比于熔融氯化钠,NaCl溶液为多微粒体系,体系中的其他微粒,如Na+、OH—会不会也放电?
饱和食盐水中放电顺序 Cl— >OH—,同理 H+ >Na+
经过分析,Na+不会影响H+放电,
OH—不会影响Cl—放电
任务一:确定原理
【评价任务】实验室中通过该装置,电解饱和食盐水制备NaOH H2 Cl2,产物在哪一极产生?
阴极产物:NaOH H2
阳极产物:Cl2
【思考】该装置可否用于大规模工业化生产?
任务一:确定原理
氯碱工业 可以分别制得Cl2 NaOH H2
工业大规模电解食盐水的装置是怎样的?
可以制得哪些产品?
任务一:确定原理
1.防止Cl2与NaOH和H2接触,防止防止副反应发生影响产品质量,防止引发不安全因素
2.用于物质的分离、提纯等
【评价任务】阳离子交换膜的作用有哪些?
任务一:确定原理
阳离子交换膜只允许阳离子通过,例如Na+;阴离子不能通过,例如OH-
【思考4】利用电解原理制备Cl2 和NaOH,需要哪些居家原材料?
由电解池的构成要素可知,电解池包括:
电源,电子导体,离子导体,电极材料
任务二:寻找原料
电源:220V交流电 、充电宝(5V直流电)
从安全性和电解池电流方向稳定性考虑,哪种电源合适?
选择充电宝(5V直流电)
电子导体:铜导线
任务二:寻找原料
离子导体:食盐水
电极材料:由电解熔融NaCl装置可知, 选择石墨棒,从废旧5号电池中取出正极
从实验安全性考虑,还要注意哪些问题?
Cl2 有毒,注意防止泄漏污染空气
防止Cl2 与H2混合爆炸
用橡皮筋将铜导线捆扎在石墨棒上
任务三:设计原创
①先制备Cl2和NaOH
制备NaOH
收集Cl2
②再将Cl2通入NaOH中
【评价方案】该装置存在哪些优点?从安全性角度分析,存在哪些缺点?
任务三:设计原创
制备NaOH
收集Cl2
缺点:步骤繁琐,收集Cl2的过程容易泄漏污染空气
优点:可以分别制备Cl2 H2 NaOH
【改进方案】如何改进?
任务三:设计原创
将阳极生成的Cl2通过上方导管插入阴极生成的NaOH溶液中
【学习借鉴】现在市面上有很多“84”消毒液制备机,老师也购买了一部,这些消毒机为何省略了将Cl2通入NaOH溶液中呢?
拆解购买的“84”消毒液制备机,发现阳极和阴极距离较小,让阳极产物Cl2与阴极产物NaOH直接接触反应,省略将Cl2通入NaOH
任务三:设计原创
【改进方案】参照市面上的“84”消毒液制备机,
如何改进该装置呢?
任务三:设计原创
缩短电极间距离
【思考】这个装置的优点有哪些?
棕色瓶,
防止H2与Cl2光照爆炸
任务三:设计原创
【思考】这个装置的优点有哪些?
阳极在阴极的下方,
Cl2在底部生成后,往上冒出,
增加与NaOH溶液接触时间
任务三:设计原创
实验验证
为何产生蓝色沉淀?
任务四:查找原因
预期现象 实际现象
阳极
阴极
产生蓝色沉淀
产生无色气体
产生黄绿色气体
产生无色气体
【思考】有的同学制作完电解食盐水装置后,阳极产生气体极少,未制得84消毒液且瓶中产生蓝色沉淀,为何阳极附近产生蓝色沉淀?
阳极没有产生氯气 蓝色为Cu2+
连接石墨电极的铜丝裸露在NaCl溶液中
Cu—2e—=Cu2+
Cu2++2OH—=Cu(OH)2↓
【归纳总结】
放电顺序:活性金属电极(如Cu Fe Zn)>Cl—>OH—>含氧酸根
任务四:查找原因
Cu
【思考】如何设计实验验证你的猜想?
【改进方案】如何进一步改进实验装置?
将铜导线连接在瓶子外部
铜导线不插入NaCl溶液中,观测到预期现象,
缺点:
①两个电极接触容易短路
②电解质溶液较少,制备消毒液量少
任务四:查找原因
任务四:查找原因
【思考】在电解工艺发明之前,通常将Cl2通入NaOH溶液中制备84消毒液。
电解NaCl溶液制备NaClO,原料利用率高
Cl2 +2NaOH=NaCl+NaClO+H2O
电解工艺发明之后,电解总反应为:2H2O+2NaCl=2NaOH+Cl2↑+H2↑
Cl2+2NaOH=NaCl+NaClO+H2O
通电
任务四:查找原因
请分析电解工艺优点
【拓展】从增大电流和离子浓度角度考虑,采取哪些改进措施,制备“84”消毒液效率更高一些?
①提高食盐水浓度,可用饱和食盐水
②增大电极接触面积,换用更粗的碳棒
③减小两电极距离
④提高电源电压
⑤加入导电性物质,如小苏打,但不能加入酸性物质
任务四:查找原因
【思考】加入小苏打NaHCO3溶液会不会改变电极反应,产生杂质?
不会,在水溶液中,含氧酸根HCO3—不会放电
任务四:查找原因
【改进措施】
③减小电极间距离
任务四:查找原因
②换用更粗的碳棒
(从1号废旧电池中取出)
①增加电极数目
4.制作“84消毒机”使用说明书
①100mL水中加入5g左右NaCl
②常温电解
③通电时间10min左右
④84消毒机使用时不能加入酸性物质
⑤反应容器不能为金属
任务四:查找原因
1.构建设计电化学装置的思路模型
1.原理
2.原料
3.原创
4.原因
5.原型
装置维度
任务五:总结原型
制备Cl2和NaOH
充电宝,石墨棒,食盐水
未制得84消毒液,蓝色沉淀如何产生?
设计电解食盐水制备Cl2和NaOH装置
原理维度
现象
电极产物
过程
电极
反应物
失电子场所
电子导体
离子导体
得电子场所
还原剂
氧化剂
氧化产物
还原产物
电子移动方向
阳离子移动方向
阴离子移动方向
失电子
得电子
阳极材料
阴极材料
装置维度
原理维度
2.构建电化学分析模型
疫情防控期间,每天用84消毒液擦拭门把手,久而久之,门把手表面的铜镀层被腐蚀出现破损,如何修补铜镀层呢?需要哪些原料?
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
