化学人教版(2019)必修第一册2.1.1活泼金属钠(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1活泼金属钠(共21张ppt) | 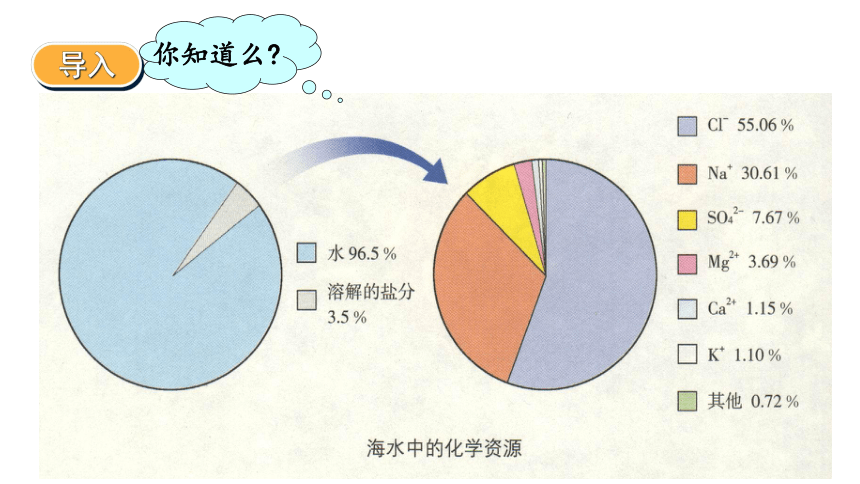 | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 17:02:49 | ||
图片预览







文档简介
(共21张PPT)
导入
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠是其中含量较高的元素,也是典型的金属元素。
你知道么
钠及其化合物
第一课时 金属钠的性质
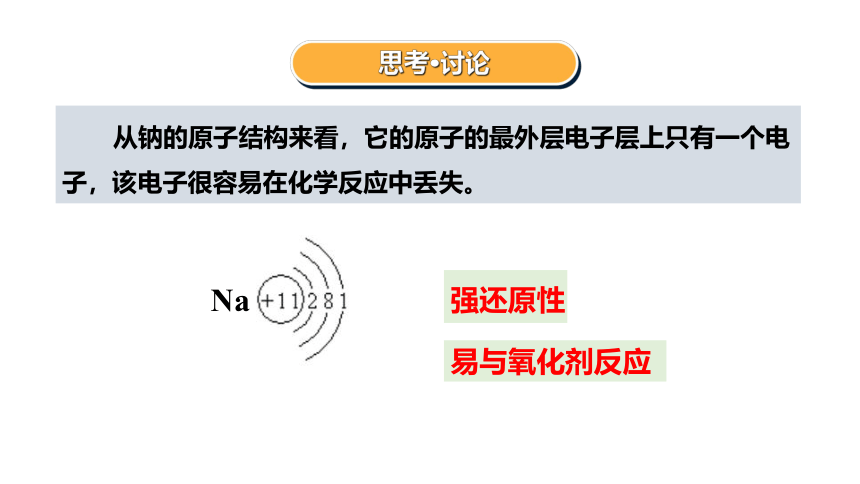
思考·讨论
强还原性
从钠的原子结构来看,它的原子的最外层电子层上只有一个电子,该电子很容易在化学反应中丢失。
Na
易与氧化剂反应
☆用镊子取(不能用手接触)
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
☆未用的钠放回原试剂瓶
一、Na与氧气的反应
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
很活泼 ,常温下能与氧气反应:
4Na + O2 = 2Na2O(白色)
Na的性质
钠必须保存在隔绝空气环境中,实验室将钠保存在煤油或石蜡油中。
物理性质 密度 硬度 颜色 状态
比煤油重
小(质地软)
银白色
固体
化学性质
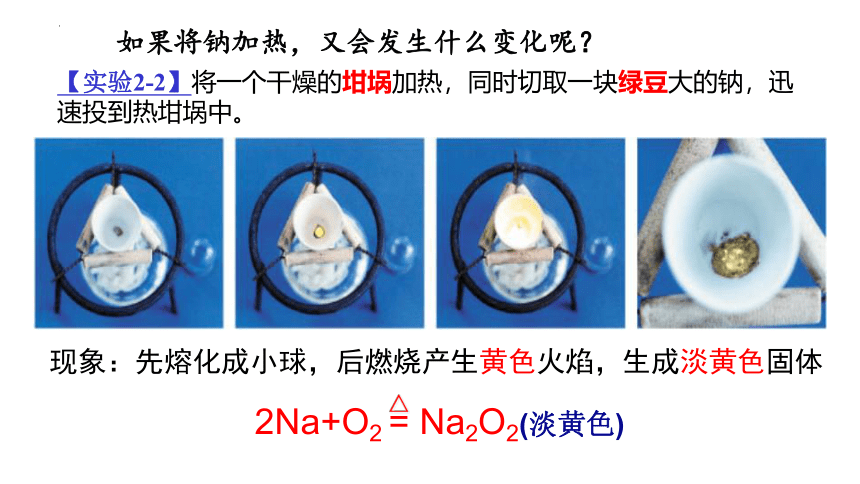
现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。
△
2Na+O2 = Na2O2(淡黄色)
如果将钠加热,又会发生什么变化呢?
氧化钠与过氧化钠的比较
氧化钠 过氧化钠
化 学 式
颜 色
生 成 条 件
氧的化合价
阴、阳离子
Na2O
Na2O2
-2
-1
白色
淡黄色
常温
点燃或加热
2Na+Cl2 = 2NaCl
点燃
小结
金属钠
与O2反应 常温下:4Na+O2=2Na2O
加热下:2Na+O2=Na2O2
△
与S反应
与Cl2反应
研磨
2Na+S = Na2S(加热会爆炸)
概括 现象 性质
浮
熔
游、响
红
钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红
密度比水小
反应放热,熔点低
产生气体
生成碱性物质
2、Na与水的反应 探究P34
钠除了能与氧气、氯气等非金属单质直接化合,还能与水发生反应。
?
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
预测
Na + H2O — NaOH +____
0 +1
化合价升高
+1 -2
化合价降低
H2
2Na + 2H2O = 2NaOH + H2↑
离子方程式:
2Na + 2H2O = 2Na+ + 2OH- +H2↑
钠与水反应的实质:
Na与H2O电离出的少量H+发生置换反应生成H2
现象:听到轻微的爆鸣声
如何检验金属钠与水反应生成的气体是H2
性质
决定
用途
钠易与O2反应
钠保存在煤油或石蜡油中
钠易与H2O反应
钠着火时用干燥的沙土扑灭
取一小试管,向其中加入等体积的水和煤油,然后把一小块金属钠放入到试管中,预测现象并解释。
活动探究
钠球先掉到煤油与水的分界面处,然后在煤油中上下跳跃,并逐渐消失
将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
2Na+2HCl=2NaCl+H2↑
思考·讨论
钠和水反应,实质上是跟水电离的H+反应,而酸中的H+浓度更大。所以钠会先与酸反应。
钠不足时,只与酸反应;
钠过量时,先酸后水。
将钠放入硫酸铜溶液中,能否置换出铜单质?
思考·讨论
现象:浮、游、熔、响、蓝色沉淀
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O+ CuSO4 = 2Na2SO4 + Cu(OH)2↓+ H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
钠与盐溶液反应实质:
钠先与水反应,生成的NaOH再与盐发生复分解反应。
将一小块金属钠投入氯化铁溶液呢?
2NaCl(熔融)= 2Na + Cl2↑
电解
工业上制取金属钠主要是用电解熔融的氯化钠的方法:
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
思维启迪
钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
钠的用途
(1)制备高压钠灯
(2)制备钠的化合物
(3)制备某些金属(如钛、锆)
(4)Na-K液态合金做原子反应堆的导热剂
思维启迪
4Na + TiCl4(熔融)= Ti+4NaCl
高温
1.(双选)下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生Na2O
C.钠具有很强的还原性 D.钠在过量氧气中反应生成Na2O2
课堂达标
BD
2.下列描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O = 2NaOH + H2↑
B. 钠在空气中加热的方程式:4Na + O2 = 2Na2O
C. 钠和盐酸反应的方程式: 2Na + 2HCl = 2NaCl + H2↑
D. 钠和熔融硫酸铜反应的方程式:2Na + CuSO4 = Cu + Na2SO4
B
3.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的盐溶液中还原出来
D.保存在煤油中的钠是银白色的固体
D
课堂达标
4.相同质量的钠分别投入到足量水、足量盐酸、足量CuSO4溶液中,产生氢气的量谁多?谁少?
银白色金属钠
(Na)
表面变暗
出现白色固体
表面变成溶液
白色粉末状物质
白色块状物
O2
风化
CO2
H2O
H2O
Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
① 4Na+O2=2Na2O
② Na2O+H2O=2NaOH
② 2Na+2H2O=2NaOH+H2↑
④ 2NaOH+CO2=Na2CO3+H2O
④ Na2CO3+10H2O=Na2CO3·10H2O
⑤ Na2CO3·10H2O= Na2CO3+10H2O
思考·讨论
(生成Na2O)
(生成NaOH)
(NaOH潮解)
(生成Na2CO3·10H2O)
(生成Na2CO3)
导入
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠是其中含量较高的元素,也是典型的金属元素。
你知道么
钠及其化合物
第一课时 金属钠的性质
思考·讨论
强还原性
从钠的原子结构来看,它的原子的最外层电子层上只有一个电子,该电子很容易在化学反应中丢失。
Na
易与氧化剂反应
☆用镊子取(不能用手接触)
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
☆未用的钠放回原试剂瓶
一、Na与氧气的反应
【实验2-1】用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
很活泼 ,常温下能与氧气反应:
4Na + O2 = 2Na2O(白色)
Na的性质
钠必须保存在隔绝空气环境中,实验室将钠保存在煤油或石蜡油中。
物理性质 密度 硬度 颜色 状态
比煤油重
小(质地软)
银白色
固体
化学性质
现象:先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。
△
2Na+O2 = Na2O2(淡黄色)
如果将钠加热,又会发生什么变化呢?
氧化钠与过氧化钠的比较
氧化钠 过氧化钠
化 学 式
颜 色
生 成 条 件
氧的化合价
阴、阳离子
Na2O
Na2O2
-2
-1
白色
淡黄色
常温
点燃或加热
2Na+Cl2 = 2NaCl
点燃
小结
金属钠
与O2反应 常温下:4Na+O2=2Na2O
加热下:2Na+O2=Na2O2
△
与S反应
与Cl2反应
研磨
2Na+S = Na2S(加热会爆炸)
概括 现象 性质
浮
熔
游、响
红
钠浮在水面上
立刻熔成一个小球
在水面上四处游动,发出“嘶嘶声”
反应后溶液变红
密度比水小
反应放热,熔点低
产生气体
生成碱性物质
2、Na与水的反应 探究P34
钠除了能与氧气、氯气等非金属单质直接化合,还能与水发生反应。
?
从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。
预测
Na + H2O — NaOH +____
0 +1
化合价升高
+1 -2
化合价降低
H2
2Na + 2H2O = 2NaOH + H2↑
离子方程式:
2Na + 2H2O = 2Na+ + 2OH- +H2↑
钠与水反应的实质:
Na与H2O电离出的少量H+发生置换反应生成H2
现象:听到轻微的爆鸣声
如何检验金属钠与水反应生成的气体是H2
性质
决定
用途
钠易与O2反应
钠保存在煤油或石蜡油中
钠易与H2O反应
钠着火时用干燥的沙土扑灭
取一小试管,向其中加入等体积的水和煤油,然后把一小块金属钠放入到试管中,预测现象并解释。
活动探究
钠球先掉到煤油与水的分界面处,然后在煤油中上下跳跃,并逐渐消失
将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?
2Na+2HCl=2NaCl+H2↑
思考·讨论
钠和水反应,实质上是跟水电离的H+反应,而酸中的H+浓度更大。所以钠会先与酸反应。
钠不足时,只与酸反应;
钠过量时,先酸后水。
将钠放入硫酸铜溶液中,能否置换出铜单质?
思考·讨论
现象:浮、游、熔、响、蓝色沉淀
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O+ CuSO4 = 2Na2SO4 + Cu(OH)2↓+ H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
钠与盐溶液反应实质:
钠先与水反应,生成的NaOH再与盐发生复分解反应。
将一小块金属钠投入氯化铁溶液呢?
2NaCl(熔融)= 2Na + Cl2↑
电解
工业上制取金属钠主要是用电解熔融的氯化钠的方法:
熔融态的氯化钠通电后,生成的氯气在此条件下密度较小,就飘在熔炉的上层而生成的钠也是以气体的形式存在,但密度较大,所以飘在下层。
两种气体相邻的位置一接触就会反应,生成氯化钠的小液滴,小液滴越来越多,最后就把两种气体完全隔开了。
再将两种气体分别抽出,再净化、冷却,就可以得到较纯金属钠了。
思维启迪
钠元素在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
钠的用途
(1)制备高压钠灯
(2)制备钠的化合物
(3)制备某些金属(如钛、锆)
(4)Na-K液态合金做原子反应堆的导热剂
思维启迪
4Na + TiCl4(熔融)= Ti+4NaCl
高温
1.(双选)下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰 B.钠燃烧时产生Na2O
C.钠具有很强的还原性 D.钠在过量氧气中反应生成Na2O2
课堂达标
BD
2.下列描述中,不正确的是( )
A. 钠和水反应的方程式:2Na + 2H2O = 2NaOH + H2↑
B. 钠在空气中加热的方程式:4Na + O2 = 2Na2O
C. 钠和盐酸反应的方程式: 2Na + 2HCl = 2NaCl + H2↑
D. 钠和熔融硫酸铜反应的方程式:2Na + CuSO4 = Cu + Na2SO4
B
3.下面关于金属钠的描述正确的是( )
A.钠的化学性质很活泼,在自然界里能以游离态存在
B.钠离子和钠原子都具有较强的还原性
C.钠能把钛锆等金属从它们的盐溶液中还原出来
D.保存在煤油中的钠是银白色的固体
D
课堂达标
4.相同质量的钠分别投入到足量水、足量盐酸、足量CuSO4溶液中,产生氢气的量谁多?谁少?
银白色金属钠
(Na)
表面变暗
出现白色固体
表面变成溶液
白色粉末状物质
白色块状物
O2
风化
CO2
H2O
H2O
Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
① 4Na+O2=2Na2O
② Na2O+H2O=2NaOH
② 2Na+2H2O=2NaOH+H2↑
④ 2NaOH+CO2=Na2CO3+H2O
④ Na2CO3+10H2O=Na2CO3·10H2O
⑤ Na2CO3·10H2O= Na2CO3+10H2O
思考·讨论
(生成Na2O)
(生成NaOH)
(NaOH潮解)
(生成Na2CO3·10H2O)
(生成Na2CO3)
