化学人教版(2019)必修第二册8.1.自然资源的开发利用(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.自然资源的开发利用(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-05 17:04:04 | ||
图片预览






文档简介
(共18张PPT)
第八章 化学与可持续发展
第一节 自然资源的开发利用
自然资源
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
可持续发展
合理利用
制约
目标:满足人类需要的同时,人类的行为要受到自然界的限制。即:人类代际之间、不同国家不同地区之间、人类与其他生物之间的公平。
包括
经济可持续发展
社会可持续发展
资源可持续发展
环境可持续发展
化学
是人类利用自然资源和应对环境问题的重要科学依据。
一、金属矿物的开发利用
1.金属冶炼原理与实质
(1)原理:Mn++ne-→M
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属还原性逐渐减弱 金属阳离子的得电子能力逐渐增强
(2)冶炼方法:
电解法
热还原法
热分解法
密度法
为什么电解法炼铝不用AlCl3,而炼镁时不用MgO
铝热反应的应用
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等高熔点金属。
矿石富集:除去杂质,提高矿石中有用成分含量。
冶炼:利用氧化还原反应,在一定条件下,
把金属离子还原成单质。
精炼:采用一定方法,提炼金属。
冶炼金属的工业流程
铝土矿
氧化铝
电解铝
净化
精炼
铝锭
提纯
电解
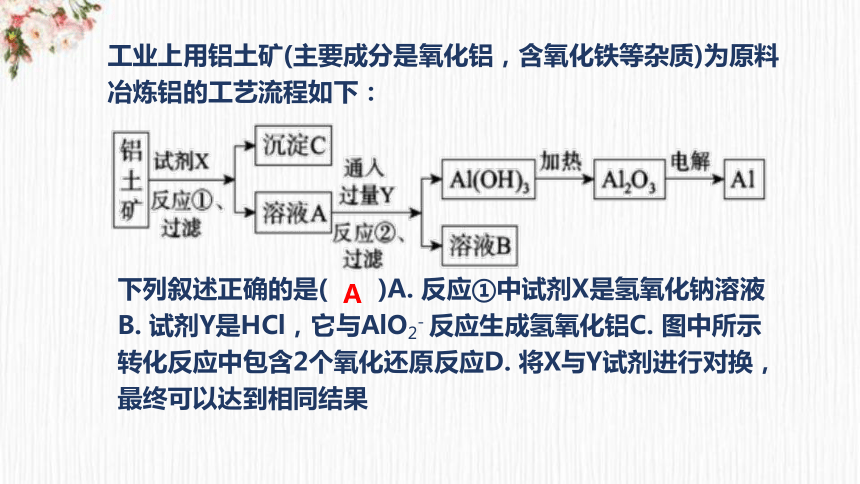
如何从铝土矿(主要成分是Al2O3,含MgO、Fe2O3、SiO2等杂质)中提纯Al2O3 ?
工业上用铝土矿(主要成分是氧化铝,含氧化铁等杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )A. 反应①中试剂X是氢氧化钠溶液B. 试剂Y是HCl,它与AlO2- 反应生成氢氧化铝C. 图中所示转化反应中包含2个氧化还原反应D. 将X与Y试剂进行对换,最终可以达到相同结果
A
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性强弱
D
已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的
方法是( )
A.电解法 B.热还原法 C.热分解法 D.铝热法
A
合理开发和利用矿物资源
(1)资源有限且分布不均 (2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染 (4)金属腐蚀造成大量损失
原 因
(1)提高金属矿物的利用率 (2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀 (4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
措 施
完成P99“思考与讨论”相关问题
二、海水资源的开发利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
海洋约占地球表面积的71%
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素,其总含量超过99%
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等,
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
海水资源
海水资源的利用—水资源的利用
主要包括:直接利用海水进行循环冷却和海水淡化等。
反渗透法
指的是在半透膜的原水一侧施加比溶液渗透压高的外界压力,原水透过半透膜时,只允许水透过,其他物质不能透过而被截留在膜表面的过程。
最先使用,技术成熟,但成本高
成本低,但未能大量生产
蒸馏实验操作步骤:
连接装置→检查装置气密性→向烧瓶中加入海水和碎瓷片→接通冷却水→给烧瓶加热→收集蒸馏水→停止对烧瓶加热→待冷却至室温后停止通入冷却水→整理仪器。
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
实验室模拟蒸馏法淡化海水
蒸馏法适用于分离互溶但沸点不同的液态混合物
海水资源的利用—海水制盐(NaCl)
HCl溶液
,过滤
蒸发结晶
粗盐
NaOH溶液、BaCl2溶液、Na2CO3溶液
均过量
适量
2NaCl+ 2H2O === H2 + Cl2 +2NaOH
电解
↑
↑
2NaCl(熔融)=== 2Na + Cl2
电解
↑
侯氏制碱法:
海水资源的利用—海水提溴
海水资源的利用—海水提溴
请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
酸和Cl2
吹出塔
空气
吸收塔
SO2和H2O
蒸馏塔
Cl2和H2O
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤①反应的离子方程式是
______________________________;
(2)步骤③反应的化学方程式是
______________________________。
从理论上考虑,下列也能吸收Br2的是_________
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因_________________________________________________________________
_______________________________________________________。
(4)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏得到液溴
____________________________________________________________________________
__________________________________________________。
2Br-+Cl2=Br2+2Cl-
SO2+Br2+2H2O=H2SO4+2HBr
ABC
若温度过高,大量水蒸气随溴排出,所得气体中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高。而“溴水混合物Ⅱ”中溴元素被富集,是浓缩溴水
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
海水资源的利用—海带提碘
2H++2I-+H2O2= I2+2H2O
如何设计实验证明海带中含有碘元素?
第八章 化学与可持续发展
第一节 自然资源的开发利用
自然资源
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
可再生资源
不可再生资源
可持续发展
合理利用
制约
目标:满足人类需要的同时,人类的行为要受到自然界的限制。即:人类代际之间、不同国家不同地区之间、人类与其他生物之间的公平。
包括
经济可持续发展
社会可持续发展
资源可持续发展
环境可持续发展
化学
是人类利用自然资源和应对环境问题的重要科学依据。
一、金属矿物的开发利用
1.金属冶炼原理与实质
(1)原理:Mn++ne-→M
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属还原性逐渐减弱 金属阳离子的得电子能力逐渐增强
(2)冶炼方法:
电解法
热还原法
热分解法
密度法
为什么电解法炼铝不用AlCl3,而炼镁时不用MgO
铝热反应的应用
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等高熔点金属。
矿石富集:除去杂质,提高矿石中有用成分含量。
冶炼:利用氧化还原反应,在一定条件下,
把金属离子还原成单质。
精炼:采用一定方法,提炼金属。
冶炼金属的工业流程
铝土矿
氧化铝
电解铝
净化
精炼
铝锭
提纯
电解
如何从铝土矿(主要成分是Al2O3,含MgO、Fe2O3、SiO2等杂质)中提纯Al2O3 ?
工业上用铝土矿(主要成分是氧化铝,含氧化铁等杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )A. 反应①中试剂X是氢氧化钠溶液B. 试剂Y是HCl,它与AlO2- 反应生成氢氧化铝C. 图中所示转化反应中包含2个氧化还原反应D. 将X与Y试剂进行对换,最终可以达到相同结果
A
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性强弱
D
已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的
方法是( )
A.电解法 B.热还原法 C.热分解法 D.铝热法
A
合理开发和利用矿物资源
(1)资源有限且分布不均 (2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染 (4)金属腐蚀造成大量损失
原 因
(1)提高金属矿物的利用率 (2)开发环保高效的金属冶炼方法
(3)防止金属的腐蚀 (4)加强废旧金属的回收和再利用
(5)使用其他材料代替金属材料
措 施
完成P99“思考与讨论”相关问题
二、海水资源的开发利用
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
海洋约占地球表面积的71%
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素,其总含量超过99%
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等,
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
海水资源
海水资源的利用—水资源的利用
主要包括:直接利用海水进行循环冷却和海水淡化等。
反渗透法
指的是在半透膜的原水一侧施加比溶液渗透压高的外界压力,原水透过半透膜时,只允许水透过,其他物质不能透过而被截留在膜表面的过程。
最先使用,技术成熟,但成本高
成本低,但未能大量生产
蒸馏实验操作步骤:
连接装置→检查装置气密性→向烧瓶中加入海水和碎瓷片→接通冷却水→给烧瓶加热→收集蒸馏水→停止对烧瓶加热→待冷却至室温后停止通入冷却水→整理仪器。
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
实验室模拟蒸馏法淡化海水
蒸馏法适用于分离互溶但沸点不同的液态混合物
海水资源的利用—海水制盐(NaCl)
HCl溶液
,过滤
蒸发结晶
粗盐
NaOH溶液、BaCl2溶液、Na2CO3溶液
均过量
适量
2NaCl+ 2H2O === H2 + Cl2 +2NaOH
电解
↑
↑
2NaCl(熔融)=== 2Na + Cl2
电解
↑
侯氏制碱法:
海水资源的利用—海水提溴
海水资源的利用—海水提溴
请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
酸和Cl2
吹出塔
空气
吸收塔
SO2和H2O
蒸馏塔
Cl2和H2O
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤①反应的离子方程式是
______________________________;
(2)步骤③反应的化学方程式是
______________________________。
从理论上考虑,下列也能吸收Br2的是_________
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因_________________________________________________________________
_______________________________________________________。
(4)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏得到液溴
____________________________________________________________________________
__________________________________________________。
2Br-+Cl2=Br2+2Cl-
SO2+Br2+2H2O=H2SO4+2HBr
ABC
若温度过高,大量水蒸气随溴排出,所得气体中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高。而“溴水混合物Ⅱ”中溴元素被富集,是浓缩溴水
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
海水资源的利用—海带提碘
2H++2I-+H2O2= I2+2H2O
如何设计实验证明海带中含有碘元素?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
