第一章 原子结构与性质 测试题(含解析) 高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章 原子结构与性质 测试题(含解析) 高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 506.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 11:21:43 | ||
图片预览




文档简介
第一章 原子结构与性质 测试题
一、选择题
1.关于原子结构的研究,科学家分别提出过:原子论、“葡萄干布丁”模型、核式模型、核外电子分层排布模型、量子力学模型。提出核外电子分层排布模型的科学家是
A.卢瑟福 B.玻尔 C.汤姆逊 D.道尔顿
2.科学家最近发表的科技信息如下:
信息1:我国科学家合成新核素—钍-207:
信息2:美国科学家利用化学线索(、、)揭示恐龙新陈代谢率高低。
信息3:我国科学家发现飞尘颗粒物中铁的同位素:。
已知:半衰期指物质质量减少一半所用时间。
下列叙述错误的是
A.同周期中,X的第一电离能最大
B.、的半衰期较长
C.的中子数为90
D.和互为同位素
3.已知A、B、C、D是原子序数依次增大的短周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子。下列说法正确的是
A.C、D原子形成的简单离子半径:D+>C2-
B.A、B、C三种元素的电负性:C>B>A
C.B、C元素的第一电离能:C>B
D.D元素构成的合金硬度比纯金属大,熔点比纯金属高
4.化合物A的结构简式如图所示。X、Y、Z、W是原子序数递增的短周期主族元素,Y在自然界中以化合态存在,Z的基态原子最外层有2个未成对电子。下列说法正确的是
A.化合物A中各原子或离子均达到2电子或8电子稳定结构
B.Y、Z、W三种元素的电负性:W<Z<Y
C.X、Y、Z、W四种元素形成的单质中,Y单质的熔点最高
D.化合物A中Y原子均发生sp2杂化
5.下列各组元素中,电负性依次减小的是
A.F、N、O B.Cl、C、 F C.Cl、S、P D.P、N、H
6.下列说法正确的是
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p轨道的轨道数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层含有的轨道数为n2(n为电子层序数)
7.下列说法正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.所有的非金属元素都分布在p区
C.核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子的化学性质相似
D.元素周期表中IIIB族到IIB族的10个纵列的元素都是金属元素
8.下列有关化学用语正确的是
A.某元素基态原子的电子排布图:
B.NH4Cl的电子式为:
C.Ca2+基态电子排布式为:1s22s22p63s23p6
D.F-的结构示意图:
9.短周期主族元素W、X、Y、Z的原子序数依次增大,某研究团队以(固态物质)为载体,利用Au-Pd纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法错误的是
A.简单离子半径:X>Y B.化合物ZW4中原子均满足最外层8电子结构
C. Y2X3、ZX2均具有较高熔点 D.工业上常用电解熔融Y2X3的方法冶炼Y
10.X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y、Z均能形成多种常见二元化合物,Y、Z形成的某化合物是参与光合作用的主要气体,基态原子中X、Y、Z的价电子数之和等于W的价电子数,下列说法正确的是
A.W属于d区元素 B.原子半径:
C.氢化物沸点: D.X与W的最外层电子数相等
11.核外电子排布中,能级会发生交错现象。以下表示的各能级能量大小关系,不符合客观事实的是
A.4s>3d>3p>3s B.6s>5p>4d>3d
C.5f>4d>3p>2s D.7d>6d>5d>4d
12.根据元素周期表和元素周期律,下列说法错误的是
①第一电离能:S>P
②铊(Tl)与铝同族,其单质既能与盐酸反应,又能与NaOH溶液反应
③锂在氧气中剧烈燃烧,产物是
④碳酸铵是易溶于水的白色固体
⑤酸性:
⑥HF、HCl、HBr、HI的还原性及热稳定性依次减弱
A.①③⑥ B.②③⑤⑥ C.①②③⑥ D.①②⑤③
13.居里夫妇用α粒子()轰击某金属原子得到,基态Y原子3p能级半充满。具有放射性,很快衰变为:,。下列说法正确的是
A.第一电离能:XB.自然界不存在Y4分子,因其化学键不稳定
C.X原子核内中子数与质子数之比为13:14
D.简单氢化物的热稳定性:Y14.有机锗被称为“生命的奇效元素”,其主要保健功效包括延缓衰老、增强免疫力、调节代谢性疾病,如图为含锗有机物的结构,下列叙述正确的是
A.Ge原子核外有32种空间运动状态不同的电子
B.C、Si、Ge三种元素均为第IVA族,其氢化物的沸点依次增大
C.名叫锗烷,也属于烷烃
D.含锗有机物和草酸()性质相似,属于同系物
15.下列说法不正确的是
A.原子核外电子排布,先排满层再排层、先排满层再排层
B.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
C.2p、3p、4p的轨道形状均为哑铃形
D.各能层含有的原子轨道数为(n为能层序数)
二、填空题
16.下表列出了①~④四种元素在周期表中的位置.
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ①
3 ② ③
4 ④
回答下列问题:
(1)①的元素符号为_____________。
(2)②的基态原子电子排布式为__________________________。
(3)③和④中原子半径较大的是_____________(填元素符号)。
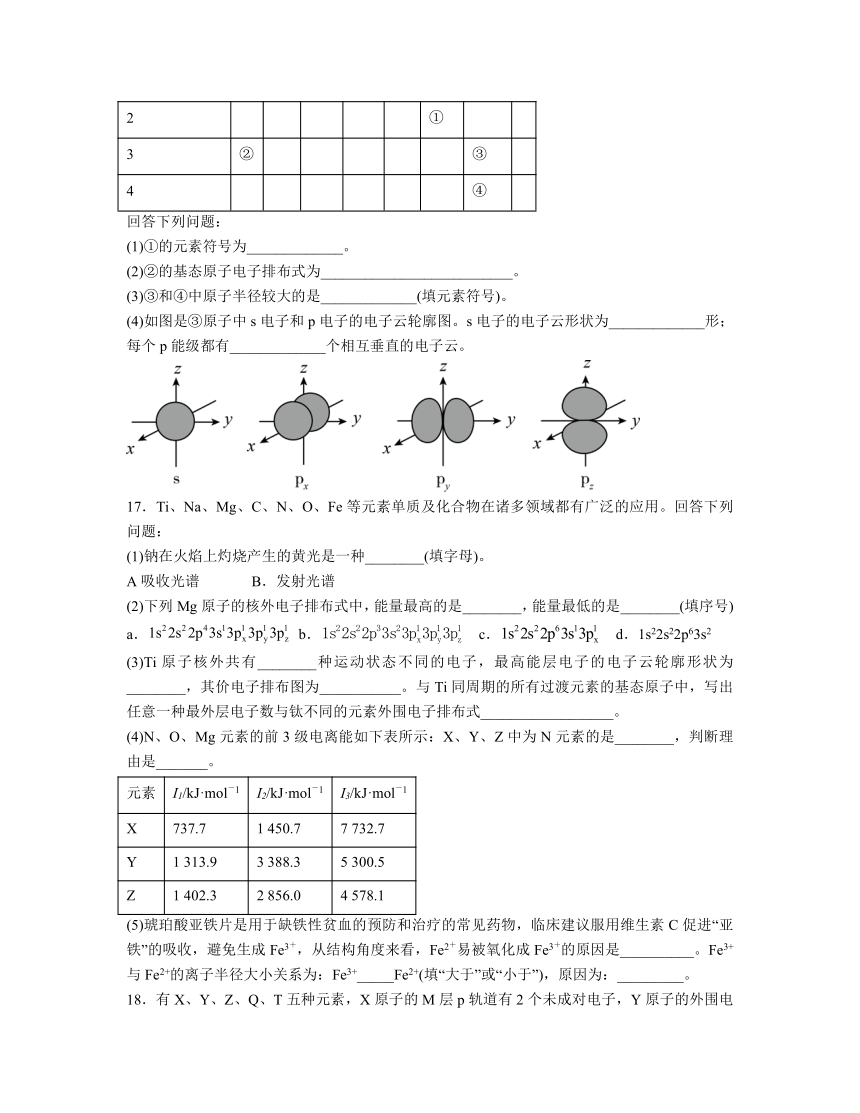
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________形;每个p能级都有_____________个相互垂直的电子云。
17.Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧产生的黄光是一种________(填字母)。
A吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是________,能量最低的是________(填序号)
a. b. c. d.1s22s22p63s2
(3)Ti原子核外共有________种运动状态不同的电子,最高能层电子的电子云轮廓形状为________,其价电子排布图为___________。与Ti同周期的所有过渡元素的基态原子中,写出任意一种最外层电子数与钛不同的元素外围电子排布式__________________。
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是________,判断理由是_______。
元素 I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1
X 737.7 1 450.7 7 732.7
Y 1 313.9 3 388.3 5 300.5
Z 1 402.3 2 856.0 4 578.1
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是__________。Fe3+与Fe2+的离子半径大小关系为:Fe3+_____Fe2+(填“大于”或“小于”),原因为:_________。
18.有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试回答下列问题:
(1)X的元素符号__________,Y的元素符号________。
(2)Z元素原子的电子排布式_______,Q元素原子的电子排布图__________,T元素原子的电子排布图_______________________________。
(3)Y的单质在Q的单质中燃烧的化学方程式:_________________________。
19.推导下列元素,回答有关问题:
(1)具有1个4p电子的元素为________(写元素名称)。基态Fe原子有____个未成对电子。Fe3+的电子排布式为_____________。
(2)3d能级全充满,4s能级只有1个电子的元素为_______,原子序数为________。在基态14C原子中,核外存在____对自旋相反的电子。基态Si原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为____、电子数为____。
(3)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则Y的基态原子的价电子排布式是________,M能层有______个电子
20.(1)A元素原子次外层电子数是最外层电子数的,其最外层电子轨道表示式是______。
(2)B是1~36号元素中未成对电子数最多的元素,B元素的名称是______,其在元素周期表中的位置是______。
21.按要求写出电子排布式或轨道表示式。
(1)基态的电子排布式为______。
(2)基态P原子的价层电子排布式为______。
(3)的轨道表示式为______。
(4)第四周期中最外层仅有1个电子的所有基态原子的电子排布式为______。
22.已知A、B、C、D为第三周期元素,其第一至第四电离能如表所示(单位:)。
元素代号 I1 I2 I3 I4
A 1521 2666 3931 5771
B 496 4562 6912 9543
C 738 1451 7733 10540
D 578 1817 2745 11575
试回答下列各题:
(1)A是_______(填元素符号,下同),B是_______,C是_______,D是_______。
(2)B在化合物中通常显_______价,B的电负性_______(填“>”“<”或“=”)C的电负性。
(3)下列元素形成的单质中,化学性质与A形成的单质最相似的是_______(填序号)。
A.氦 B.铍 C.锂 D.氢
(4)大部分元素都会出现相邻两个电离能的数据相差较大的情况,请预测B的第2次电离能数据飞跃将是在失去第_______个电子时。
三、元素或物质推断题
23.科学家合成一种新化合物(如图所示)。
其中W、X、Y、Z为同周期元素,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X核外电子数的一半。
回答下列问题:
(1)W、X、Y、Z原子半径由大到小的顺序为__(用对应的元素符号表示)。
(2)Z的核外电子排布式为__。
(3)基态X原子价电子轨道表示式为__。
(4)W元素基态原子核外电子有__种运动状态,其中电子占据能量最高的原子轨道符号表示为__。
(5)X的电负性__(填“大于”或“小于”)Y,原因是__。
【参考答案】
一、选择题
1.B
解析:原子结构模型演变的主要历程:1803年,道尔顿建立原子学说;1903年,英国科学家汤姆逊提出了“葡萄干布丁”模型;1911年,英国科学家卢瑟福提出了核式模型;1913年,丹麦物理学家玻尔提出了核外电子分层排布的原子结构模型;奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型;答案选B。
2.C
解析:A.题中有2a+176=207+5,a=18,18号元素为Ar,同周期从左向右第一电离能是增大趋势,即稀有气体第一电离能最大,故A说法正确;
B.碳-14半衰期约5730年,半衰期较长,可以测定年代,氧-18属于稳定型的,常作示踪原子,故B说法正确;
C.根据守恒思想,有18+72=b,b=90,中子数=207-90=117,故C说法错误;
D.和中子数分别为30、32,它们质子数均为26,均是由铁元素组成的不同原子,和互为同位素,故D说法正确;
答案为C。
3.B
【分析】A是宇宙中含量最多的元素,所以A为H;C元素原子的价层电子排布是nsnnp2n,n=2,所以C的价电子排布为为2s22p4,C为O。B元素原子最高能级的不同轨道都有电子,并且自旋方向相同,即B为N。D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子,即其最外层只有一个电子,D为短周期元素,D为Na。
解析:A.简单离子的半径:电子层越多半径越大;同电子层结构,核电荷数越多半径越大。C、D的简单离子分别为O2-、Na+,半径O2->Na+,A项错误;
B.同周期从左往右电负性增强:BC.B价电子为2s2p3半充满稳定即N难失去一个电子,而C为2s22p4失去一个电子后为半满即O易失去一个电子,所以第一电离能:B>C,C项错误;
D.合金破坏了金属键,金属键减弱,导致合金熔点比纯金的低,D项错误;
故选B。
4.C
【分析】化合物A的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,Z的基态原子最外层有2个未成对电子,则Z为O;Y元素在自然界都以化合态存在,且Y的原子序数小于Z,化合物A中Y可以形成3个或4个共价键,则Y为B;X形成1个共价键,W形成+1价阳离子,则X为H,W为Na,以此分析解答。
解析:A.化合物A中有2个B原子只形成了3个共价键,没有达到8电子稳定结构,故A错误;
B.B、O、Na三种元素的电负性顺序为:O>B>Na,故B错误;
C.分子晶体、金属晶体、共价晶体,其熔点依次升高,X、Y、Z、W四种元素形成的单质中,H2、O2是分子晶体,Na是金属晶体,熔点低于100℃,B的单质是共价晶体,熔点最高,故C正确;
D.阴离子中的Y形成三个σ键时,发生sp2杂化,形成四个σ键时,发生sp3杂化,故D错误;
故答案选C。
5.C
解析:A.元素周期表中,同周期主族元素从左向右电负性逐渐增强,则F>O>N,A错误;
B.同主族元素从上到下,电负性逐渐减弱,则F>Cl,B错误;
C.同周期主族元素从左到右,电负性逐渐增强,则Cl>S>P,C正确;
D.元素周期表中,同主族元素从上到下电负性逐渐减弱,则N>P,故N>P>H,D错误;
故选C。
6.D
解析:A.同一原子中,1s、2s、3s电子的能量逐渐增大,故A错误;
B.同一原子中,2p、3p、4p能级的轨道数相同,都是3个,故B错误;
C.能量低的电子在离核近的区域运动的几率高,能量高的电子在离核远的区域运动的几率高,故C错误;
D.各能层含有的能级数与其能层数相等,各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,则各能层含有的轨道数为n2,故D正确;
故选D。
7.D
解析:A.第一周期最外层电子排布是从ns1过渡到ns2,故A错误;
B.非金属元素H元素位于s区,故B错误;
C.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素,He是稀有气体元素,Be为金属元素,二者性质不相似,故C错误;
D.过渡元素包括副族与第Ⅷ族,为元素周期表中的第3列到12列,即ⅢB到ⅡB的10个纵行,都是金属元素,故D正确;
故答案选D。
8.C
解析:A.根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋方向相同,A错误;
B.氯离子最外层应有8个电子,电子式为,B错误;
C.Ca为20号元素,失去外围两个电子形成Ca2+,Ca2+基态电子排布式为:1s22s22p63s23p6,C正确;
D.F-核电荷数为9,核外有10个电子,结构示意图为,D错误;
综上所述答案为C。
9.B
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,W、X都能形成双原子分子,且二者结合成化合物W2X2、W2X,则W为H元素,X为O元素;由固态化合物Y2X3、ZX2及ZW4中元素的化合价,可确定Z显-4或+4价,则Z为Si元素,Y显+3价,则Y为Al元素。从而得出W、X、Y、Z分别为H、O、Al、Si。
解析:A.X、Y分别为O、Al,O2-与Al3+的电子层结构相同,但Al的核电荷数大,则简单离子半径:O2->Al3+,A正确;
B.化合物ZW4为SiH4,Si原子满足最外层8电子结构,但H原子不满足最外层8电子结构,B错误;
C.Y2X3、ZX2分别为Al2O3、SiO2,二者分别属于离子晶体、共价晶体,均具有较高熔点,C正确;
D.工业上冶炼Al时,常用电解熔融Al2O3的方法,D正确;
故选B。
10.D
【分析】X、Y、Z、W为原子序数依次增大的前四周期元素,Y、Z形成的某化合物是参与光合作用的主要气体,则Y为C元素、Z为O元素;X与Y、Z均能形成多种常见二元化合物,则X为H元素;基态原子中X、Y、Z的价电子数之和等于W的价电子数,则W为Cu元素;
解析:A.铜元素的原子序数为29,价电子排布式为3d104s1,处于元素周期表的ds区,故A错误;
B.同周期元素,从左到右原子半径依次减小,氧原子的原子半径小于碳原子,故B错误;
C.碳元素的氢化物可以是气态烃、液态烃、固态烃,固态烃的沸点高于水或过氧化氢,故C错误;
D.氢原子和铜原子的最外层电子数均为1,故D正确;
故选D。
11.A
解析:原子核外电子排布按照能量由低到高的各能级顺序为1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f ,A不符合事实,故答案选A。
12.C
解析:①同周期元素,从左到右第一电离能呈增大趋势,磷原子的3p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则磷元素的第一电离能大于硫元素,故错误;
②同主族元素,从上到下元素的金属性依次增强,则铊元素的金属性强于铝元素,铊单质能与盐酸反应,但不能与氢氧化钠溶液反应,故错误;
③同主族元素,从上到下元素的金属性依次增强,锂元素的金属性弱于钠元素,则锂在氧气中剧烈燃烧只能生成氧化锂,不能生成过氧化锂,故错误;
④碳酸铵属于铵盐,是易溶于水的白色固体,故正确;
⑤同主族元素,从上到下元素的非金属性依次减弱,最高价氧化物对应水化物的酸性依次减弱,同周期元素,从左到右元素的非金属性依次增强,最高价氧化物对应水化物的酸性依次增强,则最高价氧化物对应水化物的酸性强弱顺序为,故正确;
⑥同主族元素,从上到下元素的非金属性依次减弱,氢化物的还原性依次增强,则HF、HCl、HBr、HI的还原性依次增强,故错误;
①②③⑥错误,故选C。
13.A
【分析】基态Y原子3p能级半充满,所以Y原子为P;由题干信息可知,A+4=30+1,A=27,X和Y质子数相差2,所以X为Al;Q和Y质子数相差1,Q为Si,据此分析解题。
解析:A.X为Al,Q为Si,Y为P,同一周期元素的第一电离能随着原子序数的增大而增大,所以第一电离能:AlB.Y原子为P,自然界存在P4,B错误;
C.X为Al,质子数为13,中子数为14,所以中子数与质子数之比为14:13,C错误;
D.P电负性大于Si,所以简单氢化物的热稳定性:Y>Q,D错误;
故选A。
14.B
解析:A.Ge为32号元素,基态原子电子排布式为,共占据17个原子轨道,因此有17种空间运动状态不同的电子,故A错误;
B.C、Si、Ge三种元素均为第IVA族,其氢化物均为分子晶体,熔沸点受分子间作用力大小影响,其摩尔质量依次增大,沸点依次增大,故B正确;
C.有机物都含有碳元素,不含碳元素,所以锗烷不是有机物,不属于烷烃,故C错误;
D.有机锗虽然和草酸一样有两个羧基,但二者并不是相差n个原子团,因此,只是性质相似,并不是同系物,故D错误;
故选B。
15.A
解析:A.原子核外电子排布,先排满层再排层、先排层再排层,但不一定要排满层再排层,如Ca原子的核外电子排布为2、8、8、2,M层未排满,故A错误;
B.s轨道都是球形,2s轨道半径大于1s轨道半径,其空间包含了1s轨道,比1s轨道大,故B正确;
C.p轨道无论哪一能层均为哑铃形,故C正确;
D.每个能层容纳的最大电子数为2n2,每个轨道最多容纳2个电子,则各能层含有的原子轨道数为,故D正确;
答案选A。
二、填空题
16.(1)O
(2)[Ne]3s1
(3)Br
(4) 球 3
【分析】①是第二周期第VIA族元素,所以①是O;②是第三周期第IA族元素,所以②是Na;③是第三周期第VIIA族元素,所以③是Cl;④是第四周期第VIIA族元素,所以④是Br,依次作答。
解析:(1)①是第二周期第VIA族元素,所以①是O;
(2)②是第三周期第IA族元素,所以②是Na,②的基态原子电子排布式[Ne]3s1;
(3)根据分析可知③是Cl,④是Br,根据同主族元素,从上到下,原子半径依次增加,所以Br>Cl;
(4)ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
17.(1)B
(2) b d
(3) 22 球形 3d54s1或3d104s1
(4) Z N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大
(5) Fe3+的3d5半满状态更稳定 小于 核电荷数相同,但是Fe3+核外电子数少
解析:(1)钠在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高的电子是不稳定的,很快跃迁回能量较低的轨道,这是就将多余的能量以黄光的形式放出,属于发射光谱,选B,故答案为:B;
(2)基态原子具有的能量最低,得到电子后,电子发生跃迁,从低能级轨道跃迁到高能级轨道,所以能量最高的是b,能量最低的是d,故答案为:b;d;
(3)Ti原子核外有22个电子,每个电子运动状态都不同,所以原子中运动状态不同的电子共有22种;其电子排布式为1s22s22p63s23p63d24s2,最高能层为4s能级,电子云轮廓形状为球形;价电子排布式为3d24s2,,价电子排布图为。与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同,结合构造原理与洪特规则,符合条件的外围电子排布式为3d54s1、3d104s1,故答案为:22;球形; ;3d54s1或3d104s1;
(4)金属元素第一电离能I1小于非金属元素,则第一电离能I1最小的X为镁元素;N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则I1较大的Z为N元素,故答案为:Z;N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大;
(5)Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半充满状态的Fe3+;因为Fe3+与Fe2+核电荷数相同,但是Fe3+核外电子数少,所以核对电子吸引能力大,半径小,故答案为:Fe3+的3d5半满状态更稳定;小于;核电荷数相同,但是Fe3+核外电子数少。
18. Si或S Fe 1s22s22p2 3Fe+2O2Fe3O4
【分析】有五种元素X、Y、Z、Q、T元素为主族元素,X原子的M层p轨道有2个未成对电子,核外电子排布为1s22s22p63s23p4或1s22s22p63s23p2,故X为S或Si元素;Y原子的特征电子构型为3d64s2,则Y为Fe;Z原子的L电子层的p能级上有一个空轨道,核外电子排布为1s22s22p2,则Z为C元素;Q原子的L电子层的p能级上只有一对成对电子,核外电子排布为1s22s22p4,故Q为O元素;T原子的M电子层上p轨道半充满,核外电子排布为1s22s22p63s23p3,则T为P元素,据此解答。
解析:(1)由分析可知,X为S或Si元素,Y为Fe,故答案为Si或S,Fe。
(2)Z为C元素,核电荷数为6,电子排布式为1s22s22p2;Q为O元素,核电荷数为8,氧原子的核外电子排布图为;T为P元素,核电荷数为15,磷原子的核外电子排布图为;故答案为1s22s22p2,,。
(3)Y的单质在Q的单质中燃烧是铁在纯氧中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2Fe3O4,故答案为3Fe+2O2Fe3O4。
19.(1) 镓 4 [Ar]3d5或1s22s22p63s23p63d5
(2) 铜 29 2 M 9 4
(3) 3d84s2 16
解析:(1)具有1个4p电子,说明其位于第四周期p区,为镓元素;铁为26号元素,其核外电子排布式为1s22s22p63s23p63d64s2,所以基态Fe原子有4个未成对,铁原子失去3个电子形成铁离子,Fe3+的电子排布式为1s22s22p63s23p63d5;
(2)3d能级全充满,4s能级只有1个电子,则该元素位于第四周期ds区,为铜元素,原子序数为29。14C有6个核外电子,核外电子排布为1s22s22p2,自旋方向相反的电子对有2对。Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9、电子数为4;
(3)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,两者处于第Ⅷ族,则X和Y分别为Fe和Ni,Y的基态原子的价电子排布式是3d84s2,M能层有16个电子。
20. 铬 第四周期第ⅥB族
解析:(1)次外层电子数是最外展电子数的元素只能是氖。最外层电子数为8,最,轨道表示式是:;
(2)1~36号元素中未成对电子数最多的元素是铬。其原子序数是24,位于元素周期表第四周期第ⅥB族。
21. (或) 、、
解析:(1)基态原子的电子排布式为,失去1个电子所得的电子排布式为或。故答案为:(或);
(2)P原子核外电子的最外层为第三层,且有5个电子,所以其价层电子排布式为。故答案为:;
(3)的电子排布式为,轨道表示式为。故答案为:;
(4)第四周期最外层只有1个电子的基态原子的最外层电子排布式为,此时、应已填满,轨道可能全空、半充满或全充满,即电子排布式为、、。故答案为:、、;
22. Ar Na Mg Al +1 < A 10
解析:A、B、C、D为第三周期元素,根据表中数据知,A每一级电离能都较大,故A应为全满稳定结构,即元素,B元素的I2突然增大,故B容易失去1个电子,即元素,C元素的I3突然增大,故C容易失去2个电子,即元素,D元素的I4突然增大,故D容易失去3个电子,即元素。
(1)由分析知A为Ar,B为Na,C为Mg,D为Al;
(2)B为元素,在化合物中通常显+1价;一般来说,同周期元素由左向右电负性逐渐增大,故电负性:,此处填“<”;
(3)A为稀有气体Ar,稀有气体之间性质相似,故此处填A;
(4)电离能的突跃变化,说明核外电子是分层排布的的电子排布式为,由于所处电子层相同,所以它的第2次电离能数据飞跃发生在失去第10个电子时。
三、元素或物质推断题
23. Na>Si>P>Cl 1s22s22p63s23p5或[Ne]3s23p5 11 3s 小于 同周期元素P比Si原子半径小,核电荷数多,吸引电子能力更强
【分析】W、X、Y、Z为同一短周期元素,据图可知X能形成4个共价键,则应为第IVA族元素,Z核外最外层电子数是X核外电子数的一半,则X核外电子数最大为14(Z不可能为0族元素),则X为C或Si,若X为C,则Z为B,不符合图示成键规律,所以X为Si,Z为Cl,四种元素位于第三周期;Y元素基态原子的未成对电子数等于其电子层数,则Y核外电子排布为1s22s22p63s23p3,即为P元素;根据图示可知,W元素的阳离子带一个正电荷,且W是所在周期中第一电离能最小的元素,则W为Na元素。
解析:通过分析知,W、X、Y、Z分别为Na、Si、P、Cl元素。
(1)同一周期从左向右原子半径逐渐减小,则W、X、Y、Z原子半径由大到小的顺序为:Na>Si>P>Cl;
(2)Cl的核外电子数=核电荷数=17,Cl的核外电子排布式为:1s22s22p63s23p5;
(3)Si处于周期表中第3周期第ⅣA族,基态Si的价电子排布式为3s23p2,则基态硅原子价电子的轨道表示式是:;
(4)Na的核外电子总数=原子序数=11,每个电子的运动状态都不同,则Na原子有11种不同的运动状态;Na元素基态原子中能量最高的电子所占据的原子轨道为3s;
(5)同周期元素P比Si原子半径小,核电荷数多,吸引电子能力更强,所以Si的电负性小于P。
一、选择题
1.关于原子结构的研究,科学家分别提出过:原子论、“葡萄干布丁”模型、核式模型、核外电子分层排布模型、量子力学模型。提出核外电子分层排布模型的科学家是
A.卢瑟福 B.玻尔 C.汤姆逊 D.道尔顿
2.科学家最近发表的科技信息如下:
信息1:我国科学家合成新核素—钍-207:
信息2:美国科学家利用化学线索(、、)揭示恐龙新陈代谢率高低。
信息3:我国科学家发现飞尘颗粒物中铁的同位素:。
已知:半衰期指物质质量减少一半所用时间。
下列叙述错误的是
A.同周期中,X的第一电离能最大
B.、的半衰期较长
C.的中子数为90
D.和互为同位素
3.已知A、B、C、D是原子序数依次增大的短周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是nsnnp2n;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子。下列说法正确的是
A.C、D原子形成的简单离子半径:D+>C2-
B.A、B、C三种元素的电负性:C>B>A
C.B、C元素的第一电离能:C>B
D.D元素构成的合金硬度比纯金属大,熔点比纯金属高
4.化合物A的结构简式如图所示。X、Y、Z、W是原子序数递增的短周期主族元素,Y在自然界中以化合态存在,Z的基态原子最外层有2个未成对电子。下列说法正确的是
A.化合物A中各原子或离子均达到2电子或8电子稳定结构
B.Y、Z、W三种元素的电负性:W<Z<Y
C.X、Y、Z、W四种元素形成的单质中,Y单质的熔点最高
D.化合物A中Y原子均发生sp2杂化
5.下列各组元素中,电负性依次减小的是
A.F、N、O B.Cl、C、 F C.Cl、S、P D.P、N、H
6.下列说法正确的是
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.同一原子中,2p、3p、4p轨道的轨道数依次增多
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.各能层含有的轨道数为n2(n为电子层序数)
7.下列说法正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.所有的非金属元素都分布在p区
C.核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子的化学性质相似
D.元素周期表中IIIB族到IIB族的10个纵列的元素都是金属元素
8.下列有关化学用语正确的是
A.某元素基态原子的电子排布图:
B.NH4Cl的电子式为:
C.Ca2+基态电子排布式为:1s22s22p63s23p6
D.F-的结构示意图:
9.短周期主族元素W、X、Y、Z的原子序数依次增大,某研究团队以(固态物质)为载体,利用Au-Pd纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法错误的是
A.简单离子半径:X>Y B.化合物ZW4中原子均满足最外层8电子结构
C. Y2X3、ZX2均具有较高熔点 D.工业上常用电解熔融Y2X3的方法冶炼Y
10.X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y、Z均能形成多种常见二元化合物,Y、Z形成的某化合物是参与光合作用的主要气体,基态原子中X、Y、Z的价电子数之和等于W的价电子数,下列说法正确的是
A.W属于d区元素 B.原子半径:
C.氢化物沸点: D.X与W的最外层电子数相等
11.核外电子排布中,能级会发生交错现象。以下表示的各能级能量大小关系,不符合客观事实的是
A.4s>3d>3p>3s B.6s>5p>4d>3d
C.5f>4d>3p>2s D.7d>6d>5d>4d
12.根据元素周期表和元素周期律,下列说法错误的是
①第一电离能:S>P
②铊(Tl)与铝同族,其单质既能与盐酸反应,又能与NaOH溶液反应
③锂在氧气中剧烈燃烧,产物是
④碳酸铵是易溶于水的白色固体
⑤酸性:
⑥HF、HCl、HBr、HI的还原性及热稳定性依次减弱
A.①③⑥ B.②③⑤⑥ C.①②③⑥ D.①②⑤③
13.居里夫妇用α粒子()轰击某金属原子得到,基态Y原子3p能级半充满。具有放射性,很快衰变为:,。下列说法正确的是
A.第一电离能:X
C.X原子核内中子数与质子数之比为13:14
D.简单氢化物的热稳定性:Y
A.Ge原子核外有32种空间运动状态不同的电子
B.C、Si、Ge三种元素均为第IVA族,其氢化物的沸点依次增大
C.名叫锗烷,也属于烷烃
D.含锗有机物和草酸()性质相似,属于同系物
15.下列说法不正确的是
A.原子核外电子排布,先排满层再排层、先排满层再排层
B.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
C.2p、3p、4p的轨道形状均为哑铃形
D.各能层含有的原子轨道数为(n为能层序数)
二、填空题
16.下表列出了①~④四种元素在周期表中的位置.
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ①
3 ② ③
4 ④
回答下列问题:
(1)①的元素符号为_____________。
(2)②的基态原子电子排布式为__________________________。
(3)③和④中原子半径较大的是_____________(填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________形;每个p能级都有_____________个相互垂直的电子云。
17.Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧产生的黄光是一种________(填字母)。
A吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是________,能量最低的是________(填序号)
a. b. c. d.1s22s22p63s2
(3)Ti原子核外共有________种运动状态不同的电子,最高能层电子的电子云轮廓形状为________,其价电子排布图为___________。与Ti同周期的所有过渡元素的基态原子中,写出任意一种最外层电子数与钛不同的元素外围电子排布式__________________。
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是________,判断理由是_______。
元素 I1/kJ·mol-1 I2/kJ·mol-1 I3/kJ·mol-1
X 737.7 1 450.7 7 732.7
Y 1 313.9 3 388.3 5 300.5
Z 1 402.3 2 856.0 4 578.1
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是__________。Fe3+与Fe2+的离子半径大小关系为:Fe3+_____Fe2+(填“大于”或“小于”),原因为:_________。
18.有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试回答下列问题:
(1)X的元素符号__________,Y的元素符号________。
(2)Z元素原子的电子排布式_______,Q元素原子的电子排布图__________,T元素原子的电子排布图_______________________________。
(3)Y的单质在Q的单质中燃烧的化学方程式:_________________________。
19.推导下列元素,回答有关问题:
(1)具有1个4p电子的元素为________(写元素名称)。基态Fe原子有____个未成对电子。Fe3+的电子排布式为_____________。
(2)3d能级全充满,4s能级只有1个电子的元素为_______,原子序数为________。在基态14C原子中,核外存在____对自旋相反的电子。基态Si原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为____、电子数为____。
(3)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则Y的基态原子的价电子排布式是________,M能层有______个电子
20.(1)A元素原子次外层电子数是最外层电子数的,其最外层电子轨道表示式是______。
(2)B是1~36号元素中未成对电子数最多的元素,B元素的名称是______,其在元素周期表中的位置是______。
21.按要求写出电子排布式或轨道表示式。
(1)基态的电子排布式为______。
(2)基态P原子的价层电子排布式为______。
(3)的轨道表示式为______。
(4)第四周期中最外层仅有1个电子的所有基态原子的电子排布式为______。
22.已知A、B、C、D为第三周期元素,其第一至第四电离能如表所示(单位:)。
元素代号 I1 I2 I3 I4
A 1521 2666 3931 5771
B 496 4562 6912 9543
C 738 1451 7733 10540
D 578 1817 2745 11575
试回答下列各题:
(1)A是_______(填元素符号,下同),B是_______,C是_______,D是_______。
(2)B在化合物中通常显_______价,B的电负性_______(填“>”“<”或“=”)C的电负性。
(3)下列元素形成的单质中,化学性质与A形成的单质最相似的是_______(填序号)。
A.氦 B.铍 C.锂 D.氢
(4)大部分元素都会出现相邻两个电离能的数据相差较大的情况,请预测B的第2次电离能数据飞跃将是在失去第_______个电子时。
三、元素或物质推断题
23.科学家合成一种新化合物(如图所示)。
其中W、X、Y、Z为同周期元素,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X核外电子数的一半。
回答下列问题:
(1)W、X、Y、Z原子半径由大到小的顺序为__(用对应的元素符号表示)。
(2)Z的核外电子排布式为__。
(3)基态X原子价电子轨道表示式为__。
(4)W元素基态原子核外电子有__种运动状态,其中电子占据能量最高的原子轨道符号表示为__。
(5)X的电负性__(填“大于”或“小于”)Y,原因是__。
【参考答案】
一、选择题
1.B
解析:原子结构模型演变的主要历程:1803年,道尔顿建立原子学说;1903年,英国科学家汤姆逊提出了“葡萄干布丁”模型;1911年,英国科学家卢瑟福提出了核式模型;1913年,丹麦物理学家玻尔提出了核外电子分层排布的原子结构模型;奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型;答案选B。
2.C
解析:A.题中有2a+176=207+5,a=18,18号元素为Ar,同周期从左向右第一电离能是增大趋势,即稀有气体第一电离能最大,故A说法正确;
B.碳-14半衰期约5730年,半衰期较长,可以测定年代,氧-18属于稳定型的,常作示踪原子,故B说法正确;
C.根据守恒思想,有18+72=b,b=90,中子数=207-90=117,故C说法错误;
D.和中子数分别为30、32,它们质子数均为26,均是由铁元素组成的不同原子,和互为同位素,故D说法正确;
答案为C。
3.B
【分析】A是宇宙中含量最多的元素,所以A为H;C元素原子的价层电子排布是nsnnp2n,n=2,所以C的价电子排布为为2s22p4,C为O。B元素原子最高能级的不同轨道都有电子,并且自旋方向相同,即B为N。D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子,即其最外层只有一个电子,D为短周期元素,D为Na。
解析:A.简单离子的半径:电子层越多半径越大;同电子层结构,核电荷数越多半径越大。C、D的简单离子分别为O2-、Na+,半径O2->Na+,A项错误;
B.同周期从左往右电负性增强:B
D.合金破坏了金属键,金属键减弱,导致合金熔点比纯金的低,D项错误;
故选B。
4.C
【分析】化合物A的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,Z的基态原子最外层有2个未成对电子,则Z为O;Y元素在自然界都以化合态存在,且Y的原子序数小于Z,化合物A中Y可以形成3个或4个共价键,则Y为B;X形成1个共价键,W形成+1价阳离子,则X为H,W为Na,以此分析解答。
解析:A.化合物A中有2个B原子只形成了3个共价键,没有达到8电子稳定结构,故A错误;
B.B、O、Na三种元素的电负性顺序为:O>B>Na,故B错误;
C.分子晶体、金属晶体、共价晶体,其熔点依次升高,X、Y、Z、W四种元素形成的单质中,H2、O2是分子晶体,Na是金属晶体,熔点低于100℃,B的单质是共价晶体,熔点最高,故C正确;
D.阴离子中的Y形成三个σ键时,发生sp2杂化,形成四个σ键时,发生sp3杂化,故D错误;
故答案选C。
5.C
解析:A.元素周期表中,同周期主族元素从左向右电负性逐渐增强,则F>O>N,A错误;
B.同主族元素从上到下,电负性逐渐减弱,则F>Cl,B错误;
C.同周期主族元素从左到右,电负性逐渐增强,则Cl>S>P,C正确;
D.元素周期表中,同主族元素从上到下电负性逐渐减弱,则N>P,故N>P>H,D错误;
故选C。
6.D
解析:A.同一原子中,1s、2s、3s电子的能量逐渐增大,故A错误;
B.同一原子中,2p、3p、4p能级的轨道数相同,都是3个,故B错误;
C.能量低的电子在离核近的区域运动的几率高,能量高的电子在离核远的区域运动的几率高,故C错误;
D.各能层含有的能级数与其能层数相等,各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,则各能层含有的轨道数为n2,故D正确;
故选D。
7.D
解析:A.第一周期最外层电子排布是从ns1过渡到ns2,故A错误;
B.非金属元素H元素位于s区,故B错误;
C.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素,He是稀有气体元素,Be为金属元素,二者性质不相似,故C错误;
D.过渡元素包括副族与第Ⅷ族,为元素周期表中的第3列到12列,即ⅢB到ⅡB的10个纵行,都是金属元素,故D正确;
故答案选D。
8.C
解析:A.根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋方向相同,A错误;
B.氯离子最外层应有8个电子,电子式为,B错误;
C.Ca为20号元素,失去外围两个电子形成Ca2+,Ca2+基态电子排布式为:1s22s22p63s23p6,C正确;
D.F-核电荷数为9,核外有10个电子,结构示意图为,D错误;
综上所述答案为C。
9.B
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,W、X都能形成双原子分子,且二者结合成化合物W2X2、W2X,则W为H元素,X为O元素;由固态化合物Y2X3、ZX2及ZW4中元素的化合价,可确定Z显-4或+4价,则Z为Si元素,Y显+3价,则Y为Al元素。从而得出W、X、Y、Z分别为H、O、Al、Si。
解析:A.X、Y分别为O、Al,O2-与Al3+的电子层结构相同,但Al的核电荷数大,则简单离子半径:O2->Al3+,A正确;
B.化合物ZW4为SiH4,Si原子满足最外层8电子结构,但H原子不满足最外层8电子结构,B错误;
C.Y2X3、ZX2分别为Al2O3、SiO2,二者分别属于离子晶体、共价晶体,均具有较高熔点,C正确;
D.工业上冶炼Al时,常用电解熔融Al2O3的方法,D正确;
故选B。
10.D
【分析】X、Y、Z、W为原子序数依次增大的前四周期元素,Y、Z形成的某化合物是参与光合作用的主要气体,则Y为C元素、Z为O元素;X与Y、Z均能形成多种常见二元化合物,则X为H元素;基态原子中X、Y、Z的价电子数之和等于W的价电子数,则W为Cu元素;
解析:A.铜元素的原子序数为29,价电子排布式为3d104s1,处于元素周期表的ds区,故A错误;
B.同周期元素,从左到右原子半径依次减小,氧原子的原子半径小于碳原子,故B错误;
C.碳元素的氢化物可以是气态烃、液态烃、固态烃,固态烃的沸点高于水或过氧化氢,故C错误;
D.氢原子和铜原子的最外层电子数均为1,故D正确;
故选D。
11.A
解析:原子核外电子排布按照能量由低到高的各能级顺序为1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f ,A不符合事实,故答案选A。
12.C
解析:①同周期元素,从左到右第一电离能呈增大趋势,磷原子的3p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则磷元素的第一电离能大于硫元素,故错误;
②同主族元素,从上到下元素的金属性依次增强,则铊元素的金属性强于铝元素,铊单质能与盐酸反应,但不能与氢氧化钠溶液反应,故错误;
③同主族元素,从上到下元素的金属性依次增强,锂元素的金属性弱于钠元素,则锂在氧气中剧烈燃烧只能生成氧化锂,不能生成过氧化锂,故错误;
④碳酸铵属于铵盐,是易溶于水的白色固体,故正确;
⑤同主族元素,从上到下元素的非金属性依次减弱,最高价氧化物对应水化物的酸性依次减弱,同周期元素,从左到右元素的非金属性依次增强,最高价氧化物对应水化物的酸性依次增强,则最高价氧化物对应水化物的酸性强弱顺序为,故正确;
⑥同主族元素,从上到下元素的非金属性依次减弱,氢化物的还原性依次增强,则HF、HCl、HBr、HI的还原性依次增强,故错误;
①②③⑥错误,故选C。
13.A
【分析】基态Y原子3p能级半充满,所以Y原子为P;由题干信息可知,A+4=30+1,A=27,X和Y质子数相差2,所以X为Al;Q和Y质子数相差1,Q为Si,据此分析解题。
解析:A.X为Al,Q为Si,Y为P,同一周期元素的第一电离能随着原子序数的增大而增大,所以第一电离能:Al
C.X为Al,质子数为13,中子数为14,所以中子数与质子数之比为14:13,C错误;
D.P电负性大于Si,所以简单氢化物的热稳定性:Y>Q,D错误;
故选A。
14.B
解析:A.Ge为32号元素,基态原子电子排布式为,共占据17个原子轨道,因此有17种空间运动状态不同的电子,故A错误;
B.C、Si、Ge三种元素均为第IVA族,其氢化物均为分子晶体,熔沸点受分子间作用力大小影响,其摩尔质量依次增大,沸点依次增大,故B正确;
C.有机物都含有碳元素,不含碳元素,所以锗烷不是有机物,不属于烷烃,故C错误;
D.有机锗虽然和草酸一样有两个羧基,但二者并不是相差n个原子团,因此,只是性质相似,并不是同系物,故D错误;
故选B。
15.A
解析:A.原子核外电子排布,先排满层再排层、先排层再排层,但不一定要排满层再排层,如Ca原子的核外电子排布为2、8、8、2,M层未排满,故A错误;
B.s轨道都是球形,2s轨道半径大于1s轨道半径,其空间包含了1s轨道,比1s轨道大,故B正确;
C.p轨道无论哪一能层均为哑铃形,故C正确;
D.每个能层容纳的最大电子数为2n2,每个轨道最多容纳2个电子,则各能层含有的原子轨道数为,故D正确;
答案选A。
二、填空题
16.(1)O
(2)[Ne]3s1
(3)Br
(4) 球 3
【分析】①是第二周期第VIA族元素,所以①是O;②是第三周期第IA族元素,所以②是Na;③是第三周期第VIIA族元素,所以③是Cl;④是第四周期第VIIA族元素,所以④是Br,依次作答。
解析:(1)①是第二周期第VIA族元素,所以①是O;
(2)②是第三周期第IA族元素,所以②是Na,②的基态原子电子排布式[Ne]3s1;
(3)根据分析可知③是Cl,④是Br,根据同主族元素,从上到下,原子半径依次增加,所以Br>Cl;
(4)ns能级各有1个轨道,np能级各有3个轨道,s电子的原子轨道都是球形的,p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直,分别以px、py、pz表示。
17.(1)B
(2) b d
(3) 22 球形 3d54s1或3d104s1
(4) Z N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大
(5) Fe3+的3d5半满状态更稳定 小于 核电荷数相同,但是Fe3+核外电子数少
解析:(1)钠在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高的电子是不稳定的,很快跃迁回能量较低的轨道,这是就将多余的能量以黄光的形式放出,属于发射光谱,选B,故答案为:B;
(2)基态原子具有的能量最低,得到电子后,电子发生跃迁,从低能级轨道跃迁到高能级轨道,所以能量最高的是b,能量最低的是d,故答案为:b;d;
(3)Ti原子核外有22个电子,每个电子运动状态都不同,所以原子中运动状态不同的电子共有22种;其电子排布式为1s22s22p63s23p63d24s2,最高能层为4s能级,电子云轮廓形状为球形;价电子排布式为3d24s2,,价电子排布图为。与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同,结合构造原理与洪特规则,符合条件的外围电子排布式为3d54s1、3d104s1,故答案为:22;球形; ;3d54s1或3d104s1;
(4)金属元素第一电离能I1小于非金属元素,则第一电离能I1最小的X为镁元素;N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则I1较大的Z为N元素,故答案为:Z;N原子外围电子排布式为2s22p3,N与O相比,2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大;
(5)Fe2+价电子为3d6,失去1个电子形成更稳定的3d5半充满状态的Fe3+;因为Fe3+与Fe2+核电荷数相同,但是Fe3+核外电子数少,所以核对电子吸引能力大,半径小,故答案为:Fe3+的3d5半满状态更稳定;小于;核电荷数相同,但是Fe3+核外电子数少。
18. Si或S Fe 1s22s22p2 3Fe+2O2Fe3O4
【分析】有五种元素X、Y、Z、Q、T元素为主族元素,X原子的M层p轨道有2个未成对电子,核外电子排布为1s22s22p63s23p4或1s22s22p63s23p2,故X为S或Si元素;Y原子的特征电子构型为3d64s2,则Y为Fe;Z原子的L电子层的p能级上有一个空轨道,核外电子排布为1s22s22p2,则Z为C元素;Q原子的L电子层的p能级上只有一对成对电子,核外电子排布为1s22s22p4,故Q为O元素;T原子的M电子层上p轨道半充满,核外电子排布为1s22s22p63s23p3,则T为P元素,据此解答。
解析:(1)由分析可知,X为S或Si元素,Y为Fe,故答案为Si或S,Fe。
(2)Z为C元素,核电荷数为6,电子排布式为1s22s22p2;Q为O元素,核电荷数为8,氧原子的核外电子排布图为;T为P元素,核电荷数为15,磷原子的核外电子排布图为;故答案为1s22s22p2,,。
(3)Y的单质在Q的单质中燃烧是铁在纯氧中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2Fe3O4,故答案为3Fe+2O2Fe3O4。
19.(1) 镓 4 [Ar]3d5或1s22s22p63s23p63d5
(2) 铜 29 2 M 9 4
(3) 3d84s2 16
解析:(1)具有1个4p电子,说明其位于第四周期p区,为镓元素;铁为26号元素,其核外电子排布式为1s22s22p63s23p63d64s2,所以基态Fe原子有4个未成对,铁原子失去3个电子形成铁离子,Fe3+的电子排布式为1s22s22p63s23p63d5;
(2)3d能级全充满,4s能级只有1个电子,则该元素位于第四周期ds区,为铜元素,原子序数为29。14C有6个核外电子,核外电子排布为1s22s22p2,自旋方向相反的电子对有2对。Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9、电子数为4;
(3)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,两者处于第Ⅷ族,则X和Y分别为Fe和Ni,Y的基态原子的价电子排布式是3d84s2,M能层有16个电子。
20. 铬 第四周期第ⅥB族
解析:(1)次外层电子数是最外展电子数的元素只能是氖。最外层电子数为8,最,轨道表示式是:;
(2)1~36号元素中未成对电子数最多的元素是铬。其原子序数是24,位于元素周期表第四周期第ⅥB族。
21. (或) 、、
解析:(1)基态原子的电子排布式为,失去1个电子所得的电子排布式为或。故答案为:(或);
(2)P原子核外电子的最外层为第三层,且有5个电子,所以其价层电子排布式为。故答案为:;
(3)的电子排布式为,轨道表示式为。故答案为:;
(4)第四周期最外层只有1个电子的基态原子的最外层电子排布式为,此时、应已填满,轨道可能全空、半充满或全充满,即电子排布式为、、。故答案为:、、;
22. Ar Na Mg Al +1 < A 10
解析:A、B、C、D为第三周期元素,根据表中数据知,A每一级电离能都较大,故A应为全满稳定结构,即元素,B元素的I2突然增大,故B容易失去1个电子,即元素,C元素的I3突然增大,故C容易失去2个电子,即元素,D元素的I4突然增大,故D容易失去3个电子,即元素。
(1)由分析知A为Ar,B为Na,C为Mg,D为Al;
(2)B为元素,在化合物中通常显+1价;一般来说,同周期元素由左向右电负性逐渐增大,故电负性:,此处填“<”;
(3)A为稀有气体Ar,稀有气体之间性质相似,故此处填A;
(4)电离能的突跃变化,说明核外电子是分层排布的的电子排布式为,由于所处电子层相同,所以它的第2次电离能数据飞跃发生在失去第10个电子时。
三、元素或物质推断题
23. Na>Si>P>Cl 1s22s22p63s23p5或[Ne]3s23p5 11 3s 小于 同周期元素P比Si原子半径小,核电荷数多,吸引电子能力更强
【分析】W、X、Y、Z为同一短周期元素,据图可知X能形成4个共价键,则应为第IVA族元素,Z核外最外层电子数是X核外电子数的一半,则X核外电子数最大为14(Z不可能为0族元素),则X为C或Si,若X为C,则Z为B,不符合图示成键规律,所以X为Si,Z为Cl,四种元素位于第三周期;Y元素基态原子的未成对电子数等于其电子层数,则Y核外电子排布为1s22s22p63s23p3,即为P元素;根据图示可知,W元素的阳离子带一个正电荷,且W是所在周期中第一电离能最小的元素,则W为Na元素。
解析:通过分析知,W、X、Y、Z分别为Na、Si、P、Cl元素。
(1)同一周期从左向右原子半径逐渐减小,则W、X、Y、Z原子半径由大到小的顺序为:Na>Si>P>Cl;
(2)Cl的核外电子数=核电荷数=17,Cl的核外电子排布式为:1s22s22p63s23p5;
(3)Si处于周期表中第3周期第ⅣA族,基态Si的价电子排布式为3s23p2,则基态硅原子价电子的轨道表示式是:;
(4)Na的核外电子总数=原子序数=11,每个电子的运动状态都不同,则Na原子有11种不同的运动状态;Na元素基态原子中能量最高的电子所占据的原子轨道为3s;
(5)同周期元素P比Si原子半径小,核电荷数多,吸引电子能力更强,所以Si的电负性小于P。
