4.3.1离子键 课件(共25张PPT) 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.1离子键 课件(共25张PPT) 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 11:23:01 | ||
图片预览







文档简介
(共25张PPT)
苹果能够落在地上,人在地球上生活而不自动脱离地球,均是因为地球的吸引力,也就是说宏观物质之间存在力的作用才能够“稳定存在”。
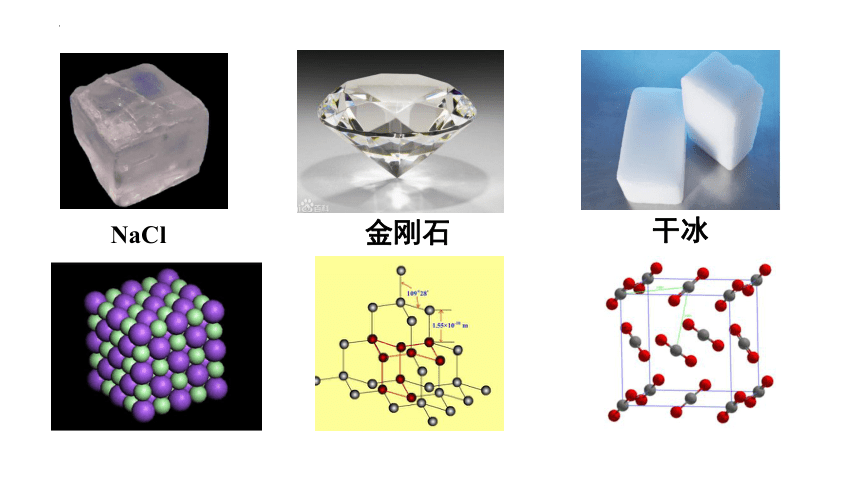
那么化学物质(如:NaCl、HCl、H2O等)能够稳定存在,构成这些物质的微观粒子之间是不是也存在着作用力呢?
NaCl
金刚石
干冰
微粒间的作用——“三键一力”
三键一力
化学键
分子间作用力
离子键
共价键
金属键
化学键:物质中相邻的原子或离子之间强烈的相互作用。
“三键一力”是微观粒子(原子、分子、离子)结合在一起构成客观物质的四种基本作用力,它的强弱不仅决定着物质的存在形态(气、固、液),熔沸点高低,硬度大小,而且与物质的化学性质也有密切的关系。
第四章 物质结构 元素周期律
第一节 化学键
第1课时 离子键
氯气和金属钠的反应:
点燃
2Na + Cl2 == 2NaCl
思考:
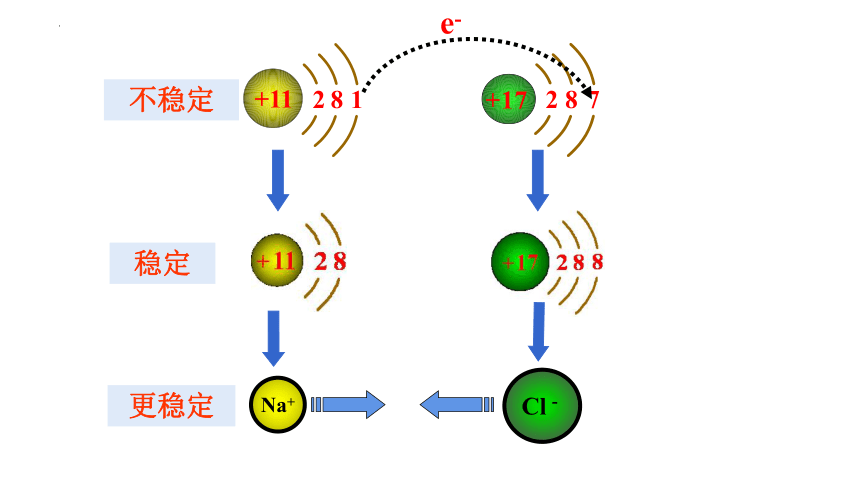
从微观角度分析,氯化钠是怎么形成的?
e-
不稳定
稳定
更稳定
Na+
Cl-
请分析在氯化钠晶体中Na+和Cl-间存在哪些相互作用?
1、 Na+和Cl-间的静电引力作用。
2、阴、阳离子的电子与电子、原子核与原子核间的静电斥力作用。
当阴、阳离子接近到一定距离时,静电引力和静电斥力达到平衡,阴阳离子间形成稳定的化学键——离子键
一、离子键
1、定义:
带相反电荷离子之间的相互作用。
2、成键微粒:
阴、阳离子
3、离子键实质:
静电作用(吸引与排斥)
阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
4、成键元素:
活泼金属元素(IA,IIA)与
活泼非金属元素(VIA,VIIA )
(AlCl3除外)
思考:哪些物质存在离子键?
1. 强碱
二、离子化合物:由离子键构成的化合物。
3. 金属氧化物
4. 金属氢化物
2. 大多数盐(除BeCl2、AlCl3、FeCl3等)
注意:
①含金属元素的化合物不一定是离子化合物。如:AlCl3等
②非金属元素的原子之间也可构成离子化合物。如:铵盐
③离子化合物都是强电解质。
氯化钠晶体中不存在单个的氯化钠分子,只存在Na+与Cl-,构成氯化钠晶体的粒子是离子而不是分子。
在氯化钠晶体中,每个氯离子周围有6个钠离子,每个钠离子周围也有6个氯离子。
NaCl是化学式,不是分子式。
【思考与交流】
1、Na+与Cl-通过离子键形成了离子化合物NaCl,氯化钠晶体是不是由分子构成的?
离子化合物溶于水或熔化时转化成自由移动的离子,离子键被破坏。但没有新物质生成,所以是物理变化。
【思考与交流】
2.离子化合物溶于水或熔化时离子键是否发生变化
3.NaCl是离子化合物,是强电解质,故食盐晶体能导电吗?
不能,导电需要条件。
离子化合物导电条件:溶于水或熔融状态。
4.熔融状态下能导电的物质一定是离子化合物吗?
不一定,如金属,合金。
熔融状态下能导电的化合物一定是离子化合物!
【思考与交流】
通过熔融状态下的物质导电性实验可以证明离子化合物。
例如:AlCl3在熔融状态下不导电,AlCl3不是离子化合物。
铵盐在熔融状态下导电,铵盐是离子化合物。
纯净的硫酸和HCl不导电,硫酸和HCl不是离子化合物。
练1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物CaCl2中,两个氯原子间也存在离子键
C
练2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和8
C
练3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
如:AlCl3
如:HCl
如:NH4Cl
练4、判断下列化合物哪些是离子化合物。
①NaOH ②H2O ③MgCl2 ④H2SO4 ⑤KNO3 ⑥NH3 ⑦CaO2 ⑧HCl
①③⑤⑦
1. 强碱
4. 金属氢化物
2. 大多数盐(除BeCl2、AlCl3、FeCl3等)
3. 金属氧化物
由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系
离子半径越小、离子所带电荷越多,离子键就越强,熔沸点越高。
【思考与交流】
物质 NaF NaCl NaBr NaI
熔点(℃) 988 801 740 660
物质 MgO MgCl2 Al2O3 AlCl3
熔点(℃) 2800 604 2050 190
Al2O3与MgO是由半径小、高电荷的离子构成,离子键很强,所以熔点很高。
由表可知Al2O3与MgO均为高熔点物质。所以Al2O3与MgO常用作耐火材料,试解释原因。
资料卡片
电子式:在元素符号周围用“ · ”或“×”来表示 原子最外层电子的式子。
1、原子的电子式:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
Na·
H·
×Mg×
·Al·
·
· C ·
·
·
· N ·
··
·
· O ·
··
··
F
2. 阳离子的电子式
由于简单阳离子最外层电子已经失去,所以无最外层电子,电子式即离子符号。复杂阳离子(NH4+)除外。
Na+
Ca2+
练习:Mg2+、Al3+、K+
3. 简单阴离子的电子式
由于阴离子的形成是由原子得电子形成,最外层电子数满足2e-或8e-结构,需将最外层电子数表示出来,并用中括号 “ [ ] ” 括上,并写出所带电荷数。
一般用 表示
R
n-
练习:O2- 、Cl-、S2-
AB型
AB2型
A2B型
4. 离子化合物电子式
①由阴阳离子电子式组成
②相同离子不能合并,同性电荷不直接相邻
Ca2+[:O:]2-
:
:
2-
思考1:下列电子式是否正确
:O: [:Na:]+ [:S:]-2
:
:
:
:
Ca2+[:Cl:] - Na2+[:O:]2-
:
:
:
:
:
:
×
×
×
×
[:Cl:] -
:
:
思考2: 某ⅡA族元素 X 和ⅦA族元素 Y 可形成离子化合物,请用电子式表示该离子化合物。
[ Y ]-
··
··
:
:
[ Y ]-
··
··
:
:
X2+
例:
4. 用电子式表示离子键的形成
以K2S为例
A原子电子式 + B原子电子式 → 离子化合物
箭头表示电子转移方向,从失指向得
S
K
K
→
S
2-
K+
K+
Br
Mg
Br
→
Mg
2
Br
Br
练习1、下列用电子式表示化合物的形成过程正确的是( )
A
练习2、已知氮化钠是离子化合物,下列叙述不正确的是( )
A.Na3N是氮化钠的分子式
B.Na+与N3-的电子层结构都与氖原子的结构相同
A
练习3、氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2。下列叙述中不正确的是( )
A、NaH的电子式为Na+[:H]-
B、NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C、微粒半径:H-<Li+
D、NaH与H2O反应时,水作氧化剂。
C
苹果能够落在地上,人在地球上生活而不自动脱离地球,均是因为地球的吸引力,也就是说宏观物质之间存在力的作用才能够“稳定存在”。
那么化学物质(如:NaCl、HCl、H2O等)能够稳定存在,构成这些物质的微观粒子之间是不是也存在着作用力呢?
NaCl
金刚石
干冰
微粒间的作用——“三键一力”
三键一力
化学键
分子间作用力
离子键
共价键
金属键
化学键:物质中相邻的原子或离子之间强烈的相互作用。
“三键一力”是微观粒子(原子、分子、离子)结合在一起构成客观物质的四种基本作用力,它的强弱不仅决定着物质的存在形态(气、固、液),熔沸点高低,硬度大小,而且与物质的化学性质也有密切的关系。
第四章 物质结构 元素周期律
第一节 化学键
第1课时 离子键
氯气和金属钠的反应:
点燃
2Na + Cl2 == 2NaCl
思考:
从微观角度分析,氯化钠是怎么形成的?
e-
不稳定
稳定
更稳定
Na+
Cl-
请分析在氯化钠晶体中Na+和Cl-间存在哪些相互作用?
1、 Na+和Cl-间的静电引力作用。
2、阴、阳离子的电子与电子、原子核与原子核间的静电斥力作用。
当阴、阳离子接近到一定距离时,静电引力和静电斥力达到平衡,阴阳离子间形成稳定的化学键——离子键
一、离子键
1、定义:
带相反电荷离子之间的相互作用。
2、成键微粒:
阴、阳离子
3、离子键实质:
静电作用(吸引与排斥)
阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
4、成键元素:
活泼金属元素(IA,IIA)与
活泼非金属元素(VIA,VIIA )
(AlCl3除外)
思考:哪些物质存在离子键?
1. 强碱
二、离子化合物:由离子键构成的化合物。
3. 金属氧化物
4. 金属氢化物
2. 大多数盐(除BeCl2、AlCl3、FeCl3等)
注意:
①含金属元素的化合物不一定是离子化合物。如:AlCl3等
②非金属元素的原子之间也可构成离子化合物。如:铵盐
③离子化合物都是强电解质。
氯化钠晶体中不存在单个的氯化钠分子,只存在Na+与Cl-,构成氯化钠晶体的粒子是离子而不是分子。
在氯化钠晶体中,每个氯离子周围有6个钠离子,每个钠离子周围也有6个氯离子。
NaCl是化学式,不是分子式。
【思考与交流】
1、Na+与Cl-通过离子键形成了离子化合物NaCl,氯化钠晶体是不是由分子构成的?
离子化合物溶于水或熔化时转化成自由移动的离子,离子键被破坏。但没有新物质生成,所以是物理变化。
【思考与交流】
2.离子化合物溶于水或熔化时离子键是否发生变化
3.NaCl是离子化合物,是强电解质,故食盐晶体能导电吗?
不能,导电需要条件。
离子化合物导电条件:溶于水或熔融状态。
4.熔融状态下能导电的物质一定是离子化合物吗?
不一定,如金属,合金。
熔融状态下能导电的化合物一定是离子化合物!
【思考与交流】
通过熔融状态下的物质导电性实验可以证明离子化合物。
例如:AlCl3在熔融状态下不导电,AlCl3不是离子化合物。
铵盐在熔融状态下导电,铵盐是离子化合物。
纯净的硫酸和HCl不导电,硫酸和HCl不是离子化合物。
练1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物CaCl2中,两个氯原子间也存在离子键
C
练2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和8
C
练3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
如:AlCl3
如:HCl
如:NH4Cl
练4、判断下列化合物哪些是离子化合物。
①NaOH ②H2O ③MgCl2 ④H2SO4 ⑤KNO3 ⑥NH3 ⑦CaO2 ⑧HCl
①③⑤⑦
1. 强碱
4. 金属氢化物
2. 大多数盐(除BeCl2、AlCl3、FeCl3等)
3. 金属氧化物
由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系
离子半径越小、离子所带电荷越多,离子键就越强,熔沸点越高。
【思考与交流】
物质 NaF NaCl NaBr NaI
熔点(℃) 988 801 740 660
物质 MgO MgCl2 Al2O3 AlCl3
熔点(℃) 2800 604 2050 190
Al2O3与MgO是由半径小、高电荷的离子构成,离子键很强,所以熔点很高。
由表可知Al2O3与MgO均为高熔点物质。所以Al2O3与MgO常用作耐火材料,试解释原因。
资料卡片
电子式:在元素符号周围用“ · ”或“×”来表示 原子最外层电子的式子。
1、原子的电子式:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
Na·
H·
×Mg×
·Al·
·
· C ·
·
·
· N ·
··
·
· O ·
··
··
F
2. 阳离子的电子式
由于简单阳离子最外层电子已经失去,所以无最外层电子,电子式即离子符号。复杂阳离子(NH4+)除外。
Na+
Ca2+
练习:Mg2+、Al3+、K+
3. 简单阴离子的电子式
由于阴离子的形成是由原子得电子形成,最外层电子数满足2e-或8e-结构,需将最外层电子数表示出来,并用中括号 “ [ ] ” 括上,并写出所带电荷数。
一般用 表示
R
n-
练习:O2- 、Cl-、S2-
AB型
AB2型
A2B型
4. 离子化合物电子式
①由阴阳离子电子式组成
②相同离子不能合并,同性电荷不直接相邻
Ca2+[:O:]2-
:
:
2-
思考1:下列电子式是否正确
:O: [:Na:]+ [:S:]-2
:
:
:
:
Ca2+[:Cl:] - Na2+[:O:]2-
:
:
:
:
:
:
×
×
×
×
[:Cl:] -
:
:
思考2: 某ⅡA族元素 X 和ⅦA族元素 Y 可形成离子化合物,请用电子式表示该离子化合物。
[ Y ]-
··
··
:
:
[ Y ]-
··
··
:
:
X2+
例:
4. 用电子式表示离子键的形成
以K2S为例
A原子电子式 + B原子电子式 → 离子化合物
箭头表示电子转移方向,从失指向得
S
K
K
→
S
2-
K+
K+
Br
Mg
Br
→
Mg
2
Br
Br
练习1、下列用电子式表示化合物的形成过程正确的是( )
A
练习2、已知氮化钠是离子化合物,下列叙述不正确的是( )
A.Na3N是氮化钠的分子式
B.Na+与N3-的电子层结构都与氖原子的结构相同
A
练习3、氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2。下列叙述中不正确的是( )
A、NaH的电子式为Na+[:H]-
B、NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C、微粒半径:H-<Li+
D、NaH与H2O反应时,水作氧化剂。
C
