4.1.1原子结构 课件(共24张PPT)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1原子结构 课件(共24张PPT)高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 11:25:09 | ||
图片预览





文档简介
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表第1课时 原 子 结 构
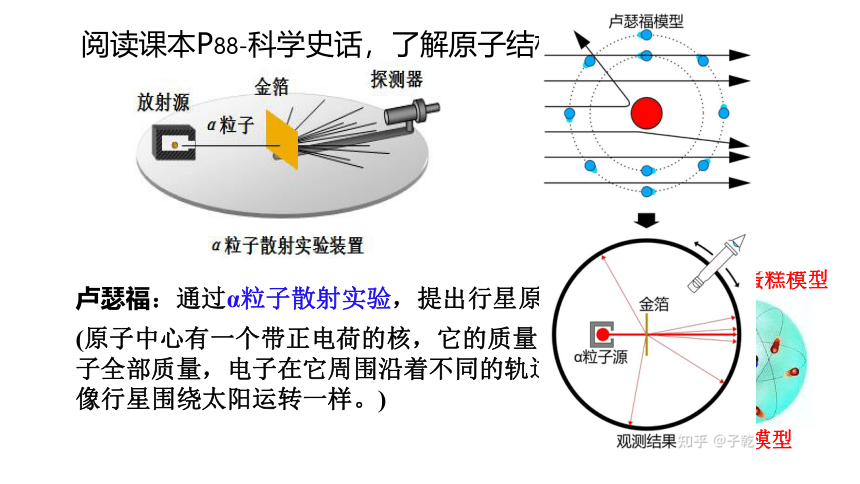
卢瑟福:通过α粒子散射实验,提出行星原子模型。
(原子中心有一个带正电荷的核,它的质量几乎等于原子全部质量,电子在它周围沿着不同的轨道运转,就像行星围绕太阳运转一样。)
行星模型
道尔顿:发现原子,并认为原子结构是坚实、不可再分的实心球。
实心球模型
汤姆孙:发现电子,并认为原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子中和了正电荷。
葡萄干蛋糕模型
阅读课本P88-科学史话,了解原子结构演变历史
量子轨道模型
电子云模型
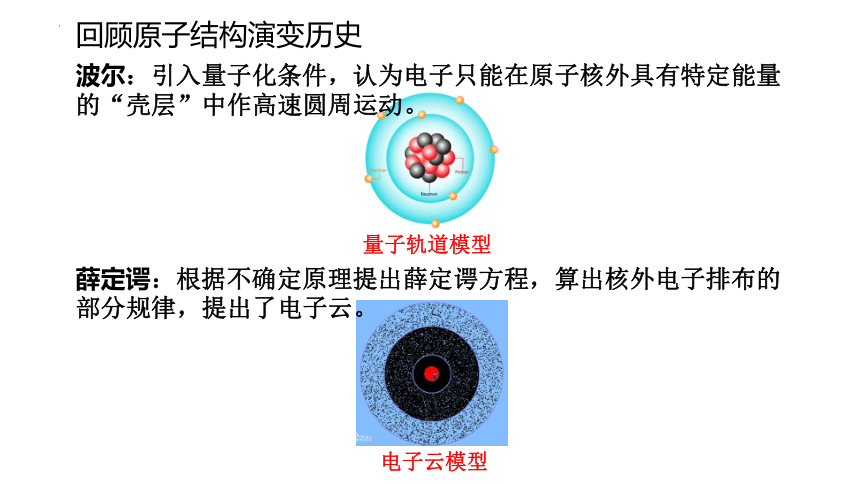
回顾原子结构演变历史
波尔:引入量子化条件,认为电子只能在原子核外具有特定能量的“壳层”中作高速圆周运动。
薛定谔:根据不确定原理提出薛定谔方程,算出核外电子排布的部分规律,提出了电子云。
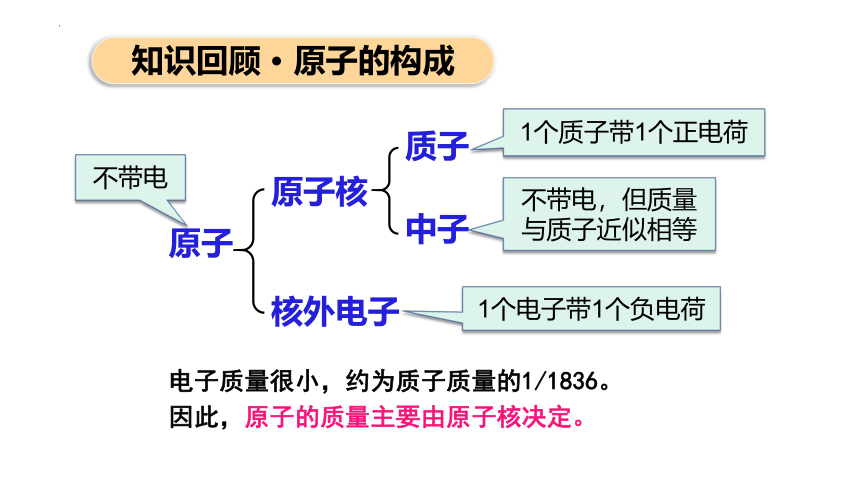
知识回顾 · 原子的构成
原子
原子核
核外电子
质子
中子
1个质子带1个正电荷
1个电子带1个负电荷
不带电,但质量与质子近似相等
不带电
电子质量很小,约为质子质量的1/1836。
因此,原子的质量主要由原子核决定。
若忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数,符号A。
质量数(A)=质子数(Z)+中子数(N)
原子组成的表示方法:
A
Z
X
C
12
6
16
O
8
科研人员最近发现放射性同位素钬( )可有效治疗肝癌,该同位素原子核中质子数和中子数之差为( )
A.99 B.32 C.166 D. 233
B
提醒:原子的质量数在数值上约等于该原子的相对原子质量!
则12C18O的相对分子质量为______,
2H2O的摩尔质量为___________
30
20g/mol
核 外 电 子 的 排 布
1、电子层
把原子核外能量不同的区域假想为不连续的壳层,称作电子层。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子层代号
n
各电子层
序号
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
与原子核距离
能量
从近到远
从低到高
核 外 电 子 的 排 布
2、核外电子的排布遵循能量最低原理
在多电子原子中,电子的能量是不同的。在离核较近区域运动的电子能量较低,在离核较远区域运动的电子能量较高。
原子核外的电子总是尽可能的先从内层排起,当一层排满后再填充下一层。
2
8
18
2n2
核 外 电 子 的 排 布
3、核外电子的排布规律
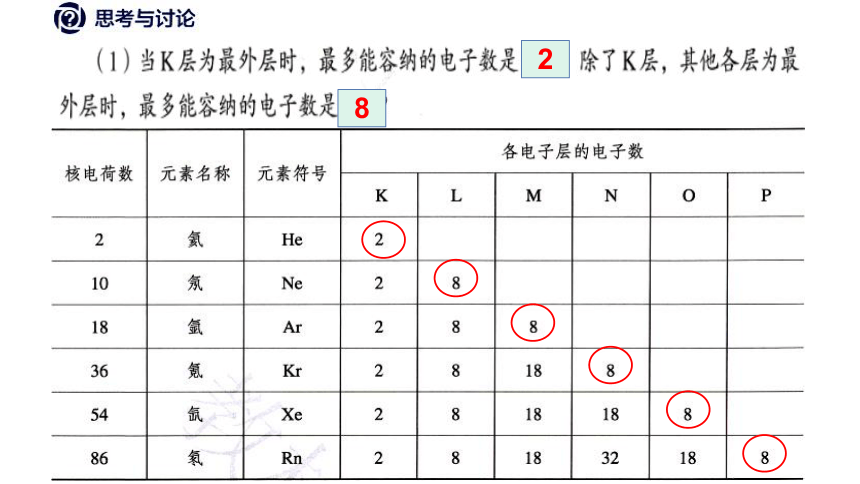
(1)各电子层最多容纳2n2个电子;
(2)最外层电子数不超过8个(K层不超过2个);
(3)次外层电子数不超过18个;倒数第三层不超过32个;
核外电子总是尽可能的先排布在能量较低的电子层上,然后由里向外,依次排布在能量逐渐升高的电子层上(能量最低原理)。
原子核
核内质子数(或核电荷数)
粒子符号
电子层
M层电子数
核 外 电 子 的 排 布
4、电子层的表示方法
+19 2 8 8 1
+20 2 8 8 2
钾(K) 钙(Ca)
1、判断下列示意图是否正确?为什么?
3、核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
A.1种 B.2种 C.3种 D.4种
B
练习:
2、试画出第33、52、87号元素的核外电子排布示意图
4.写出1~18号元素中符合下列条件的原子(或离子)的
粒子符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:______。
(2)某元素原子L层上的电子数为K层的一半:________。
(3)某元素原子得到2个电子后所形成的
电子总数与氩原子的电子总数相同的离子:________。
(4)某元素原子的最外层电子数
等于次外层电子数的2倍:__________。
O
Li
S2-
C
小结
寻找“10电子”微粒和“18电子”微粒的方法
(1)“10电子”微粒
寻找“10电子”微粒和“18电子”微粒的方法
(2)“18电子”微粒
18电子”的微粒
分子
离子
一核18电子
Ar
K+、Ca2+、Cl-、S2-
二核18电子
F2、HCl
O22-、HS-
三核18电子
H2S
四核18电子
PH3、H2O2
五核18电子
SiH4、CH3F、NH2OH
六核18电子
N2H4、CH3OH
其他微粒
C2H6、CH3NH2
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A:_____;B:_____;C:______;D______。
(2)写出A、B、E三种微粒反应的离子方程式:______________________________________。
H2O NH3 NH4+ OH-
Al3++3NH3+3H2O===Al(OH)3↓+3NH4+或
Mg2++2NH3+2H2O===Mg(OH)2↓+ 2NH4+
核外电子排布规律
1.1~20号元素原子核外电子排布特征
(1)最外层电子数为1的原子有H、Li、Na、K。
(2)最外层电子数为2的原子有He、Be、Mg、Ca。
(3)最外层电子数与次外层电子数存在倍数关系的情况
①最外层电子数=次外层电子数的原子:Be、Ar。
②最外层电子数=次外层电子数2倍的原子:C。
③最外层电子数=次外层电子数3倍的原子:O。
④最外层电子数=次外层电子数4倍的原子:Ne。
⑤最外层电子数=次外层电子数的????????原子:Li、Si。
第一节 原子结构与元素周期表第1课时 原 子 结 构
卢瑟福:通过α粒子散射实验,提出行星原子模型。
(原子中心有一个带正电荷的核,它的质量几乎等于原子全部质量,电子在它周围沿着不同的轨道运转,就像行星围绕太阳运转一样。)
行星模型
道尔顿:发现原子,并认为原子结构是坚实、不可再分的实心球。
实心球模型
汤姆孙:发现电子,并认为原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子中和了正电荷。
葡萄干蛋糕模型
阅读课本P88-科学史话,了解原子结构演变历史
量子轨道模型
电子云模型
回顾原子结构演变历史
波尔:引入量子化条件,认为电子只能在原子核外具有特定能量的“壳层”中作高速圆周运动。
薛定谔:根据不确定原理提出薛定谔方程,算出核外电子排布的部分规律,提出了电子云。
知识回顾 · 原子的构成
原子
原子核
核外电子
质子
中子
1个质子带1个正电荷
1个电子带1个负电荷
不带电,但质量与质子近似相等
不带电
电子质量很小,约为质子质量的1/1836。
因此,原子的质量主要由原子核决定。
若忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数,符号A。
质量数(A)=质子数(Z)+中子数(N)
原子组成的表示方法:
A
Z
X
C
12
6
16
O
8
科研人员最近发现放射性同位素钬( )可有效治疗肝癌,该同位素原子核中质子数和中子数之差为( )
A.99 B.32 C.166 D. 233
B
提醒:原子的质量数在数值上约等于该原子的相对原子质量!
则12C18O的相对分子质量为______,
2H2O的摩尔质量为___________
30
20g/mol
核 外 电 子 的 排 布
1、电子层
把原子核外能量不同的区域假想为不连续的壳层,称作电子层。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子层代号
n
各电子层
序号
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
与原子核距离
能量
从近到远
从低到高
核 外 电 子 的 排 布
2、核外电子的排布遵循能量最低原理
在多电子原子中,电子的能量是不同的。在离核较近区域运动的电子能量较低,在离核较远区域运动的电子能量较高。
原子核外的电子总是尽可能的先从内层排起,当一层排满后再填充下一层。
2
8
18
2n2
核 外 电 子 的 排 布
3、核外电子的排布规律
(1)各电子层最多容纳2n2个电子;
(2)最外层电子数不超过8个(K层不超过2个);
(3)次外层电子数不超过18个;倒数第三层不超过32个;
核外电子总是尽可能的先排布在能量较低的电子层上,然后由里向外,依次排布在能量逐渐升高的电子层上(能量最低原理)。
原子核
核内质子数(或核电荷数)
粒子符号
电子层
M层电子数
核 外 电 子 的 排 布
4、电子层的表示方法
+19 2 8 8 1
+20 2 8 8 2
钾(K) 钙(Ca)
1、判断下列示意图是否正确?为什么?
3、核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
A.1种 B.2种 C.3种 D.4种
B
练习:
2、试画出第33、52、87号元素的核外电子排布示意图
4.写出1~18号元素中符合下列条件的原子(或离子)的
粒子符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:______。
(2)某元素原子L层上的电子数为K层的一半:________。
(3)某元素原子得到2个电子后所形成的
电子总数与氩原子的电子总数相同的离子:________。
(4)某元素原子的最外层电子数
等于次外层电子数的2倍:__________。
O
Li
S2-
C
小结
寻找“10电子”微粒和“18电子”微粒的方法
(1)“10电子”微粒
寻找“10电子”微粒和“18电子”微粒的方法
(2)“18电子”微粒
18电子”的微粒
分子
离子
一核18电子
Ar
K+、Ca2+、Cl-、S2-
二核18电子
F2、HCl
O22-、HS-
三核18电子
H2S
四核18电子
PH3、H2O2
五核18电子
SiH4、CH3F、NH2OH
六核18电子
N2H4、CH3OH
其他微粒
C2H6、CH3NH2
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A:_____;B:_____;C:______;D______。
(2)写出A、B、E三种微粒反应的离子方程式:______________________________________。
H2O NH3 NH4+ OH-
Al3++3NH3+3H2O===Al(OH)3↓+3NH4+或
Mg2++2NH3+2H2O===Mg(OH)2↓+ 2NH4+
核外电子排布规律
1.1~20号元素原子核外电子排布特征
(1)最外层电子数为1的原子有H、Li、Na、K。
(2)最外层电子数为2的原子有He、Be、Mg、Ca。
(3)最外层电子数与次外层电子数存在倍数关系的情况
①最外层电子数=次外层电子数的原子:Be、Ar。
②最外层电子数=次外层电子数2倍的原子:C。
③最外层电子数=次外层电子数3倍的原子:O。
④最外层电子数=次外层电子数4倍的原子:Ne。
⑤最外层电子数=次外层电子数的????????原子:Li、Si。
