4.1.2 元素周期表 课件(共31张PPT)第四章第一节第二课时 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2 元素周期表 课件(共31张PPT)第四章第一节第二课时 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 11:26:21 | ||
图片预览






文档简介
(共31张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表第2课时 元素周期表
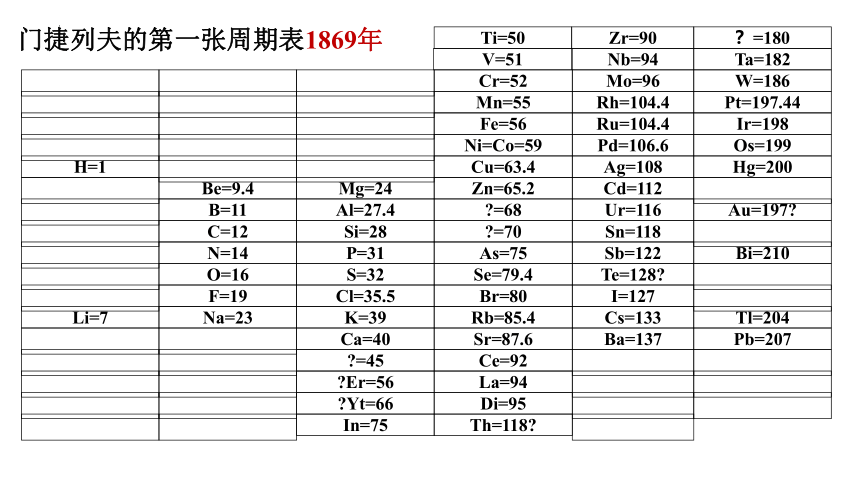
历史上,为了寻求各种元素及其化合物的内在联系和规律性,人们进行了许多尝试。1869年,俄国化学家门捷列夫在前人研究的基础上,将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表的发展历程
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表1869年
随着化学科学的不断发展,元素周期表中为未知元素留下的空位先后被填满,周期表的形式也变得更加完美。原子结构的奥秘被揭示以后,元素周期表中元素的排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们现在常用的这种形式。
由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的。
元素周期表的发展历程
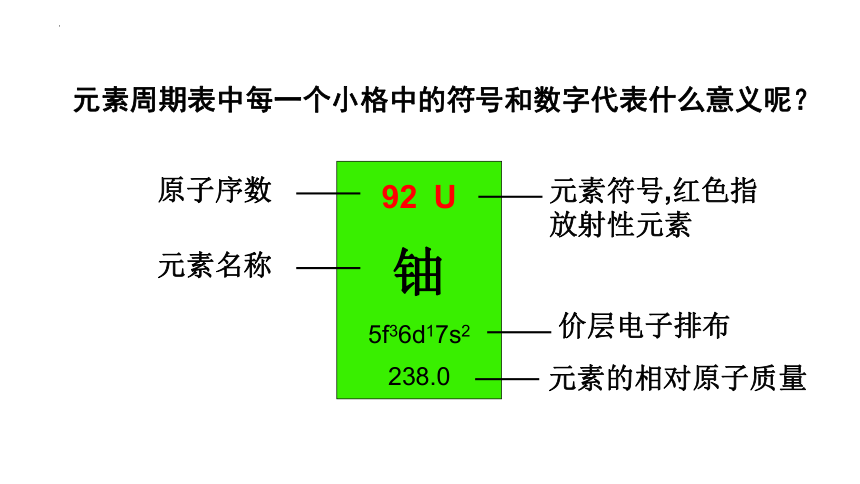
元素周期表中每一个小格中的符号和数字代表什么意义呢?
U
铀5f36d17s2
238.0
原子序数
元素名称
元素符号,红色指放射性元素
价层电子排布
元素的相对原子质量
周期表中的符号和数字
请同学们仔细观察元素周期表思考:
1、什么是原子序数?原子序数与原子结构有何关系?
2、现在的元素周期表以什么原则编排?
3、有多少横行?每横行有多少种元素?
有多少纵列?如何分布?
原子序数=核电荷数=质子数=核外电子数
元素编号
按原子序数递增原则,从左到右排布
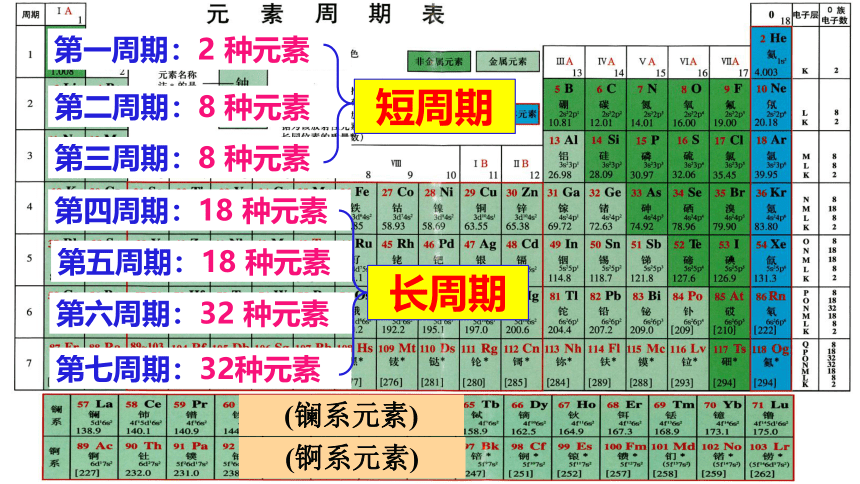
有7横行,每一横行称为一周期。
有18纵列。
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
(镧系元素)
(锕系元素)
短周期
长周期
请画出第一、二、三周期各元素的原子结构,同一周期元素的原子结构有什么特点?
同周期元素的电子层数相同
周期序数 = 电子层数
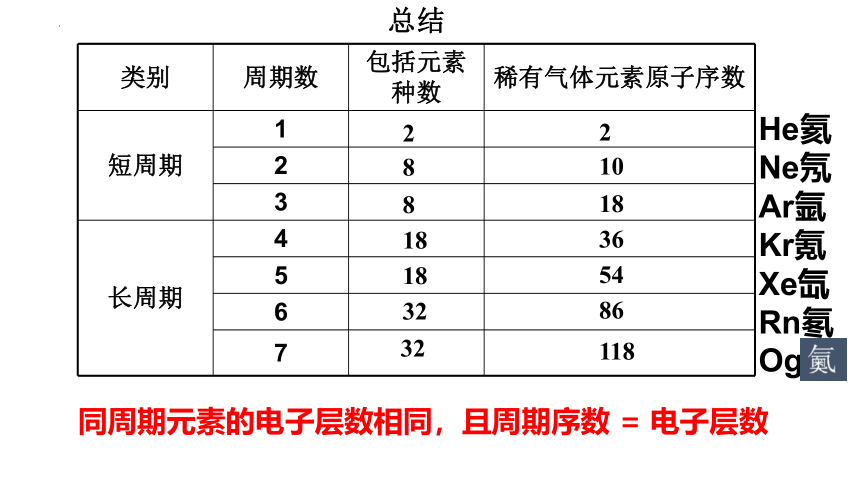
类别 周期数 包括元素种数 稀有气体元素原子序数
短周期 1
2
3
长周期 4
5
6
7
2
8
8
18
18
32
32
2
10
18
36
54
86
118
总结
He氦
Ne氖
Ar氩
Kr氪
Xe氙
Rn氡
Og
同周期元素的电子层数相同,且周期序数 = 电子层数
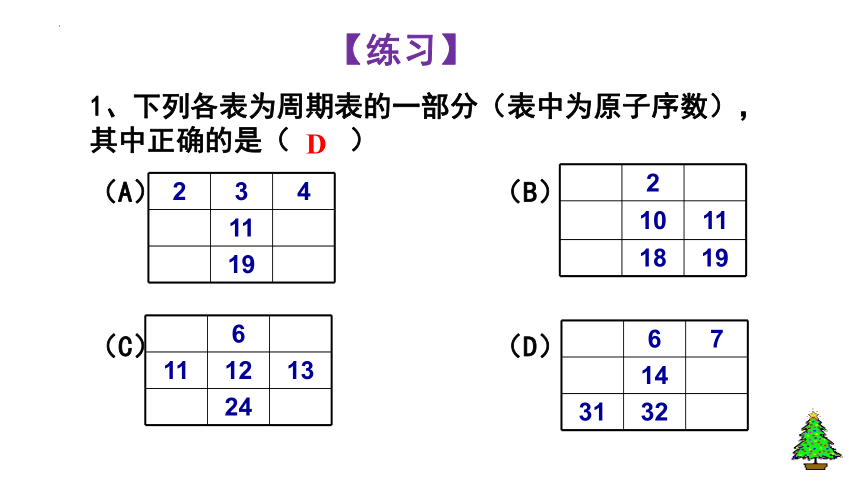
1、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
【练习】
【练习】
2、下列原子分别位于第几周期?
第二周期
第四周期
第三周期
第三周期
周期序数 = 电子层数
族
(18纵列,
16族)
主族(A):
副族(B):
第Ⅷ族:
0族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
三个纵列(8、9、10),位于Ⅶ B 与ⅠB中间
稀有气体元素
七主 八副 一零
族
(1)主族:由_______元素和______元素共同组成的族(第18列除外)
短周期
长周期
列序 1 2 13 14 15 16 17
主族序数 ___ ___ ____ ____ ___ ____ ____
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
(2)副族:仅由______元素组成的族
长周期
列序 3 4 5 6 7 11 12
族序数 ___ ___ ___ ___ ____ ___ ___
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族:包括_________三个纵列。
(3)0族:第__纵列,该族元素又称为_________元素。
8、9、10
18
稀有气体
从ⅢB族到ⅡB族【3 ~ 12】10个纵行的元素,它包括了第Ⅷ族和全部副族元素,这些元素都是金属元素。
第ⅠA族(除氢外):碱金属元素
第IIA族:碱土元素
第ⅣA族:碳族元素
第ⅤA称:氮族元素
第ⅥA族:氧族元素
第ⅦA族:卤族元素
0族:稀有气体元素
族的别称
主族序数 = 最外层电子数
+3
+11
+19
+37
+55
ⅠA ⅦA
112
111
110
109
108
107
106
105
104
89-103
80
79
78
77
76
75
74
73
72
57-71
48
47
46
45
44
43
42
41
40
39
30
29
28
27
26
25
24
23
22
21
86
85
84
83
82
81
54
53
52
51
50
49
36
35
34
33
32
31
18
17
16
15
14
13
10
9
8
7
6
5
2
88
87
56
55
38
37
20
19
12
11
4
3
1
7
6
5
4
18
8
2
M
L
k
3
8
2
L
K
2
2
K
1
103
102
101
100
99
98
97
96
95
94
93
92
91
90
89
71
70
69
68
67
66
65
64
63
62
61
60
59
58
57
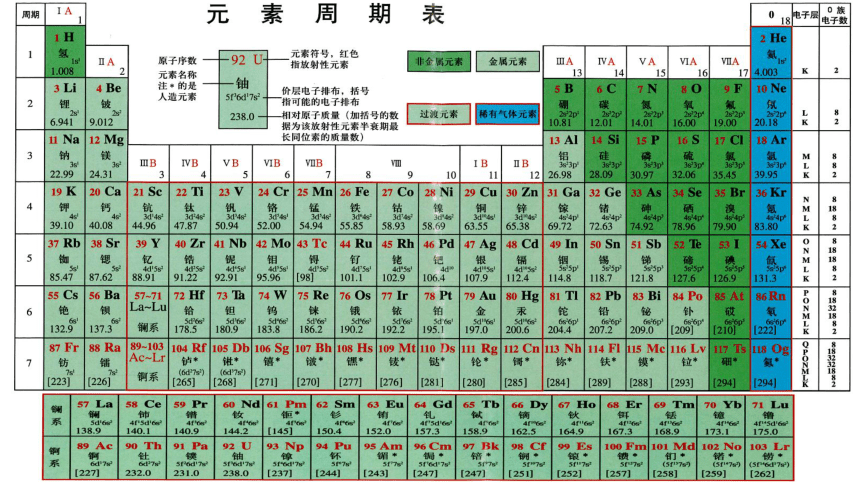
元素周期表
IA
IIA
IIIA
IVA
V
A
VIA
VIIA
0
IIIB IVB VB VIB VIIB VIII IB II B
锕系
镧系
主族
周期
副族
过渡元素
Ⅷ族
零族
元素周期表的结构
元素周期表
长周期(4个)
短周期(3个)
0族
主族 ⅠA-ⅦA
副族 ⅠB-ⅦB、
第Ⅷ族
周期(7个)
族(16个)
(7个横行)
(18个纵行)
小结-元素周期表的结构
元素Cl在周期表中位置描述:
第三周期VIIA族
元素在周期表中位置描述为:
第 x 周期 第 x 族
汉字:一~七
指明主(A)、副(B)
例1、原子序数为35的元素在周期表中的位置是 ____________
第四周期ⅦA族
根据稀有气体元素的位置推测
例2、已知某主族元素的原子结构示意图如下,判断其位置。
周期序数=电子层数
主族序数=最外层电子数
第四周期IA族
第五周期ⅦA族
最外层电 子数(N) 3≤N<8 N=1或2 N>次外层电子数
元素在周期 表中的位置 主族 第ⅠA族、 第ⅡA族、 第Ⅷ族、 副族、 0族元素氦 第二周期
原子最外层电子规律
问题探究1:最外层有一个、二个电子的元素一定是第ⅠA、ⅡA族元素吗?
问题探究2:同周期的X、Y两元素,X位于第ⅡA族、 Y位于第ⅢA族,则其原子序数的差值是__________
b=a+m ⅠA和ⅡA(过渡金属之前)
b=a+n ⅢA至ⅦA和O族(过渡金属之后)
1、11或25
在前加前,在后加后
相邻周期的同主族aX、bY(a<b)两元素,X所在周期元素种类为m种、 Y所在周期元素种类为n种,则Y元素的原子序数是:
拓展:甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能是( )
A.X+2 B.X+28 C.X+32 D.X+44
解析
各周期元素种类2、8、8、18、18、32、32,则乙的原子序数可以是X+2、X+8或X+18或连续周期的元素种类的代数和。
B
1. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别是( )
A. Mg Al Si B. Li Be Mg C. N O S D. P S O
A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
【练习】
C
2.化合物种类最多的族是________ ;元素种类最多的族是_______;
Ca元素的原子序数为20,其相邻的同族元素的原子序数是__________;其相邻的同周期主族元素的原子序数是__________;
短周期元素中,族序数等于周期序数的元素有__________,族序数等于周期序数2倍的元素有________,周期序数等于族序数2倍的元素有______,族序数等于周期序数3倍的元素有________。
第ⅣA族
12 ; 38
19 ; 31
H、Be、Al
C、S
Li
第ⅢB族
O
【练习】
棱台型元素周期表
扇形元素周期表
透视式
螺旋型周期表
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表第2课时 元素周期表
历史上,为了寻求各种元素及其化合物的内在联系和规律性,人们进行了许多尝试。1869年,俄国化学家门捷列夫在前人研究的基础上,将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表的发展历程
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表1869年
随着化学科学的不断发展,元素周期表中为未知元素留下的空位先后被填满,周期表的形式也变得更加完美。原子结构的奥秘被揭示以后,元素周期表中元素的排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们现在常用的这种形式。
由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的。
元素周期表的发展历程
元素周期表中每一个小格中的符号和数字代表什么意义呢?
U
铀5f36d17s2
238.0
原子序数
元素名称
元素符号,红色指放射性元素
价层电子排布
元素的相对原子质量
周期表中的符号和数字
请同学们仔细观察元素周期表思考:
1、什么是原子序数?原子序数与原子结构有何关系?
2、现在的元素周期表以什么原则编排?
3、有多少横行?每横行有多少种元素?
有多少纵列?如何分布?
原子序数=核电荷数=质子数=核外电子数
元素编号
按原子序数递增原则,从左到右排布
有7横行,每一横行称为一周期。
有18纵列。
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
(镧系元素)
(锕系元素)
短周期
长周期
请画出第一、二、三周期各元素的原子结构,同一周期元素的原子结构有什么特点?
同周期元素的电子层数相同
周期序数 = 电子层数
类别 周期数 包括元素种数 稀有气体元素原子序数
短周期 1
2
3
长周期 4
5
6
7
2
8
8
18
18
32
32
2
10
18
36
54
86
118
总结
He氦
Ne氖
Ar氩
Kr氪
Xe氙
Rn氡
Og
同周期元素的电子层数相同,且周期序数 = 电子层数
1、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
【练习】
【练习】
2、下列原子分别位于第几周期?
第二周期
第四周期
第三周期
第三周期
周期序数 = 电子层数
族
(18纵列,
16族)
主族(A):
副族(B):
第Ⅷ族:
0族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
三个纵列(8、9、10),位于Ⅶ B 与ⅠB中间
稀有气体元素
七主 八副 一零
族
(1)主族:由_______元素和______元素共同组成的族(第18列除外)
短周期
长周期
列序 1 2 13 14 15 16 17
主族序数 ___ ___ ____ ____ ___ ____ ____
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
(2)副族:仅由______元素组成的族
长周期
列序 3 4 5 6 7 11 12
族序数 ___ ___ ___ ___ ____ ___ ___
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族:包括_________三个纵列。
(3)0族:第__纵列,该族元素又称为_________元素。
8、9、10
18
稀有气体
从ⅢB族到ⅡB族【3 ~ 12】10个纵行的元素,它包括了第Ⅷ族和全部副族元素,这些元素都是金属元素。
第ⅠA族(除氢外):碱金属元素
第IIA族:碱土元素
第ⅣA族:碳族元素
第ⅤA称:氮族元素
第ⅥA族:氧族元素
第ⅦA族:卤族元素
0族:稀有气体元素
族的别称
主族序数 = 最外层电子数
+3
+11
+19
+37
+55
ⅠA ⅦA
112
111
110
109
108
107
106
105
104
89-103
80
79
78
77
76
75
74
73
72
57-71
48
47
46
45
44
43
42
41
40
39
30
29
28
27
26
25
24
23
22
21
86
85
84
83
82
81
54
53
52
51
50
49
36
35
34
33
32
31
18
17
16
15
14
13
10
9
8
7
6
5
2
88
87
56
55
38
37
20
19
12
11
4
3
1
7
6
5
4
18
8
2
M
L
k
3
8
2
L
K
2
2
K
1
103
102
101
100
99
98
97
96
95
94
93
92
91
90
89
71
70
69
68
67
66
65
64
63
62
61
60
59
58
57
元素周期表
IA
IIA
IIIA
IVA
V
A
VIA
VIIA
0
IIIB IVB VB VIB VIIB VIII IB II B
锕系
镧系
主族
周期
副族
过渡元素
Ⅷ族
零族
元素周期表的结构
元素周期表
长周期(4个)
短周期(3个)
0族
主族 ⅠA-ⅦA
副族 ⅠB-ⅦB、
第Ⅷ族
周期(7个)
族(16个)
(7个横行)
(18个纵行)
小结-元素周期表的结构
元素Cl在周期表中位置描述:
第三周期VIIA族
元素在周期表中位置描述为:
第 x 周期 第 x 族
汉字:一~七
指明主(A)、副(B)
例1、原子序数为35的元素在周期表中的位置是 ____________
第四周期ⅦA族
根据稀有气体元素的位置推测
例2、已知某主族元素的原子结构示意图如下,判断其位置。
周期序数=电子层数
主族序数=最外层电子数
第四周期IA族
第五周期ⅦA族
最外层电 子数(N) 3≤N<8 N=1或2 N>次外层电子数
元素在周期 表中的位置 主族 第ⅠA族、 第ⅡA族、 第Ⅷ族、 副族、 0族元素氦 第二周期
原子最外层电子规律
问题探究1:最外层有一个、二个电子的元素一定是第ⅠA、ⅡA族元素吗?
问题探究2:同周期的X、Y两元素,X位于第ⅡA族、 Y位于第ⅢA族,则其原子序数的差值是__________
b=a+m ⅠA和ⅡA(过渡金属之前)
b=a+n ⅢA至ⅦA和O族(过渡金属之后)
1、11或25
在前加前,在后加后
相邻周期的同主族aX、bY(a<b)两元素,X所在周期元素种类为m种、 Y所在周期元素种类为n种,则Y元素的原子序数是:
拓展:甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能是( )
A.X+2 B.X+28 C.X+32 D.X+44
解析
各周期元素种类2、8、8、18、18、32、32,则乙的原子序数可以是X+2、X+8或X+18或连续周期的元素种类的代数和。
B
1. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别是( )
A. Mg Al Si B. Li Be Mg C. N O S D. P S O
A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
【练习】
C
2.化合物种类最多的族是________ ;元素种类最多的族是_______;
Ca元素的原子序数为20,其相邻的同族元素的原子序数是__________;其相邻的同周期主族元素的原子序数是__________;
短周期元素中,族序数等于周期序数的元素有__________,族序数等于周期序数2倍的元素有________,周期序数等于族序数2倍的元素有______,族序数等于周期序数3倍的元素有________。
第ⅣA族
12 ; 38
19 ; 31
H、Be、Al
C、S
Li
第ⅢB族
O
【练习】
棱台型元素周期表
扇形元素周期表
透视式
螺旋型周期表
