专题2 化学反应速率与化学平衡 单元检测题(含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题2 化学反应速率与化学平衡 单元检测题(含答案) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 462.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 20:36:54 | ||
图片预览




文档简介
专题2《化学反应速率与化学平衡》单元检测题
一、单选题(共13题)
1.下列关于工业合成氨的说法正确的是
A.工业合成氨采用10~30MPa,是因为该条件下催化剂的活性最好
B.选择不同的催化剂会改变此反应△H的数值
C.合成氨工业中采用低温以提高平衡转化率
D.合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率
2.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
3.时,在含有的某溶液中,加入过量金属锡(),发生反应:,体系中和变化关系如图所示。下列说法不正确的是
A.
B.时,该反应的平衡常数
C.1-2分钟内,用表示的平均速率是
D.往平衡体系中加入后,增大
4.一定温度下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)。反应过程中的部分数据如下表所示:
c/(mol/L) t/min c(N2) c(H2) c(NH3)
0 1.0 3.0 0
3 0.25
6 2.4
9 0.8
下列说法正确的是
A.t=6min时,反应刚好达到平衡状态
B.0~3min内,用N2表示的平均反应速率为0.125mol/(L·min)
C.达到平衡时,容器内的气体分子数N(N2):N(H2):N(NH3)=1:3:2
D.在容器中加入催化剂,会加快化学反应速率
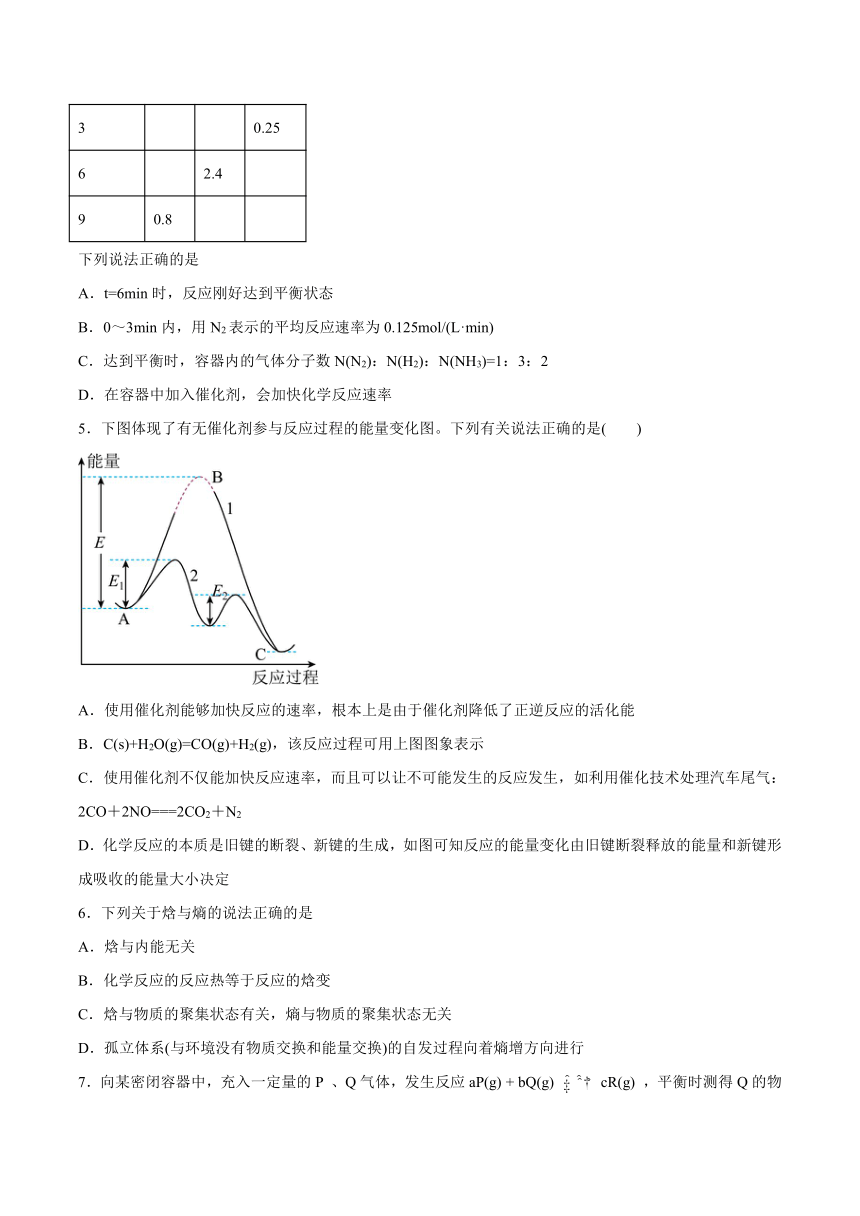
5.下图体现了有无催化剂参与反应过程的能量变化图。下列有关说法正确的是( )
A.使用催化剂能够加快反应的速率,根本上是由于催化剂降低了正逆反应的活化能
B.C(s)+H2O(g)=CO(g)+H2(g),该反应过程可用上图图象表示
C.使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO===2CO2+N2
D.化学反应的本质是旧键的断裂、新键的生成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定
6.下列关于焓与熵的说法正确的是
A.焓与内能无关
B.化学反应的反应热等于反应的焓变
C.焓与物质的聚集状态有关,熵与物质的聚集状态无关
D.孤立体系(与环境没有物质交换和能量交换)的自发过程向着熵增方向进行
7.向某密闭容器中,充入一定量的P 、Q气体,发生反应aP(g) + bQ(g) cR(g) ,平衡时测得Q的物质的量浓度为0.30 mol· L-1。保持温度不变,将容器的容积缩小至原来的一半,反应重新达到平衡后,测得Q的物质的量浓度为0.62 mol· L-1。下列说法正确的是
A.a+b>c
B.重新达到平衡后,P的转化率增大
C.重新达到平衡后,R的体积分数减小
D.该反应的平衡常数表达式为K=
8.已知反应。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.降低温度,K减小 B.充入一定量的氮气,不变
C.更换高效催化剂,的转化率增大 D.减小压强,增加
9.在密闭容器中发生下列反应,反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.C的物质的量浓度减小 B.平衡向正反应方向移动
C.A的体积分数变小 D.
10.在反应中,表示该反应速率最快的是
A. B.
C. D.
11.下列关于化学反应速率的说法正确的是( )
①恒温时,增大压强,化学反应速率一定加快。
②其他条件不变,温度越高,化学反应速率越快。
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量。
④3mol·L﹣1·s﹣1的反应速率一定比1mol·L﹣1·s﹣1的反应速率大。
⑤升高温度能增大反应物分子中活化分子的百分数。
⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多。
⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率。
A.②⑤ B.②⑤⑥ C.②⑤⑧ D.②⑤⑥⑧
12.下列判断正确的是
A.一定温度下,反应能自发进行,该反应的△H<0
B.H2O(g)变成液态水,△S>0
C.反应 △H<0,△S>0
D.凡是放热反应都是自发的,吸热反应都是非自发的
13.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.反应2H2(g)+O2(g)=2H2O(g)的H可通过下列估算:H=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
B.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的H<0
C.氢氧燃料电池的电子运动方向为:负极→导线→正极→内电路→负极,形成闭合回路
D.常温常压下,氢氧燃料电池放电过程中消耗11.2LH2,转移电子的数目为6.02×1023
二、非选择题(共10题)
14.水溶性硝态氮(以NO、NO等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO,产生两种对大气无污染的气体。该反应的离子方程式为___________。
(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是___________。
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是______。
(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为___________、___________。
15.t℃ 时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C平均反应速率为__________。
(2)x=__________;平衡常数K=____________。
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)____。
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
三、实验题
16.I.用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。
(1)在检查装置的气密性后,向试管a中加入10mL6mol/L稀HNO3和lgCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于_________,进行一段时间后速率又逐渐减慢,原因是_________。
(3)欲较快地制得NO,可采取的措施是_________。
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
II.为了探究几种气态氧化物的性质,某同学设计了以下实验:
用三只集气瓶收集满二氧化硫、二氧化氮气体。倒置在水槽中,然后分别缓慢通入适量氧气或氯气,如图所示。一段时间后,A、B装置中集气瓶中充满溶液,C装置中集气瓶里还有气体。
(4)写出C水槽中反应的化学方程式:____________。
(5)写出B水槽里发生氧化还原反应的离子方程式:____________。
(6)如果装置A中通入的氧气恰好使液体充满集气瓶,假设瓶内液体不扩散,气体摩尔体积为aL/mol,集气瓶中溶液的物质的量浓度为________。
17.现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸nmol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。
请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是_______。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有_______。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号)_______。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:_______(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为_______;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为_______。
四、计算题
18.某温度下,在容积为2L的密闭容器中充入5mol气体A和3mol气体B,发生反应:3A(g)+B(g)2C(g)+2D(g),5分钟后反应达到平衡状态,测得生成2molD,计算以下量(写出计算过程):
(1)计算A的转化率。
(2)计算该温度下该反应的化学平衡常数。
19.在一个盛有催化剂、容积可变的密闭容器中,保持一定温度和压强,进行以下反应:3H2(g)+N2(g) 2NH3(g)。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表已知项)。在相同温度、压强下,保持平衡时各组分的体积分数不变。对下列编号(1)~(3)的状态,填写表中①②③④⑤的内容。
已知 编号 起始状态各物质的物质的量(mol) 平衡时NH3的物质的量(mol)
N2 H2 NH3
1 4 0 a
(1) 1.5 6 0 ①___
(2) ②__ ③___ 1 0.5a
(3) c b(b≥4c) ④___ ⑤___
20.2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol,反应Ⅰ的平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)
21.已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是__________,F的电子式是_____________。
(2)写出反应①的离子方程式:___________;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________(填“增大”、“不变”或“减小”),B的转化率_________。(填“升高”、“不变”或“降低”),L的体积分数___________(填“增大”、“不变”、“减小”或“无法确定”)。
22.(A、B、C、D、E、F是原子序数依次增大的短周期主族元素,B、C相邻且与其他元素不位于同一周期,D、E、B、C、F的主族族序数依次增大,且这五种元素的族序数之和为22。
(1)E在元素周期表中的位置是______。
(2)C与D形成的含有两种化学键的化合物的电子式为______。
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为______。
(4)A2C2和FC2是市场上较好的消毒剂,等质量的A2C2和FC2分别与足量的二氧化硫反应时,消耗二氧化硫的质量之比为______。
(5)500℃下,向一容积为8L的恒容密闭容器中充人物质的量均为2mol的A单质和B单质,发生化合反应,0.5min后达到平衡,测得容器中平衡时的压强为起始时的80%,则用B单质表示该过程中的化学反应速率为______;A单质的平衡转化率为______。
(6)利用如图所示装置,可将B、C形成的常见污染气体转化为化工原料X,同时获得电能总反应方程式中只含A、B、C三种元素。
①电极Ⅱ的名称是______(填“正极”或“负极”)。
②电极Ⅰ上的电极反应式为______。
23.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z位于同一主族且二者均可与Y元素形成两种常见的化合物,W原子的最外层电子数比次外层电数少5个。
(1)几种元素的原子半径由大到小的顺序是_______(用元素符号表示),X与Z可形成一种稳定的化合物,用电子式表示该化合物的形成过程_______。
(2)由X、Y、Z三种原子组成的物质含有化学键类型为_______。
(3)写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为_______。
(4)在催化下可发生分解反应,为探究一定温度下溶液的浓度、的浓度对分解速率的影响情况,某同学设计了如下实验,内容见下表:
实验序号 实验所用试剂
酸性溶液 溶液
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
Ⅰ 4 0.1 3 2 3
Ⅱ 4 0.1 2 2
Ⅲ 5 0.1 2 2
①_______。
②实验Ⅰ、Ⅱ的探究目的是_______。
③实验Ⅰ、Ⅲ探究催化剂浓度对分解速率的影响,则_______,若实验Ⅲ中产生气泡的速率较快,由此可得出的结论是_______。
参考答案:
1.D 2.B 3.D 4.D 5.A 6.D 7.C 8.B 9.D 10.A 11.A 12.A 13.B
14.(1)5C6H12O6+24NO+24H+ 12N2↑+30CO2↑+42H2O.
(2) 纳米铁铜双金属的比表面积大,能吸附废水中更多的硝态氮;纳米铁铜双金属颗粒更小,表面的反应活性点更多(或还原性更强);纳米铁铜双金属能形成更多的微小原电池,短时间内反应速率更快 向两支试管中分别加入等体积硝态氮废水,同时通入相同时间的足量的空气和氮气;停止通气后,向两支试管中加入等量的纳米铁铜双金属,相同时间后,测定两份废水中硝态氮的含量,比较有氧和无氧环境中的脱氮率
(3) 在NR酶的作用下,NO在酸性介质中(结合H+)得电子生成NH2OH(和H2O)(或NO+5H++4e-=NH2OH+H2O) 在HH酶的作用下,NH2OH和NH3转化为N2H4(和H2O)(或NH2OH+NH3=N2H4+H2O)
15. 0.2mol/L min 4 C
16.(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2) 反应放热,使温度升高,反应速率加快 反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢
(3)AB
(4)2SO2+O2+2H2O=2H2SO4
(5)Cl2+SO2+2H2O=2Cl-+SO+4H+
(6)mol·L-1
17.(1)点燃B处的酒精灯,给催化剂加热
(2)干燥气体,使SO2和O2均匀混合
(3)①③
(4)
(5) 75% 1.5<c<2
18.60%;1
19. 1.5a 0 0.5 2(b-4c) (b-3c)a
20.0.02MPa
21.(1) 第二周期第ⅥA族
(2)NH+OH-NH3↑+H2O
(3)NO+2HNO3(浓)═3NO2+H2O
(4)2CuNH4(OH)CrO42CuO Cr2O3+N2↑+5H2O
(5) > 增大 降低 无法确定
22.(1)第三周期第ⅢA族
(2)
(3)Al(OH)3+3H+=Al3++3H2O
(4)27:34
(5) 0.1mol·L-1·min-1 60%
(6) 正极 NO+NO2+3H2O-4e-=6H++2NO
23.(1) Na>Al>O>H NaH
(2)离子键和共价键
(3)Al(OH)3+OH-=AlO+2H2O
(4) 1 H2O2的浓度对分解速率的影响 3 催化剂浓度大时,催化效果较好
一、单选题(共13题)
1.下列关于工业合成氨的说法正确的是
A.工业合成氨采用10~30MPa,是因为该条件下催化剂的活性最好
B.选择不同的催化剂会改变此反应△H的数值
C.合成氨工业中采用低温以提高平衡转化率
D.合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率
2.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
3.时,在含有的某溶液中,加入过量金属锡(),发生反应:,体系中和变化关系如图所示。下列说法不正确的是
A.
B.时,该反应的平衡常数
C.1-2分钟内,用表示的平均速率是
D.往平衡体系中加入后,增大
4.一定温度下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)。反应过程中的部分数据如下表所示:
c/(mol/L) t/min c(N2) c(H2) c(NH3)
0 1.0 3.0 0
3 0.25
6 2.4
9 0.8
下列说法正确的是
A.t=6min时,反应刚好达到平衡状态
B.0~3min内,用N2表示的平均反应速率为0.125mol/(L·min)
C.达到平衡时,容器内的气体分子数N(N2):N(H2):N(NH3)=1:3:2
D.在容器中加入催化剂,会加快化学反应速率
5.下图体现了有无催化剂参与反应过程的能量变化图。下列有关说法正确的是( )
A.使用催化剂能够加快反应的速率,根本上是由于催化剂降低了正逆反应的活化能
B.C(s)+H2O(g)=CO(g)+H2(g),该反应过程可用上图图象表示
C.使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO===2CO2+N2
D.化学反应的本质是旧键的断裂、新键的生成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定
6.下列关于焓与熵的说法正确的是
A.焓与内能无关
B.化学反应的反应热等于反应的焓变
C.焓与物质的聚集状态有关,熵与物质的聚集状态无关
D.孤立体系(与环境没有物质交换和能量交换)的自发过程向着熵增方向进行
7.向某密闭容器中,充入一定量的P 、Q气体,发生反应aP(g) + bQ(g) cR(g) ,平衡时测得Q的物质的量浓度为0.30 mol· L-1。保持温度不变,将容器的容积缩小至原来的一半,反应重新达到平衡后,测得Q的物质的量浓度为0.62 mol· L-1。下列说法正确的是
A.a+b>c
B.重新达到平衡后,P的转化率增大
C.重新达到平衡后,R的体积分数减小
D.该反应的平衡常数表达式为K=
8.已知反应。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.降低温度,K减小 B.充入一定量的氮气,不变
C.更换高效催化剂,的转化率增大 D.减小压强,增加
9.在密闭容器中发生下列反应,反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.C的物质的量浓度减小 B.平衡向正反应方向移动
C.A的体积分数变小 D.
10.在反应中,表示该反应速率最快的是
A. B.
C. D.
11.下列关于化学反应速率的说法正确的是( )
①恒温时,增大压强,化学反应速率一定加快。
②其他条件不变,温度越高,化学反应速率越快。
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量。
④3mol·L﹣1·s﹣1的反应速率一定比1mol·L﹣1·s﹣1的反应速率大。
⑤升高温度能增大反应物分子中活化分子的百分数。
⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多。
⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率。
A.②⑤ B.②⑤⑥ C.②⑤⑧ D.②⑤⑥⑧
12.下列判断正确的是
A.一定温度下,反应能自发进行,该反应的△H<0
B.H2O(g)变成液态水,△S>0
C.反应 △H<0,△S>0
D.凡是放热反应都是自发的,吸热反应都是非自发的
13.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.反应2H2(g)+O2(g)=2H2O(g)的H可通过下列估算:H=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
B.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的H<0
C.氢氧燃料电池的电子运动方向为:负极→导线→正极→内电路→负极,形成闭合回路
D.常温常压下,氢氧燃料电池放电过程中消耗11.2LH2,转移电子的数目为6.02×1023
二、非选择题(共10题)
14.水溶性硝态氮(以NO、NO等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO,产生两种对大气无污染的气体。该反应的离子方程式为___________。
(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是___________。
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是______。
(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为___________、___________。
15.t℃ 时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C平均反应速率为__________。
(2)x=__________;平衡常数K=____________。
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)____。
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
三、实验题
16.I.用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。
(1)在检查装置的气密性后,向试管a中加入10mL6mol/L稀HNO3和lgCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于_________,进行一段时间后速率又逐渐减慢,原因是_________。
(3)欲较快地制得NO,可采取的措施是_________。
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
II.为了探究几种气态氧化物的性质,某同学设计了以下实验:
用三只集气瓶收集满二氧化硫、二氧化氮气体。倒置在水槽中,然后分别缓慢通入适量氧气或氯气,如图所示。一段时间后,A、B装置中集气瓶中充满溶液,C装置中集气瓶里还有气体。
(4)写出C水槽中反应的化学方程式:____________。
(5)写出B水槽里发生氧化还原反应的离子方程式:____________。
(6)如果装置A中通入的氧气恰好使液体充满集气瓶,假设瓶内液体不扩散,气体摩尔体积为aL/mol,集气瓶中溶液的物质的量浓度为________。
17.现用下图所示装置及所给药品探究工业制硫酸时二氧化硫的转化率。已知C中含硫酸nmol,设气体进入C和D时能分别完全吸收某一种气体,且忽略装置内空气中的CO2。
请回答下列问题:
(1)检查完装置的气密性且加入药品后,开始进行时首先应进行的操作是_______。
(2)通过观察中气泡的逸出速率可控制SO2和O2的流量和体积比,A装置还起的作用有_______。
(3)为了提高测定SO2转化率的准确度,下列操作或改进可行的是(填序号)_______。
①熄灭酒精灯后,停止通入SO2,继续通入O2一段时间
②熄灭酒精灯后,停止通入O2,继续通入SO2一段时间
③在C、D之间加装一个盛有浓硫酸的洗气瓶
(4)若气体经过充分,实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则二氧化硫的转化率是:_______(用含字母的代数式表示,结果可不化简)。
(5)若向接触室中通入2 molSO2(g)和1molO2(g),在一定温度下,反应达到平衡时测得接触室内的压强为起始时的0.75倍,则SO2的转化率为_______;相同条件下,当起始时同时通入a mol SO2、b mol O2、c mol SO3(g)时,达到平衡时与原平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围为_______。
四、计算题
18.某温度下,在容积为2L的密闭容器中充入5mol气体A和3mol气体B,发生反应:3A(g)+B(g)2C(g)+2D(g),5分钟后反应达到平衡状态,测得生成2molD,计算以下量(写出计算过程):
(1)计算A的转化率。
(2)计算该温度下该反应的化学平衡常数。
19.在一个盛有催化剂、容积可变的密闭容器中,保持一定温度和压强,进行以下反应:3H2(g)+N2(g) 2NH3(g)。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表已知项)。在相同温度、压强下,保持平衡时各组分的体积分数不变。对下列编号(1)~(3)的状态,填写表中①②③④⑤的内容。
已知 编号 起始状态各物质的物质的量(mol) 平衡时NH3的物质的量(mol)
N2 H2 NH3
1 4 0 a
(1) 1.5 6 0 ①___
(2) ②__ ③___ 1 0.5a
(3) c b(b≥4c) ④___ ⑤___
20.2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol,反应Ⅰ的平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)
21.已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是__________,F的电子式是_____________。
(2)写出反应①的离子方程式:___________;
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是__________(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。其中:CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的化学方程式:______________________。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8molK和1.1molB放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4mol/L,此时反应v正_____v逆(填“>”、“<”或“=”)。当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度__________(填“增大”、“不变”或“减小”),B的转化率_________。(填“升高”、“不变”或“降低”),L的体积分数___________(填“增大”、“不变”、“减小”或“无法确定”)。
22.(A、B、C、D、E、F是原子序数依次增大的短周期主族元素,B、C相邻且与其他元素不位于同一周期,D、E、B、C、F的主族族序数依次增大,且这五种元素的族序数之和为22。
(1)E在元素周期表中的位置是______。
(2)C与D形成的含有两种化学键的化合物的电子式为______。
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为______。
(4)A2C2和FC2是市场上较好的消毒剂,等质量的A2C2和FC2分别与足量的二氧化硫反应时,消耗二氧化硫的质量之比为______。
(5)500℃下,向一容积为8L的恒容密闭容器中充人物质的量均为2mol的A单质和B单质,发生化合反应,0.5min后达到平衡,测得容器中平衡时的压强为起始时的80%,则用B单质表示该过程中的化学反应速率为______;A单质的平衡转化率为______。
(6)利用如图所示装置,可将B、C形成的常见污染气体转化为化工原料X,同时获得电能总反应方程式中只含A、B、C三种元素。
①电极Ⅱ的名称是______(填“正极”或“负极”)。
②电极Ⅰ上的电极反应式为______。
23.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z位于同一主族且二者均可与Y元素形成两种常见的化合物,W原子的最外层电子数比次外层电数少5个。
(1)几种元素的原子半径由大到小的顺序是_______(用元素符号表示),X与Z可形成一种稳定的化合物,用电子式表示该化合物的形成过程_______。
(2)由X、Y、Z三种原子组成的物质含有化学键类型为_______。
(3)写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式为_______。
(4)在催化下可发生分解反应,为探究一定温度下溶液的浓度、的浓度对分解速率的影响情况,某同学设计了如下实验,内容见下表:
实验序号 实验所用试剂
酸性溶液 溶液
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
Ⅰ 4 0.1 3 2 3
Ⅱ 4 0.1 2 2
Ⅲ 5 0.1 2 2
①_______。
②实验Ⅰ、Ⅱ的探究目的是_______。
③实验Ⅰ、Ⅲ探究催化剂浓度对分解速率的影响,则_______,若实验Ⅲ中产生气泡的速率较快,由此可得出的结论是_______。
参考答案:
1.D 2.B 3.D 4.D 5.A 6.D 7.C 8.B 9.D 10.A 11.A 12.A 13.B
14.(1)5C6H12O6+24NO+24H+ 12N2↑+30CO2↑+42H2O.
(2) 纳米铁铜双金属的比表面积大,能吸附废水中更多的硝态氮;纳米铁铜双金属颗粒更小,表面的反应活性点更多(或还原性更强);纳米铁铜双金属能形成更多的微小原电池,短时间内反应速率更快 向两支试管中分别加入等体积硝态氮废水,同时通入相同时间的足量的空气和氮气;停止通气后,向两支试管中加入等量的纳米铁铜双金属,相同时间后,测定两份废水中硝态氮的含量,比较有氧和无氧环境中的脱氮率
(3) 在NR酶的作用下,NO在酸性介质中(结合H+)得电子生成NH2OH(和H2O)(或NO+5H++4e-=NH2OH+H2O) 在HH酶的作用下,NH2OH和NH3转化为N2H4(和H2O)(或NH2OH+NH3=N2H4+H2O)
15. 0.2mol/L min 4 C
16.(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2) 反应放热,使温度升高,反应速率加快 反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢
(3)AB
(4)2SO2+O2+2H2O=2H2SO4
(5)Cl2+SO2+2H2O=2Cl-+SO+4H+
(6)mol·L-1
17.(1)点燃B处的酒精灯,给催化剂加热
(2)干燥气体,使SO2和O2均匀混合
(3)①③
(4)
(5) 75% 1.5<c<2
18.60%;1
19. 1.5a 0 0.5 2(b-4c) (b-3c)a
20.0.02MPa
21.(1) 第二周期第ⅥA族
(2)NH+OH-NH3↑+H2O
(3)NO+2HNO3(浓)═3NO2+H2O
(4)2CuNH4(OH)CrO42CuO Cr2O3+N2↑+5H2O
(5) > 增大 降低 无法确定
22.(1)第三周期第ⅢA族
(2)
(3)Al(OH)3+3H+=Al3++3H2O
(4)27:34
(5) 0.1mol·L-1·min-1 60%
(6) 正极 NO+NO2+3H2O-4e-=6H++2NO
23.(1) Na>Al>O>H NaH
(2)离子键和共价键
(3)Al(OH)3+OH-=AlO+2H2O
(4) 1 H2O2的浓度对分解速率的影响 3 催化剂浓度大时,催化效果较好
