专题2 化学反应速率与化学平衡 单元检测题(含解析) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题2 化学反应速率与化学平衡 单元检测题(含解析) 2022-2023学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 609.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 20:54:10 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》单元检测题
一、单选题
1.在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(s),所得实验数据如下表,下列说法不正确的是
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(X) n(Y) n(M) n(N)
① 800 0.10 0.40 0.080 0.080
② 800 0.20 0.80 a a
③ 900 0.10 0.15 0.06 0.06
A.正反应为放热反应
B.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C.实验②中,该反应的平衡常数K=12.5
D.实验②中,达到平衡时,a大于0.16
2.将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+O2(g)2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
A.容器中混合气体的密度保持不变 B.每消耗1molO2的同时生成1molSO3
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等
3.下列不能用勒夏特列原理解释的是
A.打开汽水瓶时,瓶中立即泛起大量泡沫
B.新制氯水久置后变为无色透明溶液
C.对平衡混和气体加压后颜色变深
D.实验室中用排饱和食盐水的方法收集氯气
4.一定条件下,在密闭容器中,进行反应2CO(g)+SO2(g) 2CO2(g)+S(s) △H<0,可以同时提高反应速率与CO转化率的措施是
A.缩小容积增大压强 B.分离出CO2
C.再充入一定量的CO D.升高温度
5.工业上合成氨的反应为:。一定条件下,物质的量之比为1:3的和在恒容密闭容器中反应,下图曲线a表示该反应在温度T下的浓度c随时间t的变化,曲线b表示该反应在某一起始反应条件改变时的浓度c随时间t的变化。下列叙述不正确的是
A.温度T下,在时间内,
B.温度T下,该反应的平衡常数
C.M点的大于N点的
D.曲线b先达到平衡,表明反应速率比较快,可能是使用了更高效的催化剂
6.已知 kJ mol。不同条件下反应过程的能量变化如图,下列说法正确的是
A.
B.改变催化剂不仅改变了反应过程也改变了反应的焓变
C.催化剂Y的效果比催化剂X的更好
D.无催化剂时,断开反应物中所有化学键需要吸收能量kJ
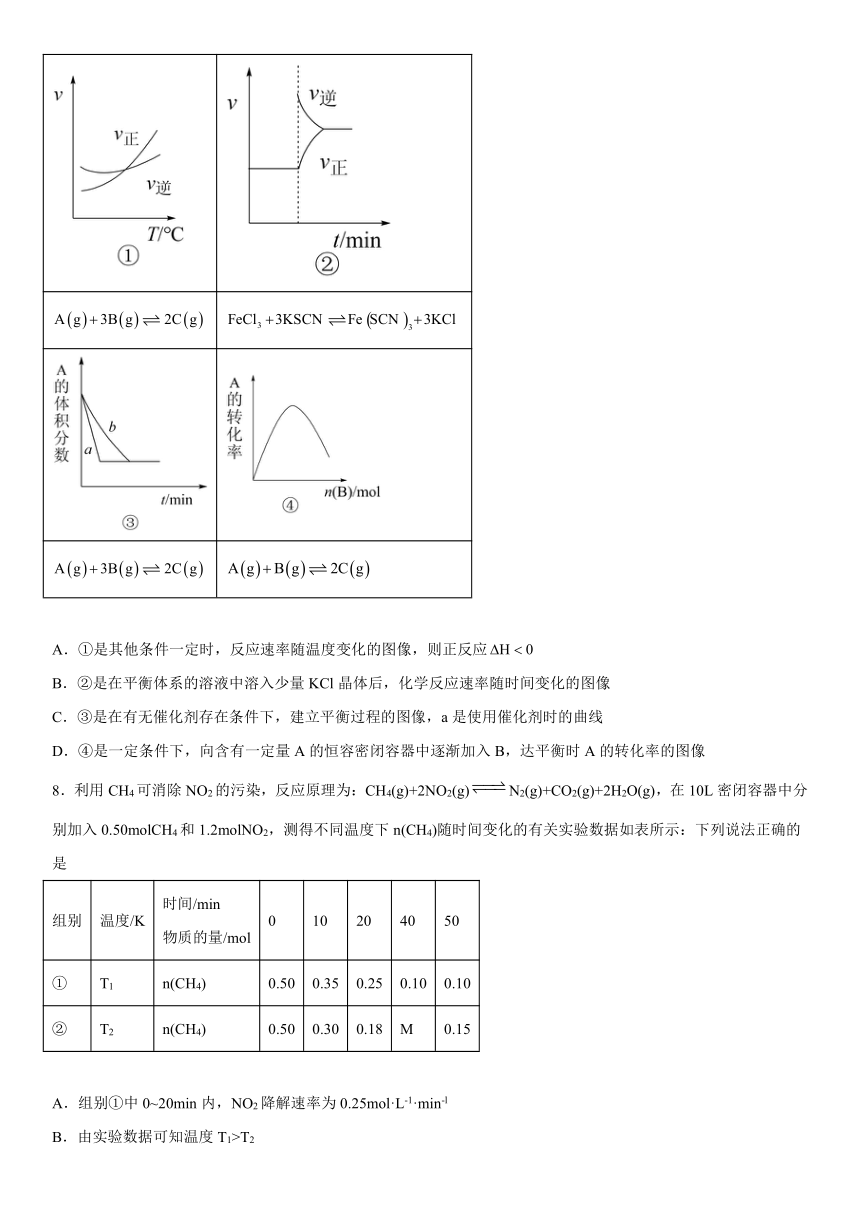
7.下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
A.①是其他条件一定时,反应速率随温度变化的图像,则正反应
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
8.利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:下列说法正确的是
组别 温度/K 时间/min 物质的量/mol 0 10 20 40 50
① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10
② T2 n(CH4) 0.50 0.30 0.18 M 0.15
A.组别①中0~20min内,NO2降解速率为0.25mol·L-1·min-l
B.由实验数据可知温度T1>T2
C.40min时,表格中M对应的数据为0.15
D.组别②中,20min时,CO2的浓度为0.32mol·L-1
9.镁是组成航空航天材料的重要元素,可由碳真空热还原MgO制得,主要反应为。下列说法错误的是
A.该反应的平衡常数
B.将容器体积压缩为原来的一半,当体系再次达到平衡时,CO的浓度增大
C.一定温度下,减小CO浓度,平衡正向移动,平衡常数不变
D.如图,当温度升高时,该反应的化学平衡常数K增大
10.某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如右图所示,对图中曲线的描述正确的是
A.OA段表示开始时,反应速率稍慢
B.AB段表示反应速率较快,一定因为产物有催化作用
C.BC段表示随时间增加,反应速率逐渐增大
D.BC段表示反应速率最快,在该时间段内收集到的气体最多
11.下列说法中正确的是
A.ΔH<0的反应均是自发进行的反应
B.能够自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,这是熵增的过程
D.能够自发进行的反应一定是熵增的过程
12.下列反应达到平衡后,升高温度和增大压强,平衡移动方向一致的是
A.C(s)+CO2(g )2CO(g) H>0 B.O2(g)+2SO2(g)2SO3(g) H<0
C.H2(g)+I2(g)2HI(g) H<0 D.Cl2(g) +H2O(l)HCl(aq)+HClO(aq) H>0
13.下列说法不正确的是
A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B.反应NH4HCO3(s)NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ mol-1能自发进行,原因是体系有自发向混乱度增加的方向进行的倾向
C.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应速率
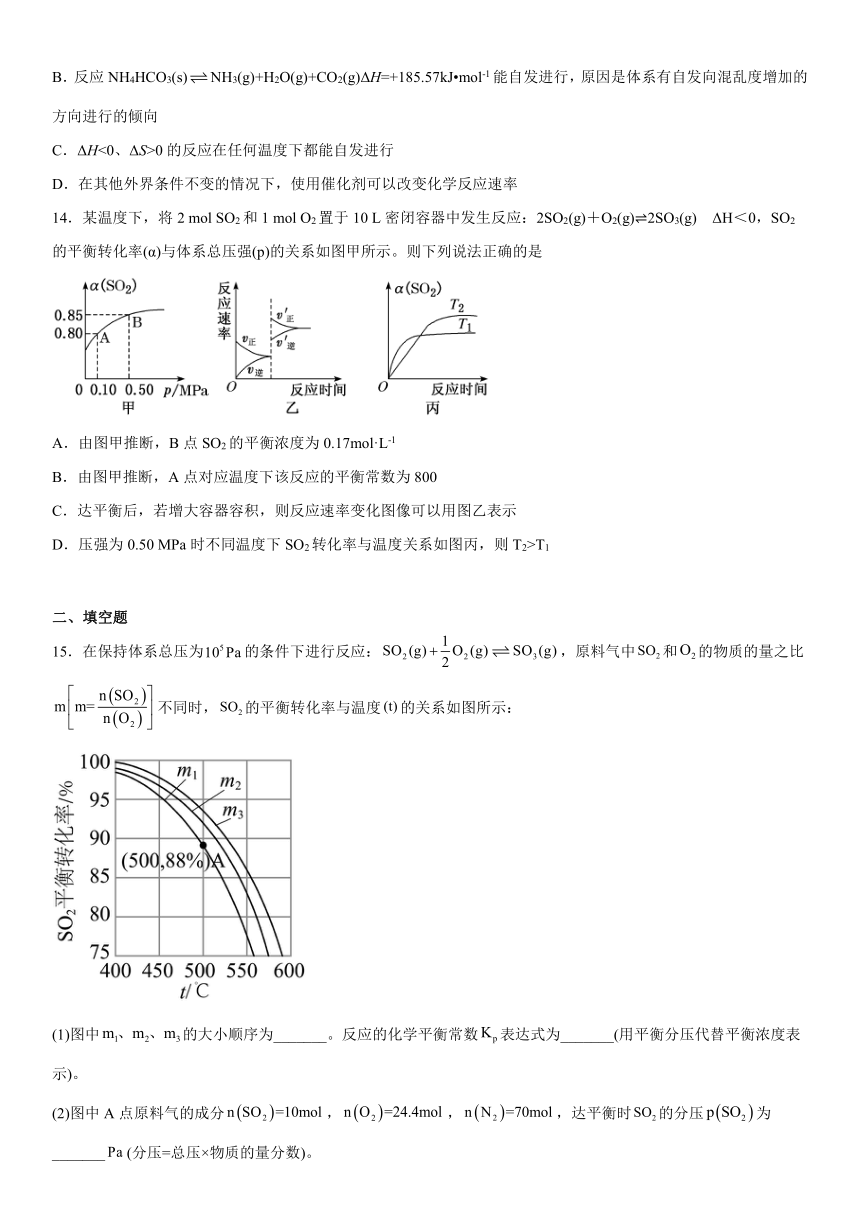
14.某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
A.由图甲推断,B点SO2的平衡浓度为0.17mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800
C.达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图丙,则T2>T1
二、填空题
15.在保持体系总压为的条件下进行反应:,原料气中和的物质的量之比不同时,的平衡转化率与温度的关系如图所示:
(1)图中的大小顺序为_______。反应的化学平衡常数表达式为_______(用平衡分压代替平衡浓度表示)。
(2)图中A点原料气的成分,,,达平衡时的分压为_______(分压=总压×物质的量分数)。
16.某小组设计实验研究单一组分浓度对化学平衡2Fe3++2I-2Fe2++I2的影响。
实验1 实验步骤 实验现象
i.取2 mL1 mol L﹣1KI溶液,滴加0.1 mol L-1FeCl3溶液2 mL。 i.溶液呈棕黄色。
ii.待试管中溶液的颜色不变后向其中滴加2滴0.1 mol L-1KSCN溶液。 ii.溶液不显红色。
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是___________。
②加入KSCN溶液的目的是___________。
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
实验2 实验现象 实验步骤
i.取2 mL0.1 mol L﹣1KI溶液于试管a中,滴加0.1 mol L-1FeCl3溶液2mL i.溶液呈棕黄色
ii.待试管中溶液的颜色不变后,取少量试管a中溶液于试管b中,滴加2滴0.1 mol L-1KSCN溶液。 ii.溶液显红色
本实验改用0.1 mol L-1KI溶液的目的是___________。
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q___________K(填“>”或“<”),平衡向___________(填“正反应”或“逆反应”)方向移动。
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:
①请在图中将方案补充完整___________。
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为___________。
17.对于可逆反应2A( )+B(g)2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是_________(填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____;
(3)v(a)、v(b)、v(c)按由大到小排序_________________;
(4)对于2SO2(g)+O2(g)2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________(填“会”或“不会”)。
18.计算模型(三段式法)
mA(g)+nB(g) pC(g)+qD(g)
初始量 a b 0 0
变化量 mx nx px qx
平衡量 ___ ___ __ __
19.在一定温度下,密闭容器中发生反应:2NO22NO+O2,经2 min后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度__________。
(2)2 min时NO2的转化率_________。
(3)2 min内生成NO的化学反应速率_________。
20.用CO2制备甲醇的反应原理为:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
回答下列问题:
(1)反应I的化学方程式是____。
(2)由图可知,反应____(填“I”或“II”)为慢反应。
(3)反应II:CO(g)+2H2(g)CH3OH(g) △H____0(填“>”“<”或“=”)。
(4)在容积可变的密闭容器中投入0.5molCO和1molH2,发生反应:CO(g)+2H2(g)CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
①P总1____P总2(填“>”“<”或“=”),判断理由是____。
②若P总1=0.25MPa,则500K时该反应的平衡常数Kp=____MPa-2。
21.500 ℃时,向容积为2 L的密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,容器内的压强随时间的变化如下表所示:
时间/min 0 10 20 30 40 +∞
压强/MPa 20 17 15 13.2 11 11
(1)达到平衡时N2的转化率为___________
(2)用压强表示该反应的平衡常数Kp=___________(Kp等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数)
22.反应aA(g)+bB(g)cC(g)( H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)B的平衡转化率中最小的是_____,其值是_______;
(3)由第一次平衡到第二次平衡,平衡移动的方向是____,采取的措施是___;
(4)比较第II阶段反应温度()和第III阶段反应速度()的高低:__(填“>、=、<”)判断的理由是_______。
试卷第1页,共3页
参考答案:
1.A
【详解】A.由实验①③数据可知,升高温度,平衡时M和N的物质的量增大,说明平衡向正反应方向移动,该反应为吸热反应,故A错误;
B.由表格数据可知,实验①中,5min达平衡时,X的反应速率为=0.016 mol/(L·min),故B正确;
C.平衡常数为温度函数,温度不变,平衡常数不变,由实验①②数据可知,①和②反应温度相同,所以化学平衡常数相等,实验①中M平衡时的物质的量为0.08 mol,则平衡时X、Y、M的浓度为0.02mol/L、0.32 mol/L、0.08 mol/L,平衡常数为=12.5,故C正确;
D.由实验①②数据可知,实验①②温度相同、体积相同,实验②可以视作①增大压强,若平衡不移动,a为0.16,该反应是气体体积减小的反应,压强增大,平衡向正反应方向移动,M的物质的量增大,所以a大于0.16,故D正确;
故选项A。
2.C
【详解】A.混合气体的质量不变,容器的体积不变,所以密度始终不变,密度不能作为判断平衡状态的标志,故A不符题意;
B.消耗O2表示正反应速率,生成SO3也表示正反应速率,都表示V(正),所以不能作为判断平衡状态的标志,故B不符题意;
C.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,压强能作为判断平衡状态的标志,故C符合题意;
D.SO3的生成速率与SO2的消耗速率都表示正反应速率,不能作为判断平衡状态的标志,故D不符题意;
故选C。
3.C
【详解】A.汽水瓶中存在碳酸的分解反应,打开汽水瓶,压强减小,平衡正向移动,故瓶中立即泛起大量气泡,可用勒夏特列原理解释,A相符;
B.氯气溶于水的反应是可逆反应,而产物次氯酸因不稳定久置易分解,使得平衡正向移动,氯水中的Cl2含量减少,可用勒夏特列原理解释,B相符;
C.平衡,反应前后的化学计量数不变,故平衡移动不受压强影响,不能用勒夏特列原理解释,C不相符;
D.氯气溶于水的反应是可逆反应,氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的离子,使平衡逆向移动,可用勒夏特列原理解释,D相符;
故选C。
4.A
【详解】A.该反应是一个反应前后气体体积减小的反应,缩小容积增大压强浓度增大,反应速率增大,平衡正向移动,CO转化率增大,故A正确;
B.分离出CO2生成物浓度减小,反应速率减小,平衡正向移动,CO转化率增大,故B错误;
C.充入一定量的CO反应物浓度增大,反应速率增大,由于反应物CO不能完全转化,则CO转化率减小,故C错误;
D.该反应的正反应是放热反应,升高温度反应速率增大,但平衡向逆反应方向移动,抑制了CO的转化,所以CO的转化率降低,故D错误;
故选:A。
5.D
【详解】A.由图可知,温度T下时,氮气浓度的变化量为(c0—c1)mol/L,则氮气的反应速率,故A正确;
B.由图可知,温度T下时,反应达到平衡,氮气浓度的变化量为(c0—c1)mol/L,则平衡时氮气、氢气和氨气的浓度分别为c1mol/L、3c0mol/L—3(c0—c1)mol/L=3c1mol/L和2(c0—c1)mol/L,反应的平衡常数K==,故B正确;
C.由图可知,M点和N点均未达到平衡,由平衡形成过程中,正反应速率增大、逆反应速率减小,正反应速率大于逆反应速率可知,M点正反应速率大于N点逆反应速率,故C正确;
D.催化剂能降低反应活化能,加快反应速率,但化学平衡不移动,由图可知,平衡时曲线b氮气的浓度小于a点,说明条件改变一定不是使用了更高效的催化剂,故D错误;
故选D。
6.C
【详解】A.焓变等于生成物总能量减去反应物总能量,因此,故A错误;
B.改变催化剂能改变了反应过程,但不能改变了反应的焓变,故B错误;
C.根据图中信息得到催化剂Y的活化能更低,其效果比催化剂X的更好,故C正确;
D.无催化剂时,断开反应物中所有化学键需要吸收能量kJ,故D错误。
综上所述,答案为C。
7.C
【详解】A.图像①,正逆反应相等,升高温度,正反应速率大于逆反应速率,平衡正向移动,则正反应ΔH>0,A错误;
B.②反应实质是Fe3++3SCN-Fe(SCN)3,K+和Cl-不参加化学反应,KCl浓度增大不影响化学反应速率与平衡,平衡不移动,B错误;
C.③使用催化剂,反应速率加快,先达到平衡,但不改变平衡时A的体积分数,C正确;
D.④不断加入B,A的转化率不断增大,与图不符,D错误;
答案为C。
8.C
【详解】A.0~20min内, n(CH4)=0.50mol-0.25mol=0.25mol,则CH4的消耗速率为v(CH4)==1.25×10-3mol/(L·min),由化学反应速率之比等于化学计量数之比,可知NO2降解速率为2v(CH4)=2.5×10-3mol/(L·min),A错误;
B.温度升高,化学反应速率增大,相同时间段内消耗的CH4量增大,根据表中数据,0~10min内,T2温度下消耗CH4的量大于T1温度下CH4消耗的量,所以温度T1<T2,B错误;
C.根据B选项可知T1<T2,温度越高反应速率越快,所以第二组反应达到平衡所用时间更短,根据表格数据可知40min时第一组已到达平衡,则第二组一定也已经平衡,所以40min时甲烷的物质的量应和50min时相等,为0.15mol,C正确;
D.组别②中,20min时, n(CH4)=0.50mol-0.18mol=0.32mol,根据方程式可知相同时段内 n(CO2)=0.32mol,容器体积为10L,所以浓度为=0.032mol/L,D错误;
综上所述答案为C。
9.B
【详解】A.该反应中只有CO是气体,则该反应的平衡常数 K=c(CO),A正确;
B.温度不变,则平衡常数 K=c(CO)不变,因此当体系再次达到平衡时,CO的浓度不变,B错误;
C.减小CO浓度,平衡正向移动,温度不变,平衡常数不变,C正确;
D.从图像知,该反应为吸热反应,则升高温度,平衡正向移动,该反应的化学平衡常数K增大,D正确;
故选B。
10.A
【详解】A.OA段表示开始时,由图像可知曲线斜率不大,反应速率稍慢,A正确;
B.该反应为放热反应,AB段表示反应速率较快,可能温度有关,B错误;
C.由图像知BC段曲线的斜率逐渐减小,反应速率逐渐减小,C错误;
D.由图像可知AB段曲线斜率最大表示反应速率最快,向纵坐标作辅助线可知在该时间段内收集到的气体最多,D错误。
答案选A。
11.C
【详解】A.反应自发进行,由可以知道,时,若,则可能大于0,反应非自发,故A错误;
B.反应自发进行,能否发生还有反应速率问题,故B错误;
C.反应向熵值增大的方向进行,同种物质熵值:液体>固体,冰在室温下自动熔化成水,是熵增的重要结果,故C正确;
D.能够自发进行的反应一定是,故D错误;
故答案为C。
12.D
【详解】A.对于反应C(s)+CO2(g )2CO(g) H>0,升高温度,平衡正向移动,增大压强,平衡逆向移动,A不符合题意;
B.对于反应O2(g)+2SO2(g)2SO3(g) H<0,升高温度,平衡逆向移动,增大压强,平衡正向移动,B不符合题意;
C.对于反应H2(g)+I2(g)2HI(g) H<0,升高温度,平衡逆向移动,增大压强,平衡不发生移动,C不符合题意;
D.对于反应Cl2(g) +H2O(l)HCl(aq)+HClO(aq) H>0,升高温度,平衡正向移动,增大压强,平衡正向移动,D符合题意;
故选D。
13.A
【详解】A.化学反应的焓变和熵变共同决定反应方向,A项错误;
B.该反应的焓变大于0、熵变大于0,根据△G=△H-T△S<0能自发进行可判断,自发进行的原因是体系有自发地向混乱度增大的方向转变的倾向,B项正确;
C.根据△G=△H-T△S<0能自发进行可判断,ΔH<0、ΔS>0的反应在任何温度下都能自发进行,C项正确;
D.在其他外界条件不变的情况下,使用催化剂可以改变反应活化能从而改变化学反应速率,D项正确;
答案选A。
14.B
【详解】A.由图甲推断,B点SO2物质的量为,即浓度为,A错误;
B.根据A点分析,达到平衡c(SO2)=0.04mol/L,c(O2)=0.02 mol/L,c(SO3)=0.16 mol/L,A点对应温度下的平衡常数为,B正确;
C.达平衡后若增大容器容积,即减小压强,平衡向着逆反应方向移动且正逆反应速率都应减小,C错误;
D.压强相同,温度高速率快,即温度高的先达到平衡,由图中信息知T1先达到平衡,即T2故选B。
15.(1)
(2)1200
【详解】(1)在同温同压下,增加二氧化硫的量,会使原料气中和的物质的量之比m变大,m越大,平衡转化率越小,则。反应的化学平衡常数表达式为,故答案为:;;
(2)总压为,根据题给信息,A点是500℃,二氧化硫的平衡转化率为,n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,可进行如下计算:
平衡时,混合气体总量为1.2mol+20mol+8.8mol+70mol=100mol,达平衡时的分压,故答案为:1200。
16.(1) 其中的KI与FeCl3充分反应 检验溶液中是否大量存在Fe3+
(2)提高平衡时溶液中的c(Fe3+)
(3) < 正反应
(4) 加入1 mL蒸馏水 溶液颜色变浅
【详解】(1)①KI与FeCl3在溶液中会发生化学反应:2Fe3++2I- 2Fe2++I2,该反应为可逆反应,待试管中溶液的颜色不变后再进行后续实验,其目的是使其中的KI与FeCl3充分反应;
②由于Fe3+与SCN-会发生反应产生Fe(SCN)3,使溶液显红色,所以向反应后的溶液中加入KSCN溶液的目的是检验溶液中是否大量存在Fe3+;
(2)FeCl3溶液与KI溶液的反应为可逆反应,c(I-)降低,平衡向左移动,c(Fe3+)增大,进而可验证甲同学的想法,故本实验改用0.1 mol L-1KI溶液的目的是为提高平衡时溶液中的c(Fe3+);
(3)取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q减小,最终使得Q<K,化学平衡向正反应方向移动;
(4)①实验II是研究增大生成物Fe2+浓度对平衡的影响,则应保证除了Fe2+之外的其它离子浓度不变,则试管c中要加入1 mL蒸馏水;
②增大生成物Fe2+浓度,平衡逆向移动,c(I2)降低,溶液颜色变浅。
17. 气体 a v(b)>v(a)>v(c) 将便宜原料的用量加大,提高贵重原料利用率 不会
【分析】(1)根据图中信息可以知道,增大压强则C的含量增加,所以可以判断A为气体,可以据此解答该题;
(2)分析图中的各点可以知道a点处于曲线上方,所以可以判断此时C的浓度过大,所以应该向逆反应的方向移动,可以据此解答该题;
(3)根据图中信息可以知道b点C的浓度最大,其次是a,浓度最小的为c,所以达到平衡后体积最大为b点,最小为c点,可以据此解答该题;
(4)增大二氧化硫在混合气体中的比率能够增加二氧化硫的转化率,而抽出气体后容积不变,则二氧化硫和氧气受到的分压强不变,平衡不移动,可以据此解答该题。
【详解】(1)若增大平衡体系的压强,平衡移动的结果应使体系的压强减小,即平衡向气体体积减小方向移动,从图中信息可以知道,压强增大,C的含量增加,所以可以判断A为气体;
故答案为:气体;
(2)分析图中的各点可以知道a点处于曲线上方,所以可以判断此时C的浓度过大,所以应该向逆反应的方向移动;
故答案为:a;
(3)根据图中信息可以知道b点C的浓度最大其次是a,浓度最小的为c,所以达到平衡后体积最大为b点,最小为c点,故v(b)>v(a)>v(c);
故答案为:v(b)>v(a)>v(c);
(4)增大二氧化硫在混合气体中的比率能够增加二氧化硫的转化率,而抽出气体后容积不变,则二氧化硫和氧气受到的分压强不变,平衡不移动。
故答案为:将便宜原料的用量加大,提高贵重原料利用率;不会。
18. a-mx b-nx px qx
【解析】略
19.(1)0.3 mol·L-1
(2)80%
(3)0.12 mol·L-1·min-1
【分析】设NO2初始浓度为a,生成O2的浓度为x,列出三段式如下:
2NO22NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
由题意得:a-2x = 0.06mol/L,x = 0.12 mol/L,则a=0.3mol/L。据此解答。
【详解】(1)根据分析可知NO2的起始浓度为0.3mol/L。
故答案为:0.3mol/L
(2)2min时NO2的转化率:α(NO2)=×100%=×100%=80%。
故答案为:80%
(3)2min内v(NO)= = = 0.12mol/(L·min)
故答案为:0.12mol/(L·min)
20.(1)H2+CO2=CO+H2O
(2)I
(3)<
(4) > 该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大 64
【解析】(1)
由图可知反应I的化学方程式是H2+CO2=CO+H2O;
(2)
反应I的正反应活化能比反应II的大,由活化能越大反应速率越慢,则反应I为慢反应;
(3)
反应II:CO(g)+2H2(g)CH3OH(g)的反应物能量比生成物能量高,为放热反应,则△H<0;
(4)
①对于反应CO(g)+2H2(g)CH3OH(g),该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大,由图象可知P总1>P总2;
②若P总1=0.25MPa,平衡时CH3OH的物质的量为0.25mol,则,平衡时总物质的量为0.25+0. 5+0.25=1,则500K时该反应的平衡常数。
21.(1)90%
(2)48 MPa-2
【分析】假设到平衡时氮气转化的物质的量为xmol,则有
根据压强比等于物质的量比可知,
=,解之得x=0.9。
【详解】(1)达到平衡时N2的转化率为×100%=90%;
(2)用压强表示该反应的平衡常数
Kp==48 MPa-2。
22. 1:3:2 aIII(B) 19% 正方向移动 从反应体系中移出产物C > 此反应为放热反应,降低温度,平衡向正反应方向移动
【详解】(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2;综上所述,本题正确答案:1:3:2;
(2)aI(B)=3mol/L/6mol/L×100%=50% ;aII(B)=(3-1.86)mol/L /3 mol/L×100%=38%;aIII(B)=(1.86-1.5)mol/L/1.86 mol/L =19%;所以B的平衡转化率aI(B)、aII(B)、aIII(B) 中最小的是aIII(B),其值是19%;
综上所述,本题正确答案:aIII(B),19%。
(3) 由浓度曲线变化可知,由第一次平衡到第二次平衡,AB 的浓度减小,C的浓度增大,平衡正向移动;由于C的浓度由2.0mol/L变为0,所以采取的措施是分离出产物C;
综上所述,本题正确答案:正方向移动,从反应体系中移出产物C。
(4)第II阶段的到第III阶段时,AB的浓度均减小,C的浓度增大,平衡正向移动,由于
I、II、III阶段容器容积不变,且反应的 H<0,故应是降低了反应温度,则有T2> T3。
综上所述,本题正确的是:>,此反应为放热反应,降低温度,平衡向正反应方向移动
一、单选题
1.在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(s),所得实验数据如下表,下列说法不正确的是
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(X) n(Y) n(M) n(N)
① 800 0.10 0.40 0.080 0.080
② 800 0.20 0.80 a a
③ 900 0.10 0.15 0.06 0.06
A.正反应为放热反应
B.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C.实验②中,该反应的平衡常数K=12.5
D.实验②中,达到平衡时,a大于0.16
2.将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+O2(g)2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
A.容器中混合气体的密度保持不变 B.每消耗1molO2的同时生成1molSO3
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等
3.下列不能用勒夏特列原理解释的是
A.打开汽水瓶时,瓶中立即泛起大量泡沫
B.新制氯水久置后变为无色透明溶液
C.对平衡混和气体加压后颜色变深
D.实验室中用排饱和食盐水的方法收集氯气
4.一定条件下,在密闭容器中,进行反应2CO(g)+SO2(g) 2CO2(g)+S(s) △H<0,可以同时提高反应速率与CO转化率的措施是
A.缩小容积增大压强 B.分离出CO2
C.再充入一定量的CO D.升高温度
5.工业上合成氨的反应为:。一定条件下,物质的量之比为1:3的和在恒容密闭容器中反应,下图曲线a表示该反应在温度T下的浓度c随时间t的变化,曲线b表示该反应在某一起始反应条件改变时的浓度c随时间t的变化。下列叙述不正确的是
A.温度T下,在时间内,
B.温度T下,该反应的平衡常数
C.M点的大于N点的
D.曲线b先达到平衡,表明反应速率比较快,可能是使用了更高效的催化剂
6.已知 kJ mol。不同条件下反应过程的能量变化如图,下列说法正确的是
A.
B.改变催化剂不仅改变了反应过程也改变了反应的焓变
C.催化剂Y的效果比催化剂X的更好
D.无催化剂时,断开反应物中所有化学键需要吸收能量kJ
7.下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
A.①是其他条件一定时,反应速率随温度变化的图像,则正反应
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
8.利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:下列说法正确的是
组别 温度/K 时间/min 物质的量/mol 0 10 20 40 50
① T1 n(CH4) 0.50 0.35 0.25 0.10 0.10
② T2 n(CH4) 0.50 0.30 0.18 M 0.15
A.组别①中0~20min内,NO2降解速率为0.25mol·L-1·min-l
B.由实验数据可知温度T1>T2
C.40min时,表格中M对应的数据为0.15
D.组别②中,20min时,CO2的浓度为0.32mol·L-1
9.镁是组成航空航天材料的重要元素,可由碳真空热还原MgO制得,主要反应为。下列说法错误的是
A.该反应的平衡常数
B.将容器体积压缩为原来的一半,当体系再次达到平衡时,CO的浓度增大
C.一定温度下,减小CO浓度,平衡正向移动,平衡常数不变
D.如图,当温度升高时,该反应的化学平衡常数K增大
10.某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如右图所示,对图中曲线的描述正确的是
A.OA段表示开始时,反应速率稍慢
B.AB段表示反应速率较快,一定因为产物有催化作用
C.BC段表示随时间增加,反应速率逐渐增大
D.BC段表示反应速率最快,在该时间段内收集到的气体最多
11.下列说法中正确的是
A.ΔH<0的反应均是自发进行的反应
B.能够自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,这是熵增的过程
D.能够自发进行的反应一定是熵增的过程
12.下列反应达到平衡后,升高温度和增大压强,平衡移动方向一致的是
A.C(s)+CO2(g )2CO(g) H>0 B.O2(g)+2SO2(g)2SO3(g) H<0
C.H2(g)+I2(g)2HI(g) H<0 D.Cl2(g) +H2O(l)HCl(aq)+HClO(aq) H>0
13.下列说法不正确的是
A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B.反应NH4HCO3(s)NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ mol-1能自发进行,原因是体系有自发向混乱度增加的方向进行的倾向
C.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应速率
14.某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
A.由图甲推断,B点SO2的平衡浓度为0.17mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800
C.达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图丙,则T2>T1
二、填空题
15.在保持体系总压为的条件下进行反应:,原料气中和的物质的量之比不同时,的平衡转化率与温度的关系如图所示:
(1)图中的大小顺序为_______。反应的化学平衡常数表达式为_______(用平衡分压代替平衡浓度表示)。
(2)图中A点原料气的成分,,,达平衡时的分压为_______(分压=总压×物质的量分数)。
16.某小组设计实验研究单一组分浓度对化学平衡2Fe3++2I-2Fe2++I2的影响。
实验1 实验步骤 实验现象
i.取2 mL1 mol L﹣1KI溶液,滴加0.1 mol L-1FeCl3溶液2 mL。 i.溶液呈棕黄色。
ii.待试管中溶液的颜色不变后向其中滴加2滴0.1 mol L-1KSCN溶液。 ii.溶液不显红色。
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是___________。
②加入KSCN溶液的目的是___________。
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
实验2 实验现象 实验步骤
i.取2 mL0.1 mol L﹣1KI溶液于试管a中,滴加0.1 mol L-1FeCl3溶液2mL i.溶液呈棕黄色
ii.待试管中溶液的颜色不变后,取少量试管a中溶液于试管b中,滴加2滴0.1 mol L-1KSCN溶液。 ii.溶液显红色
本实验改用0.1 mol L-1KI溶液的目的是___________。
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q___________K(填“>”或“<”),平衡向___________(填“正反应”或“逆反应”)方向移动。
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:
①请在图中将方案补充完整___________。
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为___________。
17.对于可逆反应2A( )+B(g)2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是_________(填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____;
(3)v(a)、v(b)、v(c)按由大到小排序_________________;
(4)对于2SO2(g)+O2(g)2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________(填“会”或“不会”)。
18.计算模型(三段式法)
mA(g)+nB(g) pC(g)+qD(g)
初始量 a b 0 0
变化量 mx nx px qx
平衡量 ___ ___ __ __
19.在一定温度下,密闭容器中发生反应:2NO22NO+O2,经2 min后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化。
求:
(1)NO2的起始浓度__________。
(2)2 min时NO2的转化率_________。
(3)2 min内生成NO的化学反应速率_________。
20.用CO2制备甲醇的反应原理为:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应进程可通过如图所示的两步反应实现。
回答下列问题:
(1)反应I的化学方程式是____。
(2)由图可知,反应____(填“I”或“II”)为慢反应。
(3)反应II:CO(g)+2H2(g)CH3OH(g) △H____0(填“>”“<”或“=”)。
(4)在容积可变的密闭容器中投入0.5molCO和1molH2,发生反应:CO(g)+2H2(g)CH3OH(g),测得平衡时CH3OH的物质的量随温度、压强变化如图所示。
①P总1____P总2(填“>”“<”或“=”),判断理由是____。
②若P总1=0.25MPa,则500K时该反应的平衡常数Kp=____MPa-2。
21.500 ℃时,向容积为2 L的密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,容器内的压强随时间的变化如下表所示:
时间/min 0 10 20 30 40 +∞
压强/MPa 20 17 15 13.2 11 11
(1)达到平衡时N2的转化率为___________
(2)用压强表示该反应的平衡常数Kp=___________(Kp等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数)
22.反应aA(g)+bB(g)cC(g)( H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)B的平衡转化率中最小的是_____,其值是_______;
(3)由第一次平衡到第二次平衡,平衡移动的方向是____,采取的措施是___;
(4)比较第II阶段反应温度()和第III阶段反应速度()的高低:__(填“>、=、<”)判断的理由是_______。
试卷第1页,共3页
参考答案:
1.A
【详解】A.由实验①③数据可知,升高温度,平衡时M和N的物质的量增大,说明平衡向正反应方向移动,该反应为吸热反应,故A错误;
B.由表格数据可知,实验①中,5min达平衡时,X的反应速率为=0.016 mol/(L·min),故B正确;
C.平衡常数为温度函数,温度不变,平衡常数不变,由实验①②数据可知,①和②反应温度相同,所以化学平衡常数相等,实验①中M平衡时的物质的量为0.08 mol,则平衡时X、Y、M的浓度为0.02mol/L、0.32 mol/L、0.08 mol/L,平衡常数为=12.5,故C正确;
D.由实验①②数据可知,实验①②温度相同、体积相同,实验②可以视作①增大压强,若平衡不移动,a为0.16,该反应是气体体积减小的反应,压强增大,平衡向正反应方向移动,M的物质的量增大,所以a大于0.16,故D正确;
故选项A。
2.C
【详解】A.混合气体的质量不变,容器的体积不变,所以密度始终不变,密度不能作为判断平衡状态的标志,故A不符题意;
B.消耗O2表示正反应速率,生成SO3也表示正反应速率,都表示V(正),所以不能作为判断平衡状态的标志,故B不符题意;
C.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,压强能作为判断平衡状态的标志,故C符合题意;
D.SO3的生成速率与SO2的消耗速率都表示正反应速率,不能作为判断平衡状态的标志,故D不符题意;
故选C。
3.C
【详解】A.汽水瓶中存在碳酸的分解反应,打开汽水瓶,压强减小,平衡正向移动,故瓶中立即泛起大量气泡,可用勒夏特列原理解释,A相符;
B.氯气溶于水的反应是可逆反应,而产物次氯酸因不稳定久置易分解,使得平衡正向移动,氯水中的Cl2含量减少,可用勒夏特列原理解释,B相符;
C.平衡,反应前后的化学计量数不变,故平衡移动不受压强影响,不能用勒夏特列原理解释,C不相符;
D.氯气溶于水的反应是可逆反应,氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的离子,使平衡逆向移动,可用勒夏特列原理解释,D相符;
故选C。
4.A
【详解】A.该反应是一个反应前后气体体积减小的反应,缩小容积增大压强浓度增大,反应速率增大,平衡正向移动,CO转化率增大,故A正确;
B.分离出CO2生成物浓度减小,反应速率减小,平衡正向移动,CO转化率增大,故B错误;
C.充入一定量的CO反应物浓度增大,反应速率增大,由于反应物CO不能完全转化,则CO转化率减小,故C错误;
D.该反应的正反应是放热反应,升高温度反应速率增大,但平衡向逆反应方向移动,抑制了CO的转化,所以CO的转化率降低,故D错误;
故选:A。
5.D
【详解】A.由图可知,温度T下时,氮气浓度的变化量为(c0—c1)mol/L,则氮气的反应速率,故A正确;
B.由图可知,温度T下时,反应达到平衡,氮气浓度的变化量为(c0—c1)mol/L,则平衡时氮气、氢气和氨气的浓度分别为c1mol/L、3c0mol/L—3(c0—c1)mol/L=3c1mol/L和2(c0—c1)mol/L,反应的平衡常数K==,故B正确;
C.由图可知,M点和N点均未达到平衡,由平衡形成过程中,正反应速率增大、逆反应速率减小,正反应速率大于逆反应速率可知,M点正反应速率大于N点逆反应速率,故C正确;
D.催化剂能降低反应活化能,加快反应速率,但化学平衡不移动,由图可知,平衡时曲线b氮气的浓度小于a点,说明条件改变一定不是使用了更高效的催化剂,故D错误;
故选D。
6.C
【详解】A.焓变等于生成物总能量减去反应物总能量,因此,故A错误;
B.改变催化剂能改变了反应过程,但不能改变了反应的焓变,故B错误;
C.根据图中信息得到催化剂Y的活化能更低,其效果比催化剂X的更好,故C正确;
D.无催化剂时,断开反应物中所有化学键需要吸收能量kJ,故D错误。
综上所述,答案为C。
7.C
【详解】A.图像①,正逆反应相等,升高温度,正反应速率大于逆反应速率,平衡正向移动,则正反应ΔH>0,A错误;
B.②反应实质是Fe3++3SCN-Fe(SCN)3,K+和Cl-不参加化学反应,KCl浓度增大不影响化学反应速率与平衡,平衡不移动,B错误;
C.③使用催化剂,反应速率加快,先达到平衡,但不改变平衡时A的体积分数,C正确;
D.④不断加入B,A的转化率不断增大,与图不符,D错误;
答案为C。
8.C
【详解】A.0~20min内, n(CH4)=0.50mol-0.25mol=0.25mol,则CH4的消耗速率为v(CH4)==1.25×10-3mol/(L·min),由化学反应速率之比等于化学计量数之比,可知NO2降解速率为2v(CH4)=2.5×10-3mol/(L·min),A错误;
B.温度升高,化学反应速率增大,相同时间段内消耗的CH4量增大,根据表中数据,0~10min内,T2温度下消耗CH4的量大于T1温度下CH4消耗的量,所以温度T1<T2,B错误;
C.根据B选项可知T1<T2,温度越高反应速率越快,所以第二组反应达到平衡所用时间更短,根据表格数据可知40min时第一组已到达平衡,则第二组一定也已经平衡,所以40min时甲烷的物质的量应和50min时相等,为0.15mol,C正确;
D.组别②中,20min时, n(CH4)=0.50mol-0.18mol=0.32mol,根据方程式可知相同时段内 n(CO2)=0.32mol,容器体积为10L,所以浓度为=0.032mol/L,D错误;
综上所述答案为C。
9.B
【详解】A.该反应中只有CO是气体,则该反应的平衡常数 K=c(CO),A正确;
B.温度不变,则平衡常数 K=c(CO)不变,因此当体系再次达到平衡时,CO的浓度不变,B错误;
C.减小CO浓度,平衡正向移动,温度不变,平衡常数不变,C正确;
D.从图像知,该反应为吸热反应,则升高温度,平衡正向移动,该反应的化学平衡常数K增大,D正确;
故选B。
10.A
【详解】A.OA段表示开始时,由图像可知曲线斜率不大,反应速率稍慢,A正确;
B.该反应为放热反应,AB段表示反应速率较快,可能温度有关,B错误;
C.由图像知BC段曲线的斜率逐渐减小,反应速率逐渐减小,C错误;
D.由图像可知AB段曲线斜率最大表示反应速率最快,向纵坐标作辅助线可知在该时间段内收集到的气体最多,D错误。
答案选A。
11.C
【详解】A.反应自发进行,由可以知道,时,若,则可能大于0,反应非自发,故A错误;
B.反应自发进行,能否发生还有反应速率问题,故B错误;
C.反应向熵值增大的方向进行,同种物质熵值:液体>固体,冰在室温下自动熔化成水,是熵增的重要结果,故C正确;
D.能够自发进行的反应一定是,故D错误;
故答案为C。
12.D
【详解】A.对于反应C(s)+CO2(g )2CO(g) H>0,升高温度,平衡正向移动,增大压强,平衡逆向移动,A不符合题意;
B.对于反应O2(g)+2SO2(g)2SO3(g) H<0,升高温度,平衡逆向移动,增大压强,平衡正向移动,B不符合题意;
C.对于反应H2(g)+I2(g)2HI(g) H<0,升高温度,平衡逆向移动,增大压强,平衡不发生移动,C不符合题意;
D.对于反应Cl2(g) +H2O(l)HCl(aq)+HClO(aq) H>0,升高温度,平衡正向移动,增大压强,平衡正向移动,D符合题意;
故选D。
13.A
【详解】A.化学反应的焓变和熵变共同决定反应方向,A项错误;
B.该反应的焓变大于0、熵变大于0,根据△G=△H-T△S<0能自发进行可判断,自发进行的原因是体系有自发地向混乱度增大的方向转变的倾向,B项正确;
C.根据△G=△H-T△S<0能自发进行可判断,ΔH<0、ΔS>0的反应在任何温度下都能自发进行,C项正确;
D.在其他外界条件不变的情况下,使用催化剂可以改变反应活化能从而改变化学反应速率,D项正确;
答案选A。
14.B
【详解】A.由图甲推断,B点SO2物质的量为,即浓度为,A错误;
B.根据A点分析,达到平衡c(SO2)=0.04mol/L,c(O2)=0.02 mol/L,c(SO3)=0.16 mol/L,A点对应温度下的平衡常数为,B正确;
C.达平衡后若增大容器容积,即减小压强,平衡向着逆反应方向移动且正逆反应速率都应减小,C错误;
D.压强相同,温度高速率快,即温度高的先达到平衡,由图中信息知T1先达到平衡,即T2
15.(1)
(2)1200
【详解】(1)在同温同压下,增加二氧化硫的量,会使原料气中和的物质的量之比m变大,m越大,平衡转化率越小,则。反应的化学平衡常数表达式为,故答案为:;;
(2)总压为,根据题给信息,A点是500℃,二氧化硫的平衡转化率为,n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,可进行如下计算:
平衡时,混合气体总量为1.2mol+20mol+8.8mol+70mol=100mol,达平衡时的分压,故答案为:1200。
16.(1) 其中的KI与FeCl3充分反应 检验溶液中是否大量存在Fe3+
(2)提高平衡时溶液中的c(Fe3+)
(3) < 正反应
(4) 加入1 mL蒸馏水 溶液颜色变浅
【详解】(1)①KI与FeCl3在溶液中会发生化学反应:2Fe3++2I- 2Fe2++I2,该反应为可逆反应,待试管中溶液的颜色不变后再进行后续实验,其目的是使其中的KI与FeCl3充分反应;
②由于Fe3+与SCN-会发生反应产生Fe(SCN)3,使溶液显红色,所以向反应后的溶液中加入KSCN溶液的目的是检验溶液中是否大量存在Fe3+;
(2)FeCl3溶液与KI溶液的反应为可逆反应,c(I-)降低,平衡向左移动,c(Fe3+)增大,进而可验证甲同学的想法,故本实验改用0.1 mol L-1KI溶液的目的是为提高平衡时溶液中的c(Fe3+);
(3)取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q减小,最终使得Q<K,化学平衡向正反应方向移动;
(4)①实验II是研究增大生成物Fe2+浓度对平衡的影响,则应保证除了Fe2+之外的其它离子浓度不变,则试管c中要加入1 mL蒸馏水;
②增大生成物Fe2+浓度,平衡逆向移动,c(I2)降低,溶液颜色变浅。
17. 气体 a v(b)>v(a)>v(c) 将便宜原料的用量加大,提高贵重原料利用率 不会
【分析】(1)根据图中信息可以知道,增大压强则C的含量增加,所以可以判断A为气体,可以据此解答该题;
(2)分析图中的各点可以知道a点处于曲线上方,所以可以判断此时C的浓度过大,所以应该向逆反应的方向移动,可以据此解答该题;
(3)根据图中信息可以知道b点C的浓度最大,其次是a,浓度最小的为c,所以达到平衡后体积最大为b点,最小为c点,可以据此解答该题;
(4)增大二氧化硫在混合气体中的比率能够增加二氧化硫的转化率,而抽出气体后容积不变,则二氧化硫和氧气受到的分压强不变,平衡不移动,可以据此解答该题。
【详解】(1)若增大平衡体系的压强,平衡移动的结果应使体系的压强减小,即平衡向气体体积减小方向移动,从图中信息可以知道,压强增大,C的含量增加,所以可以判断A为气体;
故答案为:气体;
(2)分析图中的各点可以知道a点处于曲线上方,所以可以判断此时C的浓度过大,所以应该向逆反应的方向移动;
故答案为:a;
(3)根据图中信息可以知道b点C的浓度最大其次是a,浓度最小的为c,所以达到平衡后体积最大为b点,最小为c点,故v(b)>v(a)>v(c);
故答案为:v(b)>v(a)>v(c);
(4)增大二氧化硫在混合气体中的比率能够增加二氧化硫的转化率,而抽出气体后容积不变,则二氧化硫和氧气受到的分压强不变,平衡不移动。
故答案为:将便宜原料的用量加大,提高贵重原料利用率;不会。
18. a-mx b-nx px qx
【解析】略
19.(1)0.3 mol·L-1
(2)80%
(3)0.12 mol·L-1·min-1
【分析】设NO2初始浓度为a,生成O2的浓度为x,列出三段式如下:
2NO22NO+O2
起始量(mol/L) x 0 0
变化量(mol/L) 0.24 0.24 0.12
平衡量(mol/L)x-0.24 0.24 0.12
由题意得:a-2x = 0.06mol/L,x = 0.12 mol/L,则a=0.3mol/L。据此解答。
【详解】(1)根据分析可知NO2的起始浓度为0.3mol/L。
故答案为:0.3mol/L
(2)2min时NO2的转化率:α(NO2)=×100%=×100%=80%。
故答案为:80%
(3)2min内v(NO)= = = 0.12mol/(L·min)
故答案为:0.12mol/(L·min)
20.(1)H2+CO2=CO+H2O
(2)I
(3)<
(4) > 该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大 64
【解析】(1)
由图可知反应I的化学方程式是H2+CO2=CO+H2O;
(2)
反应I的正反应活化能比反应II的大,由活化能越大反应速率越慢,则反应I为慢反应;
(3)
反应II:CO(g)+2H2(g)CH3OH(g)的反应物能量比生成物能量高,为放热反应,则△H<0;
(4)
①对于反应CO(g)+2H2(g)CH3OH(g),该反应是气体分子数减小的反应,其他条件相同时,增大压强,平衡正移,甲醇的物质的量增大,由图象可知P总1>P总2;
②若P总1=0.25MPa,平衡时CH3OH的物质的量为0.25mol,则,平衡时总物质的量为0.25+0. 5+0.25=1,则500K时该反应的平衡常数。
21.(1)90%
(2)48 MPa-2
【分析】假设到平衡时氮气转化的物质的量为xmol,则有
根据压强比等于物质的量比可知,
=,解之得x=0.9。
【详解】(1)达到平衡时N2的转化率为×100%=90%;
(2)用压强表示该反应的平衡常数
Kp==48 MPa-2。
22. 1:3:2 aIII(B) 19% 正方向移动 从反应体系中移出产物C > 此反应为放热反应,降低温度,平衡向正反应方向移动
【详解】(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2;综上所述,本题正确答案:1:3:2;
(2)aI(B)=3mol/L/6mol/L×100%=50% ;aII(B)=(3-1.86)mol/L /3 mol/L×100%=38%;aIII(B)=(1.86-1.5)mol/L/1.86 mol/L =19%;所以B的平衡转化率aI(B)、aII(B)、aIII(B) 中最小的是aIII(B),其值是19%;
综上所述,本题正确答案:aIII(B),19%。
(3) 由浓度曲线变化可知,由第一次平衡到第二次平衡,AB 的浓度减小,C的浓度增大,平衡正向移动;由于C的浓度由2.0mol/L变为0,所以采取的措施是分离出产物C;
综上所述,本题正确答案:正方向移动,从反应体系中移出产物C。
(4)第II阶段的到第III阶段时,AB的浓度均减小,C的浓度增大,平衡正向移动,由于
I、II、III阶段容器容积不变,且反应的 H<0,故应是降低了反应温度,则有T2> T3。
综上所述,本题正确的是:>,此反应为放热反应,降低温度,平衡向正反应方向移动
