1.1物质的分类和转化 课件(共41张PPT)
文档属性
| 名称 | 1.1物质的分类和转化 课件(共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 21:12:14 | ||
图片预览







文档简介
(共41张PPT)
高一衔接和新课导入:
第一章:
欢迎来到高一化学课堂
分类是一种思想:
人为的
多角度的
认识物质......
并用化学语言表述......
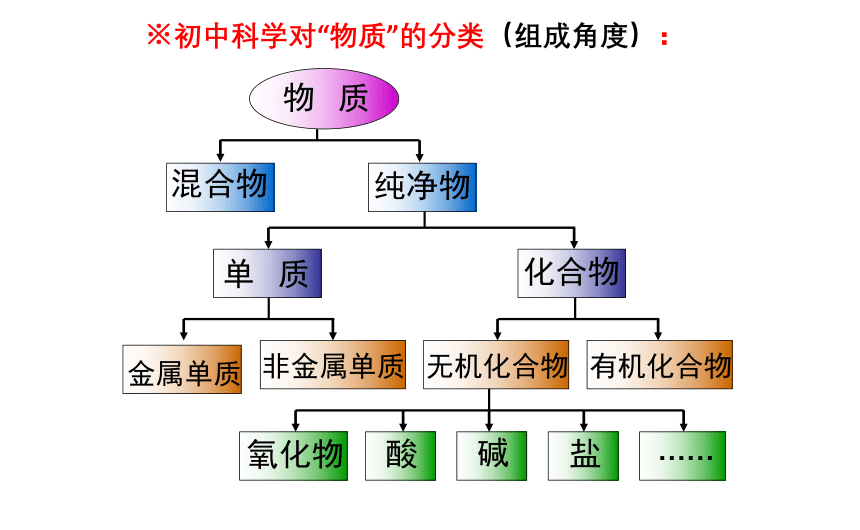
物 质
混合物
纯净物
单 质
化合物
氧化物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
※初中科学对“物质”的分类(组成角度):
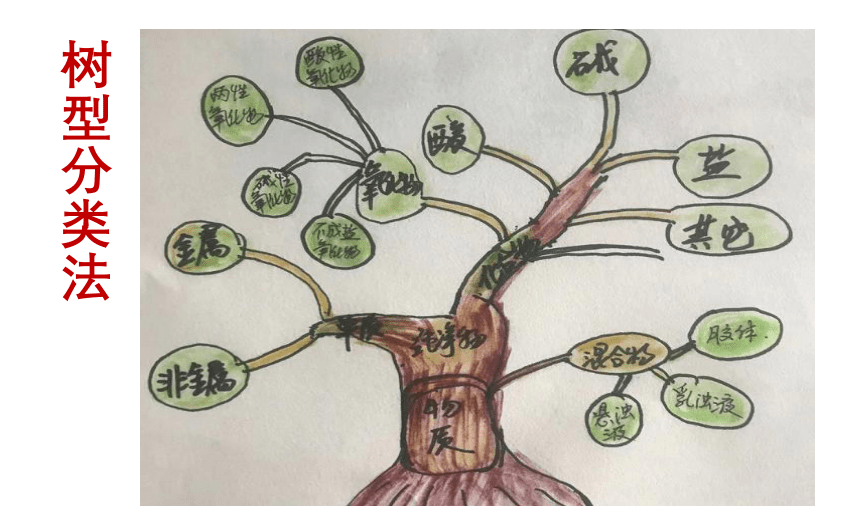
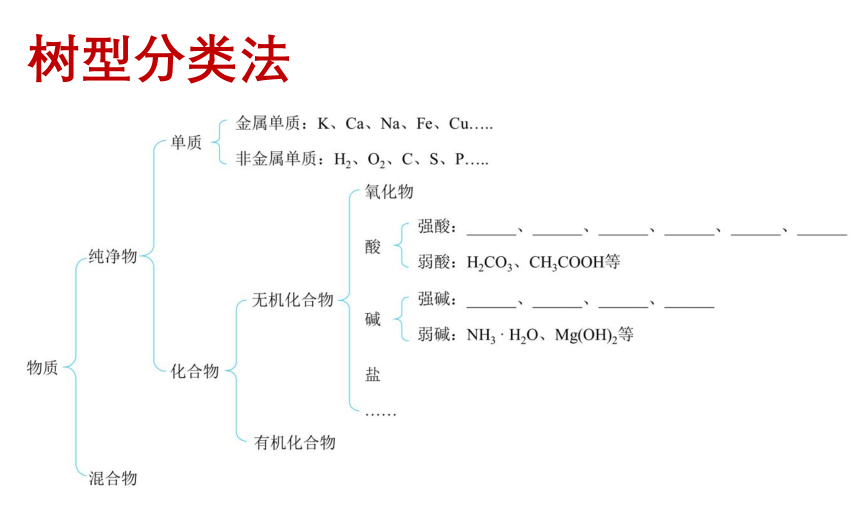
树型分类法
树型分类法
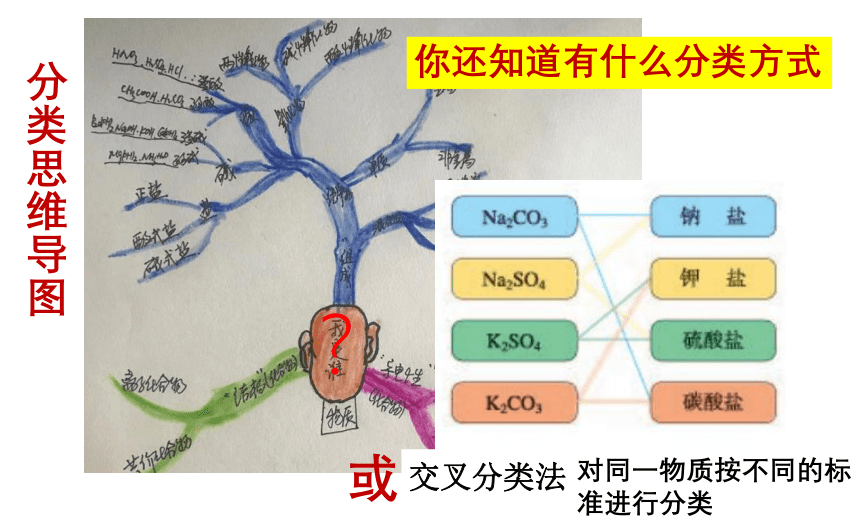
分类思维导图
?
或
你还知道有什么分类方式
交叉分类法
对同一物质按不同的标准进行分类
【高一衔接:】
请从“组成”角度对下列物质进行分类?
(写出最终归属)
1、钙;2、氯气;3、75%食盐水; 4、泥水;
5、氧化钙;6、二氧化碳; 7、二氧化氮(NO2);
8、过氧化钠(Na2O2);9、盐酸;10、硫酸;
11、醋酸; 12、氢氧化钙;13、五水硫酸铜;
14、硫酸氢钠;15、碱式碳酸铜;16、氨气(NH3);
17、葡萄糖(C6H12O6);
(1)Na2SO4、KNO3都是含氧酸盐( )
(2)HNO3既属于一元酸又属于含氧酸,这种分类方法是树状分类法( )
(3)Na2CO3含有氧元素,属于氧化物( )
(4)CuSO4·5H2O属于混合物( )
(5)2Na2O2+2H2O===4NaOH +O2↑是置换反应( )
(6)只由一种元素组成的物质,可能是混合物( )
【例1】下列说法正确的是( )
A.含有氧元素的化合物一定是氧化物
B.纯净物一定由同种原子构成
C.由同种分子构成的物质一定是纯净物
D. 含一种元素的物质一定是单质
C
【变1】下列各组物质中,按单质、化合物、混合物顺序排列的是
A.铁、四氧化三铁、烧碱
B.氯气、纯碱、石灰水
C.水银、空气、干冰
D.二氧化硫、水蒸气、盐酸
B
金刚石
物理性质 金刚石 石墨
硬度 很大 较软
熔沸点 很高 很高
导电性 不导电 能导电
C60
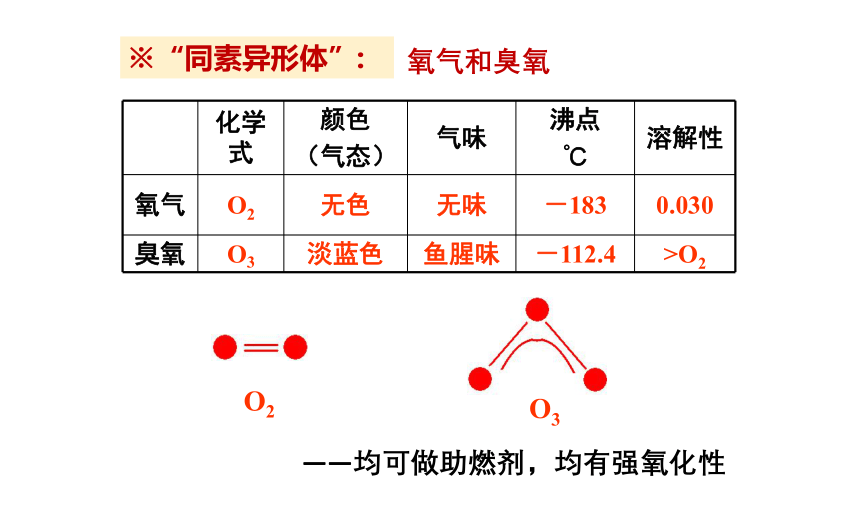
“同素异形体”:
由同一种元素形成几种性质不同的单质 称同素异形体。
碳纳米管
同素异形体的“物质性质”不同,“化学性质”相似。
化学式 颜色 (气态) 气味 沸点 ℃ 溶解性
氧气 O2 无色 无味 -183 0.030
臭氧 O3 淡蓝色 鱼腥味 -112.4 >O2
O2
O3
※“同素异形体”:
——均可做助燃剂,均有强氧化性
氧气和臭氧
思考与交流:
由同种元素组成的物质,一定是纯净物吗?
(1)Na和Na+是同素异形体吗?
(2)Fe2O3和Fe3O4是同素异形体吗?
(3)1H和2H是同素异形体吗?
【再思考:】
(4)红磷和白磷是同素异形体吗?
——1H和2H均为原子,不是物质,不能用宏观分类;
从微观角度分类:1H和2H为“同位素”关系。
“氧化物”的继续分类:
① 按组成元素分类
② 按化学性质分类
金属氧化物( CuO )
非金属氧化物( CO2 )
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
其它
碱性氧化物:能与酸反应生成盐和水的氧化物如CaO;
酸性氧化物:能与碱反应生成盐和水的氧化物如CO2;
请定义:两性氧化物和不成盐氧化物的概念?
深化:高中分类
(1)酸性氧化物:与水反应只生成相应价态的酸,或与碱反应只生成一种盐和水的氧化物。如:
(2)碱性氧化物:与水反应只生成相应价态的碱,或与酸反应只生成一种盐和水的氧化物。如:
Na2O + H2O === 2NaOH; Na2O + 2HCl=== 2NaCl + H2O
常见碱性氧化物CuO Fe2O3 Na2O MgO
常见酸性氧化物CO2 SO2 SO3 Mn2O7
补充:
两性氧化物:Al2O3
不成盐氧化物:CO、NO
请归纳以下两者关系:
碱性氧化物 ? 金属氧化物
酸性氧化物 ? 非金属氧化物
举例:
Na2O2属于哪种氧化物?
1、金属氧化物与碱性氧化物的关系
金属氧化物不一定是碱性氧化物,
碱性氧化物一定是金属氧化物;
如: Al2O3为两性氧化物、Na2O2为过氧化物。
2、非金属氧化物与酸性氧化物的关系
非金属氧化物不一定是酸性氧化物,
酸性氧化物不一定是非金属氧化物。
归纳
如Mn2O7为酸性氧化物;CO、H2O为不成盐氧化物。
从H、O、Na、S四种元素中选择适当的元素,组成下列类别中的物质,越多越好。
(1)酸 ;
(2)酸性氧化物 ;
(3)碱 ;
(4)碱性氧化物 ;
(5)正盐 ;
(6)酸式盐 。
【问题解决】
请写出:上述酸性氧化物与上述碱反应的化学方程式?
上述碱性氧化物与上述酸反应的化学方程式?
*“混合物”的继续分类:
深化:高中分类
分散系及其分类
分散质
分散剂
分散系:分散质分撒在分散剂里形成的混合物。
1、溶液:是一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
2、悬浊液:是固体小颗粒悬浮于液体里形成混合物。
3、乳浊液:是小液滴分散到液体里形成的混合物。
硫酸铜溶液
泥浆水悬浊液
油水乳浊液
Fe(OH)3胶体
丁达尔现象
硫酸铜溶液
氢氧化铁水混合体系
自然界的丁达尔现象:
气溶胶
自然界的丁达尔现象
有色玻璃
烟 水 晶
生活中胶体:
豆浆溶液、蛋白质溶液、淀粉溶液……
固溶胶
浊液分散系
分散质粒子直径
>100nm
胶体分散系
1nm<分散质粒子直径
<100nm
溶液分散系
分散质粒子直径
<1nm
微观世界:探究产生丁达尔现象的本质原因
丁达尔效应:胶体粒子对光线散射而形成光亮通路的现象。
分散系的分类:
按照分散质粒子的大小来分:
分散系
溶液
浊液
胶体
(<1nm)
(1~100nm)
(>100nm)
胶体:分散质微粒的直径大小在1-100nm之间的分散系。
1nm=10-9m
本质区别
分散系
*混合物的分类:
1.农业生产:土壤的保肥作用。
2.医疗卫生:血液透析;医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
3.日常生活:制豆腐原理;明矾净水。
4.自然地理:江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙形成胶体发生聚沉。
5.工业生产:制有色玻璃(固溶胶),改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改进材料的光学性质。国防工业中有些火药、炸药须制成胶体。石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
胶体有什么用?
1、关于溶液、浊液、胶体说法正确的是( )
A.都是透明的混合体系
B.都是均一的、稳定的分散系
C.区别方法可做丁达尔效应实验
D.肯定都是混合物
D
【问题解决】
2、胶体和其他分散系(溶液、浊液)的本质区别是 ( )
A.分散质粒子的大小
B.是不是一种稳定的体系
C.会不会产生丁达乐效应
D.粒子有没有带电荷
A
【问题解决】
3、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会出现黑色沉淀
A.①④ B.②③④
C.②③ D.①③④
C
【问题解决】
问:纳米碳是不是胶体?
×
转化是有规律的:
从分类上认识物质的性质......
从分类上寻找物质变化的规律并用之......
【思考与讨论】
(1)写出下列物质之间转化的化学方程式,体会金属单质到盐、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2→CaSO4
C → CO2 → H2CO3→CaCO3
(2)对于上述转化关系,从物质分类的角度看,你有什么规律,总结并交流。
金属
非金属
碱性氧化物
酸性氧化物
碱
酸
盐
盐
O2
H2O
O2
H2O
碱或碱性氧化物
酸或酸性氧化物
盐
盐和水
盐和酸
盐和氢气
碱和盐
两种新盐
金属与盐
※ 常见无机物转化规律图(八圈图)
“八圈图”应用:
金属性质?
1、与非金属反应
2、与水反应
3、与酸反应
4、与某些盐反应
“八圈图”应用:
非金属性质?
1、与金属反应
2、与水反应
3、与碱反应
4、与某些盐反应
“八圈图”应用:
酸有哪些通性?
1、与活泼金属反应
2、与碱性氧化物反应
3、与碱反应
4、与某些盐反应
5、与酸碱指示剂反应
碱有哪些共性?
1、与非金属反应
2、与酸性氧化物反应
3、与酸反应
4、与某些盐反应
5、与酸碱指示剂反应
“八圈图”应用:
盐的性质?
+活泼金属
新盐 + 不活泼金属
+酸 新盐 + 新酸
+碱 新盐 + 新碱
+盐 新盐1 + 新盐2
盐
“八圈图”应用:
【例1】某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( )
A.稀硫酸 B.氧气
C.二氧化碳 D.氧化钙
碳
C
资料
H2SO4、HCl、HNO3、HBr、HI
强酸:
强碱:
NaOH、KOH、Ca(OH)2、Ba(OH)2
物质溶解性口诀:
钾钠铵盐全能溶,硝酸盐类也全溶。
盐酸盐溶除银汞,硫酸盐中除钡铅。
碱中钾钠铵钡溶,碳酸盐中多不溶。
※ 物质的转化反应类型
化合反应
分解反应
置换反应
复分解反应
反应条件?
反应条件?
强制弱!
有沉淀、
气体、
水生成!
初中科学知识:
高一衔接和新课导入:
第一章:
欢迎来到高一化学课堂
分类是一种思想:
人为的
多角度的
认识物质......
并用化学语言表述......
物 质
混合物
纯净物
单 质
化合物
氧化物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
※初中科学对“物质”的分类(组成角度):
树型分类法
树型分类法
分类思维导图
?
或
你还知道有什么分类方式
交叉分类法
对同一物质按不同的标准进行分类
【高一衔接:】
请从“组成”角度对下列物质进行分类?
(写出最终归属)
1、钙;2、氯气;3、75%食盐水; 4、泥水;
5、氧化钙;6、二氧化碳; 7、二氧化氮(NO2);
8、过氧化钠(Na2O2);9、盐酸;10、硫酸;
11、醋酸; 12、氢氧化钙;13、五水硫酸铜;
14、硫酸氢钠;15、碱式碳酸铜;16、氨气(NH3);
17、葡萄糖(C6H12O6);
(1)Na2SO4、KNO3都是含氧酸盐( )
(2)HNO3既属于一元酸又属于含氧酸,这种分类方法是树状分类法( )
(3)Na2CO3含有氧元素,属于氧化物( )
(4)CuSO4·5H2O属于混合物( )
(5)2Na2O2+2H2O===4NaOH +O2↑是置换反应( )
(6)只由一种元素组成的物质,可能是混合物( )
【例1】下列说法正确的是( )
A.含有氧元素的化合物一定是氧化物
B.纯净物一定由同种原子构成
C.由同种分子构成的物质一定是纯净物
D. 含一种元素的物质一定是单质
C
【变1】下列各组物质中,按单质、化合物、混合物顺序排列的是
A.铁、四氧化三铁、烧碱
B.氯气、纯碱、石灰水
C.水银、空气、干冰
D.二氧化硫、水蒸气、盐酸
B
金刚石
物理性质 金刚石 石墨
硬度 很大 较软
熔沸点 很高 很高
导电性 不导电 能导电
C60
“同素异形体”:
由同一种元素形成几种性质不同的单质 称同素异形体。
碳纳米管
同素异形体的“物质性质”不同,“化学性质”相似。
化学式 颜色 (气态) 气味 沸点 ℃ 溶解性
氧气 O2 无色 无味 -183 0.030
臭氧 O3 淡蓝色 鱼腥味 -112.4 >O2
O2
O3
※“同素异形体”:
——均可做助燃剂,均有强氧化性
氧气和臭氧
思考与交流:
由同种元素组成的物质,一定是纯净物吗?
(1)Na和Na+是同素异形体吗?
(2)Fe2O3和Fe3O4是同素异形体吗?
(3)1H和2H是同素异形体吗?
【再思考:】
(4)红磷和白磷是同素异形体吗?
——1H和2H均为原子,不是物质,不能用宏观分类;
从微观角度分类:1H和2H为“同位素”关系。
“氧化物”的继续分类:
① 按组成元素分类
② 按化学性质分类
金属氧化物( CuO )
非金属氧化物( CO2 )
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
其它
碱性氧化物:能与酸反应生成盐和水的氧化物如CaO;
酸性氧化物:能与碱反应生成盐和水的氧化物如CO2;
请定义:两性氧化物和不成盐氧化物的概念?
深化:高中分类
(1)酸性氧化物:与水反应只生成相应价态的酸,或与碱反应只生成一种盐和水的氧化物。如:
(2)碱性氧化物:与水反应只生成相应价态的碱,或与酸反应只生成一种盐和水的氧化物。如:
Na2O + H2O === 2NaOH; Na2O + 2HCl=== 2NaCl + H2O
常见碱性氧化物CuO Fe2O3 Na2O MgO
常见酸性氧化物CO2 SO2 SO3 Mn2O7
补充:
两性氧化物:Al2O3
不成盐氧化物:CO、NO
请归纳以下两者关系:
碱性氧化物 ? 金属氧化物
酸性氧化物 ? 非金属氧化物
举例:
Na2O2属于哪种氧化物?
1、金属氧化物与碱性氧化物的关系
金属氧化物不一定是碱性氧化物,
碱性氧化物一定是金属氧化物;
如: Al2O3为两性氧化物、Na2O2为过氧化物。
2、非金属氧化物与酸性氧化物的关系
非金属氧化物不一定是酸性氧化物,
酸性氧化物不一定是非金属氧化物。
归纳
如Mn2O7为酸性氧化物;CO、H2O为不成盐氧化物。
从H、O、Na、S四种元素中选择适当的元素,组成下列类别中的物质,越多越好。
(1)酸 ;
(2)酸性氧化物 ;
(3)碱 ;
(4)碱性氧化物 ;
(5)正盐 ;
(6)酸式盐 。
【问题解决】
请写出:上述酸性氧化物与上述碱反应的化学方程式?
上述碱性氧化物与上述酸反应的化学方程式?
*“混合物”的继续分类:
深化:高中分类
分散系及其分类
分散质
分散剂
分散系:分散质分撒在分散剂里形成的混合物。
1、溶液:是一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
2、悬浊液:是固体小颗粒悬浮于液体里形成混合物。
3、乳浊液:是小液滴分散到液体里形成的混合物。
硫酸铜溶液
泥浆水悬浊液
油水乳浊液
Fe(OH)3胶体
丁达尔现象
硫酸铜溶液
氢氧化铁水混合体系
自然界的丁达尔现象:
气溶胶
自然界的丁达尔现象
有色玻璃
烟 水 晶
生活中胶体:
豆浆溶液、蛋白质溶液、淀粉溶液……
固溶胶
浊液分散系
分散质粒子直径
>100nm
胶体分散系
1nm<分散质粒子直径
<100nm
溶液分散系
分散质粒子直径
<1nm
微观世界:探究产生丁达尔现象的本质原因
丁达尔效应:胶体粒子对光线散射而形成光亮通路的现象。
分散系的分类:
按照分散质粒子的大小来分:
分散系
溶液
浊液
胶体
(<1nm)
(1~100nm)
(>100nm)
胶体:分散质微粒的直径大小在1-100nm之间的分散系。
1nm=10-9m
本质区别
分散系
*混合物的分类:
1.农业生产:土壤的保肥作用。
2.医疗卫生:血液透析;医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
3.日常生活:制豆腐原理;明矾净水。
4.自然地理:江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙形成胶体发生聚沉。
5.工业生产:制有色玻璃(固溶胶),改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改进材料的光学性质。国防工业中有些火药、炸药须制成胶体。石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
胶体有什么用?
1、关于溶液、浊液、胶体说法正确的是( )
A.都是透明的混合体系
B.都是均一的、稳定的分散系
C.区别方法可做丁达尔效应实验
D.肯定都是混合物
D
【问题解决】
2、胶体和其他分散系(溶液、浊液)的本质区别是 ( )
A.分散质粒子的大小
B.是不是一种稳定的体系
C.会不会产生丁达乐效应
D.粒子有没有带电荷
A
【问题解决】
3、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )。
①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会出现黑色沉淀
A.①④ B.②③④
C.②③ D.①③④
C
【问题解决】
问:纳米碳是不是胶体?
×
转化是有规律的:
从分类上认识物质的性质......
从分类上寻找物质变化的规律并用之......
【思考与讨论】
(1)写出下列物质之间转化的化学方程式,体会金属单质到盐、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2→CaSO4
C → CO2 → H2CO3→CaCO3
(2)对于上述转化关系,从物质分类的角度看,你有什么规律,总结并交流。
金属
非金属
碱性氧化物
酸性氧化物
碱
酸
盐
盐
O2
H2O
O2
H2O
碱或碱性氧化物
酸或酸性氧化物
盐
盐和水
盐和酸
盐和氢气
碱和盐
两种新盐
金属与盐
※ 常见无机物转化规律图(八圈图)
“八圈图”应用:
金属性质?
1、与非金属反应
2、与水反应
3、与酸反应
4、与某些盐反应
“八圈图”应用:
非金属性质?
1、与金属反应
2、与水反应
3、与碱反应
4、与某些盐反应
“八圈图”应用:
酸有哪些通性?
1、与活泼金属反应
2、与碱性氧化物反应
3、与碱反应
4、与某些盐反应
5、与酸碱指示剂反应
碱有哪些共性?
1、与非金属反应
2、与酸性氧化物反应
3、与酸反应
4、与某些盐反应
5、与酸碱指示剂反应
“八圈图”应用:
盐的性质?
+活泼金属
新盐 + 不活泼金属
+酸 新盐 + 新酸
+碱 新盐 + 新碱
+盐 新盐1 + 新盐2
盐
“八圈图”应用:
【例1】某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( )
A.稀硫酸 B.氧气
C.二氧化碳 D.氧化钙
碳
C
资料
H2SO4、HCl、HNO3、HBr、HI
强酸:
强碱:
NaOH、KOH、Ca(OH)2、Ba(OH)2
物质溶解性口诀:
钾钠铵盐全能溶,硝酸盐类也全溶。
盐酸盐溶除银汞,硫酸盐中除钡铅。
碱中钾钠铵钡溶,碳酸盐中多不溶。
※ 物质的转化反应类型
化合反应
分解反应
置换反应
复分解反应
反应条件?
反应条件?
强制弱!
有沉淀、
气体、
水生成!
初中科学知识:
