专题常见气体的实验室制备提升练习2022_2023学年高一化学暑假作业(人教版)
文档属性
| 名称 | 专题常见气体的实验室制备提升练习2022_2023学年高一化学暑假作业(人教版) |
|
|
| 格式 | docx | ||
| 文件大小 | 826.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 16:09:51 | ||
图片预览

文档简介
专题常见气体的实验室制备提升练习2022_2023学年高一化学暑假作业(人教版)
一、单选题,共12小题
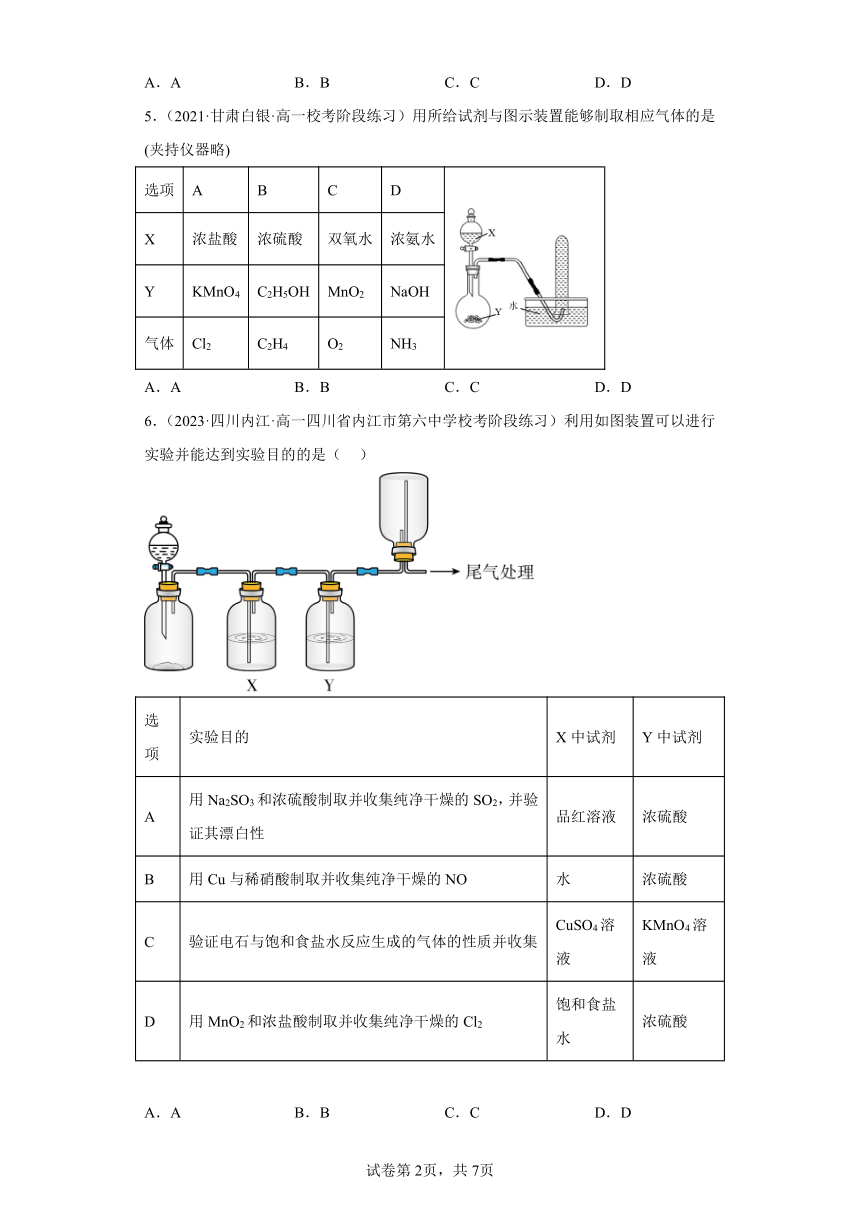
1.(2022·吉林·高一统考阶段练习)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作安全瓶防倒吸装置的是
A. B. C. D.
2.(2022·广西·高一校联考阶段练习)下列气体中,既可用排水法又可用向上排空气法收集的是
A.NO2 B.O2 C.SO2 D.NO
3.(2023·江苏扬州·高一统考期中)实验室用如图装置制氨气并验证氨气的某些化学性质,能达到实验目的的是
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
4.(2023·山东日照·高一期中)图中a、b、c表示相应仪器中加入的试剂,可用图装置制取、净化、收集的气体是
选项 气体 a b c
A SO2 浓硫酸 亚硫酸钠 碱石灰
B CO2 盐酸 碳酸钙 饱和NaHCO3
C NO 稀HNO3 铜屑 H2O
D NO2 浓HNO3 铜屑 NaOH溶液
A.A B.B C.C D.D
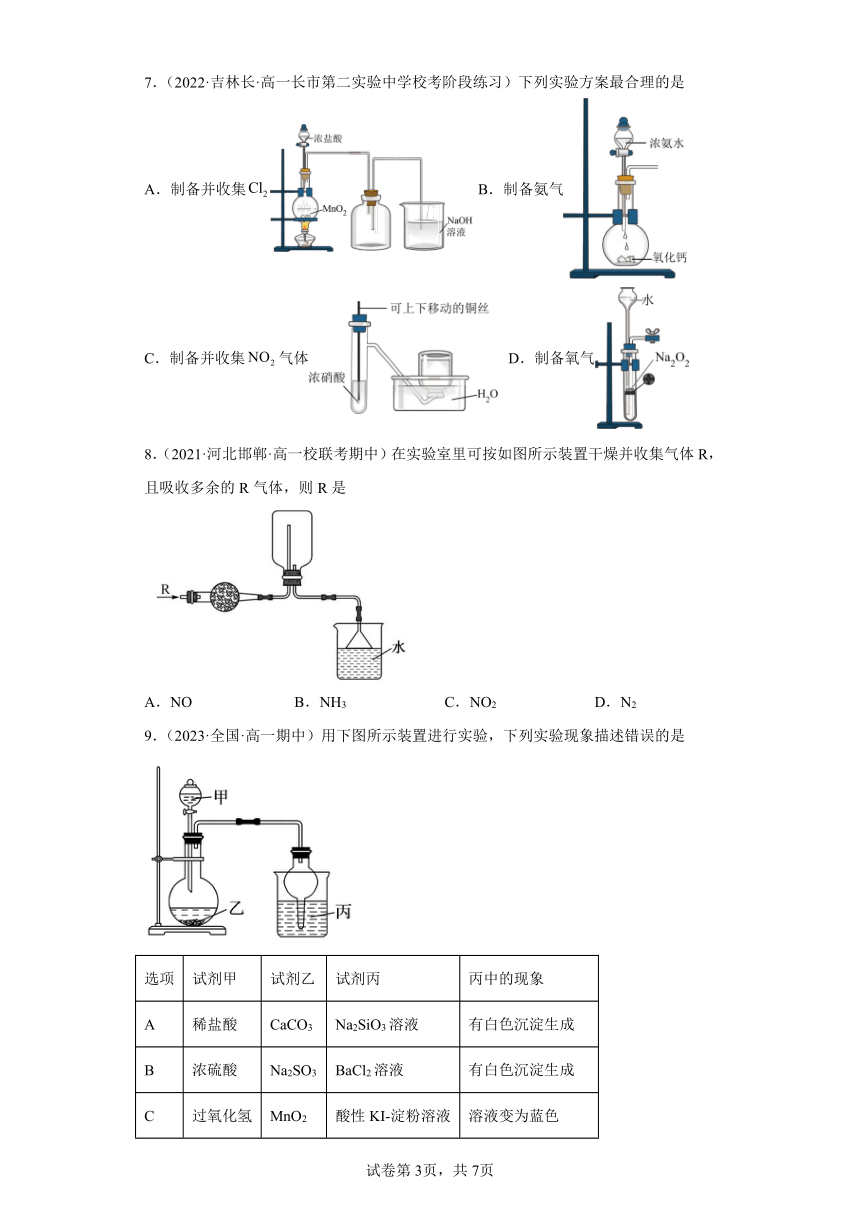
5.(2021·甘肃白银·高一校考阶段练习)用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
选项 A B C D
X 浓盐酸 浓硫酸 双氧水 浓氨水
Y KMnO4 C2H5OH MnO2 NaOH
气体 Cl2 C2H4 O2 NH3
A.A B.B C.C D.D
6.(2023·四川内江·高一四川省内江市第六中学校考阶段练习)利用如图装置可以进行实验并能达到实验目的的是( )
选项 实验目的 X中试剂 Y中试剂
A 用Na2SO3和浓硫酸制取并收集纯净干燥的SO2,并验证其漂白性 品红溶液 浓硫酸
B 用Cu与稀硝酸制取并收集纯净干燥的NO 水 浓硫酸
C 验证电石与饱和食盐水反应生成的气体的性质并收集 CuSO4溶液 KMnO4溶液
D 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 饱和食盐水 浓硫酸
A.A B.B C.C D.D
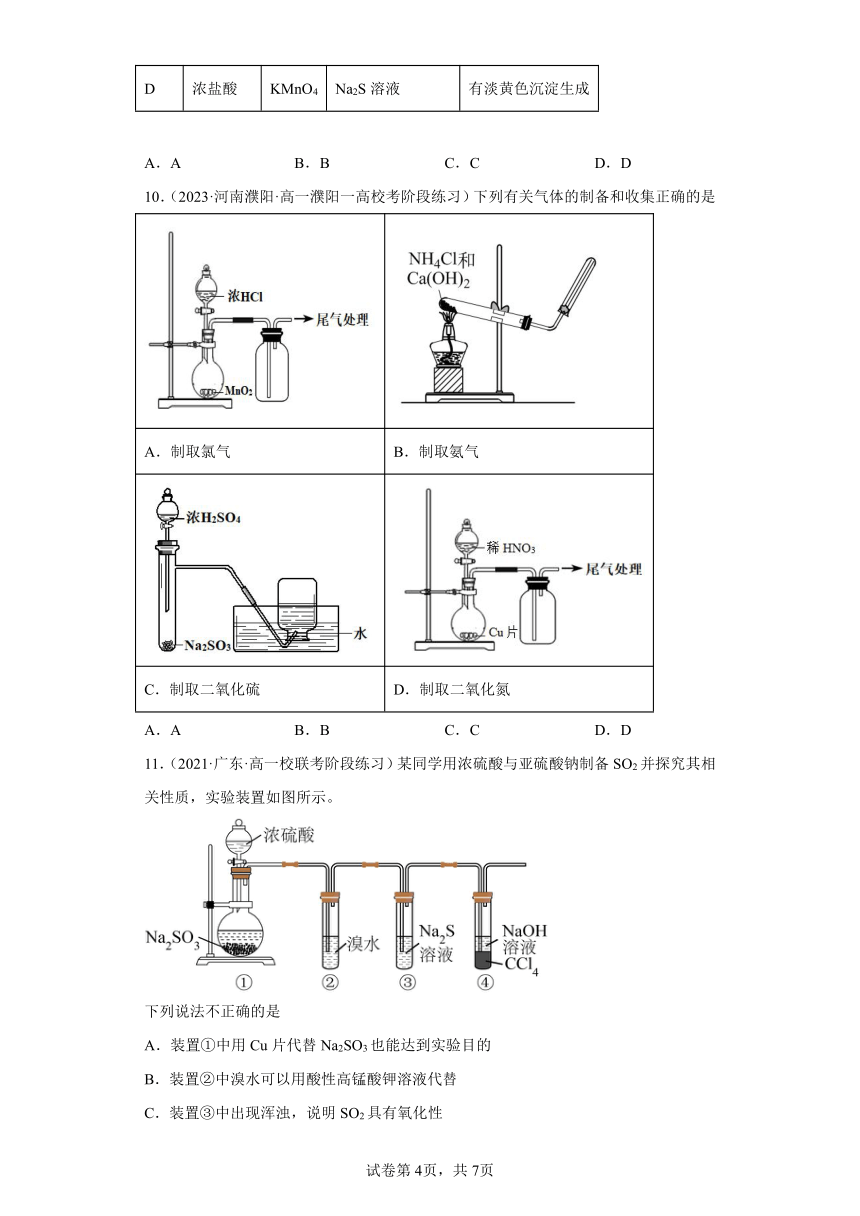
7.(2022·吉林长·高一长市第二实验中学校考阶段练习)下列实验方案最合理的是
A.制备并收集 B.制备氨气
C.制备并收集气体 D.制备氧气
8.(2021·河北邯郸·高一校联考期中)在实验室里可按如图所示装置干燥并收集气体R,且吸收多余的R气体,则R是
A.NO B.NH3 C.NO2 D.N2
9.(2023·全国·高一期中)用下图所示装置进行实验,下列实验现象描述错误的是
选项 试剂甲 试剂乙 试剂丙 丙中的现象
A 稀盐酸 CaCO3 Na2SiO3溶液 有白色沉淀生成
B 浓硫酸 Na2SO3 BaCl2溶液 有白色沉淀生成
C 过氧化氢 MnO2 酸性KI-淀粉溶液 溶液变为蓝色
D 浓盐酸 KMnO4 Na2S溶液 有淡黄色沉淀生成
A.A B.B C.C D.D
10.(2023·河南濮阳·高一濮阳一高校考阶段练习)下列有关气体的制备和收集正确的是
A.制取氯气 B.制取氨气
C.制取二氧化硫 D.制取二氧化氮
A.A B.B C.C D.D
11.(2021·广东·高一校联考阶段练习)某同学用浓硫酸与亚硫酸钠制备SO2并探究其相关性质,实验装置如图所示。
下列说法不正确的是
A.装置①中用Cu片代替Na2SO3也能达到实验目的
B.装置②中溴水可以用酸性高锰酸钾溶液代替
C.装置③中出现浑浊,说明SO2具有氧化性
D.装置④的作用是吸收SO2,防止发生倒吸和污染环境
12.(2021·山西太原·高一山西实验中学校考阶段练习)将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现白色沉淀,若再通入另一种气体X,有白色沉淀产生。则气体X不可能是
A.NH3 B.NO2 C.Cl2 D.CO2
二、非选择题,共3小题
13.(2023·安徽滁州·高一安徽省定远中学校考)实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。
写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。
(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
14.(2023·新疆伊犁·高一校联考期中)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是______,发生装置B应选择以下三种装置中的______(填①或②或③)。
(2)图①中a的仪器名称______,D装置中主要反应离子方程式为______。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的_____(填序号)①酸性②吸水性③脱水性④强氧化性,并写出“体积膨胀,并放出有刺激性气味的气体(SO2)”对应的化学方程式:_____。
(4)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
a.氯化铁溶液 b.氯化亚铁溶液 c.硫氰化钾溶液 d.氯化钡溶液 e.品红溶液 f.酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有______(选填一个序号)试剂的试管内,再加入______(选填一个序号)试剂。发生的现象是______。若SO2过量,取适量D中溶液滴加至盛有_____(选填一个序号)试剂的试管内,发生的现象是______。
15.(2023·全国·高一期中)Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取,反应装置如图所示(夹持装置已略)。
已知:Cl2O熔点为116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)写出装置A中发生反应的离子方程式:_______。
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,_______,加水,一段时间后,水不能顺利流下,则气密性良好。
(3)下列有关该实验的说法中不正确的是_______。
A.实验室也可用KMnO4与浓盐酸反应制备氯气
B.B中试剂是浓硫酸,目的是干燥氯气
C.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
D.从装置D中逸出气体的主要成分是Cl2O
(4)①装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式_______。
②设计实验方案验证C中生成的产物中另一种盐X中的阴离子_______。
(5)该实验装置存在一处明显的不足,其改进措施为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.该装置是排液量气装置,故A错误;
B.该装置可作为安全瓶防倒吸,因为进气管较短(刚漏出瓶塞)若发生倒吸,倒吸液会被盛装在B 瓶中,不会再倒流到前一装置,从而防止倒吸,故B正确;
C.该装置是混气装置,进入C 瓶中两气体在C 瓶中充分混合,故C错误;
D.该装置是洗气装置,故D错误;
故选B。
2.B
【分析】气体可用排水法收集,则气体不溶于水且不与水反应,气体可用向上排空气法收集,则气体密度比空气大且不与空气中物质反应。
【详解】A.NO2能溶于水且与水反应,不能用排水法收集,A错误;
B.O2不溶于水且不与水反应,可用排水法收集,密度比空气大且不与空气中物质反应,可用向上排空气法收集,B正确;
C.SO2能溶于水且与水反应,不能用排水法收集,C错误;
D.NO能与空气中氧气反应,不能用排空气法收集,D错误;
答案选B。
3.C
【详解】A.与反应生成,不加热的情况下难以分解,无生成,故无法制备氨气,A项错误;
B.与浓反应,不能用浓干燥,B项错误;
C.与反应生成和,黑色的转化为红色的,N元素的化合价升高,说明具有还原性,C项正确;
D.苯的密度比水的密度小,在上层,直接通入下层的水中,会发生倒吸,D项错误;
答案选C。
4.B
【详解】A.亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫能与碱石灰反应,不能用碱石灰来吸收二氧化硫的水气,故A错误;
B.盐酸和碳酸钙反应生成二氧化碳,盐酸有挥发性,所以生成的二氧化碳中有氯化氢,氯化氢和碳酸氢钠反应生成二氧化碳,饱和的碳酸氢钠和二氧化碳不反应,所以可用饱和碳酸氢钠洗气,二氧化碳的密度大于空气的密度,所以可用向上排空气法收集,故B正确;
C.铜和稀硝酸反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以不能用排空气法收集一氧化氮,故C错误;
D.铜和浓硝酸反应生成二氧化氮,浓硝酸有挥发性,所以二氧化氮中有硝酸,硝酸能和碱反应,二氧化氮和碱也反应,所以不能用氢氧化钠洗气,故D错误;
答案为B。
5.C
【详解】A.浓盐酸和KMnO4固体混合有氯气生成,但氯气溶于水,且与水发生反应,则不能用排水法收集,故A不符合题意;
B.在浓硫酸存在下,乙醇消去制乙烯需要迅速升温到,故B不符合题意;
C.双氧水分解制氧气,制取装置不需要加热,收集氧气可以用排水法,故C符合题意;
D.氨气极易溶于水,不能用排水法收集,故D不符合题意;
故选:C。
6.A
【详解】A.Na2SO3和浓硫酸生成二氧化硫,二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫,浓硫酸具有吸水性且和二氧化硫不反应,所以能干燥二氧化硫,二氧化硫密度大于空气,所以采用此法排空气收集,二氧化硫有毒,不能直接排空,应该有尾气处理装置,故A能达到实验目的;
B.用Cu与稀硝酸制取一氧化氮中含有挥发出来的硝酸,一氧化氮难溶于水,可用水除去硝酸,再用浓硫酸干燥,但是一氧化氮能与氧气反应,不能用排空气法收集,故B不能达到实验目的;
C.电石与饱和食盐水反应生成的乙炔中混有硫化氢,选硫酸铜可除去,Y中高锰酸钾可氧化乙炔,后续装置不能收集乙炔气体,故C不能达到实验目的;
D.MnO2和浓盐酸常温下不反应,缺少加热装置,故D不能达到实验目的;
答案选A。
7.B
【详解】A.Cl2的密度比空气大,收集时应长管进短管出,应用向上排空气法,A不符合题意;
B.浓氨水滴入CaO中,CaO与水反应放热,NH3·H2O受热分解并挥发出NH3,可以制取NH3,B符合题意;
C.NO2能与水反应,不能用排水法收集,C不符合题意;
D.Na2O2为粉末状固体,与水剧烈反应,不能用启普发生器的简易装置制取氧气,D不符合题意;
故选B。
8.B
【分析】收集装置中,气体从长导管进,短导管出,相当于使用向下排空气法收集气体说明该气体不与空气反应,且该气体密度小于空气,多余的气体可以用水吸收,且使用防倒吸装置说明该气体极易溶于水。
【详解】A.NO会与空气中的O2反应,A不符合题意;
B.氨气密度小于空气,极易溶于水,尾气吸收需要防倒吸,B符合题意;
C.NO2密度比空气大,应该采用向上排空气法收集,不能用此法收集二氧化氮,C不符合题意;
D.氮气的密度与空气接近,不能用排空气法进行收集,氮气与水不反应,N2不能用水作尾气处理装置,D不符合题意;
答案选B。
9.B
【详解】A. 盐酸和碳酸钙反应生成CO2,CO2与硅酸钠溶液反应生成硅酸白色沉淀,正确;
B. 浓硫酸与亚硫酸钠反应生成SO2,但SO2与氯化钡不反应,错误;
C. 过氧化氢在二氧化锰的作用下分解生成氧气,氧气把碘化钾氧化为单质碘,淀粉遇碘显蓝色,正确;
D. 浓盐酸与高锰酸钾混合生成氯气,氯气把硫化钠氧化为单质S,生成淡黄色沉淀,正确;
故选B。
10.B
【详解】A.实验室用MnO2和浓盐酸制取氯气,必须在加热条件下,故A错误;
B.实验室可以用氯化铵和氢氧化钙固体混合在加热条件下制取氨气,用向上排空气法收集氨气,收集氨气时,为了防止对流,在收集氨气的试管口放一团棉花,故B正确;
C.二氧化硫易溶于水,不能用排水法收集,故C错误;
D.用浓硝酸和铜制取NO2,铜和稀硝酸生成的是NO,故D错误;
故选B。
11.A
【详解】A.浓硫酸和Cu片的反应需要加热,图中的装置①没有加热装置,故不能用Cu片代替Na2SO3,A错误
B.装置②中的溴水是用来检验SO2的还原性的,可以用酸性高锰酸钾溶液代替溴水,B正确;
C.装置③中的Na2S溶液是用来检验SO2的氧化性的,反应的离子方程式为,其中SO2作氧化剂,现象是溶液变浑浊,C正确;
D.SO2不溶于CCl4,将SO2通入到装置④,不会引起倒吸,且SO2会被NaOH溶液吸收,不会被排放到空气中,D正确;
故选A。
12.D
【分析】由强酸制弱酸的原理可知,SO2与BaCl2溶液不反应,不可能生成BaSO3沉淀,通入另一种气体产生白色沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,否则不生成沉淀。
【详解】A. 通入氨气溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,A选项不符合题意;
B. NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,B选项不符合题意;
C. Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,C选项不符合题意;
D. 碳酸和亚硫酸均比盐酸的酸性弱,所以二氧化碳和二氧化硫与氯化钡均不反应,不会产生沉淀物,D选项符合题意;
答案选D。
【点睛】在复分解反应中,一般是较强酸制较弱酸;所以切记:CO2和SO2与BaCl2或CaCl2均不反应。
13. NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O 氢氧化钠溶于水放出大量热,且溶液中氢氧根离子浓度增大,抑制氨气的溶解,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出 因为氢氧化钠溶于水产生大量的热 D CaO+H2O=Ca(OH)2,消耗水并放热,Ca(OH)2和NH4Cl受热发生反应:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O D
【分析】(1)碳酸氢铵与氢氧化钠固体反应生成碳酸钠和氨气、水;
(2)依据氢氧化钠溶于水放出大量热,且溶液中氢氧根离子浓度增大,抑制氨气的溶解,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出解答;
(3)依据反应物状态和反应条件选择发生装置;生石灰溶于水生成氢氧化钙,且放出大量的热,氢氧化钙与氯化铵反应生成氨气,氨气受热挥发,据此解答;
(4)A.氨气的密度小于空气密度,且和氧气不反应;
B.有缓冲作用的装置能防止倒吸;
C.氨水溶液呈碱性,碱遇酚酞试液变红色;
D.该装置不能形成红色喷泉。
【详解】(1)固体NH4HCO3与NaOH在常温下反应产生碳酸钠、水、氨气,反应的化学方程式为:NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O;
(2)在氨水中存在化学平衡和电离平衡:NH3+H2ONH3·H2ONH4++OH-,将氨水加入到固体NaOH中时,NaOH溶解电离产生OH-,电离平衡逆向移动,c(NH3·H2O)增大,化学平衡逆向移动,分解产生氨气,而且NaOH固体溶解放出热量,降低氨气在水中的溶解度,会加快一水合氨的分解作用,从而得到更多的氨气;
(3)④NH4Cl浓溶液中加生石灰,物质的状态为固体与液体混合制取气体,反应不需要加热,所以应选择装置D为发生装置;生石灰溶于水生成氢氧化钙,且放出大量的热,氢氧化钙与氯化铵反应生成氨气,反应方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O,氨气受热挥发,因此可以制取氨气;
(4)A.氨气的密度比空气小,在室温下与空气的成分不能反应,所以可以用向下排空气方法收集氨气,A正确;
B.干燥管由于容积较大而具有缓冲作用,因此能防止倒吸,B正确;
C.若氨气收集满,就会通过导气管进入到烧杯的水中,与烧杯内的水反应产生一水合氨,一水合氨电离产生OH-而使水显碱性,碱遇酚酞试液就变红色,C正确;
D.干燥管有缓冲作用,烧杯中液体不能进入烧瓶中,因而不能形成红色喷泉,D错误;
故合理选项是D。
14.(1) 防倒吸 ①
(2) 分液漏斗 Cl2+SO2+2H2O=4H++2Cl-+SO
(3) ③④ C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(4) b c 溶液呈血红色 e 红色褪去为无色,加热后又变为红色
【分析】依据实验目的可知A、B气体中,一种是SO2,一种是Cl2,制备氯气中含有杂质氯化氢,需要通过饱和食盐水除去氯化氢,故装置B制取Cl2,装置A生成SO2,二者在D中进行反应,装置E可以除去未反应的气体,据此分析解答。
【详解】(1)根据分析,A装置为制取SO2的装置,因SO2易溶于水,故F仪器的作用为防倒吸;制取Cl2所用试剂为MnO2和浓盐酸,属于固、液混合加热制取气体,故应选①装置作为发生装置。
(2)图①中a为分液漏斗;D装置中,Cl2和SO2同时通入水中时,Cl2将SO2氧化生成H2SO4,Cl2被还原为HCl,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO。
(3)浓硫酸使蔗糖碳化,体现其③脱水性,体积膨胀,并放出有刺激性气味的气体,说明生成的C和浓硫酸反应生成了二氧化硫,体现浓硫酸的④强氧化性,即上述现象体现了浓硫酸的③脱水性和④强氧化性;浓硫酸与碳在加热条件下发生氧化还原反应生成二氧化碳、水和二氧化硫,反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(4)若Cl2过量,则在D中溶液中除含H2SO4、HCl外,还含有剩余Cl2及HClO,具有强氧化性,可将Fe2+氧化为Fe3+,滴加硫氰化钾溶液呈血红色,因此可先加b氯化亚铁溶液,后加c硫氰化钾溶液进行检验,现象为溶液呈血红色;若SO2过量,则在D溶液中含有SO2、H2SO3,SO2具有漂白性,能使品红溶液褪色,但SO2与品红化合生成的物质不稳定,加热会重新分解,溶液又变为红色,因此可选用e品红溶液进行检验,现象为红色褪去为无色,加热后又变为红色。
15. 打开分液漏斗旋塞 BD 取少量反应后的固体于试管中,加水溶解,滴加足量的硝酸银和稀硝酸溶液,若生成白色沉淀,则说明固体中含有氯离子 在装置D末端连接盛放NaOH溶液的尾气吸收装置
【分析】A中二氧化锰和浓盐酸共热反应生成氯气、氯化锰、水,用B装置中的饱和食盐水除去氯气中的氯化氢,装置C中潮湿的与反应生成,根据化合价升降规律,还应该有氯化钠生成,D中用液氨冷却收集。
【详解】(1)装置A中二氧化锰和浓盐酸加热生成氯气、氯化锰、水,发生反应的离子方程式;
(2)装置A的气密性检验方法为:用止水夹夹住装置A两端的橡胶管,打开分液漏斗旋塞,加水,一段时间后,水不能顺利流下,则气密性良好;
(3) A.与浓盐酸在常温下反应生成氯化钾、氯化锰、氯气、水,实验室也可用与浓盐酸反应制备氯气,故A正确;
B.用潮湿的与反应制取,氯气不需要干燥,B中试剂是饱和食盐水,目的是除去氯气中的氯化氢,故B错误;
C.浓度过高时易发生分解并爆炸,所以氮气的作用之一是稀释生成的,减少实验爆炸危险,故C正确;
D.Cl2O熔点为116℃,沸点为3.8℃,Cl2沸点为-34.6℃,液氨沸点为-33.5℃,D中用液氨冷却收集,氯气比Cl2O易挥发,因此从装置D中逸出气体的主要成分是,故D错误;
选BD;
(4)①装置C中潮湿的与以等物质的量反应,生成、气体和另一种盐X,根据化合价升降规律,生成盐X是氯化钠,所以该反应化学方程式为;
②X中的阴离子是氯离子,氯离子和硝酸银反应生成氯化银沉淀,检验氯离子的方法是:取少量反应后的固体于试管中,加水溶解,滴加足量的硝酸银和稀硝酸溶液,若生成白色沉淀,则说明固体中含有氯离子;
(5)氯气有毒,该装置没有尾气处理装置,为防止氯气污染空气,在装置D末端连接盛放NaOH溶液的尾气吸收装置。
答案第1页,共2页
答案第1页,共2页
一、单选题,共12小题
1.(2022·吉林·高一统考阶段练习)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作安全瓶防倒吸装置的是
A. B. C. D.
2.(2022·广西·高一校联考阶段练习)下列气体中,既可用排水法又可用向上排空气法收集的是
A.NO2 B.O2 C.SO2 D.NO
3.(2023·江苏扬州·高一统考期中)实验室用如图装置制氨气并验证氨气的某些化学性质,能达到实验目的的是
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
4.(2023·山东日照·高一期中)图中a、b、c表示相应仪器中加入的试剂,可用图装置制取、净化、收集的气体是
选项 气体 a b c
A SO2 浓硫酸 亚硫酸钠 碱石灰
B CO2 盐酸 碳酸钙 饱和NaHCO3
C NO 稀HNO3 铜屑 H2O
D NO2 浓HNO3 铜屑 NaOH溶液
A.A B.B C.C D.D
5.(2021·甘肃白银·高一校考阶段练习)用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
选项 A B C D
X 浓盐酸 浓硫酸 双氧水 浓氨水
Y KMnO4 C2H5OH MnO2 NaOH
气体 Cl2 C2H4 O2 NH3
A.A B.B C.C D.D
6.(2023·四川内江·高一四川省内江市第六中学校考阶段练习)利用如图装置可以进行实验并能达到实验目的的是( )
选项 实验目的 X中试剂 Y中试剂
A 用Na2SO3和浓硫酸制取并收集纯净干燥的SO2,并验证其漂白性 品红溶液 浓硫酸
B 用Cu与稀硝酸制取并收集纯净干燥的NO 水 浓硫酸
C 验证电石与饱和食盐水反应生成的气体的性质并收集 CuSO4溶液 KMnO4溶液
D 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 饱和食盐水 浓硫酸
A.A B.B C.C D.D
7.(2022·吉林长·高一长市第二实验中学校考阶段练习)下列实验方案最合理的是
A.制备并收集 B.制备氨气
C.制备并收集气体 D.制备氧气
8.(2021·河北邯郸·高一校联考期中)在实验室里可按如图所示装置干燥并收集气体R,且吸收多余的R气体,则R是
A.NO B.NH3 C.NO2 D.N2
9.(2023·全国·高一期中)用下图所示装置进行实验,下列实验现象描述错误的是
选项 试剂甲 试剂乙 试剂丙 丙中的现象
A 稀盐酸 CaCO3 Na2SiO3溶液 有白色沉淀生成
B 浓硫酸 Na2SO3 BaCl2溶液 有白色沉淀生成
C 过氧化氢 MnO2 酸性KI-淀粉溶液 溶液变为蓝色
D 浓盐酸 KMnO4 Na2S溶液 有淡黄色沉淀生成
A.A B.B C.C D.D
10.(2023·河南濮阳·高一濮阳一高校考阶段练习)下列有关气体的制备和收集正确的是
A.制取氯气 B.制取氨气
C.制取二氧化硫 D.制取二氧化氮
A.A B.B C.C D.D
11.(2021·广东·高一校联考阶段练习)某同学用浓硫酸与亚硫酸钠制备SO2并探究其相关性质,实验装置如图所示。
下列说法不正确的是
A.装置①中用Cu片代替Na2SO3也能达到实验目的
B.装置②中溴水可以用酸性高锰酸钾溶液代替
C.装置③中出现浑浊,说明SO2具有氧化性
D.装置④的作用是吸收SO2,防止发生倒吸和污染环境
12.(2021·山西太原·高一山西实验中学校考阶段练习)将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现白色沉淀,若再通入另一种气体X,有白色沉淀产生。则气体X不可能是
A.NH3 B.NO2 C.Cl2 D.CO2
二、非选择题,共3小题
13.(2023·安徽滁州·高一安徽省定远中学校考)实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。
写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。
(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
14.(2023·新疆伊犁·高一校联考期中)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是______,发生装置B应选择以下三种装置中的______(填①或②或③)。
(2)图①中a的仪器名称______,D装置中主要反应离子方程式为______。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的_____(填序号)①酸性②吸水性③脱水性④强氧化性,并写出“体积膨胀,并放出有刺激性气味的气体(SO2)”对应的化学方程式:_____。
(4)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
a.氯化铁溶液 b.氯化亚铁溶液 c.硫氰化钾溶液 d.氯化钡溶液 e.品红溶液 f.酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有______(选填一个序号)试剂的试管内,再加入______(选填一个序号)试剂。发生的现象是______。若SO2过量,取适量D中溶液滴加至盛有_____(选填一个序号)试剂的试管内,发生的现象是______。
15.(2023·全国·高一期中)Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取,反应装置如图所示(夹持装置已略)。
已知:Cl2O熔点为116℃,沸点为3.8℃,浓度过高或加热时易发生分解并爆炸。Cl2沸点为-34.6℃,液氨沸点为-33.5℃。
(1)写出装置A中发生反应的离子方程式:_______。
(2)检查虚框中装置气密性的方法为:用止水夹夹住装置A两端的橡胶管,_______,加水,一段时间后,水不能顺利流下,则气密性良好。
(3)下列有关该实验的说法中不正确的是_______。
A.实验室也可用KMnO4与浓盐酸反应制备氯气
B.B中试剂是浓硫酸,目的是干燥氯气
C.氮气的作用之一是稀释生成的Cl2O,减少实验爆炸危险
D.从装置D中逸出气体的主要成分是Cl2O
(4)①装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐X,试写出该反应化学方程式_______。
②设计实验方案验证C中生成的产物中另一种盐X中的阴离子_______。
(5)该实验装置存在一处明显的不足,其改进措施为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.该装置是排液量气装置,故A错误;
B.该装置可作为安全瓶防倒吸,因为进气管较短(刚漏出瓶塞)若发生倒吸,倒吸液会被盛装在B 瓶中,不会再倒流到前一装置,从而防止倒吸,故B正确;
C.该装置是混气装置,进入C 瓶中两气体在C 瓶中充分混合,故C错误;
D.该装置是洗气装置,故D错误;
故选B。
2.B
【分析】气体可用排水法收集,则气体不溶于水且不与水反应,气体可用向上排空气法收集,则气体密度比空气大且不与空气中物质反应。
【详解】A.NO2能溶于水且与水反应,不能用排水法收集,A错误;
B.O2不溶于水且不与水反应,可用排水法收集,密度比空气大且不与空气中物质反应,可用向上排空气法收集,B正确;
C.SO2能溶于水且与水反应,不能用排水法收集,C错误;
D.NO能与空气中氧气反应,不能用排空气法收集,D错误;
答案选B。
3.C
【详解】A.与反应生成,不加热的情况下难以分解,无生成,故无法制备氨气,A项错误;
B.与浓反应,不能用浓干燥,B项错误;
C.与反应生成和,黑色的转化为红色的,N元素的化合价升高,说明具有还原性,C项正确;
D.苯的密度比水的密度小,在上层,直接通入下层的水中,会发生倒吸,D项错误;
答案选C。
4.B
【详解】A.亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫能与碱石灰反应,不能用碱石灰来吸收二氧化硫的水气,故A错误;
B.盐酸和碳酸钙反应生成二氧化碳,盐酸有挥发性,所以生成的二氧化碳中有氯化氢,氯化氢和碳酸氢钠反应生成二氧化碳,饱和的碳酸氢钠和二氧化碳不反应,所以可用饱和碳酸氢钠洗气,二氧化碳的密度大于空气的密度,所以可用向上排空气法收集,故B正确;
C.铜和稀硝酸反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以不能用排空气法收集一氧化氮,故C错误;
D.铜和浓硝酸反应生成二氧化氮,浓硝酸有挥发性,所以二氧化氮中有硝酸,硝酸能和碱反应,二氧化氮和碱也反应,所以不能用氢氧化钠洗气,故D错误;
答案为B。
5.C
【详解】A.浓盐酸和KMnO4固体混合有氯气生成,但氯气溶于水,且与水发生反应,则不能用排水法收集,故A不符合题意;
B.在浓硫酸存在下,乙醇消去制乙烯需要迅速升温到,故B不符合题意;
C.双氧水分解制氧气,制取装置不需要加热,收集氧气可以用排水法,故C符合题意;
D.氨气极易溶于水,不能用排水法收集,故D不符合题意;
故选:C。
6.A
【详解】A.Na2SO3和浓硫酸生成二氧化硫,二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫,浓硫酸具有吸水性且和二氧化硫不反应,所以能干燥二氧化硫,二氧化硫密度大于空气,所以采用此法排空气收集,二氧化硫有毒,不能直接排空,应该有尾气处理装置,故A能达到实验目的;
B.用Cu与稀硝酸制取一氧化氮中含有挥发出来的硝酸,一氧化氮难溶于水,可用水除去硝酸,再用浓硫酸干燥,但是一氧化氮能与氧气反应,不能用排空气法收集,故B不能达到实验目的;
C.电石与饱和食盐水反应生成的乙炔中混有硫化氢,选硫酸铜可除去,Y中高锰酸钾可氧化乙炔,后续装置不能收集乙炔气体,故C不能达到实验目的;
D.MnO2和浓盐酸常温下不反应,缺少加热装置,故D不能达到实验目的;
答案选A。
7.B
【详解】A.Cl2的密度比空气大,收集时应长管进短管出,应用向上排空气法,A不符合题意;
B.浓氨水滴入CaO中,CaO与水反应放热,NH3·H2O受热分解并挥发出NH3,可以制取NH3,B符合题意;
C.NO2能与水反应,不能用排水法收集,C不符合题意;
D.Na2O2为粉末状固体,与水剧烈反应,不能用启普发生器的简易装置制取氧气,D不符合题意;
故选B。
8.B
【分析】收集装置中,气体从长导管进,短导管出,相当于使用向下排空气法收集气体说明该气体不与空气反应,且该气体密度小于空气,多余的气体可以用水吸收,且使用防倒吸装置说明该气体极易溶于水。
【详解】A.NO会与空气中的O2反应,A不符合题意;
B.氨气密度小于空气,极易溶于水,尾气吸收需要防倒吸,B符合题意;
C.NO2密度比空气大,应该采用向上排空气法收集,不能用此法收集二氧化氮,C不符合题意;
D.氮气的密度与空气接近,不能用排空气法进行收集,氮气与水不反应,N2不能用水作尾气处理装置,D不符合题意;
答案选B。
9.B
【详解】A. 盐酸和碳酸钙反应生成CO2,CO2与硅酸钠溶液反应生成硅酸白色沉淀,正确;
B. 浓硫酸与亚硫酸钠反应生成SO2,但SO2与氯化钡不反应,错误;
C. 过氧化氢在二氧化锰的作用下分解生成氧气,氧气把碘化钾氧化为单质碘,淀粉遇碘显蓝色,正确;
D. 浓盐酸与高锰酸钾混合生成氯气,氯气把硫化钠氧化为单质S,生成淡黄色沉淀,正确;
故选B。
10.B
【详解】A.实验室用MnO2和浓盐酸制取氯气,必须在加热条件下,故A错误;
B.实验室可以用氯化铵和氢氧化钙固体混合在加热条件下制取氨气,用向上排空气法收集氨气,收集氨气时,为了防止对流,在收集氨气的试管口放一团棉花,故B正确;
C.二氧化硫易溶于水,不能用排水法收集,故C错误;
D.用浓硝酸和铜制取NO2,铜和稀硝酸生成的是NO,故D错误;
故选B。
11.A
【详解】A.浓硫酸和Cu片的反应需要加热,图中的装置①没有加热装置,故不能用Cu片代替Na2SO3,A错误
B.装置②中的溴水是用来检验SO2的还原性的,可以用酸性高锰酸钾溶液代替溴水,B正确;
C.装置③中的Na2S溶液是用来检验SO2的氧化性的,反应的离子方程式为,其中SO2作氧化剂,现象是溶液变浑浊,C正确;
D.SO2不溶于CCl4,将SO2通入到装置④,不会引起倒吸,且SO2会被NaOH溶液吸收,不会被排放到空气中,D正确;
故选A。
12.D
【分析】由强酸制弱酸的原理可知,SO2与BaCl2溶液不反应,不可能生成BaSO3沉淀,通入另一种气体产生白色沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,否则不生成沉淀。
【详解】A. 通入氨气溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,A选项不符合题意;
B. NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,B选项不符合题意;
C. Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,C选项不符合题意;
D. 碳酸和亚硫酸均比盐酸的酸性弱,所以二氧化碳和二氧化硫与氯化钡均不反应,不会产生沉淀物,D选项符合题意;
答案选D。
【点睛】在复分解反应中,一般是较强酸制较弱酸;所以切记:CO2和SO2与BaCl2或CaCl2均不反应。
13. NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O 氢氧化钠溶于水放出大量热,且溶液中氢氧根离子浓度增大,抑制氨气的溶解,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出 因为氢氧化钠溶于水产生大量的热 D CaO+H2O=Ca(OH)2,消耗水并放热,Ca(OH)2和NH4Cl受热发生反应:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O D
【分析】(1)碳酸氢铵与氢氧化钠固体反应生成碳酸钠和氨气、水;
(2)依据氢氧化钠溶于水放出大量热,且溶液中氢氧根离子浓度增大,抑制氨气的溶解,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出解答;
(3)依据反应物状态和反应条件选择发生装置;生石灰溶于水生成氢氧化钙,且放出大量的热,氢氧化钙与氯化铵反应生成氨气,氨气受热挥发,据此解答;
(4)A.氨气的密度小于空气密度,且和氧气不反应;
B.有缓冲作用的装置能防止倒吸;
C.氨水溶液呈碱性,碱遇酚酞试液变红色;
D.该装置不能形成红色喷泉。
【详解】(1)固体NH4HCO3与NaOH在常温下反应产生碳酸钠、水、氨气,反应的化学方程式为:NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O;
(2)在氨水中存在化学平衡和电离平衡:NH3+H2ONH3·H2ONH4++OH-,将氨水加入到固体NaOH中时,NaOH溶解电离产生OH-,电离平衡逆向移动,c(NH3·H2O)增大,化学平衡逆向移动,分解产生氨气,而且NaOH固体溶解放出热量,降低氨气在水中的溶解度,会加快一水合氨的分解作用,从而得到更多的氨气;
(3)④NH4Cl浓溶液中加生石灰,物质的状态为固体与液体混合制取气体,反应不需要加热,所以应选择装置D为发生装置;生石灰溶于水生成氢氧化钙,且放出大量的热,氢氧化钙与氯化铵反应生成氨气,反应方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O,氨气受热挥发,因此可以制取氨气;
(4)A.氨气的密度比空气小,在室温下与空气的成分不能反应,所以可以用向下排空气方法收集氨气,A正确;
B.干燥管由于容积较大而具有缓冲作用,因此能防止倒吸,B正确;
C.若氨气收集满,就会通过导气管进入到烧杯的水中,与烧杯内的水反应产生一水合氨,一水合氨电离产生OH-而使水显碱性,碱遇酚酞试液就变红色,C正确;
D.干燥管有缓冲作用,烧杯中液体不能进入烧瓶中,因而不能形成红色喷泉,D错误;
故合理选项是D。
14.(1) 防倒吸 ①
(2) 分液漏斗 Cl2+SO2+2H2O=4H++2Cl-+SO
(3) ③④ C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(4) b c 溶液呈血红色 e 红色褪去为无色,加热后又变为红色
【分析】依据实验目的可知A、B气体中,一种是SO2,一种是Cl2,制备氯气中含有杂质氯化氢,需要通过饱和食盐水除去氯化氢,故装置B制取Cl2,装置A生成SO2,二者在D中进行反应,装置E可以除去未反应的气体,据此分析解答。
【详解】(1)根据分析,A装置为制取SO2的装置,因SO2易溶于水,故F仪器的作用为防倒吸;制取Cl2所用试剂为MnO2和浓盐酸,属于固、液混合加热制取气体,故应选①装置作为发生装置。
(2)图①中a为分液漏斗;D装置中,Cl2和SO2同时通入水中时,Cl2将SO2氧化生成H2SO4,Cl2被还原为HCl,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO。
(3)浓硫酸使蔗糖碳化,体现其③脱水性,体积膨胀,并放出有刺激性气味的气体,说明生成的C和浓硫酸反应生成了二氧化硫,体现浓硫酸的④强氧化性,即上述现象体现了浓硫酸的③脱水性和④强氧化性;浓硫酸与碳在加热条件下发生氧化还原反应生成二氧化碳、水和二氧化硫,反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
(4)若Cl2过量,则在D中溶液中除含H2SO4、HCl外,还含有剩余Cl2及HClO,具有强氧化性,可将Fe2+氧化为Fe3+,滴加硫氰化钾溶液呈血红色,因此可先加b氯化亚铁溶液,后加c硫氰化钾溶液进行检验,现象为溶液呈血红色;若SO2过量,则在D溶液中含有SO2、H2SO3,SO2具有漂白性,能使品红溶液褪色,但SO2与品红化合生成的物质不稳定,加热会重新分解,溶液又变为红色,因此可选用e品红溶液进行检验,现象为红色褪去为无色,加热后又变为红色。
15. 打开分液漏斗旋塞 BD 取少量反应后的固体于试管中,加水溶解,滴加足量的硝酸银和稀硝酸溶液,若生成白色沉淀,则说明固体中含有氯离子 在装置D末端连接盛放NaOH溶液的尾气吸收装置
【分析】A中二氧化锰和浓盐酸共热反应生成氯气、氯化锰、水,用B装置中的饱和食盐水除去氯气中的氯化氢,装置C中潮湿的与反应生成,根据化合价升降规律,还应该有氯化钠生成,D中用液氨冷却收集。
【详解】(1)装置A中二氧化锰和浓盐酸加热生成氯气、氯化锰、水,发生反应的离子方程式;
(2)装置A的气密性检验方法为:用止水夹夹住装置A两端的橡胶管,打开分液漏斗旋塞,加水,一段时间后,水不能顺利流下,则气密性良好;
(3) A.与浓盐酸在常温下反应生成氯化钾、氯化锰、氯气、水,实验室也可用与浓盐酸反应制备氯气,故A正确;
B.用潮湿的与反应制取,氯气不需要干燥,B中试剂是饱和食盐水,目的是除去氯气中的氯化氢,故B错误;
C.浓度过高时易发生分解并爆炸,所以氮气的作用之一是稀释生成的,减少实验爆炸危险,故C正确;
D.Cl2O熔点为116℃,沸点为3.8℃,Cl2沸点为-34.6℃,液氨沸点为-33.5℃,D中用液氨冷却收集,氯气比Cl2O易挥发,因此从装置D中逸出气体的主要成分是,故D错误;
选BD;
(4)①装置C中潮湿的与以等物质的量反应,生成、气体和另一种盐X,根据化合价升降规律,生成盐X是氯化钠,所以该反应化学方程式为;
②X中的阴离子是氯离子,氯离子和硝酸银反应生成氯化银沉淀,检验氯离子的方法是:取少量反应后的固体于试管中,加水溶解,滴加足量的硝酸银和稀硝酸溶液,若生成白色沉淀,则说明固体中含有氯离子;
(5)氯气有毒,该装置没有尾气处理装置,为防止氯气污染空气,在装置D末端连接盛放NaOH溶液的尾气吸收装置。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
