1.3电能转化为化学能——电解原理的应用(第二课时)课件 (共26张PPT)2022-2023学年鲁科版(2019)高中化学选择性必修一
文档属性
| 名称 | 1.3电能转化为化学能——电解原理的应用(第二课时)课件 (共26张PPT)2022-2023学年鲁科版(2019)高中化学选择性必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 99.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 11:01:23 | ||
图片预览








文档简介
(共26张PPT)
电能转化为化学能——电解原理的应用(第二课时)
修复被84消毒液腐蚀的镀铜门把手
疫情防控期间,每天用84消毒液擦拭门把手,久而久之,门把手表面的铜镀层被腐蚀出现破损,如何修补铜镀层呢?需要哪些原料?
任务一:探究原理
【查阅资料】门把手基体材质为铁,表面镀铜,活泼性Fe>Cu,依据何种原理修复?
①依据氧化还原原理,Fe可将Cu2+置换,可通过置换反应进行化学修补,用含有Cu2+的盐溶液浸泡门把手,该反应为Fe+Cu2+=Fe2++Cu
优点:操作简单
缺点:进一步消耗门把手的基体铁,修补后表面仍然凹凸不平;镀层不致密
该方法有哪些优点、缺点呢?
②结合上节课电解池,可否利用电解原理修复?
电源:220V交流电 、充电宝(5V直流电)
从安全性和电解池电流方向稳定性考虑,
电源、离子导体、电子导体、电极材料怎样选取?
依据电解池模型,Cu2++2e-=Cu ,
可以将门把手作为阴极
任务一:探究原理
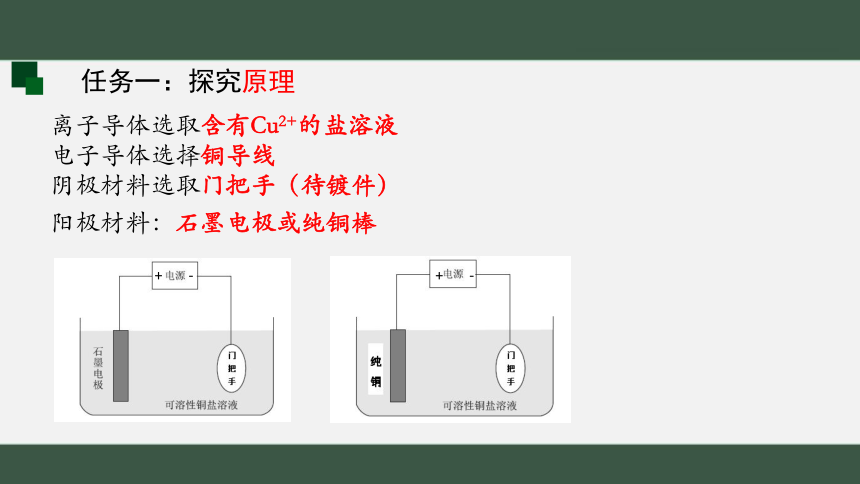
电源选择充电宝(5V直流电)
离子导体选取含有Cu2+的盐溶液
电子导体选择铜导线
阴极材料选取门把手(待镀件)
任务一:探究原理
阳极材料:石墨电极或纯铜棒
+
-
+
-
任务二:寻找原料
【思考】如何利用居家材料,制备含Cu2+的电解质溶液作为离子导体?
废旧铜电线(紫铜,Cu含量≥99%)
废旧铜阀门(黄铜,Cu、Zn合金)
【质疑】①白醋(含有CH3COOH)可否溶解Cu?
根据金属活动性顺序,CH3COOH与Cu不自发
缺点:步骤繁琐,反应较慢,产率低
2Cu+O2=2CuO
CuO+2CH3COOH=Cu(CH3COO)2+H2O
△
②可否将铜丝加热变为黑色氧化铜,再加入白醋溶解?
任务二:寻找原料
【思考】回顾上节课,用铜导线连接碳棒电解食盐水,
铜丝与石墨作阳极,Cu优先放电Cu—2e—=Cu2+
任务二:寻找原料
③可通过电解方法,让废旧铜导线或铜阀门作电解池阳极,实现Cu-2e-=Cu2+
废旧铜阀门成分为黄铜,含有Cu、Zn,价格低
废旧铜导线成分为紫铜,Cu含量≥99%,价格高
【思考】选择哪种材料作为阳极材料?
从成本和实验效果角度考虑
任务二:寻找原料
【思考】从原材料成本角度考虑,选择黄铜(Cu、Zn合金)合适,但黄铜中含有的Zn是否会变为Zn2+ 进入溶液中?Zn2+会不会对阴极Cu2++2e-=Cu造成干扰?
阴极:由离子放电顺序可知,得电子能力Cu2+>Zn2+
Cu2+优先于Zn2+ 得电子析出,
选择黄铜(Cu、Zn合金)不会对Cu2+造成干扰
任务二:寻找原料
阳极:活泼性Zn>Cu,Zn-2e-=Zn2+ ,Cu-2e-=Cu2+
Zn2+能进入离子导体中
【思考】选择何种电解质溶液作为离子导体?
纯净水、食醋、食盐水、纯碱溶液,哪一种合适?
纯净水导电能力较差,不合适
根据离子放电顺序,
食盐溶液中阴极发生反应2H2O+2e-=H2↑+2OH-
OH-与Cu2+反应生成Cu(OH)2,不合适
纯碱溶液中的CO32-与Cu2+反应,不合适
综合考虑,食醋(含有CH3COOH)最合适
任务二:寻找原料
任务二:寻找原料
当溶液变为蓝色时,停止通电。发现阳极底部附近有少量固体沉积
【思考】阳极底部固体如何产生的?应如何处理?
阳极底部固体称为阳极泥
阳极泥的来源:银等不如铜活泼的金属在电解过程中不发生氧化反应,最终沉积在电解池的底部,与其他不溶性杂质形成阳极泥
过滤阳极泥
任务二:寻找原料
【拓展应用】铜是重要的金属材料, 它的主要用途之一是制作导线, 这要求铜具有很高的纯度。 工业上主要从黄铜矿中提炼铜。 冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铅等杂质, 俗称粗铜。这些杂质的存在使粗铜的导电性不够理想,如何将粗铜提炼变为精铜?
粗铜作为阳极,精铜作为阴极,电解质溶液为硫酸酸化的CuSO4溶液
阳极发生的主要是铜电极材料氧化为Cu2+ 的反应
阳极:Cu-2e-=Cu2+ Zn-2e-=Zn2+ Fe-2e-=Fe2+
阴极:Cu2++2e-=Cu
任务二:寻找原料
图示:铜的电解精炼
任务二:寻找原料
将门把手拆卸,用导线连接电源负极放入含Cu2+的离子导体中,用石墨棒做阳极进行电镀
[思考]1.如何设计电镀装置?
任务三:设计原创
若不慎将镀件连接电源正极,会产生何种后果?
镀件中金属失电子,
加快镀件腐蚀
①拆卸门把手麻烦
②门把手铜镀层只有部分破损,将门把手全部浸入后,无法修补凹陷缺损的部位,不仅浪费电镀液,而且门把手表面将全部电镀,破坏原有的铜镀层,不美观
[思考]2.实际操作过程中会遇到什么困难
任务三:设计原创
能否参照刷油漆修补破损油漆层的方法,用刷子做电极,蘸取电镀液,刷在破损部位,进行电刷镀?可用棉花包裹电极增加接触面积
[思考]3.如何既不破坏原镀层,又能进行局部精准修复?参照修补刷漆的方式
任务三:设计原创
设计电刷镀装置
阳极选择石墨棒还是铜棒?
方案1:石墨棒接电源正极,镀件门把手接电源负极 ,棉花包裹石墨棒蘸取电镀液
任务三:设计原创
任务三:设计原创
方案2:铜棒(多股铜丝缠绕而成)接电源正极,镀件门把手接电源负极 ,棉花包裹铜棒蘸取电镀液
任务三:设计原创
实施方案2(铜棒+棉花作阳极)
用棉花+石墨棒作阳极,蘸取醋酸铜溶液刷镀过程中,刷镀的铜镀层与阳极长时间接触后变黑,发现阳极有气泡产生,请解释该现象
任务四:查找原因
由阳极放电顺序可知,石墨作惰性电极,OH—放电
4OH--4e-=2H2O+O2↑,阴极生成的铜被阳极新生成的活性O2氧化
实施方案2(石墨棒+棉花作阳极)
方案1中石墨作阳极,为惰性电极,较难被消耗,但是容易产生活性O2,极易氧化铜镀层,影响电镀效果
方案2中铜棒作阳极,可补充离子导体中的Cu2+,不会产生O2,但阳极铜棒会不断被消耗,需要定期更换
【思考】方案1和方案2,从刷镀效果和电极稳定性角度,比较两种方案异同
任务四:查找原因
①若使用碳棒作阳极,应该不断移动碳棒进行刷镀,避免碳棒与镀件在相同位置长时间接触,导致OH-放电产生的O2积聚,氧化铜镀层
②适当增加电镀液浓度、提高电压可以加快刷镀效果
使用自制电刷镀机有哪些注意事项?
任务四:查找原因
1.确定阳极
①阳极材料
②阳极反应物
2.确定阴极
①阴极材料
②阴极反应物
3.构成闭合回路
①离子导体②电子导体
实验现象
任务五:总结原型
总结设计电镀装置的关键问题
①如何使镀层金属沉积在待镀金属表面?
②是否需要补充消耗的镀层物质?如何补充?
原理维度
1.原理
2.原料
3.原创
4.原因
5.原型
装置维度
任务五:总结原型
电解修复铜镀层
废旧黄铜件,白醋,碳棒,充电宝,棉花
设计电刷镀装置
铜镀层为何变黑?
原理维度
构建设计电镀装置的思路模型
电能转化为化学能——电解原理的应用(第二课时)
修复被84消毒液腐蚀的镀铜门把手
疫情防控期间,每天用84消毒液擦拭门把手,久而久之,门把手表面的铜镀层被腐蚀出现破损,如何修补铜镀层呢?需要哪些原料?
任务一:探究原理
【查阅资料】门把手基体材质为铁,表面镀铜,活泼性Fe>Cu,依据何种原理修复?
①依据氧化还原原理,Fe可将Cu2+置换,可通过置换反应进行化学修补,用含有Cu2+的盐溶液浸泡门把手,该反应为Fe+Cu2+=Fe2++Cu
优点:操作简单
缺点:进一步消耗门把手的基体铁,修补后表面仍然凹凸不平;镀层不致密
该方法有哪些优点、缺点呢?
②结合上节课电解池,可否利用电解原理修复?
电源:220V交流电 、充电宝(5V直流电)
从安全性和电解池电流方向稳定性考虑,
电源、离子导体、电子导体、电极材料怎样选取?
依据电解池模型,Cu2++2e-=Cu ,
可以将门把手作为阴极
任务一:探究原理
电源选择充电宝(5V直流电)
离子导体选取含有Cu2+的盐溶液
电子导体选择铜导线
阴极材料选取门把手(待镀件)
任务一:探究原理
阳极材料:石墨电极或纯铜棒
+
-
+
-
任务二:寻找原料
【思考】如何利用居家材料,制备含Cu2+的电解质溶液作为离子导体?
废旧铜电线(紫铜,Cu含量≥99%)
废旧铜阀门(黄铜,Cu、Zn合金)
【质疑】①白醋(含有CH3COOH)可否溶解Cu?
根据金属活动性顺序,CH3COOH与Cu不自发
缺点:步骤繁琐,反应较慢,产率低
2Cu+O2=2CuO
CuO+2CH3COOH=Cu(CH3COO)2+H2O
△
②可否将铜丝加热变为黑色氧化铜,再加入白醋溶解?
任务二:寻找原料
【思考】回顾上节课,用铜导线连接碳棒电解食盐水,
铜丝与石墨作阳极,Cu优先放电Cu—2e—=Cu2+
任务二:寻找原料
③可通过电解方法,让废旧铜导线或铜阀门作电解池阳极,实现Cu-2e-=Cu2+
废旧铜阀门成分为黄铜,含有Cu、Zn,价格低
废旧铜导线成分为紫铜,Cu含量≥99%,价格高
【思考】选择哪种材料作为阳极材料?
从成本和实验效果角度考虑
任务二:寻找原料
【思考】从原材料成本角度考虑,选择黄铜(Cu、Zn合金)合适,但黄铜中含有的Zn是否会变为Zn2+ 进入溶液中?Zn2+会不会对阴极Cu2++2e-=Cu造成干扰?
阴极:由离子放电顺序可知,得电子能力Cu2+>Zn2+
Cu2+优先于Zn2+ 得电子析出,
选择黄铜(Cu、Zn合金)不会对Cu2+造成干扰
任务二:寻找原料
阳极:活泼性Zn>Cu,Zn-2e-=Zn2+ ,Cu-2e-=Cu2+
Zn2+能进入离子导体中
【思考】选择何种电解质溶液作为离子导体?
纯净水、食醋、食盐水、纯碱溶液,哪一种合适?
纯净水导电能力较差,不合适
根据离子放电顺序,
食盐溶液中阴极发生反应2H2O+2e-=H2↑+2OH-
OH-与Cu2+反应生成Cu(OH)2,不合适
纯碱溶液中的CO32-与Cu2+反应,不合适
综合考虑,食醋(含有CH3COOH)最合适
任务二:寻找原料
任务二:寻找原料
当溶液变为蓝色时,停止通电。发现阳极底部附近有少量固体沉积
【思考】阳极底部固体如何产生的?应如何处理?
阳极底部固体称为阳极泥
阳极泥的来源:银等不如铜活泼的金属在电解过程中不发生氧化反应,最终沉积在电解池的底部,与其他不溶性杂质形成阳极泥
过滤阳极泥
任务二:寻找原料
【拓展应用】铜是重要的金属材料, 它的主要用途之一是制作导线, 这要求铜具有很高的纯度。 工业上主要从黄铜矿中提炼铜。 冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铅等杂质, 俗称粗铜。这些杂质的存在使粗铜的导电性不够理想,如何将粗铜提炼变为精铜?
粗铜作为阳极,精铜作为阴极,电解质溶液为硫酸酸化的CuSO4溶液
阳极发生的主要是铜电极材料氧化为Cu2+ 的反应
阳极:Cu-2e-=Cu2+ Zn-2e-=Zn2+ Fe-2e-=Fe2+
阴极:Cu2++2e-=Cu
任务二:寻找原料
图示:铜的电解精炼
任务二:寻找原料
将门把手拆卸,用导线连接电源负极放入含Cu2+的离子导体中,用石墨棒做阳极进行电镀
[思考]1.如何设计电镀装置?
任务三:设计原创
若不慎将镀件连接电源正极,会产生何种后果?
镀件中金属失电子,
加快镀件腐蚀
①拆卸门把手麻烦
②门把手铜镀层只有部分破损,将门把手全部浸入后,无法修补凹陷缺损的部位,不仅浪费电镀液,而且门把手表面将全部电镀,破坏原有的铜镀层,不美观
[思考]2.实际操作过程中会遇到什么困难
任务三:设计原创
能否参照刷油漆修补破损油漆层的方法,用刷子做电极,蘸取电镀液,刷在破损部位,进行电刷镀?可用棉花包裹电极增加接触面积
[思考]3.如何既不破坏原镀层,又能进行局部精准修复?参照修补刷漆的方式
任务三:设计原创
设计电刷镀装置
阳极选择石墨棒还是铜棒?
方案1:石墨棒接电源正极,镀件门把手接电源负极 ,棉花包裹石墨棒蘸取电镀液
任务三:设计原创
任务三:设计原创
方案2:铜棒(多股铜丝缠绕而成)接电源正极,镀件门把手接电源负极 ,棉花包裹铜棒蘸取电镀液
任务三:设计原创
实施方案2(铜棒+棉花作阳极)
用棉花+石墨棒作阳极,蘸取醋酸铜溶液刷镀过程中,刷镀的铜镀层与阳极长时间接触后变黑,发现阳极有气泡产生,请解释该现象
任务四:查找原因
由阳极放电顺序可知,石墨作惰性电极,OH—放电
4OH--4e-=2H2O+O2↑,阴极生成的铜被阳极新生成的活性O2氧化
实施方案2(石墨棒+棉花作阳极)
方案1中石墨作阳极,为惰性电极,较难被消耗,但是容易产生活性O2,极易氧化铜镀层,影响电镀效果
方案2中铜棒作阳极,可补充离子导体中的Cu2+,不会产生O2,但阳极铜棒会不断被消耗,需要定期更换
【思考】方案1和方案2,从刷镀效果和电极稳定性角度,比较两种方案异同
任务四:查找原因
①若使用碳棒作阳极,应该不断移动碳棒进行刷镀,避免碳棒与镀件在相同位置长时间接触,导致OH-放电产生的O2积聚,氧化铜镀层
②适当增加电镀液浓度、提高电压可以加快刷镀效果
使用自制电刷镀机有哪些注意事项?
任务四:查找原因
1.确定阳极
①阳极材料
②阳极反应物
2.确定阴极
①阴极材料
②阴极反应物
3.构成闭合回路
①离子导体②电子导体
实验现象
任务五:总结原型
总结设计电镀装置的关键问题
①如何使镀层金属沉积在待镀金属表面?
②是否需要补充消耗的镀层物质?如何补充?
原理维度
1.原理
2.原料
3.原创
4.原因
5.原型
装置维度
任务五:总结原型
电解修复铜镀层
废旧黄铜件,白醋,碳棒,充电宝,棉花
设计电刷镀装置
铜镀层为何变黑?
原理维度
构建设计电镀装置的思路模型
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
