专题2《化学反应速率与化学平衡》检测(含解析)题2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》检测(含解析)题2022-2023学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 975.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-06 21:57:20 | ||
图片预览




文档简介
专题2《化学反应速率与化学平衡》检测题
一、单选题
1.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和图示相符的是
选项 A B C D
研究目的 压强对反应的影响 温度对反应的影响 平衡体系中增加N2对反应的影响 催化剂对反应的影响
图示
A.A B.B C.C D.D
2.一定温度下,某容积为1L的恒容密闭容器中通入2molSO2和1molO2,发生反应: (Q>0)。下列有关说法正确的是
A.该反应在高温下才能自发进行
B.充入少量He使体系压强增大,v正、v逆均不变
C.若该反应的活化能为akJ/mol,则其逆反应的活化能为(Q-a)kJ/mol
D.当SO2和O2转化率相等时,该反应达到化学平衡状态
3.750℃时,和发生的两个反应的方程式分别如下:
①;
②;
下列说法正确的是
A.反应①的平衡常数可表示为
B.反应②的
C.如希望尽可能转化为NO,可利用催化剂的选择性
D.反应②的
4.由下列实验操作及现象不能得出相应结论的是
选项 实验操作 现象 结论
A 将盛有相同浓度的CuCl2溶液的两支试管分别置于冷水和热水中 冷水中溶液呈蓝色,热水中则为黄色 Cu2+在不同温度下颜色不同
B 向填充有经硫酸处理的K2Cr2O7的导管中吹入乙醇蒸气 固体由橙色变为绿色 乙醇具有还原性
C 向盛有FeCl2溶波的试管中加入酸化后的H2O2溶液 溶液变为棕黄色且出现无色气泡 生成了Fe3+,同时Fe3+催化分解H2O2
D 用玻璃棒蘸取Na2O2与足量水反应后得到的溶液,点在pH试纸上 pH试纸呈蓝色 反应生成了碱
A.A B.B C.C D.D
5.下列措施对增大反应速率明显有效的是
A.Al在氧气中燃烧生成Al2O3,将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末
C.Na与水反应时增大水的用量
D.Zn与稀硫酸反应时,适当提高溶液的温度
6.一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2=1:3
B.当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡
C.X、Y的转化率不相等
D.0≤c2≤0.42
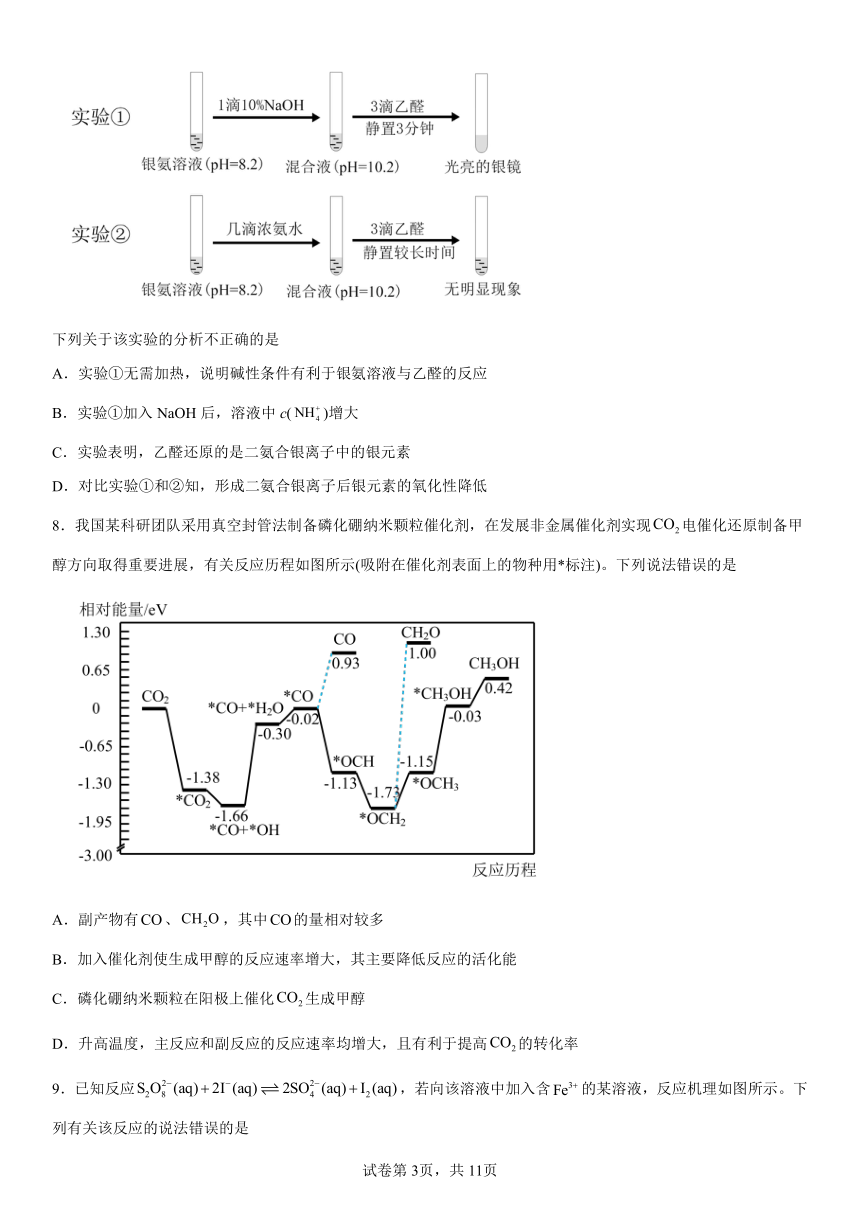
7.某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。
已知[Ag(NH3)2]+Ag++2NH3
下列关于该实验的分析不正确的是
A.实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应
B.实验①加入NaOH后,溶液中c()增大
C.实验表明,乙醛还原的是二氨合银离子中的银元素
D.对比实验①和②知,形成二氨合银离子后银元素的氧化性降低
8.我国某科研团队采用真空封管法制备磷化硼纳米颗粒催化剂,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,有关反应历程如图所示(吸附在催化剂表面上的物种用*标注)。下列说法错误的是
A.副产物有、,其中的量相对较多
B.加入催化剂使生成甲醇的反应速率增大,其主要降低反应的活化能
C.磷化硼纳米颗粒在阳极上催化生成甲醇
D.升高温度,主反应和副反应的反应速率均增大,且有利于提高的转化率
9.已知反应,若向该溶液中加入含的某溶液,反应机理如图所示。下列有关该反应的说法错误的是
①
②
A.反应①和反应②相比,反应②更容易发生
B.是该反应的催化剂
C.增大的浓度,能够加快反应速率
D.若不加,正反应的活化能比逆反应的活化能大
10.下列相关实验不能达到预期目的的是
相关实验 预期目的
A 相同温度下,等质量的大理石块。大理石粉分别与等体积、等浓度的盐酸反应 探究接触面积对化学反应速率的影响
B 把装有颜色相同的和混合气的两支试管(密封)分别浸入冷水和热水中 探究温度对化学平衡的影响
C 在等体积等浓度的草酸()无色溶液中,加入不同浓度等体积的高锰酸钾 探究反应物浓度对化学反应速率的影响
D 两支试管中装有等体积、等浓度溶液,向其中一支试管中加入溶液 探究溶液对分解速率的影响
A.A B.B C.C D.D
11.实验证据推理是化学研究的常用方法,下列实验操作和现象均正确,并一定能得到正确结论的是
选项 实验操作 现象 结论
A 密闭环境中,将浓盐酸滴加到小苏打溶液中,并将产生的气体通入水玻璃中 水玻璃中出现白色胶状沉淀 非金属性:C>Si
B 取少量硫酸酸化的溶液,先加入几滴双氧水,再加入几滴KSCN溶液 加入KSCN后溶液变红 该溶液已经氧化变质
C 取两支相同的试管,分别加入2mL 0.1mol/L和1mL 0.1mol/L溶液,再同时向两支试管中加入2mL 0.1mol/L 溶液 加入2mL 溶液的试管出现浑浊时间短 其他条件相同,溶液浓度越大,和反应的速率越快
D 取2mL 0.5mol/L的溶液于试管中,置于冷水中,一段时间后取出逐渐加热 冷水中的溶液为蓝色,加热后逐渐变黄 是吸热反应
A.A B.B C.C D.D
12.T℃时,将0.10 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)2NO2(g) ΔH>0,实验数据如图。下列说法错误的是
A.混合气体的密度始终保持不变
B.a点v正>v逆
C.60秒后,再充入少量NO2或N2O4,达平衡后,NO2的体积分数减小
D.升高温度,容器内的气体颜色变浅
13.神舟十三号载人飞船运载火箭使用偏二甲肼做燃料、四氧化二氮作助燃剂,热化学方程,下列有关说法正确的是
A. B.若生成液态水,变大
C.该反应的 D.火箭发射过程中,该反应中的化学能全部转化为动能
14.下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
二、填空题
15.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的__(填序号)。
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸。
16.NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为: 4NH3(g)+5O2(g) 4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是___________(双选,填字母)。
A.NH3和NO浓度相等 B.NO百分含量保持不变
C.容器中气体的压强不变 D.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是___________。(双选,填字母)
A.向装置中再充入N2 B.向装置中再充入O2 C.改变反应的催化剂 D.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应达到平衡时,该反应的平衡常数表达式为___________,NH3的转化率α(NH3 )=___________。
17.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
t/℃ 200 300 400
K K1 K2 0.5
①试比较K1、K2的大小,K1___K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是___(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g)N2(g)+3H2(g)的K′=___(填数值)。
④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正___v(N2)逆(填“>”、“<”“=”或“不能确定”)。
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___(填“向左”、“向右”或“不”)移动;使用催化剂__(填“增大”、“减小”或“不改变”)反应的ΔH。
18.工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.270 0.012
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为_______,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容充入H2 e.分离出甲醇
19.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的平衡常数表达式:_______。该反应为_______反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3) 能判断该反应是否达到化学平衡状态的依据是_______(多选不得分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
(5)若在(4)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,CO2的物质的量为_______mol。
20.可以通过控制哪些反应条件来提高氨的合成反应的速率_____
21.铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 (kJ/mol) K
ⅰ. +489
ⅱ. X
ⅲ. +172
试计算,______,、与之间的关系为______。
(2)℃时,向某恒温密闭容器中加入一定量的和C,发生反应ⅰ,反应达到平衡后,在时刻,改变某条件,随时间(t)的变化关系如图1所示,则时刻改变的条件可能是______(填写字母)。
a.保持温度不变,加少量铁粉 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p kPa)加入1 mol 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图所示。
①T℃时,若向平衡体系中再充入一定量按的混合气体,平衡______(填“正向”、“逆向”或“不”)移动。
②925℃时,用平衡分压代替平衡浓度表示的化学平衡常数为______kPa。[气体分压()=气体总压(p)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作]
22.目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:
已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_____为宜。
(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是________________(用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为________________。
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:___________________________(答一点即可)。
③已知2H++[Au(CN)2]-Au++2HCN,该反应的K=____________。
(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为____________。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为______________。
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=____mg/(L·min)(结果保留两位有效数字)。
23.一定条件下,在体积为3L的密闭容器中发生反应CO(g)+2H2(g)CH3OH(g),CH3OH的物质的量与时间变化图象如图:
(1)该反应的平衡常数表达式K=__;
(2)降低温度,K值将__(填“增大”、“减小”或“不变”)。
(3)若起始时加入1molCO和2molH2,则达平衡时,CO和H2的转化率之比为__。
(4)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__(用nB,tB表示)。
(5)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.CO的浓度不再变化
b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变
d.v生成(CH3OH)=v消耗(CO)
(6)300℃时,将容器的容积压缩到原来的,在其他条件不变的情况下,对平衡体系产生的影响是__。
a.CH3OH的物质的量增加
b.正反应速率加快,逆反应速率减慢
c.c(CO)和c(H2)均减小
d.重新平衡时减小
24.请回答下列问题:
Ⅰ.在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应:CO(g) + 2H2(g)CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与的关系如右图所示。
(1)当起始=2,经过2min达到平衡,CO的转化率为40%,则0~2min内平均反应速率v(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________(填“增大”、“减小”或“不变”);
(2)当起始=3时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
(3)若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___________vB(N2)(填“>”“<”或“=”)。
(4)若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为___________Pa(分压=总压×物质的量分数,保留一位小数)。
(5)已知N2(g)+3H2(g)2NH3(g) H=-92 kJ/mol,在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为___________mol,NH3产率为___________(产率为实际产量与理论产量的比值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,A错误;
B.因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,B错误;
C.反应平衡后,增大氮气的量,平衡正向进行,这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,C正确;
D.因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符合,D错误;
故选C。
2.B
【详解】A.由 (Q>0)可知,该反应的ΔH<0 , ΔS<0, 由ΔG = ΔH-TΔS<0 可得,该反应在低温下才能自发进行,故A错误;
B.保持体积不变,充入少量He,体系压强虽然增大,但反应混合气体各组分的浓度不变,反应速率不变,故B正确;
C.正反应的活化能与逆反应的活化能的差值为反应热,故其逆反应的活化能为(Q + a)KJ/mol , 故C错误;
D.由 (Q>0)可知,开始加入2molSO2和1molO2,与系数比一致,消耗的也是系数比,所以不管是否平衡,两者的转化率始终相等,故D错误;
答案为B。
3.C
【详解】A.750℃时,H2O为气态,则反应①的平衡常数可表示为,A错误;
B.750℃时,H2O为气态,反应②的正反应是一个气体体积增大的方向,则其正反应的,B错误;
C.如希望尽可能转化为NO,可利用催化剂的选择性让反应①尽可能发生,而减少反应②的发生甚至阻止其发生,C正确;
D.反应②的,D错误;
故答案为:C。
4.A
【详解】A.为蓝色,为黄色,冷水中溶液呈蓝色、热水中则为黄色是因为升温平衡向生成的方向移动,即与不同配体结合形成不同颜色的配位离子,并非是在不同温度下颜色不同,A项错误;
B.K2Cr2O7可氧化乙醇,固体由橙色变为绿色,可知乙醇具有还原性,B项正确;
C.酸性溶液中过氧化氢可氧化亚铁离子,且生成铁离子可促进过氧化氢分解生成氧气,则溶液变成棕黄色,一段时间后溶液中出现气泡,C项正确;
D.pH试纸呈蓝色说明溶液呈碱性,则Na2O2与水反应生成了碱NaOH,D项正确;
故选:A。
5.D
【详解】下列措施对增大反应速率明显有效的是
A. Al在氧气中燃烧生成Al2O3,将Al粉改为Al片,接触面积减小,反应速率减小,故A错误;
B. Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末,生成醋酸,醋酸为弱酸,溶液中氢离子浓度减小,反应速率减小,故B错误;
C.水为纯液体,改变用量,反应速率不变,故C错误;
D. Zn与稀硫酸反应时,适当提高溶液的温度,可增大活化分子百分数,反应速率增大,故D正确;
答案选D。
6.C
【详解】A.由方程式可知,反应物的物质的量浓度的变化量与化学计量数成正比,则( c1-0.1moL/L):(c2-0.3mol/L)=1:3,则c1:c2=l:3, A正确;
B.根据方程式可知v(X)正=3v(Y)正,所以当4v(X)正=v(Y)逆时,即12v(Y)正=v(Y)逆,所以逆反应速率大于正反应速率,该反应还在向逆反应方向建立平衡,B正确;
C.反应起始时c1:c2=l:3,由方程式可知,反应物的物质的量变化量与化学计量数呈正比,转化的物质的量也为1:3,则转化率应相等,C错误;
D.若反应开始时只有反应物,即c3=0时,即把平衡时的Z的浓度转化为0,此时c1=0.14mol/L,c2=0.42mol/L;若反应开始只有生成物,c2=0;若反应开始时既存在反应物又有生成物,则0综上所述答案为C。
7.A
【分析】在溶液中,存在如下两个平衡体系:[Ag(NH3)2]+Ag++2NH3,NH3+H2O+OH-。
【详解】A.对比实验①和②,加入NaOH和浓氨水后,溶液的pH仍相同,即碱性相同,所以不能说明碱性条件有利于银氨溶液与乙醛的反应,A不正确;
B.实验①加入NaOH后,Ag++OH-=AgOH↓,会使[Ag(NH3)2]+Ag++2NH3平衡正向移动,溶液中c(NH3)增大,则NH3+H2O+OH-平衡也发生正向移动,所以c()增大,B正确;
C.实验现象为产生光亮的银镜,则表明乙醛还原的是二氨合银离子中的银元素,C正确;
D.实验②中,加入浓氨水,增大了溶液中的c(NH3),[Ag(NH3)2]+Ag++2NH3平衡逆向移动,c(Ag+)减小,从而表明形成二氨合银离子后银元素的氧化性降低,D正确;
故选A。
8.C
【详解】A.由题图可知,副产物为和,生成副产物的能垒相对较高,反应难进行,生成的量较少;生成副产物的能垒相对较低,反应易进行,生成的量较多,所以相对多的副产物为,A正确;
B.加入催化剂可降低反应的活化能,B正确;
C.电催化制备甲醇时,在阴极上得电子生成甲醇,则磷化硼纳米颗粒在阴极上,C错误;
D.升高温度,主反应和副反应的反应速率均增大,由题图可知,主、副反应均是吸热反应,因此升温有利于提高的转化率,D正确;
故选C。
9.D
【详解】A.反应①的活化能比反应②大,反应②更容易发生,故A正确;
B.反应前后Fe3+没有发生改变,Fe3+是该反应的催化剂,故B正确;
C.Fe3+是反应物,增大Fe3+的浓度,加快反应速率,故C正确;
D.总反应放热,加不加Fe3+,都是正反应的活化能比逆反应的活化能小,故D错误;
故选D。
10.C
【详解】A.本项可以达到实验目的,块状大理石的反应速率应该慢于粉末状大理石,A项正确;
B.温度可以影响化学平衡常数,因此冷水和热水中的反应体系的平衡不一样,颜色也会不一样,B项正确;
C.该实验是测量观察高锰酸钾溶液褪色时间来比较反应速率,若高锰酸钾过量,则会影响实验结果,正确的探究变量应是不同浓度的草酸溶液,C项错误;
D.两试管内装有等体积等浓度的过氧化氢,消除了无关变量,因此可以达到实验目的,D项正确;
答案选C。
11.D
【详解】A.浓盐酸挥发出氯化氢也能导致水玻璃产生白色胶状沉淀,A项错误;
B.双氧水具有氧化性,可将氧化为,B项错误;
C.两试管中溶液体积不同导致浓度不同,不符合控制变量的思想,应向加入1mL 溶液的试管加入1mL蒸馏水进行比较,C项错误;
D.显蓝色,显黄色,升温反应正向移动,是吸热反应,D项正确。
故选D。
12.D
【详解】A.混合气体密度,与相互转化,没有其他状态的物质生成,不变,该容器体积恒定为1L,不变,即不变,A正确;
B.反应从开始后,向的正方向移动,根据图象60秒时才达到平衡,所以a点并未达到平衡,正从正反应建立平衡,所以a点v正>v逆,B正确;
C.60秒后,再充入少量NO2或N2O4,等效于增压、达平衡后,NO2的体积分数减小,C正确;
D.升高温度N2O4(g)2NO2(g) ΔH>0平衡右移,容器内NO2气体浓度增大、颜色变深,D错误;
答案为D。
13.C
【详解】A.运载火箭使用偏二甲肼做燃料、四氧化二氮作助燃剂,说明反应为放热反应,焓变小于零,A错误;
B.放热焓变小于零,气态水变为液态水放出热量,故焓变变小,B错误;
C.该反应为气体分子数增加的反应,熵变大于零,C正确;
D.火箭发射过程中,该反应中的化学能部分转化为动能、部分转化为热能等其它形式,D错误;
故选C。
14.C
【详解】A.通过压缩体积,增大压强,活化分子数目不变,分子总数目不变,则活化分子百分数不变,但是因为单位体积内活化分子数目增加,有效碰撞几率增加,导致化学反应速率增大,A正确;
B.升高温度,分子的能量增加,使某些分子变成活化分子,即活化分子数目增加,分子总数目不变,使得活化分子百分数增大,所以化学反应速率增大,B正确;
C.加入反应物,单位体积分子总数增加,活化分子百分数不变;单位体积内活化分子数目增加,导致单位体积内有效碰撞几率增加,所以化学反应速率增大;C错误;
D.使用催化剂,反应活化能降低,使大部分分子变成了活化分子,有效碰撞几率增加,所以化学反应速率增大,D正确;
故选C。
15.③⑦⑧
【分析】①加H2O,使盐酸浓度降低,反应速率减慢,对氢气的产量无影响;
②加NaOH固体,能消耗盐酸,降低氢气的产量;
③滴入几滴浓盐酸,增加了盐酸浓度,能加快反应速率,由于盐酸本是过量的,对氢气的产量无影响,故符合题意;
④加CH3COONa固体,能结合氢离子,降低了氢离子浓度,使反应速率减慢;
⑤加NaCl溶液,使盐酸浓度降低,反应速率减慢,对氢气的产量无影响;
⑥滴入几滴硫酸铜溶液,能写出原电池,加快反应速率,但会消耗铁,使氢气的产量减少;
⑦升高温度(不考虑盐酸挥发),能加快反应速率,对氢气的产量无影响,故符合题意;
⑧改用10mL0.1mol/L盐酸,相当于增加了盐酸浓度,能加快反应速率,由于盐酸本是过量的,对氢气的产量无影响,故符合题意;
【详解】由分析可知,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的③⑦⑧,故答案为:③⑦⑧;
16.(1)BC
(2)BD
(3) 80%
【解析】(1)
A.NH3和NO浓度相等,两者浓度不再改变才能说达到平衡,故A不符合题意;
B.NO百分含量保持不变,说明NO的物质的量不再改变,说明达到平衡,故B符合题意;
C.该反应是体积增大的反应,容器内压强不断增大,当容器中气体的压强不变,说明已经达到平衡,故C符合题意;
D.NH3的生成速率,逆向反应,NO的消耗速率,逆向反应,两者铜一个方向,不能作为判断平衡标志,故D不符合题意;
综上所述,答案为:BC。
(2)
A.向装置中再充入N2,容器内压强增大,但各物质的量浓度不变,平衡不移动,转化率不变,故A不符合题意;
B.向装置中再充入O2,氧气浓度增大,平衡正向移动,氨气消耗,氨气转化率增大,故B符合题意;
C.改变反应的催化剂,平衡不移动,转化率不变,故C不符合题意;
D.降低温度,平衡向放热反应即正向移动,氨气消耗,转化率增大,故D符合题意;
综上所述,答案为:BD。
(3)
将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下。根据题意该条件下反应达到平衡时,该反应的平衡常数表达式为,达到平衡时测得c(NO)=0.040 mol/L,Δc(NH3)=0.040 mol/L,Δn(NH3)=0.040 mol,则NH3的转化率α(NH3 )= ;故答案为:80%。
17. > c 2 = 向左 不改变
【详解】①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②N2(g)+3H2(g)2NH3(g)ΔH<0,反应是气体体积减小的放热反应,则
a.容器内各物质的浓度之比等于计量数之比,但不确定各物质起始浓度以及转化率,因此无法确定达到平衡时各物质浓度,因此不能证明正逆反应速率相等,故a不选;
b.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3v(N2)正=v(H2)逆时能说明反应处于平衡状态,故b不选;
c.该反应为气体非等体积反应,当容器内压强不变,说明气体的物质的量不变,该反应达平衡状态,故c选;
d.该反应参加反应的物质都是气体,根据质量守恒可知,气体总质量不变,如果是在密闭容器中反应,体积不变,密度始终不变,故d不选;
故答案为:c;
③由表格数据可知,在400℃时,N2(g)+3H2(g)2NH3(g)的K==0.5,温度不变时,平衡常数不变,因此2NH3(g)N2(g)+3H2(g)的K′====2;
④400℃时,某时刻N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L,则QC===0.5=K,则该时刻处于平衡状态,故v(N2)正=v(N2)逆;
⑤若在恒温、恒压条件下向平衡体系中通入氩气,而氩气不参加化学反应,容器体积将增大,参加反应的各物质的分压将减小,因此平衡将向左移动;使用催化剂只是改变反应的活化能,不改变反应的焓变,故答案为:向左;不改变。
18. K= < 80% 0.16mol L-1 s-1 250℃ de
【详解】(1)已知CO(g)+2H2(g)CH3OH(g)△H,该反应的平衡常数表达式为K=;
(2)①温度升高,K减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则,CO的转化率为×100%=80%,用H2表示反应速率为=0.16mol L-1 s-1;
K==2.041(mol/L)-2,温度应为250℃;
(3)a. 升温,平衡向逆反应方向移动,CO的转化率的减小,故不选;b. 加入催化剂,平衡不移动,转化率不变,故不选;c. 增加CO的浓度,CO的转化率的减小,故不选;d. 恒容充入H2,氢气浓度增大,平衡向正反应方向移动,CO转化率增大,故选;e. 分离出甲醇,平衡向正反应方向移动,CO转化率增大,故选;故答案为de。
19. K= 吸热 bc bc 830 0.8
【详解】(1)化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的平衡常数表达式K=;根据表格数据可知:升高温度,化学平衡常数增大,说明升高温度化学平衡正向移动,则该反应的正反应方向为吸热反应;
(2)a.及时分离出CO气体,化学平衡正向移动,但由于生成物浓度降低,所以化学反应速率减小,a不符合题意;
b.适当升高温度,化学反应速率加快;由于该反应的正反应是吸热反应,升高温度,化学平衡正向移动,b符合题意;
c.增大CO2的浓度,化学反应速率加快;增大反应物浓度,化学平衡正向移动,c符合题意;
d.选择高效催化剂化学反应速率加快,但化学平衡不发生移动,d不符合题意;
故合理选项是bc;
(3)a.该反应是反应前后气体物质的量不变的反应,反应在一定体积的密闭容器中进行,容器中压强始终不变,因此不能据此判断反应是否处于平衡状态,a不符合题意; b.若反应未达到平衡,则CO的物质的量就会发生变化,若混合气体中c(CO)不变,则反应处于平衡状态,b符合题意;
c.在任何情况下都存在v正(H2)=v正(H2O),若v正(H2)=v逆(H2O),则v正(H2O)=v逆(H2O),反应处于平衡状态,c符合题意;
d.当容器中c(CO2)=c(CO)时,反应可能处于平衡状态,也可能未达到平衡,这与反应开始加入的物质的量及反应条件有关,因此不能据此判断反应是否达到平衡状态,d不符合题意;
故合理选项是bc;
(4)在某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则K= =1.0,根据表格数据可知反应温度是830℃;
(5)假设CO2转化量是x mol,由于容器的容积是1 L,所以物质的平衡时的浓度与其物质的量数值相等,则平衡时各种气体的浓度分别是c(CO2)=(2-x) mol/L;c(H2)= (3-x) mol/L;c(CO)=c(H2O)=x mol/L,故K==,解得x=1.2 mol,故充分反应达平衡时,CO2的物质的量为n(CO2)=2 mol-1.2 mol=0.8 mol。
20.升高反应温度、增大反应体系压强、使用高效催化剂
【解析】略
21.(1) -27 K2·K
(2)d
(3) 正向 23.04p
【详解】(1)已知:
ⅰ. ΔH1=+489 kJ/mol ⅲ. ΔH3=+172 kJ/mol
依据盖斯定律反应ii可由i-3×iii得到,所以反应ii的焓变ΔH2=489 kJ/mol-3×172 kJ/mol=-27kJ/mol,根据多重平衡规则,K1、K2与K3之间的关系为K1=K2·K;
(2)a.保持温度不变,加少量铁粉,铁粉是固体,对逆反应速率和化学平衡无影响,a不选;
b.保持体积不变,升高温度,化学反应速率加快,平衡正向移动,再次达到平衡时逆反应速率不能回到原平衡状态,b不选;
c.保持体积不变,加少量碳粉,碳粉是固体,对逆反应速率和化学平衡无影响,c不选;
d.保持体积不变,增大CO浓度,逆反应速率增大,温度保持不变,化学平衡常数不变,最终逆反应速率不变,d选,
故答案为d;
(3)①根据图像可知T℃平衡时一氧化碳和二氧化碳的体积分数相同,若向平衡体系中再充入一定量按的混合气体,由于此时,所以平衡正向移动;
②925℃时,CO的体积分数为96%,则p(CO2)=4%p=0.04p,p(CO)=96%p=0.96p,所以分压平衡常数为。
22. 87% CN-+H2OHCN+OH- 4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH 氧气在溶液中的溶解度随着温度的升高而下降,温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,随温度的升高,Ca(OH)2的溶解度反而下降,部分碱从溶液中析出 4×10-20 1:2 NaHCO3 0.016
【详解】试题分析:(1)根据图示,磨矿细度为87%,浸渣品位最高;(2)碱抑制CN-水解;(3)①“氰化”环节, NaCN溶液浸取调节pH的矿泥,敞口放置,氧气将Au氧化为Na[Au(CN)2];②温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,温度的升高,Ca(OH)2的溶解度减小,部分碱从溶液中析出;③2H++[Au(CN)2]-Au++2HCN,该反应的K= ;(4)根据得失电子守恒计算用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比;(5)①根据氧化还原反应规律和元素守恒分析A的化学式;②根据v(CN-)=计算。
解析:(1)根据图示,磨矿细度时,浸渣品位最高,所以浸出率应选择磨矿细度87%为宜;(2)根据水解方程式是CN-+H2OHCN+OH-,碱能抑制CN-水解;(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,氧气将Au氧化为Na[Au(CN)2],①反应方程式是4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH;②氧气在溶液中的溶解度随着温度的升高而下降,温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,随温度的升高,Ca(OH)2的溶解度反而下降,部分碱从溶液中析出,所以生产中控制反应液的温度在10-20℃;Ka(HCN)=5×10-10,即 Au++2CN-=[Au(CN)2]- 平衡常数KB= =1×1038, 2H++[Au(CN)2]-Au++2HCN,平衡常数K=4×10-20 ;(4)用锌还原NaAu(CN)2生成金,锌化合价由0变为+2价,金化合价由+1变为0,所以消耗的锌与生成的金的物质的量之比为1:2;(5)①根据氧化还原反应规律和元素守恒,NaCN、H2O2、H2O 反应生成氨气和碳酸氢钠,故A是NaHCO3;②v(CN-)== 0.016 mg/(L·min)。
23. 增大 1:1 mol·L-1·min-1 ac ad
【分析】(1)平衡常数表达式K的求算,直接套用公式;
(2)根据图象,温度升高,甲醇的物质的量减少,说明平衡逆向进行,所以该反应的正向是放热反应;
(3)反应CO:H2=1:2,加入1molCO和2molH2,如果消耗xmolCO,对应消耗2xmolH2,以此计算;
(4)根据物质变化的物质的量之比等于化学计量数之比,代入公式计算;
(5)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态;
(6)根据化学平衡状态变化因素进行分析。
【详解】(1)平衡常数表达式K=,故答案为:;
(2)根据图象,温度升高,甲醇的物质的量减少,说明平衡逆向进行,升高温度,平衡向吸热反应方向移动,所以该反应的正向是放热反应,则降低温度,K值将增大,故答案为:增大;
(3)反应CO:H2=1:2,加入1molCO和2molH2,如果消耗xmolCO,对应消耗2xmolH2,CO和H2的转化率之比==1:1,故答案为:1:1;
(4)根据物质变化的物质的量之比等于化学计量数之比,500 ℃时,反应在tB达到平衡,生成甲醇nB moL,消耗氢气2nB,容器的体积为3L,以H2的浓度变化表示的化学反应速率是mol·L-1·min-1,故答案为:mol·L-1·min-1;
(5)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,a.CO的浓度不再变化,说明反应处于平衡状态,正确;b. 在恒容、密闭容器中,混合气体的密度始终不改变,错误;
c.混合气体的平均摩尔质量M=m/n,质量不变,平衡时,物质的量不再改变,则混合气体的平均摩尔质量不再改变,正确;d.v生成(CH3OH)=v消耗(CO) 反应速度的方向是相同的,错误;故答案为:ac;
(6) 300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,a. 平衡正向移动,CH3OH的物质的量增加,正确;b. 正逆反应速率都加快,错误;c. 器体积减小, c(CO)和c(H2)均增大,错误;d. 甲醇的物质的量增加,氢气的物质的量减少,浓度之比等于物质的量之比,重新平衡时c(H2)/c(CH3OH)减小,正确;故答案为:ad。
【点睛】本题易错项(5) 判断可逆反应达到化学平衡状态的标志,要分析可逆反应中物质的状态,所给的条件(恒温、恒容或恒压),再结合选项,针对性解答,涉及到密度、平均相对分子质量,可通过公式判定。
24.(1) 0.2mol·L-1· min-1 减小
(2)F
(3)<
(4)8.3×103
(5) 3 20%
【详解】(1)当起始=2,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,则投入CO的物质的量是1 mol,经过2min达到平衡,CO的转化率为40%,则0~2min内平均反应速率v(CO)= ,v(H2): v(CO)=2:1,故v(H2)= 0.2mol·L-1· min-1;此状态下,有:
该反应的平衡常数K为 ,若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,则体系的浓度商Qc为,Qc>K,平衡逆向移动,达新平衡时H2的转化率将减小。
(2)当起始=3时,H2和CO物质的量之和为3mol,参与反应的CO比=2时要少,生成的CH3OH也较少,故达到平衡状态后,CH3OH的体积分数可能是图象中的F。
(3)B的温度比A高出许多,其反应速率也更快,故vA(N2) <vB(N2)。
(4)设达到平衡时产生的氨气的物质的量为xmol,依题意有:
从图中得知,平衡后混合物中氨的体积分数为66.7%,故 ,解得,体系总物质的量为(mol),则B点N2的分压p(N2)为 。
(5)依题意,反应放出的热量为18.4 kJ,则转化N2的物质的量为 ,则有:
达到平衡后,容器内的压强变为原来的90%,可列式: ,解得n(H2)=3(mol);根据方程式,1molN2完全反应理论可生成2molNH3,故NH3产率为。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列研究目的和图示相符的是
选项 A B C D
研究目的 压强对反应的影响 温度对反应的影响 平衡体系中增加N2对反应的影响 催化剂对反应的影响
图示
A.A B.B C.C D.D
2.一定温度下,某容积为1L的恒容密闭容器中通入2molSO2和1molO2,发生反应: (Q>0)。下列有关说法正确的是
A.该反应在高温下才能自发进行
B.充入少量He使体系压强增大,v正、v逆均不变
C.若该反应的活化能为akJ/mol,则其逆反应的活化能为(Q-a)kJ/mol
D.当SO2和O2转化率相等时,该反应达到化学平衡状态
3.750℃时,和发生的两个反应的方程式分别如下:
①;
②;
下列说法正确的是
A.反应①的平衡常数可表示为
B.反应②的
C.如希望尽可能转化为NO,可利用催化剂的选择性
D.反应②的
4.由下列实验操作及现象不能得出相应结论的是
选项 实验操作 现象 结论
A 将盛有相同浓度的CuCl2溶液的两支试管分别置于冷水和热水中 冷水中溶液呈蓝色,热水中则为黄色 Cu2+在不同温度下颜色不同
B 向填充有经硫酸处理的K2Cr2O7的导管中吹入乙醇蒸气 固体由橙色变为绿色 乙醇具有还原性
C 向盛有FeCl2溶波的试管中加入酸化后的H2O2溶液 溶液变为棕黄色且出现无色气泡 生成了Fe3+,同时Fe3+催化分解H2O2
D 用玻璃棒蘸取Na2O2与足量水反应后得到的溶液,点在pH试纸上 pH试纸呈蓝色 反应生成了碱
A.A B.B C.C D.D
5.下列措施对增大反应速率明显有效的是
A.Al在氧气中燃烧生成Al2O3,将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末
C.Na与水反应时增大水的用量
D.Zn与稀硫酸反应时,适当提高溶液的温度
6.一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2=1:3
B.当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡
C.X、Y的转化率不相等
D.0≤c2≤0.42
7.某小组同学用乙醛进行银镜反应实验时,补充做了以下实验。
已知[Ag(NH3)2]+Ag++2NH3
下列关于该实验的分析不正确的是
A.实验①无需加热,说明碱性条件有利于银氨溶液与乙醛的反应
B.实验①加入NaOH后,溶液中c()增大
C.实验表明,乙醛还原的是二氨合银离子中的银元素
D.对比实验①和②知,形成二氨合银离子后银元素的氧化性降低
8.我国某科研团队采用真空封管法制备磷化硼纳米颗粒催化剂,在发展非金属催化剂实现电催化还原制备甲醇方向取得重要进展,有关反应历程如图所示(吸附在催化剂表面上的物种用*标注)。下列说法错误的是
A.副产物有、,其中的量相对较多
B.加入催化剂使生成甲醇的反应速率增大,其主要降低反应的活化能
C.磷化硼纳米颗粒在阳极上催化生成甲醇
D.升高温度,主反应和副反应的反应速率均增大,且有利于提高的转化率
9.已知反应,若向该溶液中加入含的某溶液,反应机理如图所示。下列有关该反应的说法错误的是
①
②
A.反应①和反应②相比,反应②更容易发生
B.是该反应的催化剂
C.增大的浓度,能够加快反应速率
D.若不加,正反应的活化能比逆反应的活化能大
10.下列相关实验不能达到预期目的的是
相关实验 预期目的
A 相同温度下,等质量的大理石块。大理石粉分别与等体积、等浓度的盐酸反应 探究接触面积对化学反应速率的影响
B 把装有颜色相同的和混合气的两支试管(密封)分别浸入冷水和热水中 探究温度对化学平衡的影响
C 在等体积等浓度的草酸()无色溶液中,加入不同浓度等体积的高锰酸钾 探究反应物浓度对化学反应速率的影响
D 两支试管中装有等体积、等浓度溶液,向其中一支试管中加入溶液 探究溶液对分解速率的影响
A.A B.B C.C D.D
11.实验证据推理是化学研究的常用方法,下列实验操作和现象均正确,并一定能得到正确结论的是
选项 实验操作 现象 结论
A 密闭环境中,将浓盐酸滴加到小苏打溶液中,并将产生的气体通入水玻璃中 水玻璃中出现白色胶状沉淀 非金属性:C>Si
B 取少量硫酸酸化的溶液,先加入几滴双氧水,再加入几滴KSCN溶液 加入KSCN后溶液变红 该溶液已经氧化变质
C 取两支相同的试管,分别加入2mL 0.1mol/L和1mL 0.1mol/L溶液,再同时向两支试管中加入2mL 0.1mol/L 溶液 加入2mL 溶液的试管出现浑浊时间短 其他条件相同,溶液浓度越大,和反应的速率越快
D 取2mL 0.5mol/L的溶液于试管中,置于冷水中,一段时间后取出逐渐加热 冷水中的溶液为蓝色,加热后逐渐变黄 是吸热反应
A.A B.B C.C D.D
12.T℃时,将0.10 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)2NO2(g) ΔH>0,实验数据如图。下列说法错误的是
A.混合气体的密度始终保持不变
B.a点v正>v逆
C.60秒后,再充入少量NO2或N2O4,达平衡后,NO2的体积分数减小
D.升高温度,容器内的气体颜色变浅
13.神舟十三号载人飞船运载火箭使用偏二甲肼做燃料、四氧化二氮作助燃剂,热化学方程,下列有关说法正确的是
A. B.若生成液态水,变大
C.该反应的 D.火箭发射过程中,该反应中的化学能全部转化为动能
14.下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
二、填空题
15.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的__(填序号)。
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸。
16.NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为: 4NH3(g)+5O2(g) 4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是___________(双选,填字母)。
A.NH3和NO浓度相等 B.NO百分含量保持不变
C.容器中气体的压强不变 D.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是___________。(双选,填字母)
A.向装置中再充入N2 B.向装置中再充入O2 C.改变反应的催化剂 D.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应达到平衡时,该反应的平衡常数表达式为___________,NH3的转化率α(NH3 )=___________。
17.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
t/℃ 200 300 400
K K1 K2 0.5
①试比较K1、K2的大小,K1___K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是___(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,2NH3(g)N2(g)+3H2(g)的K′=___(填数值)。
④400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正___v(N2)逆(填“>”、“<”“=”或“不能确定”)。
⑤若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___(填“向左”、“向右”或“不”)移动;使用催化剂__(填“增大”、“减小”或“不改变”)反应的ΔH。
18.工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.270 0.012
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为_______,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容充入H2 e.分离出甲醇
19.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的平衡常数表达式:_______。该反应为_______反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3) 能判断该反应是否达到化学平衡状态的依据是_______(多选不得分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
(5)若在(4)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,CO2的物质的量为_______mol。
20.可以通过控制哪些反应条件来提高氨的合成反应的速率_____
21.铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 (kJ/mol) K
ⅰ. +489
ⅱ. X
ⅲ. +172
试计算,______,、与之间的关系为______。
(2)℃时,向某恒温密闭容器中加入一定量的和C,发生反应ⅰ,反应达到平衡后,在时刻,改变某条件,随时间(t)的变化关系如图1所示,则时刻改变的条件可能是______(填写字母)。
a.保持温度不变,加少量铁粉 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p kPa)加入1 mol 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图所示。
①T℃时,若向平衡体系中再充入一定量按的混合气体,平衡______(填“正向”、“逆向”或“不”)移动。
②925℃时,用平衡分压代替平衡浓度表示的化学平衡常数为______kPa。[气体分压()=气体总压(p)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作]
22.目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:
已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_____为宜。
(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是________________(用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为________________。
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:___________________________(答一点即可)。
③已知2H++[Au(CN)2]-Au++2HCN,该反应的K=____________。
(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为____________。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为______________。
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=____mg/(L·min)(结果保留两位有效数字)。
23.一定条件下,在体积为3L的密闭容器中发生反应CO(g)+2H2(g)CH3OH(g),CH3OH的物质的量与时间变化图象如图:
(1)该反应的平衡常数表达式K=__;
(2)降低温度,K值将__(填“增大”、“减小”或“不变”)。
(3)若起始时加入1molCO和2molH2,则达平衡时,CO和H2的转化率之比为__。
(4)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__(用nB,tB表示)。
(5)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.CO的浓度不再变化
b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变
d.v生成(CH3OH)=v消耗(CO)
(6)300℃时,将容器的容积压缩到原来的,在其他条件不变的情况下,对平衡体系产生的影响是__。
a.CH3OH的物质的量增加
b.正反应速率加快,逆反应速率减慢
c.c(CO)和c(H2)均减小
d.重新平衡时减小
24.请回答下列问题:
Ⅰ.在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应:CO(g) + 2H2(g)CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与的关系如右图所示。
(1)当起始=2,经过2min达到平衡,CO的转化率为40%,则0~2min内平均反应速率v(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________(填“增大”、“减小”或“不变”);
(2)当起始=3时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)2NH3(g),在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
(3)若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___________vB(N2)(填“>”“<”或“=”)。
(4)若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为___________Pa(分压=总压×物质的量分数,保留一位小数)。
(5)已知N2(g)+3H2(g)2NH3(g) H=-92 kJ/mol,在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为___________mol,NH3产率为___________(产率为实际产量与理论产量的比值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,A错误;
B.因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,B错误;
C.反应平衡后,增大氮气的量,平衡正向进行,这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,C正确;
D.因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符合,D错误;
故选C。
2.B
【详解】A.由 (Q>0)可知,该反应的ΔH<0 , ΔS<0, 由ΔG = ΔH-TΔS<0 可得,该反应在低温下才能自发进行,故A错误;
B.保持体积不变,充入少量He,体系压强虽然增大,但反应混合气体各组分的浓度不变,反应速率不变,故B正确;
C.正反应的活化能与逆反应的活化能的差值为反应热,故其逆反应的活化能为(Q + a)KJ/mol , 故C错误;
D.由 (Q>0)可知,开始加入2molSO2和1molO2,与系数比一致,消耗的也是系数比,所以不管是否平衡,两者的转化率始终相等,故D错误;
答案为B。
3.C
【详解】A.750℃时,H2O为气态,则反应①的平衡常数可表示为,A错误;
B.750℃时,H2O为气态,反应②的正反应是一个气体体积增大的方向,则其正反应的,B错误;
C.如希望尽可能转化为NO,可利用催化剂的选择性让反应①尽可能发生,而减少反应②的发生甚至阻止其发生,C正确;
D.反应②的,D错误;
故答案为:C。
4.A
【详解】A.为蓝色,为黄色,冷水中溶液呈蓝色、热水中则为黄色是因为升温平衡向生成的方向移动,即与不同配体结合形成不同颜色的配位离子,并非是在不同温度下颜色不同,A项错误;
B.K2Cr2O7可氧化乙醇,固体由橙色变为绿色,可知乙醇具有还原性,B项正确;
C.酸性溶液中过氧化氢可氧化亚铁离子,且生成铁离子可促进过氧化氢分解生成氧气,则溶液变成棕黄色,一段时间后溶液中出现气泡,C项正确;
D.pH试纸呈蓝色说明溶液呈碱性,则Na2O2与水反应生成了碱NaOH,D项正确;
故选:A。
5.D
【详解】下列措施对增大反应速率明显有效的是
A. Al在氧气中燃烧生成Al2O3,将Al粉改为Al片,接触面积减小,反应速率减小,故A错误;
B. Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末,生成醋酸,醋酸为弱酸,溶液中氢离子浓度减小,反应速率减小,故B错误;
C.水为纯液体,改变用量,反应速率不变,故C错误;
D. Zn与稀硫酸反应时,适当提高溶液的温度,可增大活化分子百分数,反应速率增大,故D正确;
答案选D。
6.C
【详解】A.由方程式可知,反应物的物质的量浓度的变化量与化学计量数成正比,则( c1-0.1moL/L):(c2-0.3mol/L)=1:3,则c1:c2=l:3, A正确;
B.根据方程式可知v(X)正=3v(Y)正,所以当4v(X)正=v(Y)逆时,即12v(Y)正=v(Y)逆,所以逆反应速率大于正反应速率,该反应还在向逆反应方向建立平衡,B正确;
C.反应起始时c1:c2=l:3,由方程式可知,反应物的物质的量变化量与化学计量数呈正比,转化的物质的量也为1:3,则转化率应相等,C错误;
D.若反应开始时只有反应物,即c3=0时,即把平衡时的Z的浓度转化为0,此时c1=0.14mol/L,c2=0.42mol/L;若反应开始只有生成物,c2=0;若反应开始时既存在反应物又有生成物,则0
7.A
【分析】在溶液中,存在如下两个平衡体系:[Ag(NH3)2]+Ag++2NH3,NH3+H2O+OH-。
【详解】A.对比实验①和②,加入NaOH和浓氨水后,溶液的pH仍相同,即碱性相同,所以不能说明碱性条件有利于银氨溶液与乙醛的反应,A不正确;
B.实验①加入NaOH后,Ag++OH-=AgOH↓,会使[Ag(NH3)2]+Ag++2NH3平衡正向移动,溶液中c(NH3)增大,则NH3+H2O+OH-平衡也发生正向移动,所以c()增大,B正确;
C.实验现象为产生光亮的银镜,则表明乙醛还原的是二氨合银离子中的银元素,C正确;
D.实验②中,加入浓氨水,增大了溶液中的c(NH3),[Ag(NH3)2]+Ag++2NH3平衡逆向移动,c(Ag+)减小,从而表明形成二氨合银离子后银元素的氧化性降低,D正确;
故选A。
8.C
【详解】A.由题图可知,副产物为和,生成副产物的能垒相对较高,反应难进行,生成的量较少;生成副产物的能垒相对较低,反应易进行,生成的量较多,所以相对多的副产物为,A正确;
B.加入催化剂可降低反应的活化能,B正确;
C.电催化制备甲醇时,在阴极上得电子生成甲醇,则磷化硼纳米颗粒在阴极上,C错误;
D.升高温度,主反应和副反应的反应速率均增大,由题图可知,主、副反应均是吸热反应,因此升温有利于提高的转化率,D正确;
故选C。
9.D
【详解】A.反应①的活化能比反应②大,反应②更容易发生,故A正确;
B.反应前后Fe3+没有发生改变,Fe3+是该反应的催化剂,故B正确;
C.Fe3+是反应物,增大Fe3+的浓度,加快反应速率,故C正确;
D.总反应放热,加不加Fe3+,都是正反应的活化能比逆反应的活化能小,故D错误;
故选D。
10.C
【详解】A.本项可以达到实验目的,块状大理石的反应速率应该慢于粉末状大理石,A项正确;
B.温度可以影响化学平衡常数,因此冷水和热水中的反应体系的平衡不一样,颜色也会不一样,B项正确;
C.该实验是测量观察高锰酸钾溶液褪色时间来比较反应速率,若高锰酸钾过量,则会影响实验结果,正确的探究变量应是不同浓度的草酸溶液,C项错误;
D.两试管内装有等体积等浓度的过氧化氢,消除了无关变量,因此可以达到实验目的,D项正确;
答案选C。
11.D
【详解】A.浓盐酸挥发出氯化氢也能导致水玻璃产生白色胶状沉淀,A项错误;
B.双氧水具有氧化性,可将氧化为,B项错误;
C.两试管中溶液体积不同导致浓度不同,不符合控制变量的思想,应向加入1mL 溶液的试管加入1mL蒸馏水进行比较,C项错误;
D.显蓝色,显黄色,升温反应正向移动,是吸热反应,D项正确。
故选D。
12.D
【详解】A.混合气体密度,与相互转化,没有其他状态的物质生成,不变,该容器体积恒定为1L,不变,即不变,A正确;
B.反应从开始后,向的正方向移动,根据图象60秒时才达到平衡,所以a点并未达到平衡,正从正反应建立平衡,所以a点v正>v逆,B正确;
C.60秒后,再充入少量NO2或N2O4,等效于增压、达平衡后,NO2的体积分数减小,C正确;
D.升高温度N2O4(g)2NO2(g) ΔH>0平衡右移,容器内NO2气体浓度增大、颜色变深,D错误;
答案为D。
13.C
【详解】A.运载火箭使用偏二甲肼做燃料、四氧化二氮作助燃剂,说明反应为放热反应,焓变小于零,A错误;
B.放热焓变小于零,气态水变为液态水放出热量,故焓变变小,B错误;
C.该反应为气体分子数增加的反应,熵变大于零,C正确;
D.火箭发射过程中,该反应中的化学能部分转化为动能、部分转化为热能等其它形式,D错误;
故选C。
14.C
【详解】A.通过压缩体积,增大压强,活化分子数目不变,分子总数目不变,则活化分子百分数不变,但是因为单位体积内活化分子数目增加,有效碰撞几率增加,导致化学反应速率增大,A正确;
B.升高温度,分子的能量增加,使某些分子变成活化分子,即活化分子数目增加,分子总数目不变,使得活化分子百分数增大,所以化学反应速率增大,B正确;
C.加入反应物,单位体积分子总数增加,活化分子百分数不变;单位体积内活化分子数目增加,导致单位体积内有效碰撞几率增加,所以化学反应速率增大;C错误;
D.使用催化剂,反应活化能降低,使大部分分子变成了活化分子,有效碰撞几率增加,所以化学反应速率增大,D正确;
故选C。
15.③⑦⑧
【分析】①加H2O,使盐酸浓度降低,反应速率减慢,对氢气的产量无影响;
②加NaOH固体,能消耗盐酸,降低氢气的产量;
③滴入几滴浓盐酸,增加了盐酸浓度,能加快反应速率,由于盐酸本是过量的,对氢气的产量无影响,故符合题意;
④加CH3COONa固体,能结合氢离子,降低了氢离子浓度,使反应速率减慢;
⑤加NaCl溶液,使盐酸浓度降低,反应速率减慢,对氢气的产量无影响;
⑥滴入几滴硫酸铜溶液,能写出原电池,加快反应速率,但会消耗铁,使氢气的产量减少;
⑦升高温度(不考虑盐酸挥发),能加快反应速率,对氢气的产量无影响,故符合题意;
⑧改用10mL0.1mol/L盐酸,相当于增加了盐酸浓度,能加快反应速率,由于盐酸本是过量的,对氢气的产量无影响,故符合题意;
【详解】由分析可知,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的③⑦⑧,故答案为:③⑦⑧;
16.(1)BC
(2)BD
(3) 80%
【解析】(1)
A.NH3和NO浓度相等,两者浓度不再改变才能说达到平衡,故A不符合题意;
B.NO百分含量保持不变,说明NO的物质的量不再改变,说明达到平衡,故B符合题意;
C.该反应是体积增大的反应,容器内压强不断增大,当容器中气体的压强不变,说明已经达到平衡,故C符合题意;
D.NH3的生成速率,逆向反应,NO的消耗速率,逆向反应,两者铜一个方向,不能作为判断平衡标志,故D不符合题意;
综上所述,答案为:BC。
(2)
A.向装置中再充入N2,容器内压强增大,但各物质的量浓度不变,平衡不移动,转化率不变,故A不符合题意;
B.向装置中再充入O2,氧气浓度增大,平衡正向移动,氨气消耗,氨气转化率增大,故B符合题意;
C.改变反应的催化剂,平衡不移动,转化率不变,故C不符合题意;
D.降低温度,平衡向放热反应即正向移动,氨气消耗,转化率增大,故D符合题意;
综上所述,答案为:BD。
(3)
将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下。根据题意该条件下反应达到平衡时,该反应的平衡常数表达式为,达到平衡时测得c(NO)=0.040 mol/L,Δc(NH3)=0.040 mol/L,Δn(NH3)=0.040 mol,则NH3的转化率α(NH3 )= ;故答案为:80%。
17. > c 2 = 向左 不改变
【详解】①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②N2(g)+3H2(g)2NH3(g)ΔH<0,反应是气体体积减小的放热反应,则
a.容器内各物质的浓度之比等于计量数之比,但不确定各物质起始浓度以及转化率,因此无法确定达到平衡时各物质浓度,因此不能证明正逆反应速率相等,故a不选;
b.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3v(N2)正=v(H2)逆时能说明反应处于平衡状态,故b不选;
c.该反应为气体非等体积反应,当容器内压强不变,说明气体的物质的量不变,该反应达平衡状态,故c选;
d.该反应参加反应的物质都是气体,根据质量守恒可知,气体总质量不变,如果是在密闭容器中反应,体积不变,密度始终不变,故d不选;
故答案为:c;
③由表格数据可知,在400℃时,N2(g)+3H2(g)2NH3(g)的K==0.5,温度不变时,平衡常数不变,因此2NH3(g)N2(g)+3H2(g)的K′====2;
④400℃时,某时刻N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L,则QC===0.5=K,则该时刻处于平衡状态,故v(N2)正=v(N2)逆;
⑤若在恒温、恒压条件下向平衡体系中通入氩气,而氩气不参加化学反应,容器体积将增大,参加反应的各物质的分压将减小,因此平衡将向左移动;使用催化剂只是改变反应的活化能,不改变反应的焓变,故答案为:向左;不改变。
18. K= < 80% 0.16mol L-1 s-1 250℃ de
【详解】(1)已知CO(g)+2H2(g)CH3OH(g)△H,该反应的平衡常数表达式为K=;
(2)①温度升高,K减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则,CO的转化率为×100%=80%,用H2表示反应速率为=0.16mol L-1 s-1;
K==2.041(mol/L)-2,温度应为250℃;
(3)a. 升温,平衡向逆反应方向移动,CO的转化率的减小,故不选;b. 加入催化剂,平衡不移动,转化率不变,故不选;c. 增加CO的浓度,CO的转化率的减小,故不选;d. 恒容充入H2,氢气浓度增大,平衡向正反应方向移动,CO转化率增大,故选;e. 分离出甲醇,平衡向正反应方向移动,CO转化率增大,故选;故答案为de。
19. K= 吸热 bc bc 830 0.8
【详解】(1)化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,则该反应的平衡常数表达式K=;根据表格数据可知:升高温度,化学平衡常数增大,说明升高温度化学平衡正向移动,则该反应的正反应方向为吸热反应;
(2)a.及时分离出CO气体,化学平衡正向移动,但由于生成物浓度降低,所以化学反应速率减小,a不符合题意;
b.适当升高温度,化学反应速率加快;由于该反应的正反应是吸热反应,升高温度,化学平衡正向移动,b符合题意;
c.增大CO2的浓度,化学反应速率加快;增大反应物浓度,化学平衡正向移动,c符合题意;
d.选择高效催化剂化学反应速率加快,但化学平衡不发生移动,d不符合题意;
故合理选项是bc;
(3)a.该反应是反应前后气体物质的量不变的反应,反应在一定体积的密闭容器中进行,容器中压强始终不变,因此不能据此判断反应是否处于平衡状态,a不符合题意; b.若反应未达到平衡,则CO的物质的量就会发生变化,若混合气体中c(CO)不变,则反应处于平衡状态,b符合题意;
c.在任何情况下都存在v正(H2)=v正(H2O),若v正(H2)=v逆(H2O),则v正(H2O)=v逆(H2O),反应处于平衡状态,c符合题意;
d.当容器中c(CO2)=c(CO)时,反应可能处于平衡状态,也可能未达到平衡,这与反应开始加入的物质的量及反应条件有关,因此不能据此判断反应是否达到平衡状态,d不符合题意;
故合理选项是bc;
(4)在某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则K= =1.0,根据表格数据可知反应温度是830℃;
(5)假设CO2转化量是x mol,由于容器的容积是1 L,所以物质的平衡时的浓度与其物质的量数值相等,则平衡时各种气体的浓度分别是c(CO2)=(2-x) mol/L;c(H2)= (3-x) mol/L;c(CO)=c(H2O)=x mol/L,故K==,解得x=1.2 mol,故充分反应达平衡时,CO2的物质的量为n(CO2)=2 mol-1.2 mol=0.8 mol。
20.升高反应温度、增大反应体系压强、使用高效催化剂
【解析】略
21.(1) -27 K2·K
(2)d
(3) 正向 23.04p
【详解】(1)已知:
ⅰ. ΔH1=+489 kJ/mol ⅲ. ΔH3=+172 kJ/mol
依据盖斯定律反应ii可由i-3×iii得到,所以反应ii的焓变ΔH2=489 kJ/mol-3×172 kJ/mol=-27kJ/mol,根据多重平衡规则,K1、K2与K3之间的关系为K1=K2·K;
(2)a.保持温度不变,加少量铁粉,铁粉是固体,对逆反应速率和化学平衡无影响,a不选;
b.保持体积不变,升高温度,化学反应速率加快,平衡正向移动,再次达到平衡时逆反应速率不能回到原平衡状态,b不选;
c.保持体积不变,加少量碳粉,碳粉是固体,对逆反应速率和化学平衡无影响,c不选;
d.保持体积不变,增大CO浓度,逆反应速率增大,温度保持不变,化学平衡常数不变,最终逆反应速率不变,d选,
故答案为d;
(3)①根据图像可知T℃平衡时一氧化碳和二氧化碳的体积分数相同,若向平衡体系中再充入一定量按的混合气体,由于此时,所以平衡正向移动;
②925℃时,CO的体积分数为96%,则p(CO2)=4%p=0.04p,p(CO)=96%p=0.96p,所以分压平衡常数为。
22. 87% CN-+H2OHCN+OH- 4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH 氧气在溶液中的溶解度随着温度的升高而下降,温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,随温度的升高,Ca(OH)2的溶解度反而下降,部分碱从溶液中析出 4×10-20 1:2 NaHCO3 0.016
【详解】试题分析:(1)根据图示,磨矿细度为87%,浸渣品位最高;(2)碱抑制CN-水解;(3)①“氰化”环节, NaCN溶液浸取调节pH的矿泥,敞口放置,氧气将Au氧化为Na[Au(CN)2];②温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,温度的升高,Ca(OH)2的溶解度减小,部分碱从溶液中析出;③2H++[Au(CN)2]-Au++2HCN,该反应的K= ;(4)根据得失电子守恒计算用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比;(5)①根据氧化还原反应规律和元素守恒分析A的化学式;②根据v(CN-)=计算。
解析:(1)根据图示,磨矿细度时,浸渣品位最高,所以浸出率应选择磨矿细度87%为宜;(2)根据水解方程式是CN-+H2OHCN+OH-,碱能抑制CN-水解;(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,氧气将Au氧化为Na[Au(CN)2],①反应方程式是4Au+8NaCN+O2+2H2O=4NaAu(CN)2+4NaOH;②氧气在溶液中的溶解度随着温度的升高而下降,温度的升高,促进了氰化物的水解,增加了HCN的挥发速度,随温度的升高,Ca(OH)2的溶解度反而下降,部分碱从溶液中析出,所以生产中控制反应液的温度在10-20℃;Ka(HCN)=5×10-10,即 Au++2CN-=[Au(CN)2]- 平衡常数KB= =1×1038, 2H++[Au(CN)2]-Au++2HCN,平衡常数K=4×10-20 ;(4)用锌还原NaAu(CN)2生成金,锌化合价由0变为+2价,金化合价由+1变为0,所以消耗的锌与生成的金的物质的量之比为1:2;(5)①根据氧化还原反应规律和元素守恒,NaCN、H2O2、H2O 反应生成氨气和碳酸氢钠,故A是NaHCO3;②v(CN-)== 0.016 mg/(L·min)。
23. 增大 1:1 mol·L-1·min-1 ac ad
【分析】(1)平衡常数表达式K的求算,直接套用公式;
(2)根据图象,温度升高,甲醇的物质的量减少,说明平衡逆向进行,所以该反应的正向是放热反应;
(3)反应CO:H2=1:2,加入1molCO和2molH2,如果消耗xmolCO,对应消耗2xmolH2,以此计算;
(4)根据物质变化的物质的量之比等于化学计量数之比,代入公式计算;
(5)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态;
(6)根据化学平衡状态变化因素进行分析。
【详解】(1)平衡常数表达式K=,故答案为:;
(2)根据图象,温度升高,甲醇的物质的量减少,说明平衡逆向进行,升高温度,平衡向吸热反应方向移动,所以该反应的正向是放热反应,则降低温度,K值将增大,故答案为:增大;
(3)反应CO:H2=1:2,加入1molCO和2molH2,如果消耗xmolCO,对应消耗2xmolH2,CO和H2的转化率之比==1:1,故答案为:1:1;
(4)根据物质变化的物质的量之比等于化学计量数之比,500 ℃时,反应在tB达到平衡,生成甲醇nB moL,消耗氢气2nB,容器的体积为3L,以H2的浓度变化表示的化学反应速率是mol·L-1·min-1,故答案为:mol·L-1·min-1;
(5)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,a.CO的浓度不再变化,说明反应处于平衡状态,正确;b. 在恒容、密闭容器中,混合气体的密度始终不改变,错误;
c.混合气体的平均摩尔质量M=m/n,质量不变,平衡时,物质的量不再改变,则混合气体的平均摩尔质量不再改变,正确;d.v生成(CH3OH)=v消耗(CO) 反应速度的方向是相同的,错误;故答案为:ac;
(6) 300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,a. 平衡正向移动,CH3OH的物质的量增加,正确;b. 正逆反应速率都加快,错误;c. 器体积减小, c(CO)和c(H2)均增大,错误;d. 甲醇的物质的量增加,氢气的物质的量减少,浓度之比等于物质的量之比,重新平衡时c(H2)/c(CH3OH)减小,正确;故答案为:ad。
【点睛】本题易错项(5) 判断可逆反应达到化学平衡状态的标志,要分析可逆反应中物质的状态,所给的条件(恒温、恒容或恒压),再结合选项,针对性解答,涉及到密度、平均相对分子质量,可通过公式判定。
24.(1) 0.2mol·L-1· min-1 减小
(2)F
(3)<
(4)8.3×103
(5) 3 20%
【详解】(1)当起始=2,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,则投入CO的物质的量是1 mol,经过2min达到平衡,CO的转化率为40%,则0~2min内平均反应速率v(CO)= ,v(H2): v(CO)=2:1,故v(H2)= 0.2mol·L-1· min-1;此状态下,有:
该反应的平衡常数K为 ,若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,则体系的浓度商Qc为,Qc>K,平衡逆向移动,达新平衡时H2的转化率将减小。
(2)当起始=3时,H2和CO物质的量之和为3mol,参与反应的CO比=2时要少,生成的CH3OH也较少,故达到平衡状态后,CH3OH的体积分数可能是图象中的F。
(3)B的温度比A高出许多,其反应速率也更快,故vA(N2) <vB(N2)。
(4)设达到平衡时产生的氨气的物质的量为xmol,依题意有:
从图中得知,平衡后混合物中氨的体积分数为66.7%,故 ,解得,体系总物质的量为(mol),则B点N2的分压p(N2)为 。
(5)依题意,反应放出的热量为18.4 kJ,则转化N2的物质的量为 ,则有:
达到平衡后,容器内的压强变为原来的90%,可列式: ,解得n(H2)=3(mol);根据方程式,1molN2完全反应理论可生成2molNH3,故NH3产率为。
答案第1页,共2页
答案第1页,共2页
