必修第二册7.1.2烷烃 课件(共27张ppt)化学人教版(2019)
文档属性
| 名称 | 必修第二册7.1.2烷烃 课件(共27张ppt)化学人教版(2019) |

|
|
| 格式 | pptx | ||
| 文件大小 | 700.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-08 11:53:33 | ||
图片预览




文档简介
(共27张PPT)
第七章 有机化合物
第一节 认识有机化合物
第2课时 烷烃
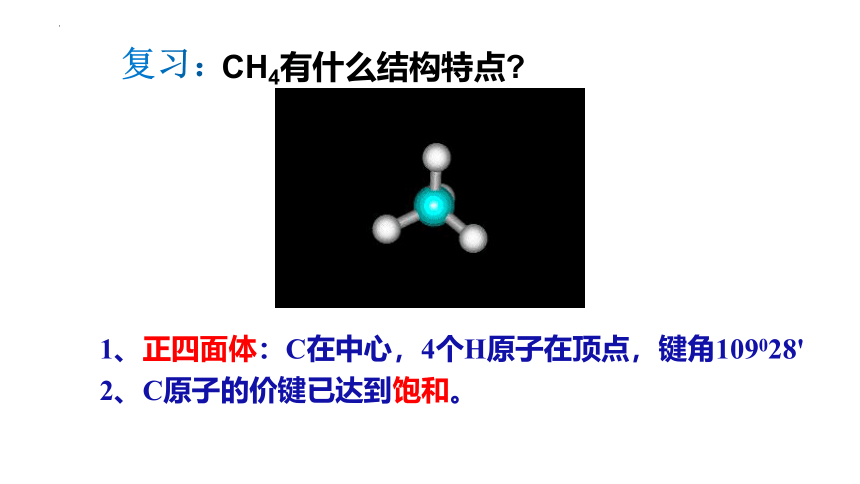
复习:
CH4有什么结构特点
1、正四面体:C在中心,4个H原子在顶点,键角109028'
2、C原子的价键已达到饱和。
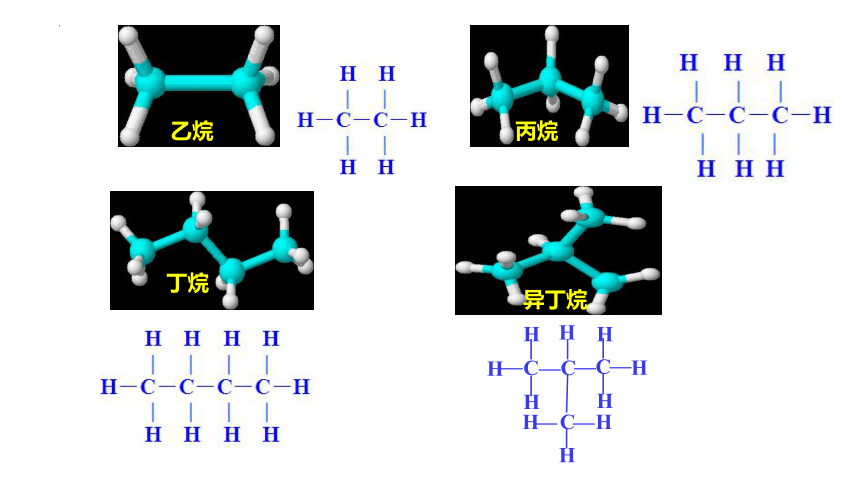
与甲烷结构相似的有机物还有很多,请你根据下列各种物质的球棍模型,写出它们的结构式,试归纳出它们在结构上的特点。
乙烷
丁烷
丙烷
异丁烷
C—C
—
—
H
C
H
H
H
C
—
H
H
H
—
—
H
H
H
丁烷
乙烷
丙烷
异丁烷
1、定义:
分子只由 元素和 元素组成,分子中碳原子之间以 相连,剩余价键全部与 结合,碳原子的化合价都达到“饱和”,这样的有机物叫做 ,也称为 。
单键
氢原子
烷烃
饱和烃
氢
碳
一、烷烃
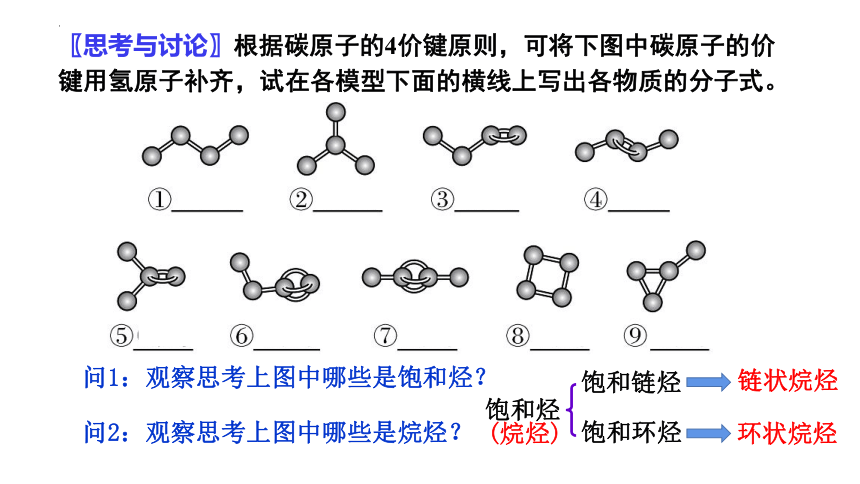
〖思考与讨论〗根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型下面的横线上写出各物质的分子式。
问1:观察思考上图中哪些是饱和烃?
问2:观察思考上图中哪些是烷烃?
饱和烃
饱和链烃
饱和环烃
链状烷烃
环状烷烃
(烷烃)
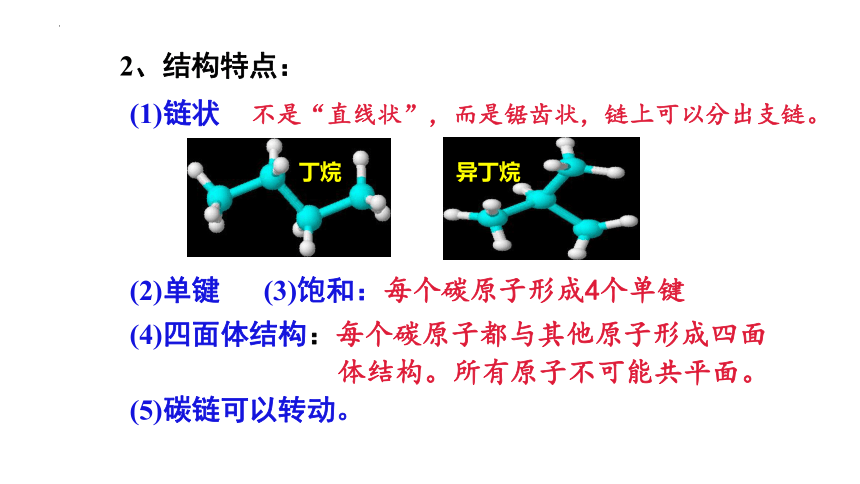
2、结构特点:
(1)链状
不是“直线状”,而是锯齿状,链上可以分出支链。
丁烷
异丁烷
(2)单键
(3)饱和:每个碳原子形成4个单键
(4)四面体结构:每个碳原子都与其他原子形成四面 体结构。所有原子不可能共平面。
(5)碳链可以转动。
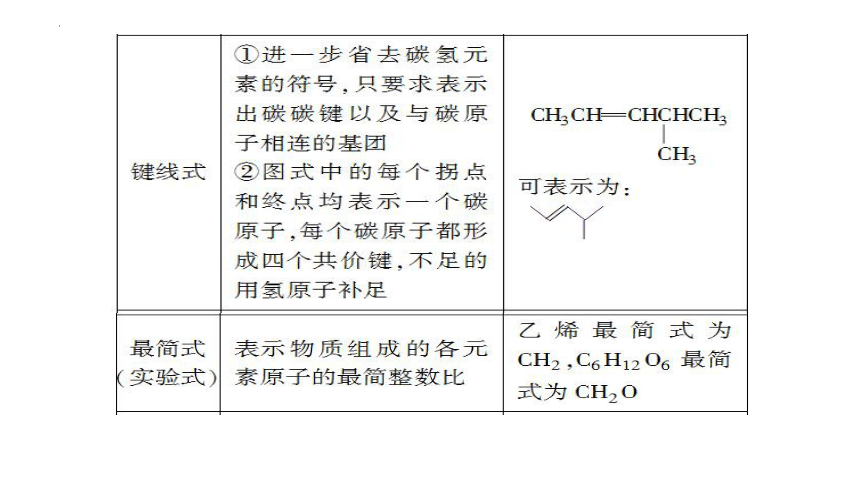
常用化学用语【有机物结构的表示方法】
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH3
CH3CH3
结构式
结构简式
结构简式
丙烷:H H H 丁烷: H H H H
| | | | | | |
H-C-C-C-H H-C-C-C-C-H
| | | | | | |
H H H H H H H
异丁烷: H
|
H-C-H
H H
| |
H-C——C——C-H
| | |
H H H
写出下列各种烷烃的结构简式:
CH3CH2CH3
CH3CH2CH2CH3
或CH3CH(CH3 )CH3
CH3CHCH3
CH3
|
或 CH(CH3)3
CH3
CH3
CH3 – C – CH – CH3
CH3
CH3 – CH2 – CH2 – CH – CH2 – CH – CH3
C2H5
CH3
(CH3)3 CCH(CH3)2
CH3(CH2)2 CH(C2H5 ) CH2CH(CH3) 2
烷烃的命名
——习惯命名法
(1)碳原子数在十个以下,用天干来命名:
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)碳原子数在十个以上,就用数字来命名:
如:C原子数目为11 、17、100等的烷烃其对应的名称分别为:十一烷、十七烷、一百烷。
CH3CHCH3
CH3
正丁烷
异丁烷
CH3CH2CH2CH2CH3
正戊烷
异戊烷
C4H10
C5H12
新戊烷
只适用于简单的有支链的链状烷烃。
CH3CH2CH2CH3
丁烷
戊烷
(3)对于有支链的烷烃:常用正、异、新来表示。
CH3CH2CHCH3
CH3
CH3CCH3
CH3
CH3
链状烷烃的通式:____________
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称 甲烷 乙烷 丙烷 丁烷 戊烷
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称 己烷 庚烷 辛烷 壬烷 癸烷
CnH2n+2 (n≥1)
环状烷烃的通式呢?_____________。
CnH2n(n≥3)
写出下列烷烃的分子式:
(1)含有38个碳原子的烷烃
(2)含有38个氢原子的烷烃
(3)相对分子量为128的烷烃
(4)同温同压下,烷烃的蒸气密度是H2的43倍
练习
C38H78
C9H20
C18H38
C6H14
二、烷烃的性质:
名称 结构简式 常温时的状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
1、物理性质
二、烷烃的性质:
1、物理性质
①状态:气(C1~C4) 液(C5~C16) 固(C17以上)
②随碳原子数增多,烷烃熔沸点依次升高,相对密度依次增大且均小于1,均不溶于水。
③当碳原子数相同时,一般支链越多,沸点越低。
如沸点:正丁烷>异丁烷、正戊烷>异戊烷>新戊烷( 36.1℃>30℃>9.5℃ )。
新戊烷沸点为9.5℃,常温下为气体
①丁烷 ②异丁烷 ③戊烷 ④异戊烷 ⑤新戊烷 ⑥丙烷,
物质的沸点由高到低的排列顺序是___________。
练习
③> ④> ⑤ >① >②> ⑥
二、烷烃的性质:
2、化学性质(与CH4相似)
(1)通常情况下稳定,均不跟强酸、强碱及强氧化剂反应,不能使酸性KMnO4溶液或溴水褪色。
(2)氧化反应(可燃性):
烷烃燃烧通式:________________________________
烃的燃烧规律
CxHy + O2 → xCO2 + H2O
(1)等物质的量的烃CxHy完全燃烧时,耗氧量决定于“”的值,值越大,耗氧量越多。
(2)等质量的烃完全燃烧时,耗氧量决定于CxHy中含氢量(含氢质量分数或的值),含氢量越大,耗氧量越多。
1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
D
2、等质量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大的是哪个?
CH4
练习
(3)取代反应:
在光照条件下与气态卤素单质反应,产物更复杂。
练习:1mol乙烷在光照条件下,最多可以与___mol的Cl2发生取代反应。试写出乙烷在光照条件下发生一氯取代的反应方程式。
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
一氯乙烷
6
烷烃的特征反应
(4)分解反应:由于其它烷烃的碳原子多,所以其它烷烃分解比甲烷复杂。一般甲烷高温分解,长链烷烃高温裂解、裂化。
C4H10 → C2H6+C2H4
高温
C4H10 → CH4+C3H6
高温
指在高温和隔绝空气的条件下,烷烃分子中的C-C键或C-H键发生断裂,由较大分子转变成较小分子的过程。
裂化:
均裂
异裂
在石油化工生产中,通过烷烃的分解可得到一系列重要的化工基本原料和燃料。
(1)乙烷、丁烷等烷烃和氯水也可以发生取代反应( )
(2)CH4和Cl2按体积比1:1混合,发生取代反应生成的产物只有两种( )
(3)1 mol 丁烷C4H10和Cl2完全发生取代反应时,有10 mol Cl2参加反应( )
判断正误
×
×
(4)CH4分子为正四面体结构,因此其生成物CH3Cl、CH2Cl2、CHCl3和CCl4都为正四面体结构( )
×
2、下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥ B.①④⑥ C.②③④ D.①②③④
B
第七章 有机化合物
第一节 认识有机化合物
第2课时 烷烃
复习:
CH4有什么结构特点
1、正四面体:C在中心,4个H原子在顶点,键角109028'
2、C原子的价键已达到饱和。
与甲烷结构相似的有机物还有很多,请你根据下列各种物质的球棍模型,写出它们的结构式,试归纳出它们在结构上的特点。
乙烷
丁烷
丙烷
异丁烷
C—C
—
—
H
C
H
H
H
C
—
H
H
H
—
—
H
H
H
丁烷
乙烷
丙烷
异丁烷
1、定义:
分子只由 元素和 元素组成,分子中碳原子之间以 相连,剩余价键全部与 结合,碳原子的化合价都达到“饱和”,这样的有机物叫做 ,也称为 。
单键
氢原子
烷烃
饱和烃
氢
碳
一、烷烃
〖思考与讨论〗根据碳原子的4价键原则,可将下图中碳原子的价键用氢原子补齐,试在各模型下面的横线上写出各物质的分子式。
问1:观察思考上图中哪些是饱和烃?
问2:观察思考上图中哪些是烷烃?
饱和烃
饱和链烃
饱和环烃
链状烷烃
环状烷烃
(烷烃)
2、结构特点:
(1)链状
不是“直线状”,而是锯齿状,链上可以分出支链。
丁烷
异丁烷
(2)单键
(3)饱和:每个碳原子形成4个单键
(4)四面体结构:每个碳原子都与其他原子形成四面 体结构。所有原子不可能共平面。
(5)碳链可以转动。
常用化学用语【有机物结构的表示方法】
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH3
CH3CH3
结构式
结构简式
结构简式
丙烷:H H H 丁烷: H H H H
| | | | | | |
H-C-C-C-H H-C-C-C-C-H
| | | | | | |
H H H H H H H
异丁烷: H
|
H-C-H
H H
| |
H-C——C——C-H
| | |
H H H
写出下列各种烷烃的结构简式:
CH3CH2CH3
CH3CH2CH2CH3
或CH3CH(CH3 )CH3
CH3CHCH3
CH3
|
或 CH(CH3)3
CH3
CH3
CH3 – C – CH – CH3
CH3
CH3 – CH2 – CH2 – CH – CH2 – CH – CH3
C2H5
CH3
(CH3)3 CCH(CH3)2
CH3(CH2)2 CH(C2H5 ) CH2CH(CH3) 2
烷烃的命名
——习惯命名法
(1)碳原子数在十个以下,用天干来命名:
甲、乙、丙、丁、戊、己、庚、辛、壬、癸
(2)碳原子数在十个以上,就用数字来命名:
如:C原子数目为11 、17、100等的烷烃其对应的名称分别为:十一烷、十七烷、一百烷。
CH3CHCH3
CH3
正丁烷
异丁烷
CH3CH2CH2CH2CH3
正戊烷
异戊烷
C4H10
C5H12
新戊烷
只适用于简单的有支链的链状烷烃。
CH3CH2CH2CH3
丁烷
戊烷
(3)对于有支链的烷烃:常用正、异、新来表示。
CH3CH2CHCH3
CH3
CH3CCH3
CH3
CH3
链状烷烃的通式:____________
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称 甲烷 乙烷 丙烷 丁烷 戊烷
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称 己烷 庚烷 辛烷 壬烷 癸烷
CnH2n+2 (n≥1)
环状烷烃的通式呢?_____________。
CnH2n(n≥3)
写出下列烷烃的分子式:
(1)含有38个碳原子的烷烃
(2)含有38个氢原子的烷烃
(3)相对分子量为128的烷烃
(4)同温同压下,烷烃的蒸气密度是H2的43倍
练习
C38H78
C9H20
C18H38
C6H14
二、烷烃的性质:
名称 结构简式 常温时的状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
1、物理性质
二、烷烃的性质:
1、物理性质
①状态:气(C1~C4) 液(C5~C16) 固(C17以上)
②随碳原子数增多,烷烃熔沸点依次升高,相对密度依次增大且均小于1,均不溶于水。
③当碳原子数相同时,一般支链越多,沸点越低。
如沸点:正丁烷>异丁烷、正戊烷>异戊烷>新戊烷( 36.1℃>30℃>9.5℃ )。
新戊烷沸点为9.5℃,常温下为气体
①丁烷 ②异丁烷 ③戊烷 ④异戊烷 ⑤新戊烷 ⑥丙烷,
物质的沸点由高到低的排列顺序是___________。
练习
③> ④> ⑤ >① >②> ⑥
二、烷烃的性质:
2、化学性质(与CH4相似)
(1)通常情况下稳定,均不跟强酸、强碱及强氧化剂反应,不能使酸性KMnO4溶液或溴水褪色。
(2)氧化反应(可燃性):
烷烃燃烧通式:________________________________
烃的燃烧规律
CxHy + O2 → xCO2 + H2O
(1)等物质的量的烃CxHy完全燃烧时,耗氧量决定于“”的值,值越大,耗氧量越多。
(2)等质量的烃完全燃烧时,耗氧量决定于CxHy中含氢量(含氢质量分数或的值),含氢量越大,耗氧量越多。
1、等物质的量的下列烃完全燃烧时,消耗O2最多的是( )
A、CH4 B、C2H6 C、C3H6 D、C6H6
D
2、等质量的CH4、C2H4、C2H6、C3H4、C3H6完全燃烧,耗氧量最大的是哪个?
CH4
练习
(3)取代反应:
在光照条件下与气态卤素单质反应,产物更复杂。
练习:1mol乙烷在光照条件下,最多可以与___mol的Cl2发生取代反应。试写出乙烷在光照条件下发生一氯取代的反应方程式。
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
一氯乙烷
6
烷烃的特征反应
(4)分解反应:由于其它烷烃的碳原子多,所以其它烷烃分解比甲烷复杂。一般甲烷高温分解,长链烷烃高温裂解、裂化。
C4H10 → C2H6+C2H4
高温
C4H10 → CH4+C3H6
高温
指在高温和隔绝空气的条件下,烷烃分子中的C-C键或C-H键发生断裂,由较大分子转变成较小分子的过程。
裂化:
均裂
异裂
在石油化工生产中,通过烷烃的分解可得到一系列重要的化工基本原料和燃料。
(1)乙烷、丁烷等烷烃和氯水也可以发生取代反应( )
(2)CH4和Cl2按体积比1:1混合,发生取代反应生成的产物只有两种( )
(3)1 mol 丁烷C4H10和Cl2完全发生取代反应时,有10 mol Cl2参加反应( )
判断正误
×
×
(4)CH4分子为正四面体结构,因此其生成物CH3Cl、CH2Cl2、CHCl3和CCl4都为正四面体结构( )
×
2、下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥ B.①④⑥ C.②③④ D.①②③④
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
