人教版九上7.2 燃料的合理利用与开发(第1课时)课件(共19张PPT)
文档属性
| 名称 | 人教版九上7.2 燃料的合理利用与开发(第1课时)课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-09 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
7.2 燃料的合理利用与开发(第1课时)
上节课的学习中,我们了解了燃烧可以放出大量的热。我们生活中的方方面面都离不开这些燃烧带来的能量。
烹调食物
冶炼钢铁
烧制陶瓷
在化学反应时,是不是只有通过燃烧才能放出热量呢?
学习目标
1.知道化学反应中时常伴随着能量变化,认识燃料充分燃烧的重要性。
2.知道化石燃料是人类重要的自然资源,对人类生活起着重要作用。
3.知道化石燃料的不可再生性以及合理开采和节约化石燃料的重要性。
4.初步了解石油炼制出的几种重要产品及其用途。
一、化学反应中的能量变化
在一支试管中加入一小匙干燥的生石灰(或几小块食品袋中的干燥剂,主要成分CaO),再加入约2 mL水,观察现象,并用手轻轻触碰试管外壁。
现象
手的感觉
化学方程式
生石灰逐渐膨胀,碎裂成粉末,产生大量的白雾
感觉发烫
CaO+H2O Ca(OH)2
一、化学反应中的能量变化
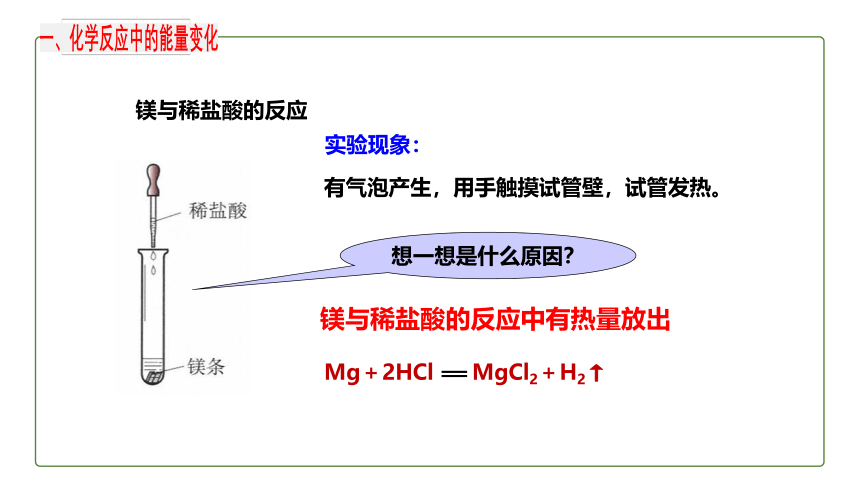
镁与稀盐酸的反应
镁与稀盐酸的反应中有热量放出
Mg+2HCl MgCl2+H2↑
实验现象:
有气泡产生,用手触摸试管壁,试管发热。
想一想是什么原因?
一、化学反应中的能量变化
【提问】
上述实验说明了什么?
化学反应中通常伴随着能量变化。
化学
反应
能量变
化情况
放热反应:放出热量的化学反应(氧化钙与水反应、镁与盐酸反应)
吸热反应:吸收热量的化学反应(碳与二氧化碳的反应)
二、化石燃料的利用
目前,人类通过化学反应获得的能量,大多来自于化石燃料的燃烧,由于资源有限,因此要控制燃烧反应,提高燃料的利用率。
煤、石油、天然气被称为化石燃料,是不可再生能源。
人类的开采使用,化石燃料最终会被耗尽。
二、化石燃料的利用
煤
的
形
成
煤:是古代植物遗体在地层下经过一系列复杂变化而形成的,被人们称为“工业的粮食”、 ”黑色的金子”。
二、化石燃料的利用
煤
隔绝空气加强热
固体:焦炭——冶金工业重要原料
液体:煤焦油——化工原料
粗氨水——化肥
煤气:煤气——燃料
(干馏)
煤气主要成分:
氢气、甲烷、一氧化碳、其他气体
干馏是化学变化
二、化石燃料的利用
煤综合利用的部分产品(工业的粮食)
二、化石燃料的利用
利用石油中各组
分沸点不同分离
是物理变化
石油的分馏
二、化石燃料的利用
石油综合利用的部分产品(工业的血液)
二、化石燃料的利用
天然气主要是由碳和氢组成的气态化合物,其中主要的是甲烷(CH4)。
(1)甲烷的物理性质
①通常状况下为无色、无味、气体
②难溶于水
③比空气轻
天然气
二、化石燃料的利用
注意:在点燃甲烷前要检验纯度
①明亮的蓝色火焰;
②烧杯内壁有水雾;
③杯壁上澄清石灰水变浑浊;
④放出热量。
CH4+2O2 ==== CO2+2H2O
点燃
甲烷燃烧现象
甲烷燃烧化学方程式
二、化石燃料的利用
沼气的制取和利用
二、化石燃料的利用
目前人类所使用的能源主要取自化石燃料,它们经历了上亿年的时间才得以形成,因此不可再生。
2009年我国化石能源基础储量和年产量分别为:
石油 28.33亿吨,1.89亿吨;
天然气 32124亿立方米,851.7亿立方米;
煤 3261亿吨,30.5亿吨。
按照目前全世界对化石燃料的消耗速度计算,这些能源可供人类使用的时间大约还有多少年?
合理利用与开发化石能源
课堂练习
1. 下列不属于化石能源的是( )
A. 石油 B. 天然气
C. 地热能 D. 煤
2. 将石油加热炼制,不可能得到的产品是( )
A. 煤焦油 B. 润滑油
C. 柴油 D. 煤油
C
A
课堂练习
3. 据《易经》记载:“泽中有火”,“上火下泽”。泽,指湖泊池沼。“泽中有火”是对“X气体”在湖泊池沼水面上起火现象的描述。这里“X气体”是指( )
A. 一氧化碳 B. 甲烷 C. 氧气 D. 氢气
4.下列关于燃料综合利用的说法正确的是( )
A. 煤在空气中加强热制得焦炭、煤焦油和煤气等产品
B. 石油中主要含有碳、氢、氧三种元素
C. 石油的分馏和煤的干馏均属于化学变化
D. 石油是由一些沸点不同的化合物组成的混合物,不加热就可以直接燃烧
B
B
课堂小结
一、化学反应中的能量变化
能量变化表现为:
1. 吸热现象:如碳与二氧化碳的反应
2. 放热现象:如氧化钙与水反应
二、化石燃料
1. 煤:是混合物,主要含碳元素,还含少量的氮、硫、氧等元素
2. 石油:利用石油中各成分的沸点不同,将它们分离
3. 天然气:主要成分是甲烷
7.2 燃料的合理利用与开发(第1课时)
上节课的学习中,我们了解了燃烧可以放出大量的热。我们生活中的方方面面都离不开这些燃烧带来的能量。
烹调食物
冶炼钢铁
烧制陶瓷
在化学反应时,是不是只有通过燃烧才能放出热量呢?
学习目标
1.知道化学反应中时常伴随着能量变化,认识燃料充分燃烧的重要性。
2.知道化石燃料是人类重要的自然资源,对人类生活起着重要作用。
3.知道化石燃料的不可再生性以及合理开采和节约化石燃料的重要性。
4.初步了解石油炼制出的几种重要产品及其用途。
一、化学反应中的能量变化
在一支试管中加入一小匙干燥的生石灰(或几小块食品袋中的干燥剂,主要成分CaO),再加入约2 mL水,观察现象,并用手轻轻触碰试管外壁。
现象
手的感觉
化学方程式
生石灰逐渐膨胀,碎裂成粉末,产生大量的白雾
感觉发烫
CaO+H2O Ca(OH)2
一、化学反应中的能量变化
镁与稀盐酸的反应
镁与稀盐酸的反应中有热量放出
Mg+2HCl MgCl2+H2↑
实验现象:
有气泡产生,用手触摸试管壁,试管发热。
想一想是什么原因?
一、化学反应中的能量变化
【提问】
上述实验说明了什么?
化学反应中通常伴随着能量变化。
化学
反应
能量变
化情况
放热反应:放出热量的化学反应(氧化钙与水反应、镁与盐酸反应)
吸热反应:吸收热量的化学反应(碳与二氧化碳的反应)
二、化石燃料的利用
目前,人类通过化学反应获得的能量,大多来自于化石燃料的燃烧,由于资源有限,因此要控制燃烧反应,提高燃料的利用率。
煤、石油、天然气被称为化石燃料,是不可再生能源。
人类的开采使用,化石燃料最终会被耗尽。
二、化石燃料的利用
煤
的
形
成
煤:是古代植物遗体在地层下经过一系列复杂变化而形成的,被人们称为“工业的粮食”、 ”黑色的金子”。
二、化石燃料的利用
煤
隔绝空气加强热
固体:焦炭——冶金工业重要原料
液体:煤焦油——化工原料
粗氨水——化肥
煤气:煤气——燃料
(干馏)
煤气主要成分:
氢气、甲烷、一氧化碳、其他气体
干馏是化学变化
二、化石燃料的利用
煤综合利用的部分产品(工业的粮食)
二、化石燃料的利用
利用石油中各组
分沸点不同分离
是物理变化
石油的分馏
二、化石燃料的利用
石油综合利用的部分产品(工业的血液)
二、化石燃料的利用
天然气主要是由碳和氢组成的气态化合物,其中主要的是甲烷(CH4)。
(1)甲烷的物理性质
①通常状况下为无色、无味、气体
②难溶于水
③比空气轻
天然气
二、化石燃料的利用
注意:在点燃甲烷前要检验纯度
①明亮的蓝色火焰;
②烧杯内壁有水雾;
③杯壁上澄清石灰水变浑浊;
④放出热量。
CH4+2O2 ==== CO2+2H2O
点燃
甲烷燃烧现象
甲烷燃烧化学方程式
二、化石燃料的利用
沼气的制取和利用
二、化石燃料的利用
目前人类所使用的能源主要取自化石燃料,它们经历了上亿年的时间才得以形成,因此不可再生。
2009年我国化石能源基础储量和年产量分别为:
石油 28.33亿吨,1.89亿吨;
天然气 32124亿立方米,851.7亿立方米;
煤 3261亿吨,30.5亿吨。
按照目前全世界对化石燃料的消耗速度计算,这些能源可供人类使用的时间大约还有多少年?
合理利用与开发化石能源
课堂练习
1. 下列不属于化石能源的是( )
A. 石油 B. 天然气
C. 地热能 D. 煤
2. 将石油加热炼制,不可能得到的产品是( )
A. 煤焦油 B. 润滑油
C. 柴油 D. 煤油
C
A
课堂练习
3. 据《易经》记载:“泽中有火”,“上火下泽”。泽,指湖泊池沼。“泽中有火”是对“X气体”在湖泊池沼水面上起火现象的描述。这里“X气体”是指( )
A. 一氧化碳 B. 甲烷 C. 氧气 D. 氢气
4.下列关于燃料综合利用的说法正确的是( )
A. 煤在空气中加强热制得焦炭、煤焦油和煤气等产品
B. 石油中主要含有碳、氢、氧三种元素
C. 石油的分馏和煤的干馏均属于化学变化
D. 石油是由一些沸点不同的化合物组成的混合物,不加热就可以直接燃烧
B
B
课堂小结
一、化学反应中的能量变化
能量变化表现为:
1. 吸热现象:如碳与二氧化碳的反应
2. 放热现象:如氧化钙与水反应
二、化石燃料
1. 煤:是混合物,主要含碳元素,还含少量的氮、硫、氧等元素
2. 石油:利用石油中各成分的沸点不同,将它们分离
3. 天然气:主要成分是甲烷
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
