浙教版九上 1.2物质的酸碱性 随堂练习(含解析)
文档属性
| 名称 | 浙教版九上 1.2物质的酸碱性 随堂练习(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-09-12 08:43:52 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
浙教版九上 1.2物质的酸碱性 随堂练习
一、单选题
1.下列有关氢氧化钠溶液的配制、保存和酸碱度测定的操作中,正确的是( )
A.称量NaOH固体
B.溶解NaOH固体
C.保存NaOH溶液
D.测NaOH溶液的pH
2.实验室有一瓶标签破损的试剂,该试剂的溶质为碳酸钠、硫酸钠、氯化钠中的一种,如图所示。则该试剂( ) 21cnjy.com
A.pH一定等于7 B.一定能使紫色石蕊变蓝
C.可用稀盐酸鉴别 D.可用氯化钡溶液鉴别
3.我们可以通过建立图像来表示化学反应过程中的量的相互关系。现一烧杯中含有HCl和CuCl2的混合液,将一定质量分数的氢氧化钠溶液加入到混合液中直至过量(CuCl2溶液看成中性),则反应中各个量的图像正确的是( ) 【出处:21教育名师】
A.甲、乙、丙 B.甲、乙 C.乙、丙 D.甲、丙
4.天宫课堂中,宇航员通过实验呈现了“奥运五环”,实验中使用了指示剂一一溴百里酚蓝,溴百里酚蓝溶液在不同环境中的显色情况如表所示。下列溶液能使绿色溴百里酚蓝溶液变为蓝色的是( )
溶液 中性溶液 碱性溶液 酸性溶液
颜色 绿色 蓝色 黄色
A.氯化钡溶液 B.硫酸溶液
C.氢氧化钾溶液 D.硫酸钠溶液
5.实验室有一瓶变质的氢氧化钠溶液,小嘉想探究试剂瓶中的氢氧化钠是否已完全变质,设计了两种方案:①取部分试液,滴入过量CaCl2溶液,取上层清液滴入酚酞,观察溶液颜色变化;②取部分试液,滴入过量CuCl2溶液,取上层清液滴入酚酞,观察溶液颜色变化。对于上述两种方案,你认为( ) 21世纪教育网版权所有
A.两种方案都行 B.方案①行,方案②不行
C.两种方案都不行 D.方案①不行,方案②行
6.小嘉用月季花制成酸碱指示剂,将其滴入白醋变红色,滴入下列物质后也变红色的是( )
A.食盐水 B.苏打水 C.肥皂水 D.柠檬水
二、填空题
7.某植物的花瓣汁液(以下简称: X汁液)呈紫色,X汁液分别滴加到盛有下列溶液的试管中有如下现象:
21教育网
溶液名称
白醋 稀盐酸 氯化钠溶液 蒸馏水 石灰水 氢氧化钾溶液
颜色 红色 红色 紫色 紫色 绿色 绿色
(1)据上表推测,X汁液 (填“能”或“不能”)做酸碱指示剂;
(2)将X汁液滴入肥皂水中溶液呈绿色,则肥皂水pH 7 (填“>“” <“或“=”)。
8.红心火龙果富含丰富的维生素、糖类和矿物质等营养素而深受很多人喜爱,因其含花青素使其果肉显红色而得名。 【来源:21·世纪·教育·网】
(1)花青素类物质的颜色随pH值变化而变化,pH<7呈红色,pH=7~8时呈紫色,pH>11时呈蓝色。吃了红心火龙果后,很多人的尿液会呈红色,据此推测尿液呈 性。
(2)火龙果富含糖类物质,能为人体提供大量的能量,请你写出糖类在体内彻底氧化分解释放能量的表达式 。 21·cn·jy·com
9.豆腐是我国传统美食,图甲是制作豆腐时添加卤水让豆腐成块的环节。卤水是氯化镁、氯化钠等的混合液,能点豆腐的是氯化镁。为了测定卤水中氯化镁的含量,小明开展了如下实验:取m1克卤水,慢慢加入碳酸钠粉末,用玻璃棒充分搅拌,直至溶液pH>10,生成沉淀的质量如图乙所示。(化学方程式: MgCl2+Na2CO3=MgCO3↓+2NaCl)
21·世纪*教育网
(1)加入碳酸钠的质量要直至溶液pH>10,此时对应图乙中的点可能是 。
(2)根据实验数据,小明计算氯化镁的含量:a%=(m2/m1) ×100%。请判断小明的计算方法是否正确,并说明理由。
【来源:21cnj*y.co*m】
(3)食盐中若含有氯化镁容易结块(如图丙),现有半烧杯该食盐的溶液,请写出完成除杂的操作和观察到的现象: 。
三、综合说理题
10.往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量,请在下图中画出混合溶液的pH随加入碳酸钠溶液质量增加而变化的曲线,并说明理由。(已知硝酸钙和硝酸钠在溶液中显中性)
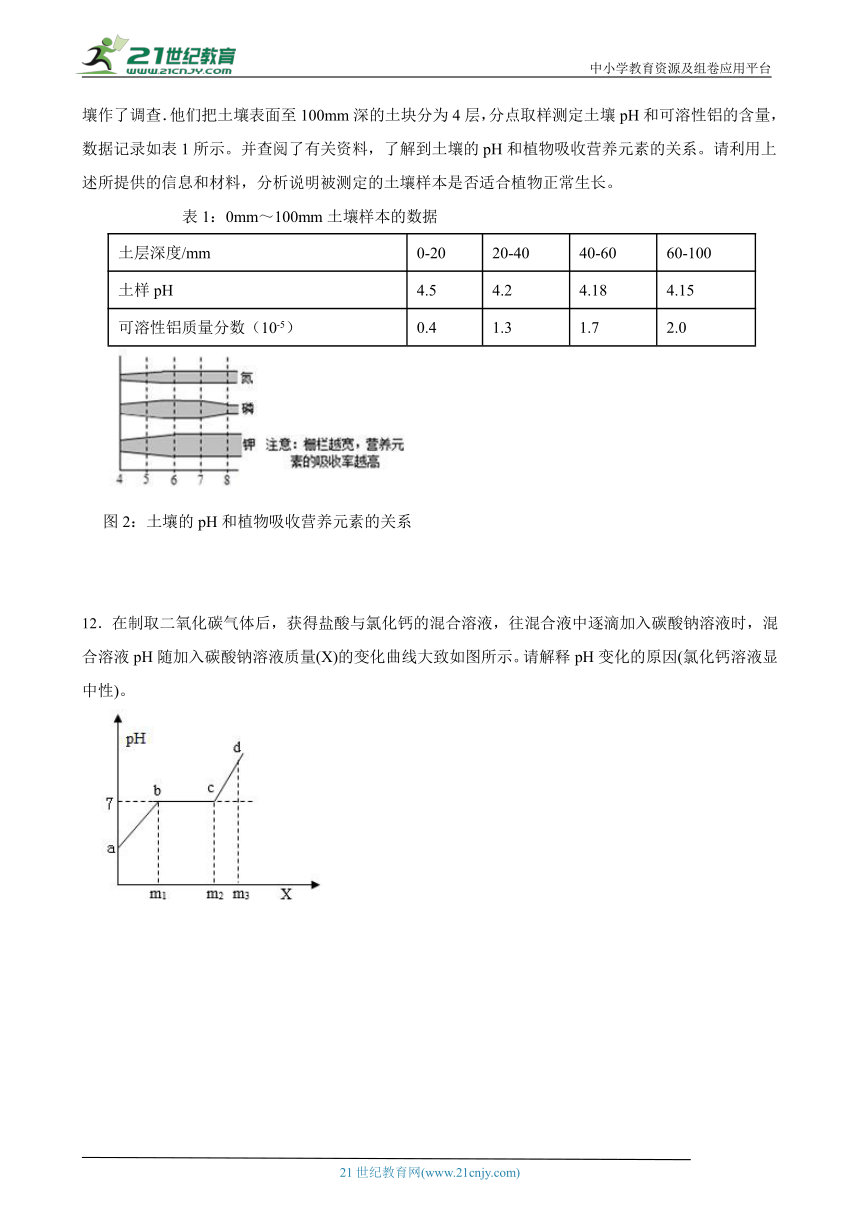
11.大气中SO2含量增加是导致酸雨增多、土壤酸化的主要原因。土壤中各种可溶性铝盐能抑制植物生长,减弱植物抵御外来侵害的能力。为了解土壤的情况,某中学“酸雨”课题研究小组对生物园的土壤作了调查.他们把土壤表面至100mm深的土块分为4层,分点取样测定土壤pH和可溶性铝的含量,数据记录如表1所示。并查阅了有关资料,了解到土壤的pH和植物吸收营养元素的关系。请利用上述所提供的信息和材料,分析说明被测定的土壤样本是否适合植物正常生长。
表1:0mm~100mm土壤样本的数据
土层深度/mm 0-20 20-40 40-60 60-100
土样pH 4.5 4.2 4.18 4.15
可溶性铝质量分数(10-5) 0.4 1.3 1.7 2.0
图2:土壤的pH和植物吸收营养元素的关系
12.在制取二氧化碳气体后,获得盐酸与氯化钙的混合溶液,往混合液中逐滴加入碳酸钠溶液时,混合溶液pH随加入碳酸钠溶液质量(X)的变化曲线大致如图所示。请解释pH变化的原因(氯化钙溶液显中性)。
www.21-cn-jy.com
答案解析部分
1.D
A、根据氢氧化钠的腐蚀性分析;
B、根据量筒的应用分析;
C、根据液体保存在细口瓶中分析;
D、根据pH试纸的使用方法分析。 www-2-1-cnjy-com
A、氢氧化钠具有腐蚀性,不能直接放约片上称量,不符合题意;
B、量筒不能用于溶解氢氧化钠,不符合题意;
C、氢氧化钠溶液应放在细口瓶中,不能放广口瓶中,不符合题意;
D、 测溶液pH需用玻璃棒蘸到少量液体滴在试纸上,然后读值,符合题意;
故选D。2-1-c-n-j-y
2.C
根据化学式书写确定溶液中溶质为碳酸钠和硫酸钠的一种,不会是氯化钠,再由碳酸钠和硫酸钠的性质进行鉴别分析。
2·1·c·n·j·y
A、若试剂为碳酸钠,则溶液呈碱性,pH大于7,不符合题意;
B、若溶液为硫酸钠,则溶液呈中性,不会使石蕊试液变色,不符合题意;
C、由化学式可知,该溶液只能是碳酸钠、硫酸钠的一种,加盐酸有气泡产生则为碳酸钠,无现象则为硫酸钠,可以鉴别,符合题意;
D、氯化钡与碳酸钠、硫酸钠都反应产生白色沉淀,无法鉴别 ,不符合题意;
故选C。21*cnjy*com
3.C
本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否符合题意。
【版权所有:21教育】
向含有盐酸和氯化铜的混合溶液中加入氢氧化钠至过量,氢氧化钠先与盐酸反应生成氯化钠和水,再与氯化铜反应生成氢氧化铜沉淀和氯化钠,所以溶液pH会从小于7上升,至等于7时,保持不变,然后再增加至大于7,甲错误;沉淀质量在加入一定质量的氢氧化钠之后开始增加,至氯化铜反应结束时保持不变,乙正确;氯化铜的质量在盐酸反应后开始减小,至完全反应,丙正确;
故选C。21教育名师原创作品
4.C
根据表格分析溴百里酚蓝溶液变色和溶液酸碱性的关系判断。
根据表格可知,溴百里酚蓝溶液遇到碱性溶液会变成蓝色。
氯化钡溶液呈中性、硫酸溶液呈酸性,氢氧化钾溶液呈碱性,而硫酸钠溶液呈中性,故C符合题意,A、B、D不合题意。
故选C。21*cnjy*com
5.B
根据验证氢氧化钠变质程度,需先除去碳酸钠,再利用氢氧化钠的性质验证是否有氢氧化钠剩余分析。
①取部分试液,滴入过量CaCl2溶液,可除去碳酸钠,再取上层清液滴入酚酞,观察溶液颜色变化以证明氢氧化钠是否存在,可验证氢氧化钠溶液是否完全变质,方案可行;②取部分试液,滴入过量CuCl2溶液,因氯化铜与碳酸钠和氢氧化钠都会发生反应,所以取上层清液滴入酚酞,观察溶液颜色变化 不能证明氢氧化钠变质程度,方案不可行;
故选B。
6.D
月季花制成酸碱指示剂,将其滴入白醋变红色,白醋是酸性的,说明酸性物质遇到该酸碱指示剂变成红色;常见的酸碱指示剂有紫色石蕊试剂和无色酚酞;紫色石蕊试液遇酸变红色,遇碱变蓝色;无色酚酞遇碱变红色,遇酸性和中性物质不变色;
月季花制成酸碱指示剂,将其滴入白醋变红色,白醋是酸性的,说明酸性物质遇到该酸碱指示剂变成红色;
A.食盐水,中性,不符合题意;
B.苏打水,碱性,不符合题意;
C.肥皂水,碱性,不符合题意;
D.柠檬水,酸性,符合题意;
故答案为:D.
7.(1)能
(2)>
(1)根据表格分析汁液遇到酸和碱溶液时能否出现不同的颜色变化即可;
(2)根据X汁液的颜色变化确定肥皂水的pH范围。
(1)根据表格可知,当X汁液遇到酸性液体时呈红色,遇到碱性溶液时呈绿色,遇到中性溶液时不变色,因此它可以做酸碱指示剂。
(2)根据表格可知,X汁液遇到碱性溶液时呈现绿色,因此肥皂水呈碱性,它的的pH>7.
8.(1)酸
(2)有机物+氧→二氧化碳+水+能量
绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物,并且释放氧气的过程,叫做光合作用;绿色植物利用氧气和有机物,在活细胞,分解产生二氧化碳和水丙释放出能量的过程叫做呼吸作用;
(1)吃了红心火龙果后,很多人的尿液会呈红色, 根据 pH<7呈红色 ,推测尿液呈酸性;
(2)】 绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物,并且释放氧气的过程,叫做光合作用;糖类在体内彻底氧化分解释放能量的表达式:有机物+氧→二氧化碳+水+能量 ;
故答案为:(1)酸(2) 有机物+氧→二氧化碳+水+能量
9.(1)D
(2)不正确,m2是碳酸镁的质量,不是氯化镁
(3)逐滴加入碳酸钠直到不再产生沉淀,再过滤蒸发结晶
(1)根据图乙确定溶液沉淀的质量变化,进而确定反应进度,弄清对应的pH值。
(2)氯化镁的含量=;
(3)除杂的原则:①不与除杂试剂反应;②不引入新的杂质,再结合结晶的方法分析解答。
(1)根据图片可知,C点时沉淀的质量保持不变,即反应刚好完全,那么此时溶液的pH=7。此后随着碳酸钠的继续滴入,则溶液呈碱性,即pH>7,因此:加入碳酸钠的质量要直至溶液pH>10,此时对应图乙中的点可能是D。
(2)根据“氯化镁的含量=”可知,氯化镁的含量等于氯化镁的质量与卤水质量的比值,而m1为卤水质量,m2为碳酸镁沉淀的质量,因此计算方法错误。
(3)氯化镁和碳酸钠反应,生成碳酸镁沉淀和氯化钠,既能除去氯化镁,又没有引入新的杂质。然后对得到的溶液进行过滤蒸发结晶即可,那么完成除杂的操作和观察到的现象:逐滴加入碳酸钠直到不再产生沉淀,再过滤蒸发结晶。
10.解:图像如图
根据往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量, 碳酸钠先与硝酸反应,然后再与硝酸钙反应,硝酸溶液pH小于7,碳酸钠溶液pH大于7分析。
往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量, 碳酸钠先与硝酸反应,然后再与硝酸钙反应,随碳酸钠的加入,溶液pH由小于7增加,至等于7后,保持不变,待硝酸钙完全反应后,继续加碳酸钠,溶液pH又增大至大于7,由此绘制图像。
故答案为: 。
11.由表1数据可知,0mm-100mm土壤样本PH均小于5,土壤呈酸性。而且土层越深pH越小,酸性越强,可溶性铝的质量分数也随之增大,这会抑制植物生长,减弱植物抵御外来侵害的能力。同时结合由图2信息可知:土壤PH<5时,植物对生长所需的营养元素N、P、K吸收率较低,因此该土壤样本不适合植物正常生长。
(1)根据表格数据,分析被测得土壤的酸碱度和可溶性铝的含量,然后结合题干信息判断是否有利于植物生成;
(2)根据图2确定适合植物吸收营养素的pH范围,然后从这个角度分析该土壤是否适合植物的正常生长。
(1)由表1数据可知,0mm-100mm土壤样本PH均小于5,土壤呈酸性。而且土层越深pH越小,酸性越强,可溶性铝的质量分数也随之增大,这会抑制植物生长,减弱植物抵御外来侵害的能力。
(2)同时结合由图2信息可知:土壤pH<5时,植物对生长所需的营养元素N、P、K吸收率较低,因此该土壤样本不适合植物正常生长。
12.开始时,盐酸的pH<7,随着碳酸钠的滴入,盐酸和碳酸钠发生中和反应,那么pH逐渐增大;在盐酸被中和的过程中,pH=7保持不变;当盐酸全部被中和后,随着碳酸钠溶液的滴入,溶液的pH成碱性,即pH增大。
(1)酸的pH<7,碱的pH>7;
(2)酸和碱发生正好中和反应,那么溶液的pH=7,据此分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版九上 1.2物质的酸碱性 随堂练习
一、单选题
1.下列有关氢氧化钠溶液的配制、保存和酸碱度测定的操作中,正确的是( )
A.称量NaOH固体
B.溶解NaOH固体
C.保存NaOH溶液
D.测NaOH溶液的pH
2.实验室有一瓶标签破损的试剂,该试剂的溶质为碳酸钠、硫酸钠、氯化钠中的一种,如图所示。则该试剂( ) 21cnjy.com
A.pH一定等于7 B.一定能使紫色石蕊变蓝
C.可用稀盐酸鉴别 D.可用氯化钡溶液鉴别
3.我们可以通过建立图像来表示化学反应过程中的量的相互关系。现一烧杯中含有HCl和CuCl2的混合液,将一定质量分数的氢氧化钠溶液加入到混合液中直至过量(CuCl2溶液看成中性),则反应中各个量的图像正确的是( ) 【出处:21教育名师】
A.甲、乙、丙 B.甲、乙 C.乙、丙 D.甲、丙
4.天宫课堂中,宇航员通过实验呈现了“奥运五环”,实验中使用了指示剂一一溴百里酚蓝,溴百里酚蓝溶液在不同环境中的显色情况如表所示。下列溶液能使绿色溴百里酚蓝溶液变为蓝色的是( )
溶液 中性溶液 碱性溶液 酸性溶液
颜色 绿色 蓝色 黄色
A.氯化钡溶液 B.硫酸溶液
C.氢氧化钾溶液 D.硫酸钠溶液
5.实验室有一瓶变质的氢氧化钠溶液,小嘉想探究试剂瓶中的氢氧化钠是否已完全变质,设计了两种方案:①取部分试液,滴入过量CaCl2溶液,取上层清液滴入酚酞,观察溶液颜色变化;②取部分试液,滴入过量CuCl2溶液,取上层清液滴入酚酞,观察溶液颜色变化。对于上述两种方案,你认为( ) 21世纪教育网版权所有
A.两种方案都行 B.方案①行,方案②不行
C.两种方案都不行 D.方案①不行,方案②行
6.小嘉用月季花制成酸碱指示剂,将其滴入白醋变红色,滴入下列物质后也变红色的是( )
A.食盐水 B.苏打水 C.肥皂水 D.柠檬水
二、填空题
7.某植物的花瓣汁液(以下简称: X汁液)呈紫色,X汁液分别滴加到盛有下列溶液的试管中有如下现象:
21教育网
溶液名称
白醋 稀盐酸 氯化钠溶液 蒸馏水 石灰水 氢氧化钾溶液
颜色 红色 红色 紫色 紫色 绿色 绿色
(1)据上表推测,X汁液 (填“能”或“不能”)做酸碱指示剂;
(2)将X汁液滴入肥皂水中溶液呈绿色,则肥皂水pH 7 (填“>“” <“或“=”)。
8.红心火龙果富含丰富的维生素、糖类和矿物质等营养素而深受很多人喜爱,因其含花青素使其果肉显红色而得名。 【来源:21·世纪·教育·网】
(1)花青素类物质的颜色随pH值变化而变化,pH<7呈红色,pH=7~8时呈紫色,pH>11时呈蓝色。吃了红心火龙果后,很多人的尿液会呈红色,据此推测尿液呈 性。
(2)火龙果富含糖类物质,能为人体提供大量的能量,请你写出糖类在体内彻底氧化分解释放能量的表达式 。 21·cn·jy·com
9.豆腐是我国传统美食,图甲是制作豆腐时添加卤水让豆腐成块的环节。卤水是氯化镁、氯化钠等的混合液,能点豆腐的是氯化镁。为了测定卤水中氯化镁的含量,小明开展了如下实验:取m1克卤水,慢慢加入碳酸钠粉末,用玻璃棒充分搅拌,直至溶液pH>10,生成沉淀的质量如图乙所示。(化学方程式: MgCl2+Na2CO3=MgCO3↓+2NaCl)
21·世纪*教育网
(1)加入碳酸钠的质量要直至溶液pH>10,此时对应图乙中的点可能是 。
(2)根据实验数据,小明计算氯化镁的含量:a%=(m2/m1) ×100%。请判断小明的计算方法是否正确,并说明理由。
【来源:21cnj*y.co*m】
(3)食盐中若含有氯化镁容易结块(如图丙),现有半烧杯该食盐的溶液,请写出完成除杂的操作和观察到的现象: 。
三、综合说理题
10.往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量,请在下图中画出混合溶液的pH随加入碳酸钠溶液质量增加而变化的曲线,并说明理由。(已知硝酸钙和硝酸钠在溶液中显中性)
11.大气中SO2含量增加是导致酸雨增多、土壤酸化的主要原因。土壤中各种可溶性铝盐能抑制植物生长,减弱植物抵御外来侵害的能力。为了解土壤的情况,某中学“酸雨”课题研究小组对生物园的土壤作了调查.他们把土壤表面至100mm深的土块分为4层,分点取样测定土壤pH和可溶性铝的含量,数据记录如表1所示。并查阅了有关资料,了解到土壤的pH和植物吸收营养元素的关系。请利用上述所提供的信息和材料,分析说明被测定的土壤样本是否适合植物正常生长。
表1:0mm~100mm土壤样本的数据
土层深度/mm 0-20 20-40 40-60 60-100
土样pH 4.5 4.2 4.18 4.15
可溶性铝质量分数(10-5) 0.4 1.3 1.7 2.0
图2:土壤的pH和植物吸收营养元素的关系
12.在制取二氧化碳气体后,获得盐酸与氯化钙的混合溶液,往混合液中逐滴加入碳酸钠溶液时,混合溶液pH随加入碳酸钠溶液质量(X)的变化曲线大致如图所示。请解释pH变化的原因(氯化钙溶液显中性)。
www.21-cn-jy.com
答案解析部分
1.D
A、根据氢氧化钠的腐蚀性分析;
B、根据量筒的应用分析;
C、根据液体保存在细口瓶中分析;
D、根据pH试纸的使用方法分析。 www-2-1-cnjy-com
A、氢氧化钠具有腐蚀性,不能直接放约片上称量,不符合题意;
B、量筒不能用于溶解氢氧化钠,不符合题意;
C、氢氧化钠溶液应放在细口瓶中,不能放广口瓶中,不符合题意;
D、 测溶液pH需用玻璃棒蘸到少量液体滴在试纸上,然后读值,符合题意;
故选D。2-1-c-n-j-y
2.C
根据化学式书写确定溶液中溶质为碳酸钠和硫酸钠的一种,不会是氯化钠,再由碳酸钠和硫酸钠的性质进行鉴别分析。
2·1·c·n·j·y
A、若试剂为碳酸钠,则溶液呈碱性,pH大于7,不符合题意;
B、若溶液为硫酸钠,则溶液呈中性,不会使石蕊试液变色,不符合题意;
C、由化学式可知,该溶液只能是碳酸钠、硫酸钠的一种,加盐酸有气泡产生则为碳酸钠,无现象则为硫酸钠,可以鉴别,符合题意;
D、氯化钡与碳酸钠、硫酸钠都反应产生白色沉淀,无法鉴别 ,不符合题意;
故选C。21*cnjy*com
3.C
本题是图像的判断题,解答时要通过题目要求分析涉及到的各物质之间量的关系,结合变化趋势先做出判断,如随着横坐标物质量的变化,纵坐标表示的物质的量的变化趋势,增加或降低等,再确定图形中的起点、终点、转折点是否符合题意。
【版权所有:21教育】
向含有盐酸和氯化铜的混合溶液中加入氢氧化钠至过量,氢氧化钠先与盐酸反应生成氯化钠和水,再与氯化铜反应生成氢氧化铜沉淀和氯化钠,所以溶液pH会从小于7上升,至等于7时,保持不变,然后再增加至大于7,甲错误;沉淀质量在加入一定质量的氢氧化钠之后开始增加,至氯化铜反应结束时保持不变,乙正确;氯化铜的质量在盐酸反应后开始减小,至完全反应,丙正确;
故选C。21教育名师原创作品
4.C
根据表格分析溴百里酚蓝溶液变色和溶液酸碱性的关系判断。
根据表格可知,溴百里酚蓝溶液遇到碱性溶液会变成蓝色。
氯化钡溶液呈中性、硫酸溶液呈酸性,氢氧化钾溶液呈碱性,而硫酸钠溶液呈中性,故C符合题意,A、B、D不合题意。
故选C。21*cnjy*com
5.B
根据验证氢氧化钠变质程度,需先除去碳酸钠,再利用氢氧化钠的性质验证是否有氢氧化钠剩余分析。
①取部分试液,滴入过量CaCl2溶液,可除去碳酸钠,再取上层清液滴入酚酞,观察溶液颜色变化以证明氢氧化钠是否存在,可验证氢氧化钠溶液是否完全变质,方案可行;②取部分试液,滴入过量CuCl2溶液,因氯化铜与碳酸钠和氢氧化钠都会发生反应,所以取上层清液滴入酚酞,观察溶液颜色变化 不能证明氢氧化钠变质程度,方案不可行;
故选B。
6.D
月季花制成酸碱指示剂,将其滴入白醋变红色,白醋是酸性的,说明酸性物质遇到该酸碱指示剂变成红色;常见的酸碱指示剂有紫色石蕊试剂和无色酚酞;紫色石蕊试液遇酸变红色,遇碱变蓝色;无色酚酞遇碱变红色,遇酸性和中性物质不变色;
月季花制成酸碱指示剂,将其滴入白醋变红色,白醋是酸性的,说明酸性物质遇到该酸碱指示剂变成红色;
A.食盐水,中性,不符合题意;
B.苏打水,碱性,不符合题意;
C.肥皂水,碱性,不符合题意;
D.柠檬水,酸性,符合题意;
故答案为:D.
7.(1)能
(2)>
(1)根据表格分析汁液遇到酸和碱溶液时能否出现不同的颜色变化即可;
(2)根据X汁液的颜色变化确定肥皂水的pH范围。
(1)根据表格可知,当X汁液遇到酸性液体时呈红色,遇到碱性溶液时呈绿色,遇到中性溶液时不变色,因此它可以做酸碱指示剂。
(2)根据表格可知,X汁液遇到碱性溶液时呈现绿色,因此肥皂水呈碱性,它的的pH>7.
8.(1)酸
(2)有机物+氧→二氧化碳+水+能量
绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物,并且释放氧气的过程,叫做光合作用;绿色植物利用氧气和有机物,在活细胞,分解产生二氧化碳和水丙释放出能量的过程叫做呼吸作用;
(1)吃了红心火龙果后,很多人的尿液会呈红色, 根据 pH<7呈红色 ,推测尿液呈酸性;
(2)】 绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能量的有机物,并且释放氧气的过程,叫做光合作用;糖类在体内彻底氧化分解释放能量的表达式:有机物+氧→二氧化碳+水+能量 ;
故答案为:(1)酸(2) 有机物+氧→二氧化碳+水+能量
9.(1)D
(2)不正确,m2是碳酸镁的质量,不是氯化镁
(3)逐滴加入碳酸钠直到不再产生沉淀,再过滤蒸发结晶
(1)根据图乙确定溶液沉淀的质量变化,进而确定反应进度,弄清对应的pH值。
(2)氯化镁的含量=;
(3)除杂的原则:①不与除杂试剂反应;②不引入新的杂质,再结合结晶的方法分析解答。
(1)根据图片可知,C点时沉淀的质量保持不变,即反应刚好完全,那么此时溶液的pH=7。此后随着碳酸钠的继续滴入,则溶液呈碱性,即pH>7,因此:加入碳酸钠的质量要直至溶液pH>10,此时对应图乙中的点可能是D。
(2)根据“氯化镁的含量=”可知,氯化镁的含量等于氯化镁的质量与卤水质量的比值,而m1为卤水质量,m2为碳酸镁沉淀的质量,因此计算方法错误。
(3)氯化镁和碳酸钠反应,生成碳酸镁沉淀和氯化钠,既能除去氯化镁,又没有引入新的杂质。然后对得到的溶液进行过滤蒸发结晶即可,那么完成除杂的操作和观察到的现象:逐滴加入碳酸钠直到不再产生沉淀,再过滤蒸发结晶。
10.解:图像如图
根据往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量, 碳酸钠先与硝酸反应,然后再与硝酸钙反应,硝酸溶液pH小于7,碳酸钠溶液pH大于7分析。
往含有硝酸钙和稀硝酸的混合溶液中,逐滴加入碳酸钠溶液至过量, 碳酸钠先与硝酸反应,然后再与硝酸钙反应,随碳酸钠的加入,溶液pH由小于7增加,至等于7后,保持不变,待硝酸钙完全反应后,继续加碳酸钠,溶液pH又增大至大于7,由此绘制图像。
故答案为: 。
11.由表1数据可知,0mm-100mm土壤样本PH均小于5,土壤呈酸性。而且土层越深pH越小,酸性越强,可溶性铝的质量分数也随之增大,这会抑制植物生长,减弱植物抵御外来侵害的能力。同时结合由图2信息可知:土壤PH<5时,植物对生长所需的营养元素N、P、K吸收率较低,因此该土壤样本不适合植物正常生长。
(1)根据表格数据,分析被测得土壤的酸碱度和可溶性铝的含量,然后结合题干信息判断是否有利于植物生成;
(2)根据图2确定适合植物吸收营养素的pH范围,然后从这个角度分析该土壤是否适合植物的正常生长。
(1)由表1数据可知,0mm-100mm土壤样本PH均小于5,土壤呈酸性。而且土层越深pH越小,酸性越强,可溶性铝的质量分数也随之增大,这会抑制植物生长,减弱植物抵御外来侵害的能力。
(2)同时结合由图2信息可知:土壤pH<5时,植物对生长所需的营养元素N、P、K吸收率较低,因此该土壤样本不适合植物正常生长。
12.开始时,盐酸的pH<7,随着碳酸钠的滴入,盐酸和碳酸钠发生中和反应,那么pH逐渐增大;在盐酸被中和的过程中,pH=7保持不变;当盐酸全部被中和后,随着碳酸钠溶液的滴入,溶液的pH成碱性,即pH增大。
(1)酸的pH<7,碱的pH>7;
(2)酸和碱发生正好中和反应,那么溶液的pH=7,据此分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
