浙教版九上 1.5 酸和碱之间发生的反应 随堂练习(含解析)
文档属性
| 名称 | 浙教版九上 1.5 酸和碱之间发生的反应 随堂练习(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-09-07 16:19:52 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
浙教版九上 1.5 酸和碱之间发生的反应 随堂练习
一、单选题
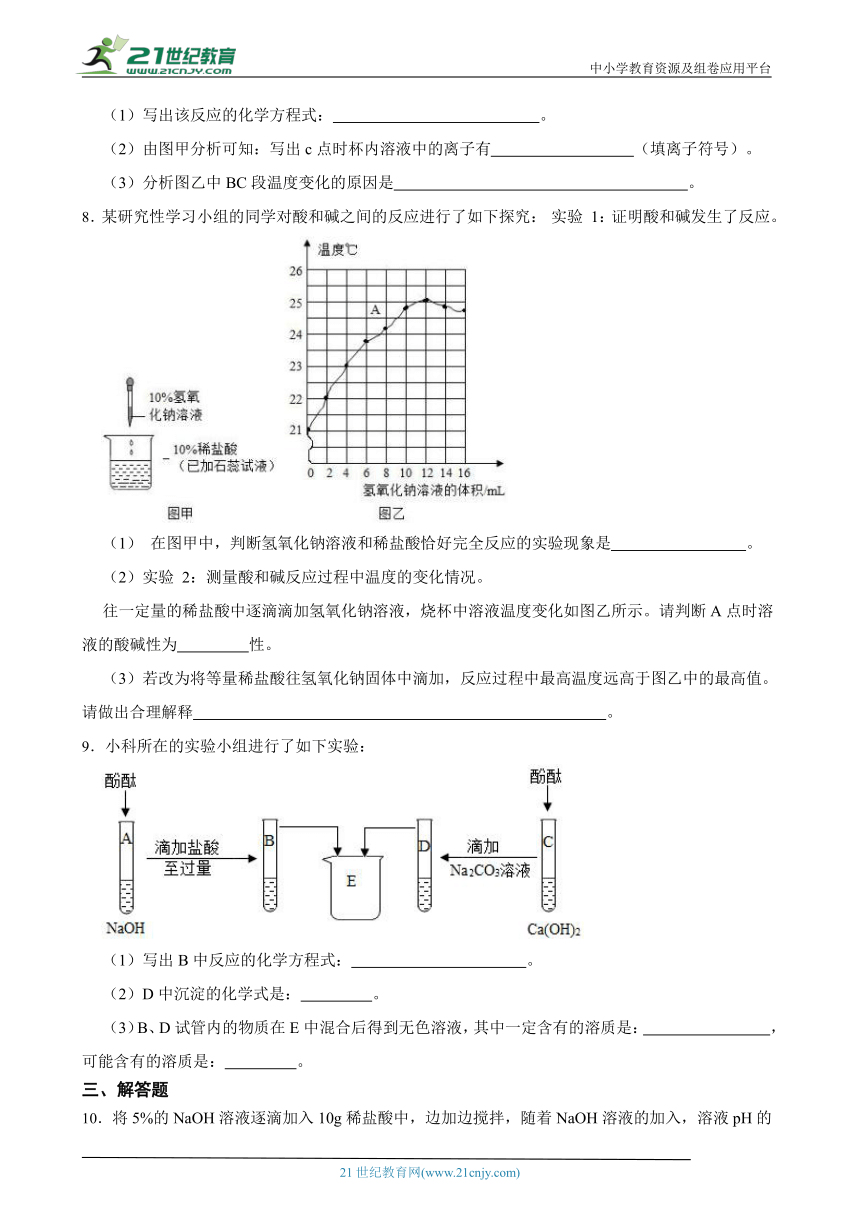
1.如图甲某同学将稀盐酸滴入氢氧化钠溶液中发生反应,图乙是该反应的微观粒子示意图。下列关于酸和碱反应的说法中,合理的是( )2-1-c-n-j-y
A.图中酸碱反应结束后,溶液pH=0
B.酸碱反应的实质是H++OH﹣=H2O
C.酸和碱的质量需相等才能发生反应
D.酸碱反应的实质是Na++Cl﹣=NaCl
2.如图是某同学在学习酸和碱之间的反应后,画出的氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。由此得出的结论正确的是( ) 21*cnjy*com
A.反应后溶液中的粒子只有Na+、Cl-
B.反应前后阴、阳离子的总数不变
C.该反应的实质是Cl-+Na+=NaCl
D.该反应属于复分解反应,反应后溶剂质量增加
3.“松花蛋”(又称“变蛋”)是大家很喜欢的一种食品,因其在制作过程中使用了碱性的物质而带有苦涩味。为减少苦涩味,在吃“松花蛋”时,最好蘸点下列哪种物质( ) 【来源:21cnj*y.co*m】
A.白酒 B.食醋 C.食盐 D.白糖
4.如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作。下列说法正确的是( ) 【出处:21教育名师】
A.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
B.当滴入液体体积为5mL时,所得溶液呈酸性
C.当滴入液体体积为9mL时,所得溶液中的溶质只有NaCl
D.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
5.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH=7
6.推理是一种重要的思维方法,以下推理合理的是( )
A.氧化物中一定含有氧元素,所以含有氧元素的物质一定是氧化物
B.置换反应有单只生成,所以有单质生成的反应一定是置换反应
C.酸碱反应生成盐和水,所以生成盐和水的反应都是酸碱反应
D.酸性溶液能使石蕊变红,所以能使石蕊变红的溶液都是酸性溶液
二、填空题
7.某科学兴趣小组同学对氢氧化钾溶液与稀硫酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上P、Q标签,向烧杯中倒入一定量的P溶液并测定其pH,再向溶液中逐滴加入Q溶液,并不断振荡,同时测定混合液的pH、温度与Q溶液质量的变化曲线:
(1)写出该反应的化学方程式: 。
(2)由图甲分析可知:写出c点时杯内溶液中的离子有 (填离子符号)。
(3)分析图乙中BC段温度变化的原因是 。
8.某研究性学习小组的同学对酸和碱之间的反应进行了如下探究: 实验 1:证明酸和碱发生了反应。
(1) 在图甲中,判断氢氧化钠溶液和稀盐酸恰好完全反应的实验现象是 。
(2)实验 2:测量酸和碱反应过程中温度的变化情况。
往一定量的稀盐酸中逐滴滴加氢氧化钠溶液,烧杯中溶液温度变化如图乙所示。请判断A点时溶液的酸碱性为 性。21世纪教育网版权所有
(3)若改为将等量稀盐酸往氢氧化钠固体中滴加,反应过程中最高温度远高于图乙中的最高值。 请做出合理解释 。21教育名师原创作品
9.小科所在的实验小组进行了如下实验:
(1)写出B中反应的化学方程式: 。
(2)D中沉淀的化学式是: 。
(3)B、D试管内的物质在E中混合后得到无色溶液,其中一定含有的溶质是: ,可能含有的溶质是: 。
21教育网
三、解答题
10.将5%的NaOH溶液逐滴加入10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。请回答:
(1)a点溶液中大量存在的离子有 。
(2)当恰好完全反应时,消耗NaOH溶液的质量为?
(3)计算稀盐酸中溶质的质量分数?
四、综合说理题
11.查阅资料已知:
氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味;
氨气和氯化氢发生反应生成氯化铵为白色固体,氯化铵溶液呈酸性;
相对分子质量越小的分子运动速度越快。
某兴趣小组做了如下实验:将一支约35厘米长的玻璃管水平放置,将一小块浸有无色酚酞试液的滤纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图)。
请你推断该实验中可以观察到的现象,并说明理由。
12.土壤的盐渍化是导致我国耕地减少的一个重大威胁,因为盐渍化之后土壤的 pH 会远高于 7(成为盐碱地),导致大多数植物难以生存。某科技攻关小组已尝试在一盐碱地上种植某种农作物,欲使农作物生长更好须采用多种措施,其中一种措施就是用碳酸水浇灌农作物,请运用所学知识解释采用碳酸水浇灌农作物的道理。【版权所有:21教育】
答案解析部分
1.B
根据酸碱恰好完全反应溶液呈中性,实质是氢离子和氢氧根离子结合成水分子分析。
A、 酸碱反应结束后,溶液pH=7 ,不符合题意;
B、 酸碱反应的实质是H++OH﹣=H2O ,符合题意;
C、 酸和碱的质量为任意值都会发生反应 ,不符合题意;
D、 酸碱反应的实质是H++OH﹣=H2O ,不符合题意;
故选B。21*cnjy*com
2.D
根据氢氧化钠和稀盐酸的反应过程分析判断。
根据图片可知,氢氧化钠和稀盐酸反应,生成氯化钠和水。
反应后溶液中的粒子为Na+、Cl-和H2O,故A错误;
反应后,氢氧根离子和氢离子结合生成水,则阴阳离子的总数变少,故B错误;
该反应的实质为:H++OH-=H2O,故C错误;
该反应为两种化合物相互交换成分,生成两种新的化合物,为复分解反应。由于没有气体和沉淀生成,因此反应后溶液质量增大,故D正确。
故选D。
3.B
根据酸性、碱性物质能发生反应分析。
松花蛋制作过程中使用碱性物质带苦涩味,所以吃时可蘸呈酸性的物质,白酒、食盐、白糖都呈中性,食醋呈酸性;
故选B。
4.A
根据反应时溶液pH的变化分析,由最初pH大于7,说明开始溶液为氢氧化钠溶液,加入盐酸后溶液pH减少,等于7时恰好完全反应。
A、当滴入液体7毫升时,溶液pH=7,证明盐酸和氢氧化钠恰好完全反应,符合题意;
B、 当滴入液体体积为5mL时,溶液pH大于7,所得溶液呈碱性 ,不符合题意;
C、 当滴入液体体积为9mL时,溶液pH大于7,所得溶液中的溶质有NaCl、HCl,不符合题意;
D、 该实验最初pH大于7,说明是将稀盐酸滴入盛有氢氧化钠溶液的烧杯中 ,不符合题意;
故选A。
5.C
根据酸和碱的化学性质分析。
A、锌能与酸反应产生氢气,加锌无明显现象,可证明酸已发生了反应 ,不符合题意;
B、氢氧化钠能使酚酞变红,加酚酞呈无色,可证明氢氧化钠发生了反应,不符合题意;
C、盐酸和反应生成的氯化钠都能与硝酸银反应产生氯化银沉淀,加硝酸银不能证明反应是否发生,符合题意;
D、 盐酸呈酸性,pH小于7,氢氧化钠呈碱性,pH大于7,用pH试纸测混合液pH=7,可证明盐酸和氢氧化钠发生反应,不符合题意;
故选C。
6.D
A、根据氧化物是由两种元素组成,且其中一种为氧元素的化合物分析;
B、根据置换反应反应物和生成物都 一种单质和一种化合物分析;
C、根据金属氧化物与酸或非金属氧化物与碱反应生成盐和水分析;
D、根据酸性溶液能使石蕊试液变红的性质分析。
A、 含有氧元素的物质不一定是氧化物,如高锰酸钾 ,不符合题意;
B、 有单质生成的反应不一定是置换反应 ,如一氧化碳与氧化铁反应生成铁和二氧化碳,不符合题意;
C、 生成盐和水的反应不都是酸碱反应,如氧化铁与盐酸反应 ,不符合题意;
D、酸性溶液能使石蕊变红,能使石蕊变红的溶液一定呈酸性,符合题意;
故选D。
7.(1)2KOH+H2SO4=K2SO4+2H2O
(2)H+、K+、SO42-
(3)加入的硫酸已经过量,酸碱反应停止
根据氢氧化钾和稀硫酸反应生成硫酸钾和水,由各点溶液pH判断反应后溶液的成分,该反应放热,反应结束时随热传递发生温度下降分析。
(1)氢氧化钾和稀硫酸反应生成硫酸钾和水,反应方程式为2KOH+H2SO4=K2SO4+2H2O 。
(2)C点溶液pH小于7,溶质为硫酸钾和硫酸,所含离子有 H+、K+、SO42- 。
(3) 图乙中BC段温度下降是由于加入的硫酸已经过量,酸碱反应停止。
故答案为:(1) 2KOH+H2SO4=K2SO4+2H2O ;(2) H+、K+、SO42- ;(3) 加入的硫酸已经过量,酸碱反应停止 。
8.(1)溶液呈现紫色
(2)酸
(3)除中和反应放热外, 氢氧化钠固体溶于水放出大量热
(1)根据石蕊试液遇中性溶液呈紫色分析;
(2)根据盐酸有剩余时反应后溶液呈酸性分析;
(3)根据氢氧化钠固体溶解和中和反应都放热分析。
21cnjy.com
(1)石蕊试液遇中性溶液呈紫色,向加入石蕊的稀盐酸中加入氢氧化钠溶液时,溶液由红色为成紫色时证明恰好完全反应;
(2)A点溶液盐酸部分反应,溶液呈酸性;
(3)因氢氧化钠固体溶解放热,所以用氢氧化钠固体与盐酸反应放出的热量高于氢氧化钠溶液与盐酸反应放出的热量,即反应时温度前者比后者要高。
故答案为:(1)溶液呈现紫色;(2)酸;(3) 除中和反应放热外, 氢氧化钠固体溶于水放出大量热 。2·1·c·n·j·y
9.(1)HCl+NaOH=NaCl+H2O
(2)CaCO3
(3)NaCl、CaCl2;HCl
(1)根据氢氧化钠与盐酸反应生成氯化钠和水分析;
(2)根据碳酸钠和氢氧化钙的反应,产生的沉淀是碳酸钙分析;
(3)根据碳酸钙能溶于盐酸,反应后溶液中溶质一定有生成物质,反应物可能有剩余分析。
(1) B中为氢氧化钠与盐酸反应生成氯化钠和水,反应的化学方程式为HCl+NaOH=NaCl+H2O ;
(2) D为碳酸钠和氢氧化钙的反应,产生的沉淀是碳酸钙,化学式为CaCO3;
(3)B、D试管内的物质在E中混合后得到无色溶液,说明B中溶质为氯化钠和盐酸,盐酸将D中碳酸钙溶解,盐酸能与碳酸钙反应,则一定与D中氢氧化钠先发生了反应,故E中一定含有的溶质是NaCl、CaCl2,可能含 HCl ;
故答案为:(1) HCl+NaOH=NaCl+H2O ;(2) CaCO3 ;(3) NaCl、CaCl2 ; HCl 。
10.(1)钠离子和氯离子或Na+、Cl-
(2)当恰好完全反应时,溶液pH=7,消耗NaOH溶液的质量16克;
(3)设稀盐酸的溶质质量分数为x
NaOH +HCl=NaCl+H2O
40 36.5
16g×5% 10gx
40:36.5=(16g×5%):10gx
x=7.3%21·cn·jy·com
根据氢氧化钠与盐酸恰好完全反应时溶液pH=7,由参加反应的氢氧化钠质量(即溶液中溶质质量)及方程式中物质质量关系计算盐酸的溶质质量,从而计算溶质质量分数分析。
(1) a点溶液是氢氧化钠与盐酸恰好完全反应,其中溶质只有氯化钠,大量存在的离子有钠离子和氯离子;【来源:21·世纪·教育·网】
11.现象:观察到滤纸先变成红色,最后逐渐褪色;先在试管的中偏右(滤纸右侧)出现白烟。
说明:因为相对分子质量越小分子运动速度越快,氨气的分子量比氯化氢小,所以运动得快,先到达滤纸,氨气溶于水呈碱性,能使滤纸(无色本分酞)变成红色,所以滤纸先变红色。氨气和氯化氢相遇时发生反应生成了白色固体,可以观察到出现白烟。当氯化氢接触到滤纸后(或生成的氯化铵)呈酸性,能使滤纸褪色,所以滤纸最后变成无色。www.21-cn-jy.com
根据氨气的相对分子质量比氯化氢小及实验中白烟产生的位置进行分析。
12.因为碳酸为酸,可与碱性物质发生中和反应,故可以调节土壤的 pH,改良碱性土壤,又因为碳酸不稳定,易分解,生成二氧化碳与水,二氧化碳是光合作用的主要原料,故还可促进植物的光合作用。21·世纪*教育网
根据酸碱能发生中和反应分析;根据碳酸性质不稳定,易分解为二氧化碳和水分析;根据二氧化碳是光合作用原料分析。www-2-1-cnjy-com
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
浙教版九上 1.5 酸和碱之间发生的反应 随堂练习
一、单选题
1.如图甲某同学将稀盐酸滴入氢氧化钠溶液中发生反应,图乙是该反应的微观粒子示意图。下列关于酸和碱反应的说法中,合理的是( )2-1-c-n-j-y
A.图中酸碱反应结束后,溶液pH=0
B.酸碱反应的实质是H++OH﹣=H2O
C.酸和碱的质量需相等才能发生反应
D.酸碱反应的实质是Na++Cl﹣=NaCl
2.如图是某同学在学习酸和碱之间的反应后,画出的氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。由此得出的结论正确的是( ) 21*cnjy*com
A.反应后溶液中的粒子只有Na+、Cl-
B.反应前后阴、阳离子的总数不变
C.该反应的实质是Cl-+Na+=NaCl
D.该反应属于复分解反应,反应后溶剂质量增加
3.“松花蛋”(又称“变蛋”)是大家很喜欢的一种食品,因其在制作过程中使用了碱性的物质而带有苦涩味。为减少苦涩味,在吃“松花蛋”时,最好蘸点下列哪种物质( ) 【来源:21cnj*y.co*m】
A.白酒 B.食醋 C.食盐 D.白糖
4.如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作。下列说法正确的是( ) 【出处:21教育名师】
A.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
B.当滴入液体体积为5mL时,所得溶液呈酸性
C.当滴入液体体积为9mL时,所得溶液中的溶质只有NaCl
D.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
5.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH=7
6.推理是一种重要的思维方法,以下推理合理的是( )
A.氧化物中一定含有氧元素,所以含有氧元素的物质一定是氧化物
B.置换反应有单只生成,所以有单质生成的反应一定是置换反应
C.酸碱反应生成盐和水,所以生成盐和水的反应都是酸碱反应
D.酸性溶液能使石蕊变红,所以能使石蕊变红的溶液都是酸性溶液
二、填空题
7.某科学兴趣小组同学对氢氧化钾溶液与稀硫酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上P、Q标签,向烧杯中倒入一定量的P溶液并测定其pH,再向溶液中逐滴加入Q溶液,并不断振荡,同时测定混合液的pH、温度与Q溶液质量的变化曲线:
(1)写出该反应的化学方程式: 。
(2)由图甲分析可知:写出c点时杯内溶液中的离子有 (填离子符号)。
(3)分析图乙中BC段温度变化的原因是 。
8.某研究性学习小组的同学对酸和碱之间的反应进行了如下探究: 实验 1:证明酸和碱发生了反应。
(1) 在图甲中,判断氢氧化钠溶液和稀盐酸恰好完全反应的实验现象是 。
(2)实验 2:测量酸和碱反应过程中温度的变化情况。
往一定量的稀盐酸中逐滴滴加氢氧化钠溶液,烧杯中溶液温度变化如图乙所示。请判断A点时溶液的酸碱性为 性。21世纪教育网版权所有
(3)若改为将等量稀盐酸往氢氧化钠固体中滴加,反应过程中最高温度远高于图乙中的最高值。 请做出合理解释 。21教育名师原创作品
9.小科所在的实验小组进行了如下实验:
(1)写出B中反应的化学方程式: 。
(2)D中沉淀的化学式是: 。
(3)B、D试管内的物质在E中混合后得到无色溶液,其中一定含有的溶质是: ,可能含有的溶质是: 。
21教育网
三、解答题
10.将5%的NaOH溶液逐滴加入10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。请回答:
(1)a点溶液中大量存在的离子有 。
(2)当恰好完全反应时,消耗NaOH溶液的质量为?
(3)计算稀盐酸中溶质的质量分数?
四、综合说理题
11.查阅资料已知:
氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味;
氨气和氯化氢发生反应生成氯化铵为白色固体,氯化铵溶液呈酸性;
相对分子质量越小的分子运动速度越快。
某兴趣小组做了如下实验:将一支约35厘米长的玻璃管水平放置,将一小块浸有无色酚酞试液的滤纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图)。
请你推断该实验中可以观察到的现象,并说明理由。
12.土壤的盐渍化是导致我国耕地减少的一个重大威胁,因为盐渍化之后土壤的 pH 会远高于 7(成为盐碱地),导致大多数植物难以生存。某科技攻关小组已尝试在一盐碱地上种植某种农作物,欲使农作物生长更好须采用多种措施,其中一种措施就是用碳酸水浇灌农作物,请运用所学知识解释采用碳酸水浇灌农作物的道理。【版权所有:21教育】
答案解析部分
1.B
根据酸碱恰好完全反应溶液呈中性,实质是氢离子和氢氧根离子结合成水分子分析。
A、 酸碱反应结束后,溶液pH=7 ,不符合题意;
B、 酸碱反应的实质是H++OH﹣=H2O ,符合题意;
C、 酸和碱的质量为任意值都会发生反应 ,不符合题意;
D、 酸碱反应的实质是H++OH﹣=H2O ,不符合题意;
故选B。21*cnjy*com
2.D
根据氢氧化钠和稀盐酸的反应过程分析判断。
根据图片可知,氢氧化钠和稀盐酸反应,生成氯化钠和水。
反应后溶液中的粒子为Na+、Cl-和H2O,故A错误;
反应后,氢氧根离子和氢离子结合生成水,则阴阳离子的总数变少,故B错误;
该反应的实质为:H++OH-=H2O,故C错误;
该反应为两种化合物相互交换成分,生成两种新的化合物,为复分解反应。由于没有气体和沉淀生成,因此反应后溶液质量增大,故D正确。
故选D。
3.B
根据酸性、碱性物质能发生反应分析。
松花蛋制作过程中使用碱性物质带苦涩味,所以吃时可蘸呈酸性的物质,白酒、食盐、白糖都呈中性,食醋呈酸性;
故选B。
4.A
根据反应时溶液pH的变化分析,由最初pH大于7,说明开始溶液为氢氧化钠溶液,加入盐酸后溶液pH减少,等于7时恰好完全反应。
A、当滴入液体7毫升时,溶液pH=7,证明盐酸和氢氧化钠恰好完全反应,符合题意;
B、 当滴入液体体积为5mL时,溶液pH大于7,所得溶液呈碱性 ,不符合题意;
C、 当滴入液体体积为9mL时,溶液pH大于7,所得溶液中的溶质有NaCl、HCl,不符合题意;
D、 该实验最初pH大于7,说明是将稀盐酸滴入盛有氢氧化钠溶液的烧杯中 ,不符合题意;
故选A。
5.C
根据酸和碱的化学性质分析。
A、锌能与酸反应产生氢气,加锌无明显现象,可证明酸已发生了反应 ,不符合题意;
B、氢氧化钠能使酚酞变红,加酚酞呈无色,可证明氢氧化钠发生了反应,不符合题意;
C、盐酸和反应生成的氯化钠都能与硝酸银反应产生氯化银沉淀,加硝酸银不能证明反应是否发生,符合题意;
D、 盐酸呈酸性,pH小于7,氢氧化钠呈碱性,pH大于7,用pH试纸测混合液pH=7,可证明盐酸和氢氧化钠发生反应,不符合题意;
故选C。
6.D
A、根据氧化物是由两种元素组成,且其中一种为氧元素的化合物分析;
B、根据置换反应反应物和生成物都 一种单质和一种化合物分析;
C、根据金属氧化物与酸或非金属氧化物与碱反应生成盐和水分析;
D、根据酸性溶液能使石蕊试液变红的性质分析。
A、 含有氧元素的物质不一定是氧化物,如高锰酸钾 ,不符合题意;
B、 有单质生成的反应不一定是置换反应 ,如一氧化碳与氧化铁反应生成铁和二氧化碳,不符合题意;
C、 生成盐和水的反应不都是酸碱反应,如氧化铁与盐酸反应 ,不符合题意;
D、酸性溶液能使石蕊变红,能使石蕊变红的溶液一定呈酸性,符合题意;
故选D。
7.(1)2KOH+H2SO4=K2SO4+2H2O
(2)H+、K+、SO42-
(3)加入的硫酸已经过量,酸碱反应停止
根据氢氧化钾和稀硫酸反应生成硫酸钾和水,由各点溶液pH判断反应后溶液的成分,该反应放热,反应结束时随热传递发生温度下降分析。
(1)氢氧化钾和稀硫酸反应生成硫酸钾和水,反应方程式为2KOH+H2SO4=K2SO4+2H2O 。
(2)C点溶液pH小于7,溶质为硫酸钾和硫酸,所含离子有 H+、K+、SO42- 。
(3) 图乙中BC段温度下降是由于加入的硫酸已经过量,酸碱反应停止。
故答案为:(1) 2KOH+H2SO4=K2SO4+2H2O ;(2) H+、K+、SO42- ;(3) 加入的硫酸已经过量,酸碱反应停止 。
8.(1)溶液呈现紫色
(2)酸
(3)除中和反应放热外, 氢氧化钠固体溶于水放出大量热
(1)根据石蕊试液遇中性溶液呈紫色分析;
(2)根据盐酸有剩余时反应后溶液呈酸性分析;
(3)根据氢氧化钠固体溶解和中和反应都放热分析。
21cnjy.com
(1)石蕊试液遇中性溶液呈紫色,向加入石蕊的稀盐酸中加入氢氧化钠溶液时,溶液由红色为成紫色时证明恰好完全反应;
(2)A点溶液盐酸部分反应,溶液呈酸性;
(3)因氢氧化钠固体溶解放热,所以用氢氧化钠固体与盐酸反应放出的热量高于氢氧化钠溶液与盐酸反应放出的热量,即反应时温度前者比后者要高。
故答案为:(1)溶液呈现紫色;(2)酸;(3) 除中和反应放热外, 氢氧化钠固体溶于水放出大量热 。2·1·c·n·j·y
9.(1)HCl+NaOH=NaCl+H2O
(2)CaCO3
(3)NaCl、CaCl2;HCl
(1)根据氢氧化钠与盐酸反应生成氯化钠和水分析;
(2)根据碳酸钠和氢氧化钙的反应,产生的沉淀是碳酸钙分析;
(3)根据碳酸钙能溶于盐酸,反应后溶液中溶质一定有生成物质,反应物可能有剩余分析。
(1) B中为氢氧化钠与盐酸反应生成氯化钠和水,反应的化学方程式为HCl+NaOH=NaCl+H2O ;
(2) D为碳酸钠和氢氧化钙的反应,产生的沉淀是碳酸钙,化学式为CaCO3;
(3)B、D试管内的物质在E中混合后得到无色溶液,说明B中溶质为氯化钠和盐酸,盐酸将D中碳酸钙溶解,盐酸能与碳酸钙反应,则一定与D中氢氧化钠先发生了反应,故E中一定含有的溶质是NaCl、CaCl2,可能含 HCl ;
故答案为:(1) HCl+NaOH=NaCl+H2O ;(2) CaCO3 ;(3) NaCl、CaCl2 ; HCl 。
10.(1)钠离子和氯离子或Na+、Cl-
(2)当恰好完全反应时,溶液pH=7,消耗NaOH溶液的质量16克;
(3)设稀盐酸的溶质质量分数为x
NaOH +HCl=NaCl+H2O
40 36.5
16g×5% 10gx
40:36.5=(16g×5%):10gx
x=7.3%21·cn·jy·com
根据氢氧化钠与盐酸恰好完全反应时溶液pH=7,由参加反应的氢氧化钠质量(即溶液中溶质质量)及方程式中物质质量关系计算盐酸的溶质质量,从而计算溶质质量分数分析。
(1) a点溶液是氢氧化钠与盐酸恰好完全反应,其中溶质只有氯化钠,大量存在的离子有钠离子和氯离子;【来源:21·世纪·教育·网】
11.现象:观察到滤纸先变成红色,最后逐渐褪色;先在试管的中偏右(滤纸右侧)出现白烟。
说明:因为相对分子质量越小分子运动速度越快,氨气的分子量比氯化氢小,所以运动得快,先到达滤纸,氨气溶于水呈碱性,能使滤纸(无色本分酞)变成红色,所以滤纸先变红色。氨气和氯化氢相遇时发生反应生成了白色固体,可以观察到出现白烟。当氯化氢接触到滤纸后(或生成的氯化铵)呈酸性,能使滤纸褪色,所以滤纸最后变成无色。www.21-cn-jy.com
根据氨气的相对分子质量比氯化氢小及实验中白烟产生的位置进行分析。
12.因为碳酸为酸,可与碱性物质发生中和反应,故可以调节土壤的 pH,改良碱性土壤,又因为碳酸不稳定,易分解,生成二氧化碳与水,二氧化碳是光合作用的主要原料,故还可促进植物的光合作用。21·世纪*教育网
根据酸碱能发生中和反应分析;根据碳酸性质不稳定,易分解为二氧化碳和水分析;根据二氧化碳是光合作用原料分析。www-2-1-cnjy-com
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
