第二章 第一节 第3课时 碳酸钠 碳酸氢钠 焰色试验
文档属性
| 名称 | 第二章 第一节 第3课时 碳酸钠 碳酸氢钠 焰色试验 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二章 第一节 钠及其化合物
第3课时 碳酸钠 碳酸氢钠 焰色试验
【学习目标】
1.通过对比学习碳酸钠、碳酸氢钠的物理、化学性质。
2.了解钠碳酸钠、碳酸氢钠的用途。
【素养目标】
1.结合真实情境或实验,了解碳酸钠、碳酸氢钠的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解碳酸钠、碳酸氢钠的应用,培养学生“科学态度与社会责任”的核心素养。
必备知识与关键能力
知识点一:Na2CO3与NaHCO3的性质比较
Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
颜色状态 白色粉末 白色晶体
溶解性 易溶于水 易溶于水(溶解度比Na2CO3小)
与盐酸 反应 CO+2H+===CO2↑+H2O HCO+H+===H2O+CO2↑
与NaOH反应 不反应 HCO+OH-===CO+H2O
与足量Ca(OH)2 反应 Ca2++CO===CaCO3↓ Ca2++OH-+HCO===CaCO3↓+H2O
与BaCl2反应 CO+Ba2+===BaCO3↓ 不反应
与CO2反应 CO+CO2+H2O===2HCO 不反应
热稳定性 较稳定 2NaHCO3Na2CO3+CO2↑+H2O
用途 玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等 焙制糕点 治疗胃酸
相互转化
典例1.下列关于Na2CO3和NaHCO3性质的说法,正确的是 ( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3C.与稀盐酸反应生成CO2的速率:NaHCO3D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
【答案】B
【解析】 A项,在水中的溶解度:NaHCO3Na2CO3;D项,NaHCO3与Na2CO3之间可以相互转化。
典例2.关于Na2CO3和NaHCO3的说法正确的是( )
A.向两者的溶液中加入BaCl2均生成白色沉淀
B.向两者的溶液中逐滴加入稀盐酸,反应现象完全相同
C.Na2CO3和NaHCO3两物质之间可以相互转化
D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象
【答案】C
【解析】A项,NaHCO3与BaCl2不反应;B项,Na2CO3溶液中逐滴加入盐酸开始无气体,NaHCO3溶液中滴加盐酸,开始就产生气体;D项,向饱和的Na2CO3溶液中通入足量的CO2气体,反应生成的NaHCO3会以沉淀的形式析出。原因有三:①生成的NaHCO3相对于Na2CO3来说溶解度更小;②反应后生成的NaHCO3质量大于Na2CO3的质量(溶质质量增加);③反应中要消耗一部分水(溶剂减少)。综合以上三点,向饱和的Na2CO3溶液中通入足量的CO2气体的化学方程式是Na2CO3+CO2+ H2O===2NaHCO3↓,因此可观察到有晶体析出。
知识点二:Na2CO3与NaHCO3的鉴别、转化与分离
1.鉴别
(1)利用热稳定性不同
(2)相同条件下利用反应速率不同
(3)利用阴离子的不同
(4)利用溶液的碱性不同
2.相互转化
(1)Na2CO3溶液→NaHCO3溶液:Na2CO3+H2O+CO2===2NaHCO3。
(2)NaHCO3→Na2CO3:①2NaHCO3Na2CO3+H2O+CO2↑(固体物质);
②NaHCO3+NaOH===Na2CO3+H2O(溶液中)。
3.Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
典例3.可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl2溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
【答案】C
【解析】加热时无气体放出只能说明不存在NaHCO3,无法证明Na2CO3的存在,A项错误;加入盐酸,不论是否含有Na2CO3均产生气体,B项错误;加入Ca(OH)2溶液,NaHCO3也可生成CaCO3沉淀,无法说明是否存在Na2CO3,D项错误。
典例4.有两支试管分别装有Na2CO3和NaHCO3溶液,下列鉴别二者的操作和判断均正确的是( )
选项 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入等浓度的盐酸 立即产生气泡者为Na2CO3
【答案】C
【解析】A项,发生的反应分别为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=== CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项,滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈;C项,Na2CO3与CaCl2发生反应Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项,逐滴加入等浓度的盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
知识点三:Na2CO3、NaHCO3与酸反应的定量关系
【方法规律】 依据图像特点判断溶液中溶质成分的方法
若a=0(即图像从原点开始) 溶液中的溶质为NaHCO3
若V(Oa)=V(ab)(即Oa段与ab段消耗盐酸的体积相同) 溶液中的溶质为Na2CO3
若V(Oa)>V(ab)(即Oa段消耗盐酸的体积大于ab段消耗盐酸的体积) 溶液中的溶质为Na2CO3和NaOH
若V(Oa)典例5.分别取等浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入稀盐酸,产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
(1)在A情况下,溶质是__________________(填化学式)。
(2)在B情况下,溶质是__________________(填化学式)。
【答案】 (1)NaOH、Na2CO3 (2)Na2CO3、NaHCO3
【解析】CO2与NaOH溶液反应时,据CO2与NaOH量的相对多少,有这样两个阶段:①CO2+2NaOH===Na2CO3+H2O,此时溶质可能为NaOH和Na2CO3或只有Na2CO3(刚好反应);②Na2CO3+CO2+H2O===2NaHCO3,此时溶质可能为Na2CO3和NaHCO3或只有NaHCO3。
知识点四:焰色试验
(1)焰色试验的概念
某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化,属于元素的性质。
(2)焰色试验的操作
铂丝无色观察火焰颜色铂丝无色
(3)常见元素的焰色
钠元素色;钾元素色(透过蓝色钴玻璃观察);铜元素色;钙元素砖红色;锂元素紫红色;钡元素黄绿色。
【点拨】 铂丝洗涤时要用盐酸洗(不能用稀H2SO4洗),然后灼烧,火焰为无色时,说明洗净。
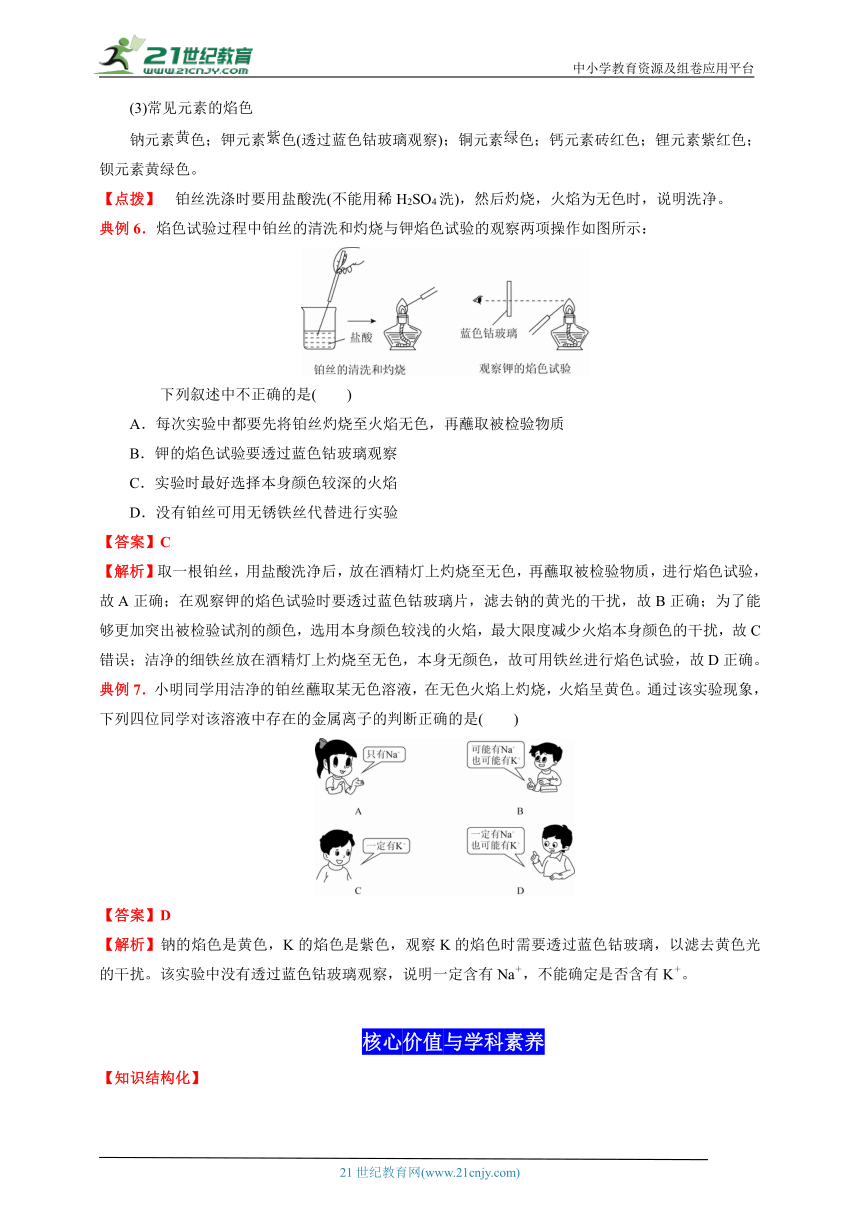
典例6.焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
【答案】C
【解析】取一根铂丝,用盐酸洗净后,放在酒精灯上灼烧至无色,再蘸取被检验物质,进行焰色试验,故A正确;在观察钾的焰色试验时要透过蓝色钴玻璃片,滤去钠的黄光的干扰,故B正确;为了能够更加突出被检验试剂的颜色,选用本身颜色较浅的火焰,最大限度减少火焰本身颜色的干扰,故C错误;洁净的细铁丝放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色试验,故D正确。
典例7.小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色。通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是( )
【答案】D
【解析】钠的焰色是黄色,K的焰色是紫色,观察K的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰。该实验中没有透过蓝色钴玻璃观察,说明一定含有Na+,不能确定是否含有K+。
核心价值与学科素养
【知识结构化】
勇于探索,创新发展——纯碱的生产历史回眸
1.路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,称为路布兰制碱法。其制备流程图如下。
此法分为三步:
(1)氯化钠与硫酸反应,生成硫酸钠:2NaCl+H2SO4Na2SO4+2HCl↑。
(2)用焦炭还原硫酸钠得硫化钠:Na2SO4+4CNa2S+4CO↑。
(3)硫化钠与石灰石反应生成碳酸钠:Na2S+CaCO3===Na2CO3+CaS。
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸作原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵。
2.索尔维制碱法
1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠和氯化钙。其制备流程图如下。
反应步骤为:
CaCO3CaO+CO2↑,
2NH4Cl+CaO===2NH3↑+CaCl2+H2O
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,
2NaHCO3Na2CO3+CO2↑+H2O,反应生成的CO2和NH3可重新作为原料使用。
优缺点:氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。索尔维制碱法的缺点,主要在于原料中各有一半的比分没有利用上,只用了食盐中的钠和石灰中的碳酸根,二者结合才生成了纯碱。食盐中另一半的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
3.侯氏制碱法
侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年所发明的一种高效、低成本的制碱方法,是将索尔维制碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。原料是食盐水、氨气和二氧化碳(合成氨厂用水煤气制取氢气时的废气)。其制备流程图如下。
反应原理:
①产生NaHCO3的反应:NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。
②产生Na2CO3的反应:2NaHCO3Na2CO3+CO2↑+H2O。
优点:CO2、饱和食盐水能循环使用,体现绿色化学思想,能充分利用食盐中的钠和氯,避免产生大量的氯化钙废液和废渣,并可节省一些设备。
典例8.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,利用CO2+NH3+H2O+NaCl===NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
则下列叙述错误的是( )
A.气体A是NH3,气体B是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
【答案】D
【解析】因NH3极易溶于水,而CO2在水中的溶解度不大,为增大CO2的溶解度,应向氨化的饱和食盐水中通入二氧化碳气体,析出碳酸氢钠,加热碳酸氢钠制备纯碱,则A为氨气,B为二氧化碳,故A正确;第Ⅲ步得到的晶体为碳酸氢钠,纯碱和碳酸氢钠与某些固体酸性物质(如酒石酸)混合遇水后可产生CO2气体,因此可用于制发酵粉,故B正确;碳酸钠是重要的化工原料之一,用途广泛,是制玻璃、肥皂、洗涤剂、香料、染料、药品等的重要原料,故C正确;第Ⅳ步操作是将碳酸氢钠直接加热分解得到碳酸钠固体,故D错误。
典例9.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.a通入CO2,然后b通入NH3,c中放蘸稀硫酸的脱脂棉
【答案】D
【解析】侯氏制碱法的原理是向饱和的NaCl溶液中先通入NH3,然后通入CO2,利用生成的碳酸氢钠溶解度小而析出。由于NH3在水中的溶解度大所以先通NH3,但为了防倒吸,所以a通入NH3,然后b通入CO2,考虑NH3的尾气处理所以选择放蘸稀硫酸的脱脂棉,即C正确。
【跟踪练习】 基础过关
1. 近来网络上流传“小苏打能饿死癌细胞”。下列关于小苏打的叙述正确的是( )
A.化学式为Na2CO3 B.受热不分解
C.属于盐 D.与盐酸不反应
【答案】C
【解析】小苏打是碳酸氢钠的俗称,化学式为NaHCO3,A项错误;NaHCO3是可溶性碳酸氢盐,受热易分解,B项错误;NaHCO3是碳酸氢盐,属于盐类,C项正确;NaHCO3能和盐酸反应生成氯化钠、水和二氧化碳,D项错误。
2. 下列有关叙述正确的是( )
A.碳酸氢钠药片,该药是抗酸药,服用时喝些醋能提高药效
B.分别将少量钠投入到盛有水和乙醇的烧杯中,可比较水和乙醇中氢的活泼性
C.钾、钠、镁等活泼金属着火时,可用泡沫灭火器灭火
D.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
【答案】B
【解析】醋酸能与碳酸氢钠反应产生二氧化碳,降低药效,A错;钠在水中反应的速率比在乙醇中的大,可比较二者氢原子的活泼性,B正确;钠、钾都能与水反应产生氢气,镁能在二氧化碳中燃烧,因而不能用泡沫灭火器灭火,C错误;钠的焰色反应为黄色,可掩盖钾的火焰的紫色,D项错误。
3. 节日燃放的绚丽焰火与“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验均应透过蓝色钴玻璃观察
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色试验是化学变化
D.焰色试验后金属丝用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
【答案】B
【解析】A错,在观察钾元素焰色试验的焰色时,为了滤去黄色的光应透过蓝色钴玻璃观察,并不是都要透过蓝色钴玻璃观察;B对,NaCl与Na2CO3中都含有钠元素,故灼烧时火焰颜色相同;C错,焰色试验体现了元素的物理性质,不发生化学变化;D错,焰色试验后金属丝用盐酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧。
4. 为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
【答案】D
【解析】Na2CO3和Na2SO4均能与Ba(OH)2反应,不能达到除杂的目的。
5. 下列实验装置不能达到实验目的的是( )
【答案】D
【解析】A项,在大试管中存有一定量的空气,若Na与水的反应是放热反应,放出的热量使空气膨胀,导致U形管中的红墨水左侧液面下降,右面液面上升,正确;B项,Na2O2与H2O反应生成的O2能使带火星的木条复燃,正确;C项,进行焰色试验可以用光洁无锈的铁丝或铂丝蘸待测溶液,然后在酒精灯的火焰上灼烧,若观察到火焰呈黄色,就证明在纯碱中含有钠元素,正确;D项,比较Na2CO3、NaHCO3的热稳定性,应该把NaHCO3放在内管,把Na2CO3放在外管,若观察到与内管连接的澄清石灰水变浑浊,就证明稳定性Na2CO3>NaHCO3,错误。
能力达成
6. 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其剩余固体质量变为w2 g,则该样品的纯度(质量分数)是( )
A. B.
C. D.
【答案】A
【解析】根据NaHCO3受热分解的化学方程式,结合反应前后固体的质量差可列式求解:
2NaHCO3Na2CO3+H2O↑+CO2↑ Δm
2×84 g 106 g 18 g 44 g 62 g
m(NaHCO3) (w1 w2) g
求出m(NaHCO3),即可得出样品的纯度。
7. 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
【答案】 (1)H2O CO2 (2)> (3)不能;因为大试管中加热温度高,而小试管中温度低,NaHCO3受热分解的原因也可能是温度高造成的。
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
(1)装置丙中反应的化学方程式为_______________________________________。
(2)装置乙的作用是______________________________。为防止污染空气,尾气中的________需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、________、________。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表。
选择的装置(填编号) 实验现象 实验结论
样品中含NaHCO3
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为________________________。
【答案】(1)NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
(2)除去CO2中的HCl气体 氨气(NH3)
(3)过滤 洗涤 灼烧
(4)A、B B中溶液变浑浊(或A、C C中物质变蓝或A、C、B C中物质变蓝,B中溶液变浑浊)
(5)%
【解析】(1)NaHCO3的溶解度不大,在氨化的饱和食盐水中通入过量CO2可析出NaHCO3沉淀。
(2)用装置甲和相应药品制得的CO2中混有HCl,用装置乙可以除去HCl。氨化的饱和食盐水可挥发出污染环境的NH3,尾气应进行处理。
(3)装置丙中产生了NaHCO3沉淀,将过滤后得到的NaHCO3进行洗涤,然后灼烧即可得到纯碱。
(4)用酒精灯加热时,Na2CO3受热不分解,NaHCO3受热分解可生成CO2、H2O和Na2CO3,加热纯碱样品,只要能检验出有CO2或H2O生成即可说明纯碱样品中含有NaHCO3。
(5)实验所得沉淀为CaCO3,n(Na2CO3)=n(CaCO3)= mol,m(Na2CO3)= g,纯碱样品的纯度为×100%=%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章 第一节 钠及其化合物
第3课时 碳酸钠 碳酸氢钠 焰色试验
【学习目标】
1.通过对比学习碳酸钠、碳酸氢钠的物理、化学性质。
2.了解钠碳酸钠、碳酸氢钠的用途。
【素养目标】
1.结合真实情境或实验,了解碳酸钠、碳酸氢钠的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解碳酸钠、碳酸氢钠的应用,培养学生“科学态度与社会责任”的核心素养。
必备知识与关键能力
知识点一:Na2CO3与NaHCO3的性质比较
Na2CO3 NaHCO3
俗名 纯碱、苏打 小苏打
颜色状态 白色粉末 白色晶体
溶解性 易溶于水 易溶于水(溶解度比Na2CO3小)
与盐酸 反应 CO+2H+===CO2↑+H2O HCO+H+===H2O+CO2↑
与NaOH反应 不反应 HCO+OH-===CO+H2O
与足量Ca(OH)2 反应 Ca2++CO===CaCO3↓ Ca2++OH-+HCO===CaCO3↓+H2O
与BaCl2反应 CO+Ba2+===BaCO3↓ 不反应
与CO2反应 CO+CO2+H2O===2HCO 不反应
热稳定性 较稳定 2NaHCO3Na2CO3+CO2↑+H2O
用途 玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等 焙制糕点 治疗胃酸
相互转化
典例1.下列关于Na2CO3和NaHCO3性质的说法,正确的是 ( )
A.在水中的溶解度:NaHCO3>Na2CO3
B.热稳定性:NaHCO3
【答案】B
【解析】 A项,在水中的溶解度:NaHCO3
典例2.关于Na2CO3和NaHCO3的说法正确的是( )
A.向两者的溶液中加入BaCl2均生成白色沉淀
B.向两者的溶液中逐滴加入稀盐酸,反应现象完全相同
C.Na2CO3和NaHCO3两物质之间可以相互转化
D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象
【答案】C
【解析】A项,NaHCO3与BaCl2不反应;B项,Na2CO3溶液中逐滴加入盐酸开始无气体,NaHCO3溶液中滴加盐酸,开始就产生气体;D项,向饱和的Na2CO3溶液中通入足量的CO2气体,反应生成的NaHCO3会以沉淀的形式析出。原因有三:①生成的NaHCO3相对于Na2CO3来说溶解度更小;②反应后生成的NaHCO3质量大于Na2CO3的质量(溶质质量增加);③反应中要消耗一部分水(溶剂减少)。综合以上三点,向饱和的Na2CO3溶液中通入足量的CO2气体的化学方程式是Na2CO3+CO2+ H2O===2NaHCO3↓,因此可观察到有晶体析出。
知识点二:Na2CO3与NaHCO3的鉴别、转化与分离
1.鉴别
(1)利用热稳定性不同
(2)相同条件下利用反应速率不同
(3)利用阴离子的不同
(4)利用溶液的碱性不同
2.相互转化
(1)Na2CO3溶液→NaHCO3溶液:Na2CO3+H2O+CO2===2NaHCO3。
(2)NaHCO3→Na2CO3:①2NaHCO3Na2CO3+H2O+CO2↑(固体物质);
②NaHCO3+NaOH===Na2CO3+H2O(溶液中)。
3.Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
典例3.可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl2溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
【答案】C
【解析】加热时无气体放出只能说明不存在NaHCO3,无法证明Na2CO3的存在,A项错误;加入盐酸,不论是否含有Na2CO3均产生气体,B项错误;加入Ca(OH)2溶液,NaHCO3也可生成CaCO3沉淀,无法说明是否存在Na2CO3,D项错误。
典例4.有两支试管分别装有Na2CO3和NaHCO3溶液,下列鉴别二者的操作和判断均正确的是( )
选项 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入等浓度的盐酸 立即产生气泡者为Na2CO3
【答案】C
【解析】A项,发生的反应分别为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=== CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项,滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈;C项,Na2CO3与CaCl2发生反应Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应;D项,逐滴加入等浓度的盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
知识点三:Na2CO3、NaHCO3与酸反应的定量关系
【方法规律】 依据图像特点判断溶液中溶质成分的方法
若a=0(即图像从原点开始) 溶液中的溶质为NaHCO3
若V(Oa)=V(ab)(即Oa段与ab段消耗盐酸的体积相同) 溶液中的溶质为Na2CO3
若V(Oa)>V(ab)(即Oa段消耗盐酸的体积大于ab段消耗盐酸的体积) 溶液中的溶质为Na2CO3和NaOH
若V(Oa)
(1)在A情况下,溶质是__________________(填化学式)。
(2)在B情况下,溶质是__________________(填化学式)。
【答案】 (1)NaOH、Na2CO3 (2)Na2CO3、NaHCO3
【解析】CO2与NaOH溶液反应时,据CO2与NaOH量的相对多少,有这样两个阶段:①CO2+2NaOH===Na2CO3+H2O,此时溶质可能为NaOH和Na2CO3或只有Na2CO3(刚好反应);②Na2CO3+CO2+H2O===2NaHCO3,此时溶质可能为Na2CO3和NaHCO3或只有NaHCO3。
知识点四:焰色试验
(1)焰色试验的概念
某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化,属于元素的性质。
(2)焰色试验的操作
铂丝无色观察火焰颜色铂丝无色
(3)常见元素的焰色
钠元素色;钾元素色(透过蓝色钴玻璃观察);铜元素色;钙元素砖红色;锂元素紫红色;钡元素黄绿色。
【点拨】 铂丝洗涤时要用盐酸洗(不能用稀H2SO4洗),然后灼烧,火焰为无色时,说明洗净。
典例6.焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
【答案】C
【解析】取一根铂丝,用盐酸洗净后,放在酒精灯上灼烧至无色,再蘸取被检验物质,进行焰色试验,故A正确;在观察钾的焰色试验时要透过蓝色钴玻璃片,滤去钠的黄光的干扰,故B正确;为了能够更加突出被检验试剂的颜色,选用本身颜色较浅的火焰,最大限度减少火焰本身颜色的干扰,故C错误;洁净的细铁丝放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色试验,故D正确。
典例7.小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色。通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是( )
【答案】D
【解析】钠的焰色是黄色,K的焰色是紫色,观察K的焰色时需要透过蓝色钴玻璃,以滤去黄色光的干扰。该实验中没有透过蓝色钴玻璃观察,说明一定含有Na+,不能确定是否含有K+。
核心价值与学科素养
【知识结构化】
勇于探索,创新发展——纯碱的生产历史回眸
1.路布兰制碱法
1791年法国医生路布兰首先取得专利,以食盐为原料,制得了纯碱,称为路布兰制碱法。其制备流程图如下。
此法分为三步:
(1)氯化钠与硫酸反应,生成硫酸钠:2NaCl+H2SO4Na2SO4+2HCl↑。
(2)用焦炭还原硫酸钠得硫化钠:Na2SO4+4CNa2S+4CO↑。
(3)硫化钠与石灰石反应生成碳酸钠:Na2S+CaCO3===Na2CO3+CaS。
路布兰制取纯碱,主要生产过程在固相中进行,难以连续生产,又需硫酸作原料,设备腐蚀严重,产品质量不纯,原料利用不充分,价格较贵。
2.索尔维制碱法
1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠和氯化钙。其制备流程图如下。
反应步骤为:
CaCO3CaO+CO2↑,
2NH4Cl+CaO===2NH3↑+CaCl2+H2O
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,
2NaHCO3Na2CO3+CO2↑+H2O,反应生成的CO2和NH3可重新作为原料使用。
优缺点:氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为纯碱,但最大的优点还在于成本低廉。索尔维制碱法的缺点,主要在于原料中各有一半的比分没有利用上,只用了食盐中的钠和石灰中的碳酸根,二者结合才生成了纯碱。食盐中另一半的氯和石灰中的钙结合生成了氯化钙,这个产物都没有利用上。
3.侯氏制碱法
侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年所发明的一种高效、低成本的制碱方法,是将索尔维制碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。原料是食盐水、氨气和二氧化碳(合成氨厂用水煤气制取氢气时的废气)。其制备流程图如下。
反应原理:
①产生NaHCO3的反应:NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。
②产生Na2CO3的反应:2NaHCO3Na2CO3+CO2↑+H2O。
优点:CO2、饱和食盐水能循环使用,体现绿色化学思想,能充分利用食盐中的钠和氯,避免产生大量的氯化钙废液和废渣,并可节省一些设备。
典例8.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,利用CO2+NH3+H2O+NaCl===NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
则下列叙述错误的是( )
A.气体A是NH3,气体B是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
【答案】D
【解析】因NH3极易溶于水,而CO2在水中的溶解度不大,为增大CO2的溶解度,应向氨化的饱和食盐水中通入二氧化碳气体,析出碳酸氢钠,加热碳酸氢钠制备纯碱,则A为氨气,B为二氧化碳,故A正确;第Ⅲ步得到的晶体为碳酸氢钠,纯碱和碳酸氢钠与某些固体酸性物质(如酒石酸)混合遇水后可产生CO2气体,因此可用于制发酵粉,故B正确;碳酸钠是重要的化工原料之一,用途广泛,是制玻璃、肥皂、洗涤剂、香料、染料、药品等的重要原料,故C正确;第Ⅳ步操作是将碳酸氢钠直接加热分解得到碳酸钠固体,故D错误。
典例9.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.a通入CO2,然后b通入NH3,c中放蘸稀硫酸的脱脂棉
【答案】D
【解析】侯氏制碱法的原理是向饱和的NaCl溶液中先通入NH3,然后通入CO2,利用生成的碳酸氢钠溶解度小而析出。由于NH3在水中的溶解度大所以先通NH3,但为了防倒吸,所以a通入NH3,然后b通入CO2,考虑NH3的尾气处理所以选择放蘸稀硫酸的脱脂棉,即C正确。
【跟踪练习】 基础过关
1. 近来网络上流传“小苏打能饿死癌细胞”。下列关于小苏打的叙述正确的是( )
A.化学式为Na2CO3 B.受热不分解
C.属于盐 D.与盐酸不反应
【答案】C
【解析】小苏打是碳酸氢钠的俗称,化学式为NaHCO3,A项错误;NaHCO3是可溶性碳酸氢盐,受热易分解,B项错误;NaHCO3是碳酸氢盐,属于盐类,C项正确;NaHCO3能和盐酸反应生成氯化钠、水和二氧化碳,D项错误。
2. 下列有关叙述正确的是( )
A.碳酸氢钠药片,该药是抗酸药,服用时喝些醋能提高药效
B.分别将少量钠投入到盛有水和乙醇的烧杯中,可比较水和乙醇中氢的活泼性
C.钾、钠、镁等活泼金属着火时,可用泡沫灭火器灭火
D.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
【答案】B
【解析】醋酸能与碳酸氢钠反应产生二氧化碳,降低药效,A错;钠在水中反应的速率比在乙醇中的大,可比较二者氢原子的活泼性,B正确;钠、钾都能与水反应产生氢气,镁能在二氧化碳中燃烧,因而不能用泡沫灭火器灭火,C错误;钠的焰色反应为黄色,可掩盖钾的火焰的紫色,D项错误。
3. 节日燃放的绚丽焰火与“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验均应透过蓝色钴玻璃观察
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色试验是化学变化
D.焰色试验后金属丝用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
【答案】B
【解析】A错,在观察钾元素焰色试验的焰色时,为了滤去黄色的光应透过蓝色钴玻璃观察,并不是都要透过蓝色钴玻璃观察;B对,NaCl与Na2CO3中都含有钠元素,故灼烧时火焰颜色相同;C错,焰色试验体现了元素的物理性质,不发生化学变化;D错,焰色试验后金属丝用盐酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧。
4. 为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
【答案】D
【解析】Na2CO3和Na2SO4均能与Ba(OH)2反应,不能达到除杂的目的。
5. 下列实验装置不能达到实验目的的是( )
【答案】D
【解析】A项,在大试管中存有一定量的空气,若Na与水的反应是放热反应,放出的热量使空气膨胀,导致U形管中的红墨水左侧液面下降,右面液面上升,正确;B项,Na2O2与H2O反应生成的O2能使带火星的木条复燃,正确;C项,进行焰色试验可以用光洁无锈的铁丝或铂丝蘸待测溶液,然后在酒精灯的火焰上灼烧,若观察到火焰呈黄色,就证明在纯碱中含有钠元素,正确;D项,比较Na2CO3、NaHCO3的热稳定性,应该把NaHCO3放在内管,把Na2CO3放在外管,若观察到与内管连接的澄清石灰水变浑浊,就证明稳定性Na2CO3>NaHCO3,错误。
能力达成
6. 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其剩余固体质量变为w2 g,则该样品的纯度(质量分数)是( )
A. B.
C. D.
【答案】A
【解析】根据NaHCO3受热分解的化学方程式,结合反应前后固体的质量差可列式求解:
2NaHCO3Na2CO3+H2O↑+CO2↑ Δm
2×84 g 106 g 18 g 44 g 62 g
m(NaHCO3) (w1 w2) g
求出m(NaHCO3),即可得出样品的纯度。
7. 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了________,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
【答案】 (1)H2O CO2 (2)> (3)不能;因为大试管中加热温度高,而小试管中温度低,NaHCO3受热分解的原因也可能是温度高造成的。
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
(1)装置丙中反应的化学方程式为_______________________________________。
(2)装置乙的作用是______________________________。为防止污染空气,尾气中的________需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、________、________。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表。
选择的装置(填编号) 实验现象 实验结论
样品中含NaHCO3
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为________________________。
【答案】(1)NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl
(2)除去CO2中的HCl气体 氨气(NH3)
(3)过滤 洗涤 灼烧
(4)A、B B中溶液变浑浊(或A、C C中物质变蓝或A、C、B C中物质变蓝,B中溶液变浑浊)
(5)%
【解析】(1)NaHCO3的溶解度不大,在氨化的饱和食盐水中通入过量CO2可析出NaHCO3沉淀。
(2)用装置甲和相应药品制得的CO2中混有HCl,用装置乙可以除去HCl。氨化的饱和食盐水可挥发出污染环境的NH3,尾气应进行处理。
(3)装置丙中产生了NaHCO3沉淀,将过滤后得到的NaHCO3进行洗涤,然后灼烧即可得到纯碱。
(4)用酒精灯加热时,Na2CO3受热不分解,NaHCO3受热分解可生成CO2、H2O和Na2CO3,加热纯碱样品,只要能检验出有CO2或H2O生成即可说明纯碱样品中含有NaHCO3。
(5)实验所得沉淀为CaCO3,n(Na2CO3)=n(CaCO3)= mol,m(Na2CO3)= g,纯碱样品的纯度为×100%=%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
