第二章 第一节 第1课时 钠
文档属性
| 名称 | 第二章 第一节 第1课时 钠 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:23 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第二章 第一节 钠及其化合物
第1课时 钠
【学习目标】
1.认识钠的物理性质。
2.通过钠的结构,理解钠的化学性质。
【素养目标】
1.结合真实情境或实验,了解钠及其氧化物的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠及其氧化物的应用,培养学生“社会责任”的核心素养。
必备知识与关键能力
知识点一:钠的物理性质
钠为银白色固体,密度为0.971 g/cm3,比水的密度小;
熔、沸点较低,分别为97.8℃和883 ℃,硬度小,用小刀可以切割。
典例1.下列关于钠的叙述错误的是( )
A.钠可以保存在煤油中
B.用一般的化学置换法不能制取金属钠
C.自然界中无游离态的钠存在
D.钠在自然界中燃烧生成氧化钠
【答案】D
【解析】钠属于活泼金属,易与水、氧气反应,钠不与煤油反应,钠比煤油的密度大,钠放入煤油中可与空气隔绝,故少量的钠可以保存在煤油中,A正确;由于钠的金属性强,冶炼金属钠不能用一般的化学置换法,B正确;钠的金属性强,在自然界中全部以化合态的形式存在,C正确;钠燃烧生成过氧化钠,D错误。
典例2.下列有关钠的物理性质的叙述正确的是( )
①银白色金属 ②质软,可以用小刀切 ③熔点低于100 ℃ ④密度比水小
⑤热和电的良导体
A.仅①②④⑤ B.仅①②③④
C.仅①③④⑤ D.①②③④⑤
【答案】D
【解析】钠为具有银白色金属光泽的金属,质软,熔点低,密度比水小,为热和电的良导体。
知识点二:钠的化学性质
1.钠与氧气的反应
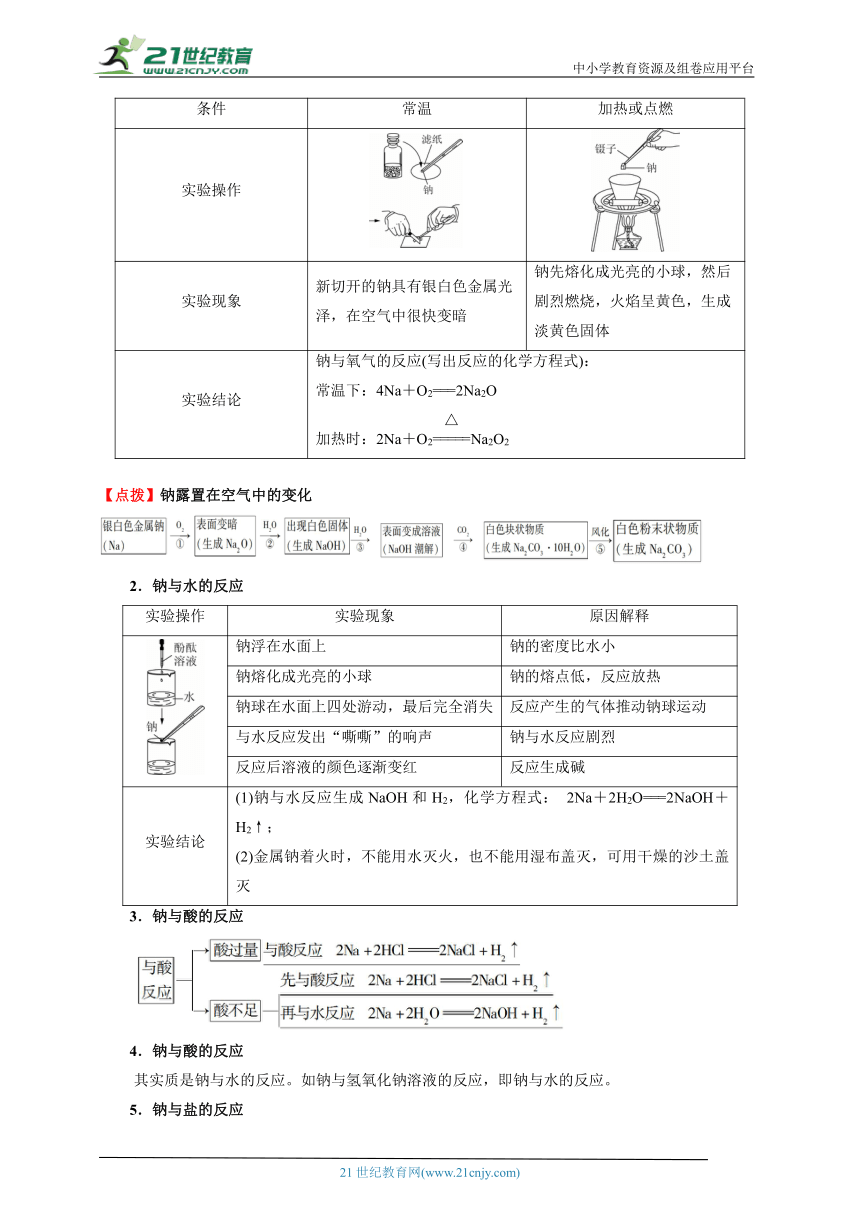
条件 常温 加热或点燃
实验操作
实验现象 新切开的钠具有银白色金属光泽,在空气中很快变暗 钠先熔化成光亮的小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
实验结论 钠与氧气的反应(写出反应的化学方程式): 常温下:4Na+O2===2Na2O 加热时:2Na+O2Na2O2
【点拨】钠露置在空气中的变化
2.钠与水的反应
实验操作 实验现象 原因解释
钠浮在水面上 钠的密度比水小
钠熔化成光亮的小球 钠的熔点低,反应放热
钠球在水面上四处游动,最后完全消失 反应产生的气体推动钠球运动
与水反应发出“嘶嘶”的响声 钠与水反应剧烈
反应后溶液的颜色逐渐变红 反应生成碱
实验结论 (1)钠与水反应生成NaOH和H2,化学方程式: 2Na+2H2O===2NaOH+H2↑; (2)金属钠着火时,不能用水灭火,也不能用湿布盖灭,可用干燥的沙土盖灭
3.钠与酸的反应
4.钠与酸的反应
其实质是钠与水的反应。如钠与氢氧化钠溶液的反应,即钠与水的反应。
5.钠与盐的反应
【注意】在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐;在无水时,4Na+TiCl4Ti+4NaCl。
典例3.取一块金属钠放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.①② B.①②③ C.①③ D.①④⑤
【答案】D
【解析】钠的熔点只有97.7 ℃,加热立即熔化。钠是一种很活泼的金属,加热时与氧气化合生成过氧化钠,呈淡黄色。钠在空气中燃烧的火焰为黄色,不会出现火花。
典例4.将一块钠投入CuSO4溶液中,实验现象为钠立即熔为小球,并浮在水面四处游动,伴有嘶嘶的声响,同时溶液中有蓝色沉淀生成。请解释上述现象并写出有关化学方程式。
【答案】钠投入CuSO4溶液中,Na先与H2O反应生成NaOH和H2,2Na+2H2O===2NaOH+H2↑;生成的NaOH与CuSO4反应生成蓝色沉淀Cu(OH)2,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
典例5.不能正确表示下列反应的离子方程式的是( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:2Na+2H+===2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O===2Na++2OH-+H2↑
【答案】B
【解析】B项中钠与CuSO4溶液反应的实质是钠先与水反应,生成的氢氧化钠再与CuSO4反应,总化学方程式:2Na+2H2O+CuSO4===Cu(OH)2↓+H2↑+Na2SO4。
核心价值与学科素养
典例6.中科院研究成果表明,利用金属钠、钾实现肿瘤高温消融的治疗新方法可用于杀死癌细胞。关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.钠燃烧时发出黄色火焰
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
【答案】 B
典例7.实验探究情境 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一绿豆大小的金属钠,可能观察到的现象是( )
【答案】 A
【解析】Na的密度比煤油大,但比水小,故Na处于水与煤油的界面处上下跳动,Na与H2O反应能产生H2。
【跟踪练习】 基础过关
1. 下列关于钠的说法不正确的是( )
A.金属钠和氧气反应,条件不同,产物不同
B.钠长期置于空气中,表面不能形成致密氧化膜
C.钠与水反应时,钠熔成小球在水面上四处游动
D.由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序中钠后面的金属
【答案】D
【解析】钠不能从金属盐溶液中置换出金属。
2. 取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属钠熔化 ②在空气中燃烧,放出紫色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色的固体物质,描述正确的是( )
A.①② B.①②③
C.①④ D.①④⑤
【答案】D
【解析】钠的熔点只有97.81 ℃,受热时立即熔化;钠是一种很活泼的金属,受热时与氧气化合生成淡黄色的过氧化钠;钠在空气中燃烧的火焰为黄色。
3. 将一小块金属钠投入到滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的是 ( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔化成光亮的小球 ⑤小球在水面上四处游动 ⑥发出“嘶嘶”的响声
A.①②③④ B.②③④⑤
C.②④⑤⑥ D.③④⑥
【答案】C
【解析】钠的密度小于水的密度,把钠放入水中, 它不会沉入水底,应浮在水面上,①不正确;钠与水反应时有NaOH生成,使紫色石蕊溶液变蓝,不是变红,③不正确。
4. 将一小块钠投入盛有5 mL饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.发出“嘶嘶”的响声
C.溶液底部有银白色物质生成
D.溶液变浑浊
【答案】C
【解析】将一小块钠投入饱和澄清石灰水中,钠与水剧烈反应,有A、B两项所叙述的现象。随着2Na+2H2O===2NaOH+H2↑反应的进行,水被消耗,溶液的温度升高,由于Ca(OH)2的溶解度随温度的升高而降低,所以溶液中的Ca(OH)2有部分析出,可以观察到溶液变浑浊。
5. 对于反应TiCl4+4Na===4NaCl+Ti,下列说法不正确的是( )
A.该反应既属于置换反应,也属于氧化还原反应
B.该反应可以用来冶炼金属
C.该反应的条件是TiCl4为熔融状态或在水溶液中
D.该反应说明钠的金属活动性比钛强
【答案】C
【解析】反应的特征是一种单质和一种化合物反应生成另一种单质和另一种化合物,为置换反应,元素化合价发生变化,属于氧化还原反应,故A正确;反应可用于制备Ti,故B正确;因Na很活泼,能与水反应,故该反应不能在水溶液中进行,故C错误;该反应为置换反应,可说明钠的金属活动性比钛强,故D正确。
能力达成
6. 将2.3 g金属钠投入100 g水中,反应结束后,下列表示的溶液中溶质的质量分数计算式中,正确的是( )
A.×100% B.×100%
C.×100% D.×100%
【答案】B
【解析】2.3 g钠投入水中产生的氢氧化钠为4 g,产生的氢气为0.1 g,即溶质为4 g,溶液质量为(100+2.3-0.1)g。
7. 现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图所示。回答下列问题[已知Na2O2易与空气中CO2、H2O(g)反应]:
(1)装置Ⅳ中盛放的药品是 溶液,其作用是 。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……) ,各仪器接口的标号字母(a、b……)顺序是空气进入 , 接 , 接 , 接 。
(3)装置Ⅱ的作用是 。
(4)操作中通空气和加热的顺序为 。
【答案】(1) NaOH 吸收导入空气中的二氧化碳
(2)Ⅳ、Ⅲ、Ⅰ、Ⅱ h,g接f,e接a,b接c
(3)防止空气中的水分和二氧化碳进入装置Ⅰ
(4)先通一段时间的空气,再加热装置Ⅰ
【解析】用金属钠和空气制备纯度较高的Na2O2,要避免生成的Na2O2与空气中的水分和二氧化碳发生反应,在制取过程中要除去这两种杂质,且要防止外界空气中的水分和二氧化碳倒吸进入装置。
8. (1)如图1所示,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到________________,发生反应的化学方程式为 。
(2)某同学用如图2所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。
①上述实验过程中发生反应的化学方程式为_____________________________________。
②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的,乙同学的广口瓶内水面上升明显大于瓶内空气体积的。下列对这两种现象解释合理的是 (填序号)。
a.甲同学可能使用钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内
c.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
【答案】(1)钠表面变暗,气球膨胀 4Na+O2===2Na2O
(2)①2Na+O2Na2O2 ②abcd
【解析】(1)钠与空气中的氧气反应生成Na2O,使钠表面变暗,同时烧瓶内压强降低,气球会膨胀。
(2)a项,若钠的量不足,则氧气消耗不完,造成进水量少于容器内空气体积的,结果偏低,合理;b项,若瓶塞未塞紧,钠熄灭冷却,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理;c项,若弹簧夹未夹紧,钠燃烧时,瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理;d项,若插入燃烧匙太慢,钠燃烧时,瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章 第一节 钠及其化合物
第1课时 钠
【学习目标】
1.认识钠的物理性质。
2.通过钠的结构,理解钠的化学性质。
【素养目标】
1.结合真实情境或实验,了解钠及其氧化物的主要性质,培养学生“科学探究与创新意识,宏观辨识与微观探析”的核心素养。
2.结合实际应用,了解钠及其氧化物的应用,培养学生“社会责任”的核心素养。
必备知识与关键能力
知识点一:钠的物理性质
钠为银白色固体,密度为0.971 g/cm3,比水的密度小;
熔、沸点较低,分别为97.8℃和883 ℃,硬度小,用小刀可以切割。
典例1.下列关于钠的叙述错误的是( )
A.钠可以保存在煤油中
B.用一般的化学置换法不能制取金属钠
C.自然界中无游离态的钠存在
D.钠在自然界中燃烧生成氧化钠
【答案】D
【解析】钠属于活泼金属,易与水、氧气反应,钠不与煤油反应,钠比煤油的密度大,钠放入煤油中可与空气隔绝,故少量的钠可以保存在煤油中,A正确;由于钠的金属性强,冶炼金属钠不能用一般的化学置换法,B正确;钠的金属性强,在自然界中全部以化合态的形式存在,C正确;钠燃烧生成过氧化钠,D错误。
典例2.下列有关钠的物理性质的叙述正确的是( )
①银白色金属 ②质软,可以用小刀切 ③熔点低于100 ℃ ④密度比水小
⑤热和电的良导体
A.仅①②④⑤ B.仅①②③④
C.仅①③④⑤ D.①②③④⑤
【答案】D
【解析】钠为具有银白色金属光泽的金属,质软,熔点低,密度比水小,为热和电的良导体。
知识点二:钠的化学性质
1.钠与氧气的反应
条件 常温 加热或点燃
实验操作
实验现象 新切开的钠具有银白色金属光泽,在空气中很快变暗 钠先熔化成光亮的小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
实验结论 钠与氧气的反应(写出反应的化学方程式): 常温下:4Na+O2===2Na2O 加热时:2Na+O2Na2O2
【点拨】钠露置在空气中的变化
2.钠与水的反应
实验操作 实验现象 原因解释
钠浮在水面上 钠的密度比水小
钠熔化成光亮的小球 钠的熔点低,反应放热
钠球在水面上四处游动,最后完全消失 反应产生的气体推动钠球运动
与水反应发出“嘶嘶”的响声 钠与水反应剧烈
反应后溶液的颜色逐渐变红 反应生成碱
实验结论 (1)钠与水反应生成NaOH和H2,化学方程式: 2Na+2H2O===2NaOH+H2↑; (2)金属钠着火时,不能用水灭火,也不能用湿布盖灭,可用干燥的沙土盖灭
3.钠与酸的反应
4.钠与酸的反应
其实质是钠与水的反应。如钠与氢氧化钠溶液的反应,即钠与水的反应。
5.钠与盐的反应
【注意】在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐;在无水时,4Na+TiCl4Ti+4NaCl。
典例3.取一块金属钠放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体
A.①② B.①②③ C.①③ D.①④⑤
【答案】D
【解析】钠的熔点只有97.7 ℃,加热立即熔化。钠是一种很活泼的金属,加热时与氧气化合生成过氧化钠,呈淡黄色。钠在空气中燃烧的火焰为黄色,不会出现火花。
典例4.将一块钠投入CuSO4溶液中,实验现象为钠立即熔为小球,并浮在水面四处游动,伴有嘶嘶的声响,同时溶液中有蓝色沉淀生成。请解释上述现象并写出有关化学方程式。
【答案】钠投入CuSO4溶液中,Na先与H2O反应生成NaOH和H2,2Na+2H2O===2NaOH+H2↑;生成的NaOH与CuSO4反应生成蓝色沉淀Cu(OH)2,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
典例5.不能正确表示下列反应的离子方程式的是( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:2Na+2H+===2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O===2Na++2OH-+H2↑
【答案】B
【解析】B项中钠与CuSO4溶液反应的实质是钠先与水反应,生成的氢氧化钠再与CuSO4反应,总化学方程式:2Na+2H2O+CuSO4===Cu(OH)2↓+H2↑+Na2SO4。
核心价值与学科素养
典例6.中科院研究成果表明,利用金属钠、钾实现肿瘤高温消融的治疗新方法可用于杀死癌细胞。关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.钠燃烧时发出黄色火焰
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
【答案】 B
典例7.实验探究情境 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一绿豆大小的金属钠,可能观察到的现象是( )
【答案】 A
【解析】Na的密度比煤油大,但比水小,故Na处于水与煤油的界面处上下跳动,Na与H2O反应能产生H2。
【跟踪练习】 基础过关
1. 下列关于钠的说法不正确的是( )
A.金属钠和氧气反应,条件不同,产物不同
B.钠长期置于空气中,表面不能形成致密氧化膜
C.钠与水反应时,钠熔成小球在水面上四处游动
D.由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序中钠后面的金属
【答案】D
【解析】钠不能从金属盐溶液中置换出金属。
2. 取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属钠熔化 ②在空气中燃烧,放出紫色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色的固体物质,描述正确的是( )
A.①② B.①②③
C.①④ D.①④⑤
【答案】D
【解析】钠的熔点只有97.81 ℃,受热时立即熔化;钠是一种很活泼的金属,受热时与氧气化合生成淡黄色的过氧化钠;钠在空气中燃烧的火焰为黄色。
3. 将一小块金属钠投入到滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的是 ( )
①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔化成光亮的小球 ⑤小球在水面上四处游动 ⑥发出“嘶嘶”的响声
A.①②③④ B.②③④⑤
C.②④⑤⑥ D.③④⑥
【答案】C
【解析】钠的密度小于水的密度,把钠放入水中, 它不会沉入水底,应浮在水面上,①不正确;钠与水反应时有NaOH生成,使紫色石蕊溶液变蓝,不是变红,③不正确。
4. 将一小块钠投入盛有5 mL饱和澄清石灰水的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.发出“嘶嘶”的响声
C.溶液底部有银白色物质生成
D.溶液变浑浊
【答案】C
【解析】将一小块钠投入饱和澄清石灰水中,钠与水剧烈反应,有A、B两项所叙述的现象。随着2Na+2H2O===2NaOH+H2↑反应的进行,水被消耗,溶液的温度升高,由于Ca(OH)2的溶解度随温度的升高而降低,所以溶液中的Ca(OH)2有部分析出,可以观察到溶液变浑浊。
5. 对于反应TiCl4+4Na===4NaCl+Ti,下列说法不正确的是( )
A.该反应既属于置换反应,也属于氧化还原反应
B.该反应可以用来冶炼金属
C.该反应的条件是TiCl4为熔融状态或在水溶液中
D.该反应说明钠的金属活动性比钛强
【答案】C
【解析】反应的特征是一种单质和一种化合物反应生成另一种单质和另一种化合物,为置换反应,元素化合价发生变化,属于氧化还原反应,故A正确;反应可用于制备Ti,故B正确;因Na很活泼,能与水反应,故该反应不能在水溶液中进行,故C错误;该反应为置换反应,可说明钠的金属活动性比钛强,故D正确。
能力达成
6. 将2.3 g金属钠投入100 g水中,反应结束后,下列表示的溶液中溶质的质量分数计算式中,正确的是( )
A.×100% B.×100%
C.×100% D.×100%
【答案】B
【解析】2.3 g钠投入水中产生的氢氧化钠为4 g,产生的氢气为0.1 g,即溶质为4 g,溶液质量为(100+2.3-0.1)g。
7. 现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图所示。回答下列问题[已知Na2O2易与空气中CO2、H2O(g)反应]:
(1)装置Ⅳ中盛放的药品是 溶液,其作用是 。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……) ,各仪器接口的标号字母(a、b……)顺序是空气进入 , 接 , 接 , 接 。
(3)装置Ⅱ的作用是 。
(4)操作中通空气和加热的顺序为 。
【答案】(1) NaOH 吸收导入空气中的二氧化碳
(2)Ⅳ、Ⅲ、Ⅰ、Ⅱ h,g接f,e接a,b接c
(3)防止空气中的水分和二氧化碳进入装置Ⅰ
(4)先通一段时间的空气,再加热装置Ⅰ
【解析】用金属钠和空气制备纯度较高的Na2O2,要避免生成的Na2O2与空气中的水分和二氧化碳发生反应,在制取过程中要除去这两种杂质,且要防止外界空气中的水分和二氧化碳倒吸进入装置。
8. (1)如图1所示,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到________________,发生反应的化学方程式为 。
(2)某同学用如图2所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。
①上述实验过程中发生反应的化学方程式为_____________________________________。
②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的,乙同学的广口瓶内水面上升明显大于瓶内空气体积的。下列对这两种现象解释合理的是 (填序号)。
a.甲同学可能使用钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内
c.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
【答案】(1)钠表面变暗,气球膨胀 4Na+O2===2Na2O
(2)①2Na+O2Na2O2 ②abcd
【解析】(1)钠与空气中的氧气反应生成Na2O,使钠表面变暗,同时烧瓶内压强降低,气球会膨胀。
(2)a项,若钠的量不足,则氧气消耗不完,造成进水量少于容器内空气体积的,结果偏低,合理;b项,若瓶塞未塞紧,钠熄灭冷却,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理;c项,若弹簧夹未夹紧,钠燃烧时,瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理;d项,若插入燃烧匙太慢,钠燃烧时,瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
