第四章 第一节 第3课时 原子结构与元素的性质
文档属性
| 名称 | 第四章 第一节 第3课时 原子结构与元素的性质 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第四章 第一节 原子结构与元素周期表
第3课时 原子结构与元素的性质
【学习目标】
1.了解碱金属、卤素在周期表中的位置。
2.了解碱金属、卤素原子的结构与性质。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
【素养目标】
1.通过探究认识同主族元素性质(金属性与非金属性)的递变规律,并能用原子结构理论加以解释。培养学生“科学探究与证据推理”的核心素养。
2.通过比较、归纳、实验等方法预测同主族元素的相似性与递变性。培养学生“科学精神与创新意识”的核心素养。
必备知识与关键能力
知识点一:碱金属元素
1.元素的性质——金属性与非金属性
2.碱金属元素
碱金属元素包括(填名称及元素符号):锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等。
(1)碱金属的原子结构(Li→Cs)
①相似性:最外层均有1个电子。
②递变性:电子层数逐渐增多,原子半径逐渐增大。
(2)碱金属的化学性质
①钠、钾与氧气反应比较实验
a.实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰(透过蓝色钴玻璃观察),钾燃烧更剧烈。
b.反应方程式:2Na+O2Na2O2、K+O2KO2。
②钾与水反应的实验
a.现象:浮于水面上,并熔化为闪亮的小球四处游动,发出嘶嘶的响声,并伴有燃烧,溶液呈红色。
b.化学方程式:2K+2H2O===2KOH+H2↑。
c.与Na和水反应相比现象不同的有反应比钠和水剧烈,并伴有燃烧,结论:活泼性K比Na强。
③锂与氧气(加热)、H2O反应的化学方程式分别为4Li+O22Li2O、2Li+2H2O===2LiOH+H2↑。
(3)碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈银白色,它们都比较软,有延展性,密度较小,熔点较低,导电、导热性强
递变 规律 密度 逐渐增大(钠、钾反常)
熔、沸点 逐渐降低
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
(4) 碱金属元素单质化学性质的相似性和递变性
①相似性
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
②递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
a.
b.与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
c.与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
d.最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
典例1.下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1 ②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大 ③具有相似的化学性质,都是活泼金属 ④都具有强还原性,在化合物中显+1价 ⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④ B.①③⑤
C.②④⑤ D.全部
【答案】D
【解析】碱金属元素原子的最外层都只有一个电子,都易失去一个电子,具有强还原性,在化合物中显+1价,①③④正确;碱金属元素从Li到Cs,原子半径逐渐增大,原子核对核外电子的束缚力逐渐减弱,失电子能力逐渐增强,②⑤正确。
典例2.下列说法不正确的是( )
A.碱金属元素在自然界中以化合态形式存在
B.金属铷投入水中会发生爆炸式反应,生成氢氧化铷和氢气
C.碱金属与氧气反应,生成物都不随反应条件或反应物的用量变化而变化
D.金属铯的密度大于钠,而钠的熔点高于铯
【答案】C
【解析】碱金属元素在自然界中均以化合态形式存在,A正确;铷的金属性很强,因此金属铷投入水中会发生爆炸式反应,生成氢氧化铷和氢气,B正确;除锂之外的碱金属与氧气反应,生成物都随反应条件的变化而变化,C错误;金属铯的密度大于钠,而钠的熔点高于铯,D正确。
典例3.下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
【答案】B
【解析】A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性,K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH。
知识点二 :卤族元素
卤族元素简称卤素,包括(填名称及符号)氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)、(Ts)。
1.卤素单质的物理性质
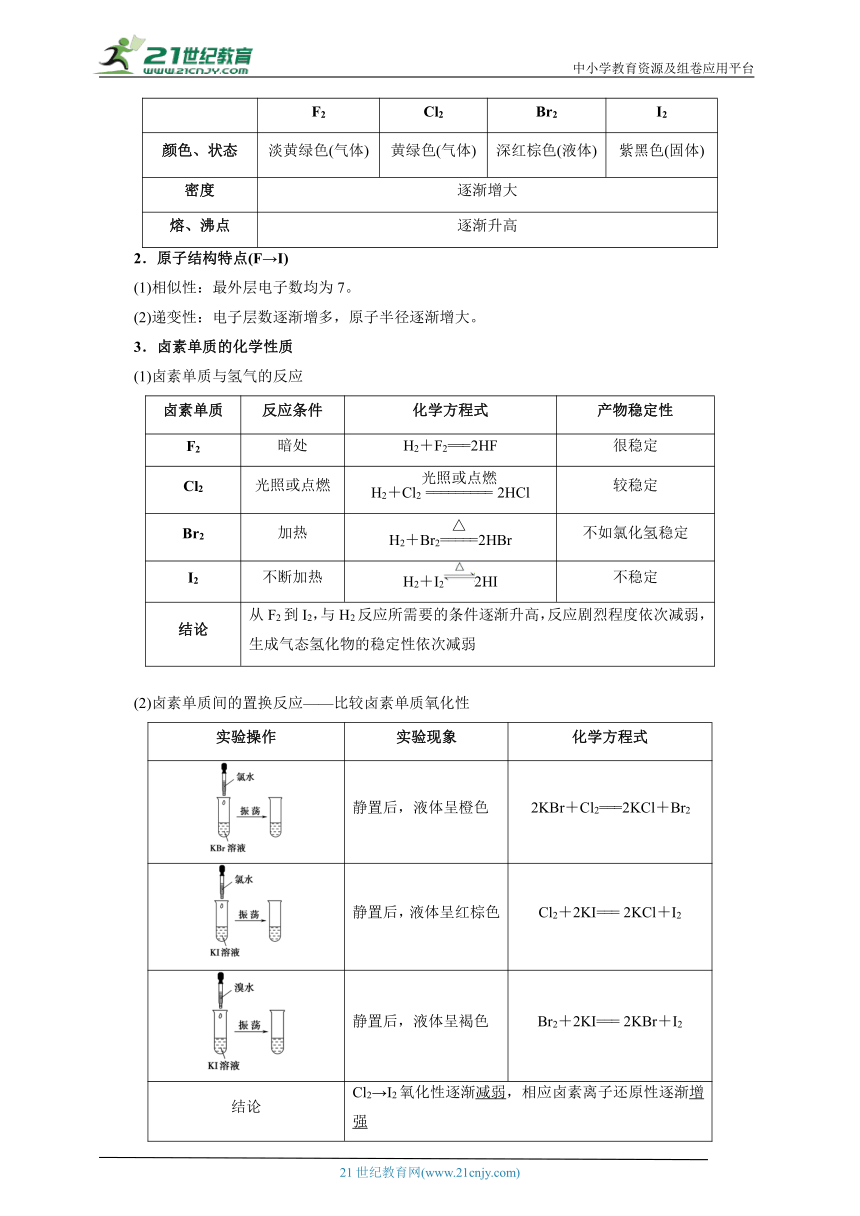
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色(气体) 黄绿色(气体) 深红棕色(液体) 紫黑色(固体)
密度 逐渐增大
熔、沸点 逐渐升高
2.原子结构特点(F→I)
(1)相似性:最外层电子数均为7。
(2)递变性:电子层数逐渐增多,原子半径逐渐增大。
3.卤素单质的化学性质
(1)卤素单质与氢气的反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 H2+F2===2HF 很稳定
Cl2 光照或点燃 H2+Cl22HCl 较稳定
Br2 加热 H2+Br22HBr 不如氯化氢稳定
I2 不断加热 H2+I22HI 不稳定
结论 从F2到I2,与H2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱
(2)卤素单质间的置换反应——比较卤素单质氧化性
实验操作 实验现象 化学方程式
静置后,液体呈橙色 2KBr+Cl2===2KCl+Br2
静置后,液体呈红棕色 Cl2+2KI=== 2KCl+I2
静置后,液体呈褐色 Br2+2KI=== 2KBr+I2
结论 Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐增强
【点拨】因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
4.周期表中同主族元素的相似性与递变性
在周期表中,同主族元素从上到下,电子层数增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,所以金属性逐渐增强,非金属性逐渐减弱。
(1)从原子结构角度认识卤族元素性质的递变规律
(2)卤族元素单质化学性质的相似性和递变性
①相似性
②递变性
具体表现如下:
a.与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI;还原性:HFb.最高价氧化物对应水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
③特殊性
a.溴是常温常压下唯一的液态的非金属单质。
b.卤素单质都有毒,溴有很强的腐蚀性,保存液溴时要加一些水进行“水封”,碘单质遇淀粉溶液变蓝色(检验I2)。
c.Cl2、Br2、I2易溶于有机溶剂苯、CCl4、汽油等。
d.F无正化合价。
典例4. 卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增多起主要作用
【答案】D
【解析】F、Cl、Br、I元素非金属性逐渐减弱的原因主要是随着核外电子层数增多,原子核对最外层电子的吸引能力减弱。
典例5.下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水反应都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
【答案】C
【解析】从F到I,元素的非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,A项错误;要注意F2及氟的化合物的特殊性:F2与水反应置换H2O中的氧生成O2,不像其他卤素单质,B项错误;卤素单质与其他物质化合时,多表现为氧化性,D项错误。
典例6.某化学小组用下图所示装置验证Cl2、Br2、I2单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成橙色,说明Cl的非金属性比Br强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
【答案】B
【解析】E处棉花球变成橙色,说明Cl2置换出了Br2,即Cl的非金属性强于Br,其离子方程式为:Cl2+2Br-===2Cl-+Br2,A、C正确;由NaOH溶液与Cl2反应的化学方程式2NaOH+Cl2===NaClO+NaCl+H2O知D正确;F处棉花球变成蓝色也可能是未反应完的Cl2与I-反应,B错误。
核心价值与学科素养
【知识结构化】
【思维模型】金属性和非金属性的强弱判断
金属性强弱
非金属性强弱
典例7.我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族。
(1)铯与O2的产物是Cs2O吗?反应剧烈程度比Na、K与O2反应程度大吗?
(2)铯与H2O反应吗?若反应写出离子方程式。
(3)铯与H2O反应现象和Na、K与H2O反应现象的主要区别可能是什么?
(4)铯投入CuCl2溶液中,能置换出Cu吗?为什么?
【答案】 (1)产物不是Cs2O。剧烈程度很大。
(2)反应,2Cs+2H2O===2Cs++2OH-+H2↑
(3)不在水面上四处游动而在水中上下浮动,放出大量气体,可能发生爆炸。
(4)不能,Cs在溶液中先与H2O反应生成CsOH,2CsOH+CuCl2===2CsCl+Cu(OH)2↓。
【跟踪练习】 基础过关
1. 下列关于碱金属按Li、Na、K、Rb、Cs的顺序叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失电子表现出强还原性
B.单质的熔点和沸点依次递减
C.单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物
D.原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强
【答案】C
【解析】金属锂在空气中燃烧只生成氧化物。
2. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是( )
A.铯的密度比水小,像钠一样浮在水面上
B.铯与水反应十分剧烈,甚至会发生爆炸
C.碳酸铯加热时易分解成二氧化碳和氧化铯
D.氢氧化铯是强碱,其碱性比氢氧化钾弱
【答案】B
【解析】铯的密度比水大,放入水中会沉在水底,故A错误;碱金属元素从上到下,与水反应的剧烈程度逐渐增大,铯与水反应十分剧烈,甚至会发生爆炸,故B正确;同主族的元素及其化合物的性质具有相似性,碳酸钠受热不易分解,因此碳酸铯加热时也不易分解,故C错误;同主族元素从上到下,金属性逐渐增强,其最高价氧化物的水化物的碱性逐渐增强,因此氢氧化铯是强碱,其碱性比氢氧化钾强,故D错误。
3. 下列关于卤族元素的递变规律不正确的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强,颜色逐渐变深
D.F2、Cl2、Br2、I2的密度逐渐增大
【答案】C
【解析】F-、Cl-、Br-、I-均为无色离子,C项错误。
4. X、Y、Z为同主族的3种元素,已知它们的最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,则下列判断正确的是( )
A.原子半径:X>Y>Z
B.气态氢化物的稳定性:HX>HY>HZ
C.元素的非金属性:XD.气态氢化物的还原性:HX>HY>HZ
【答案】B
【解析】由同主族元素的最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,可知非金属性:X>Y>Z。同主族元素从上到下,非金属性逐渐减弱,原子半径逐渐增大,则原子半径:XY>Z,则气态氢化物的稳定性:HX>HY>HZ,故B正确;元素的非金属性:X>Y>Z,故C错误;元素的非金属性越强,则其简单气态氢化物的还原性越弱,非金属性:X>Y>Z,则气态氢化物的还原性:HX5. 为比较卤素单质的氧化性进行了如下实验:①将氯水滴入溴化钠溶液中,溶液变黄;②将氯水滴入碘化钾溶液中,溶液变褐色。下列有关分析不合理的是( )
A.实验①中反应:Cl2+2Br-===2Cl-+Br2
B.向实验②所得溶液中再加入CCl4,振荡、静置,下层溶液为紫红色
C.根据实验①②得出结论,氧化性:Cl2>Br2>I2
D.将实验②中的氯水换成溴水即可达到实验目的
【答案】C
【解析】将氯水滴入溴化钠溶液中,溶液变黄,说明有单质溴生成,则实验①中反应为Cl2+2Br-===2Cl-+Br2,A正确;实验②将氯水滴入碘化钾溶液中,溶液变褐色,说明有单质碘生成,则所得溶液中再加入CCl4,振荡、静置,下层溶液为紫红色,B正确;根据实验①可以得出氧化性:Cl2>Br2,根据实验②可以得出氧化性:Cl2>I2,但通过实验①②无法得出氧化性:Br2>I2,C错误;要想达到比较卤素单质氧化性的目的,只需要将②中氯水换成溴水即可,D正确。
能力达成
6. 硒(Se)被誉为“生命的奇效元素”,富硒食品倍受追捧。已知硒元素与氧元素同主族,与钙元素同周期。下列关于硒的描述错误的是( )
A.原子序数是24
B.气态氢化物的化学式是H2Se,还原性:H2Se>H2O
C.最高价氧化物是SeO3,是酸性氧化物
D.原子半径比硫原子的大
【答案】A
【解析】硒元素与氧元素同主族,与钙元素同周期,则Se位于元素周期表中的第四周期第ⅥA族,与氧元素的原子序数相差18,其原子序数为16+18=34,A错误;硒的最低化合价为-2价,气态氢化物的化学式是H2Se,非金属性:O>Se,则氢化物的还原性:H2O7. X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
A.X的氧化物对应水溶液的酸性比Y的氧化物对应水溶液的酸性强
B.Y-的还原性强于X-
C.X的单质X2能将Y的阴离子Y-氧化为Y2
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
【答案】A
【解析】元素非金属性强弱可由其最高价氧化物对应水化物的酸性强弱来判断,没有指明是否是最高价氧化物时,无法判断两者的非金属性强弱,A符合题意;元素非金属性越弱,对应离子的还原性越强,B不符合题意;X的单质X2能与Y的阴离子Y-发生置换反应生成Y2,说明X比Y的非金属性强,C不符合题意;X、Y的单质分别氧化同一种金属,产物中金属元素的价态越高,说明单质的氧化性越强,说明X比Y的非金属性强,D不符合题意。
8. 为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和KI 淀粉溶液中。如下图所示仪器和药品,试完成下列问题:
(1)若所制取气体从左到右流向时,上述仪器接口的连接顺序为 接 , 接 ,
接 , 接 。
(2)实验开始后装置5中反应的化学方程式为 。
(3)装置3的作用是 ,反应的离子方程式为 。
(4)装置1中产生的现象是 ,反应的化学方程式为 。
【答案】(1) F G H D C B A E
(2) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(3)吸收未反应完的Cl2,防止污染空气, Cl2+2OH-===Cl-+ClO-+H2O。
(4)溶液显蓝色 Cl2+2KI===2KCl+I2。
【解析】首先弄清实验原理及目的:通过卤素单质之间的置换反应证明它们之间氧化性强弱。为此通过装置4和装置5来制取Cl2,再通过Cl2与NaBr和KI 淀粉溶液反应,并通过现象来证明反应情况。实验过程中要注意尾气处理,以防止污染空气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第四章 第一节 原子结构与元素周期表
第3课时 原子结构与元素的性质
【学习目标】
1.了解碱金属、卤素在周期表中的位置。
2.了解碱金属、卤素原子的结构与性质。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
【素养目标】
1.通过探究认识同主族元素性质(金属性与非金属性)的递变规律,并能用原子结构理论加以解释。培养学生“科学探究与证据推理”的核心素养。
2.通过比较、归纳、实验等方法预测同主族元素的相似性与递变性。培养学生“科学精神与创新意识”的核心素养。
必备知识与关键能力
知识点一:碱金属元素
1.元素的性质——金属性与非金属性
2.碱金属元素
碱金属元素包括(填名称及元素符号):锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)等。
(1)碱金属的原子结构(Li→Cs)
①相似性:最外层均有1个电子。
②递变性:电子层数逐渐增多,原子半径逐渐增大。
(2)碱金属的化学性质
①钠、钾与氧气反应比较实验
a.实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰(透过蓝色钴玻璃观察),钾燃烧更剧烈。
b.反应方程式:2Na+O2Na2O2、K+O2KO2。
②钾与水反应的实验
a.现象:浮于水面上,并熔化为闪亮的小球四处游动,发出嘶嘶的响声,并伴有燃烧,溶液呈红色。
b.化学方程式:2K+2H2O===2KOH+H2↑。
c.与Na和水反应相比现象不同的有反应比钠和水剧烈,并伴有燃烧,结论:活泼性K比Na强。
③锂与氧气(加热)、H2O反应的化学方程式分别为4Li+O22Li2O、2Li+2H2O===2LiOH+H2↑。
(3)碱金属单质的物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈银白色,它们都比较软,有延展性,密度较小,熔点较低,导电、导热性强
递变 规律 密度 逐渐增大(钠、钾反常)
熔、沸点 逐渐降低
个性特点 ①铯略带金属光泽;②锂的密度比煤油的小;③钠的密度比钾大
(4) 碱金属元素单质化学性质的相似性和递变性
①相似性
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
②递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
a.
b.与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
c.与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
d.最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
典例1.下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1 ②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大 ③具有相似的化学性质,都是活泼金属 ④都具有强还原性,在化合物中显+1价 ⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④ B.①③⑤
C.②④⑤ D.全部
【答案】D
【解析】碱金属元素原子的最外层都只有一个电子,都易失去一个电子,具有强还原性,在化合物中显+1价,①③④正确;碱金属元素从Li到Cs,原子半径逐渐增大,原子核对核外电子的束缚力逐渐减弱,失电子能力逐渐增强,②⑤正确。
典例2.下列说法不正确的是( )
A.碱金属元素在自然界中以化合态形式存在
B.金属铷投入水中会发生爆炸式反应,生成氢氧化铷和氢气
C.碱金属与氧气反应,生成物都不随反应条件或反应物的用量变化而变化
D.金属铯的密度大于钠,而钠的熔点高于铯
【答案】C
【解析】碱金属元素在自然界中均以化合态形式存在,A正确;铷的金属性很强,因此金属铷投入水中会发生爆炸式反应,生成氢氧化铷和氢气,B正确;除锂之外的碱金属与氧气反应,生成物都随反应条件的变化而变化,C错误;金属铯的密度大于钠,而钠的熔点高于铯,D正确。
典例3.下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
【答案】B
【解析】A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性,K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH。
知识点二 :卤族元素
卤族元素简称卤素,包括(填名称及符号)氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)、(Ts)。
1.卤素单质的物理性质
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色(气体) 黄绿色(气体) 深红棕色(液体) 紫黑色(固体)
密度 逐渐增大
熔、沸点 逐渐升高
2.原子结构特点(F→I)
(1)相似性:最外层电子数均为7。
(2)递变性:电子层数逐渐增多,原子半径逐渐增大。
3.卤素单质的化学性质
(1)卤素单质与氢气的反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 H2+F2===2HF 很稳定
Cl2 光照或点燃 H2+Cl22HCl 较稳定
Br2 加热 H2+Br22HBr 不如氯化氢稳定
I2 不断加热 H2+I22HI 不稳定
结论 从F2到I2,与H2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱
(2)卤素单质间的置换反应——比较卤素单质氧化性
实验操作 实验现象 化学方程式
静置后,液体呈橙色 2KBr+Cl2===2KCl+Br2
静置后,液体呈红棕色 Cl2+2KI=== 2KCl+I2
静置后,液体呈褐色 Br2+2KI=== 2KBr+I2
结论 Cl2→I2氧化性逐渐减弱,相应卤素离子还原性逐渐增强
【点拨】因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
4.周期表中同主族元素的相似性与递变性
在周期表中,同主族元素从上到下,电子层数增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,所以金属性逐渐增强,非金属性逐渐减弱。
(1)从原子结构角度认识卤族元素性质的递变规律
(2)卤族元素单质化学性质的相似性和递变性
①相似性
②递变性
具体表现如下:
a.与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即:
稳定性:HF>HCl>HBr>HI;还原性:HF
③特殊性
a.溴是常温常压下唯一的液态的非金属单质。
b.卤素单质都有毒,溴有很强的腐蚀性,保存液溴时要加一些水进行“水封”,碘单质遇淀粉溶液变蓝色(检验I2)。
c.Cl2、Br2、I2易溶于有机溶剂苯、CCl4、汽油等。
d.F无正化合价。
典例4. 卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增多起主要作用
【答案】D
【解析】F、Cl、Br、I元素非金属性逐渐减弱的原因主要是随着核外电子层数增多,原子核对最外层电子的吸引能力减弱。
典例5.下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水反应都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
【答案】C
【解析】从F到I,元素的非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,A项错误;要注意F2及氟的化合物的特殊性:F2与水反应置换H2O中的氧生成O2,不像其他卤素单质,B项错误;卤素单质与其他物质化合时,多表现为氧化性,D项错误。
典例6.某化学小组用下图所示装置验证Cl2、Br2、I2单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成橙色,说明Cl的非金属性比Br强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
【答案】B
【解析】E处棉花球变成橙色,说明Cl2置换出了Br2,即Cl的非金属性强于Br,其离子方程式为:Cl2+2Br-===2Cl-+Br2,A、C正确;由NaOH溶液与Cl2反应的化学方程式2NaOH+Cl2===NaClO+NaCl+H2O知D正确;F处棉花球变成蓝色也可能是未反应完的Cl2与I-反应,B错误。
核心价值与学科素养
【知识结构化】
【思维模型】金属性和非金属性的强弱判断
金属性强弱
非金属性强弱
典例7.我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族。
(1)铯与O2的产物是Cs2O吗?反应剧烈程度比Na、K与O2反应程度大吗?
(2)铯与H2O反应吗?若反应写出离子方程式。
(3)铯与H2O反应现象和Na、K与H2O反应现象的主要区别可能是什么?
(4)铯投入CuCl2溶液中,能置换出Cu吗?为什么?
【答案】 (1)产物不是Cs2O。剧烈程度很大。
(2)反应,2Cs+2H2O===2Cs++2OH-+H2↑
(3)不在水面上四处游动而在水中上下浮动,放出大量气体,可能发生爆炸。
(4)不能,Cs在溶液中先与H2O反应生成CsOH,2CsOH+CuCl2===2CsCl+Cu(OH)2↓。
【跟踪练习】 基础过关
1. 下列关于碱金属按Li、Na、K、Rb、Cs的顺序叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失电子表现出强还原性
B.单质的熔点和沸点依次递减
C.单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物
D.原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强
【答案】C
【解析】金属锂在空气中燃烧只生成氧化物。
2. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是( )
A.铯的密度比水小,像钠一样浮在水面上
B.铯与水反应十分剧烈,甚至会发生爆炸
C.碳酸铯加热时易分解成二氧化碳和氧化铯
D.氢氧化铯是强碱,其碱性比氢氧化钾弱
【答案】B
【解析】铯的密度比水大,放入水中会沉在水底,故A错误;碱金属元素从上到下,与水反应的剧烈程度逐渐增大,铯与水反应十分剧烈,甚至会发生爆炸,故B正确;同主族的元素及其化合物的性质具有相似性,碳酸钠受热不易分解,因此碳酸铯加热时也不易分解,故C错误;同主族元素从上到下,金属性逐渐增强,其最高价氧化物的水化物的碱性逐渐增强,因此氢氧化铯是强碱,其碱性比氢氧化钾强,故D错误。
3. 下列关于卤族元素的递变规律不正确的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强,颜色逐渐变深
D.F2、Cl2、Br2、I2的密度逐渐增大
【答案】C
【解析】F-、Cl-、Br-、I-均为无色离子,C项错误。
4. X、Y、Z为同主族的3种元素,已知它们的最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,则下列判断正确的是( )
A.原子半径:X>Y>Z
B.气态氢化物的稳定性:HX>HY>HZ
C.元素的非金属性:X
【答案】B
【解析】由同主族元素的最高价氧化物对应水化物的酸性:HXO4>HYO4>HZO4,可知非金属性:X>Y>Z。同主族元素从上到下,非金属性逐渐减弱,原子半径逐渐增大,则原子半径:X
A.实验①中反应:Cl2+2Br-===2Cl-+Br2
B.向实验②所得溶液中再加入CCl4,振荡、静置,下层溶液为紫红色
C.根据实验①②得出结论,氧化性:Cl2>Br2>I2
D.将实验②中的氯水换成溴水即可达到实验目的
【答案】C
【解析】将氯水滴入溴化钠溶液中,溶液变黄,说明有单质溴生成,则实验①中反应为Cl2+2Br-===2Cl-+Br2,A正确;实验②将氯水滴入碘化钾溶液中,溶液变褐色,说明有单质碘生成,则所得溶液中再加入CCl4,振荡、静置,下层溶液为紫红色,B正确;根据实验①可以得出氧化性:Cl2>Br2,根据实验②可以得出氧化性:Cl2>I2,但通过实验①②无法得出氧化性:Br2>I2,C错误;要想达到比较卤素单质氧化性的目的,只需要将②中氯水换成溴水即可,D正确。
能力达成
6. 硒(Se)被誉为“生命的奇效元素”,富硒食品倍受追捧。已知硒元素与氧元素同主族,与钙元素同周期。下列关于硒的描述错误的是( )
A.原子序数是24
B.气态氢化物的化学式是H2Se,还原性:H2Se>H2O
C.最高价氧化物是SeO3,是酸性氧化物
D.原子半径比硫原子的大
【答案】A
【解析】硒元素与氧元素同主族,与钙元素同周期,则Se位于元素周期表中的第四周期第ⅥA族,与氧元素的原子序数相差18,其原子序数为16+18=34,A错误;硒的最低化合价为-2价,气态氢化物的化学式是H2Se,非金属性:O>Se,则氢化物的还原性:H2O
A.X的氧化物对应水溶液的酸性比Y的氧化物对应水溶液的酸性强
B.Y-的还原性强于X-
C.X的单质X2能将Y的阴离子Y-氧化为Y2
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
【答案】A
【解析】元素非金属性强弱可由其最高价氧化物对应水化物的酸性强弱来判断,没有指明是否是最高价氧化物时,无法判断两者的非金属性强弱,A符合题意;元素非金属性越弱,对应离子的还原性越强,B不符合题意;X的单质X2能与Y的阴离子Y-发生置换反应生成Y2,说明X比Y的非金属性强,C不符合题意;X、Y的单质分别氧化同一种金属,产物中金属元素的价态越高,说明单质的氧化性越强,说明X比Y的非金属性强,D不符合题意。
8. 为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和KI 淀粉溶液中。如下图所示仪器和药品,试完成下列问题:
(1)若所制取气体从左到右流向时,上述仪器接口的连接顺序为 接 , 接 ,
接 , 接 。
(2)实验开始后装置5中反应的化学方程式为 。
(3)装置3的作用是 ,反应的离子方程式为 。
(4)装置1中产生的现象是 ,反应的化学方程式为 。
【答案】(1) F G H D C B A E
(2) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(3)吸收未反应完的Cl2,防止污染空气, Cl2+2OH-===Cl-+ClO-+H2O。
(4)溶液显蓝色 Cl2+2KI===2KCl+I2。
【解析】首先弄清实验原理及目的:通过卤素单质之间的置换反应证明它们之间氧化性强弱。为此通过装置4和装置5来制取Cl2,再通过Cl2与NaBr和KI 淀粉溶液反应,并通过现象来证明反应情况。实验过程中要注意尾气处理,以防止污染空气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
