2.2 化学平衡(第1课时 化学平衡状态 化学平衡常数)(解析版)
文档属性
| 名称 | 2.2 化学平衡(第1课时 化学平衡状态 化学平衡常数)(解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第二章 第二节 化学平衡
第1课时 化学平衡状态 化学平衡常数
【学习目标】
1.通过溶解和结晶过程的分析,认识化学反应的可逆性。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
3.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
4.能够利用化学平衡常数进行简单的计算。如计算物质的平衡浓度、转化率等。
【素养目标】
1.可逆反应都有一定的限度,是可调控的,条件改变,限度被破坏, 达到新的平衡状态。能从多角度、动态地分析化学平衡状态的各种表现。认识温度是决定化学平衡常数的唯一物理量。培养学生“变化观念与平衡思想”学科素养。
2.能建立“逆、等、动、定、变”的认知模型,并利用模型解决化学平衡的实际问题。通过“三段式”分析推理方法,建立化学平衡常数的认知模型,并能根据模型理解本质和规律及进行简单计算。培养学生“证据推理与模型认知”的学科素养。
必备知识与关键能力
知识点一:化学平衡状态
1.化学平衡研究的对象——可逆反应
(1)定义
在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点
双向性 指可逆反应分为方向相反的两个反应:正反应和逆反应
双同性 指正、逆反应是在同一条件下,同时进行
共存性 指反应物的转化率小于100%,反应物与生成物共存
【点拨】可逆反应不等同于可逆过程。可逆过程包括物理变化和化学变化,而可逆反应属于化学反应。
2.化学平衡状态
(1)概念
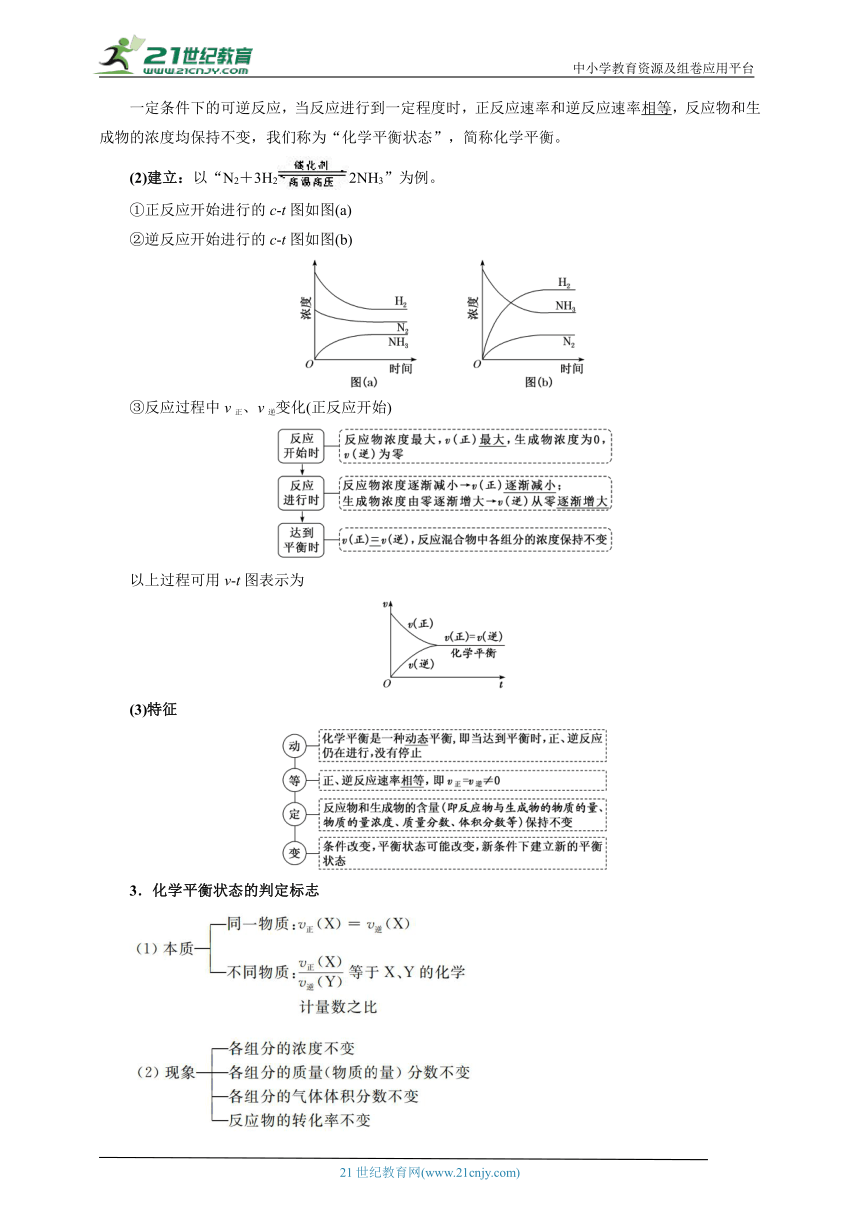
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度均保持不变,我们称为“化学平衡状态”,简称化学平衡。
(2)建立:以“N2+3H22NH3”为例。
①正反应开始进行的c t图如图(a)
②逆反应开始进行的c t图如图(b)
③反应过程中v正、v逆变化(正反应开始)
以上过程可用v t图表示为
(3)特征
3.化学平衡状态的判定标志
【点拨】 理解平衡状态判定标志 (有正有逆 符合比例;变量不变即平衡)
(1)全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间而变化。
(2)对同一物质而言,断裂的化学键的物质的量与形成的化学键的物质的量相等。
(3)对于有色物质参加或生成的可逆反应,体系的颜色不再随时间而变化。
(4)绝热体系的温度不变,说明反应处于平衡状态。
(5)全部是气体的非等体积反应,恒压条件下,密度不再变化;对于有固体参与或生成的气体平衡体系,密度不再变化。
总之,要抓住变化的量不变可作平衡的标志;如果该物理量始终是一个定值,就不能作为判断是否达平衡的标志。
举例 mA(g)+nB(g)pC(g) +qD(g) 状态
混合物体系中各成分的含量 各物质的物质的量或各物质的物质的量分数一定 平衡
各物质的质量或各物质的质量分数一定 平衡
各气体的体积或体积分数一定 平衡
总压强、总体积、总物质的量一定 不一定平衡
正、逆反应速率的关系 在单位时间内消耗了m mol A,同时生成m mol A,即v正=v逆 平衡
在单位时间内消耗了n mol B,同时生成p mol C 不一定平衡
vA∶vB∶vC∶vD=m∶n∶p∶q,v正不一定等于v逆? 不一定平衡
在单位时间内生成了n mol B,同时消耗了q mol D 不一定平衡
压强 m+n≠p+q时,总压强一定(其他条件一定) 平衡
m+n=p+q时,总压强一定(其他条件一定) 不一定平衡
混合气体的平均相对分子质量() 一定,当m+n≠p+q时 平衡
一定,当m+n=p+q时 不一定平衡
温度 任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定 平衡
密度 密度一定 不一定平衡
颜色 含有有色物质的体系颜色不再变化 平衡
典例1.对于可逆反应2SO2+O22SO3 ΔH<0,在混合气体中充入一定量的 18O2,经足够长的时间后,下列有关说法中正确的是( )
A.18O只存在于O2中
B.18O只存在于O2和SO3中
C.某个二氧化硫分子的相对分子质量可能为66
D.三氧化硫的相对分子质量均为82
【答案】C
【解析】由于2SO2+O22SO3为可逆反应,故18O存在于O2、SO3、SO2中,故A、B项错误;SO2的相对分子质量可能为64或66或68,C项正确;SO3的相对分子质量可能为80或82或84,D项错误。
典例2.在一定温度下,恒容容器中发生:X(g)+2Y(g) 3Z(g)。能说明反应达到平衡状态的是________(填序号)。
①Z的生成速率与Z的分解速率相等
②容器内的压强不再变化
③单位时间内消耗a mol X,同时生成3a mol Z
④混合气体总的物质的量不再变化
⑤混合气体的密度不再变化
⑥c(X)∶c(Y)∶c(Z)=1∶2∶3
⑦c(Z)不再变化
【答案】①⑦
典例3.在一定条件下,向2 L密闭容器中通入2 mol N2和6 mol H2,发生反应:N2(g)+3H2(g)2NH3(g),以下选项能够说明反应已达到平衡状态的是( )
A.c(NH3)∶c(H2)∶c(N2)=2∶3∶1
B.单位时间内1个键断裂的同时,有6个N—H键形成
C.混合气体的平均相对分子质量不再改变
D.单位时间内有6个N—H键形成的同时,有3个H—H键断裂
【答案】C
【解析】c(NH3)∶c(H2)∶c(N2)=2∶3∶1,并不能说明浓度不变,所以不一定是平衡状态,A错误;单位时间内1个键断裂,同时有6个N—H键形成,均是向正反应方向进行,未体现正反应速率与逆反应速率相等的关系,B错误;该反应是反应前后气体分子数不同的反应,未达到平衡前混合气体的物质的量是变量,质量是定量,所以平均摩尔质量是变量,混合气体的平均相对分子质量也是变量,则混合气体的平均相对分子质量不再改变时能说明反应达到平衡,C正确;单位时间内有6个N—H键形成的同时,有3个H—H键断裂,均是向正反应方向进行,未体现正反应速率与逆反应速率相等的关系,D错误。
典例4.在1 L恒温恒容的密闭容器中投入一定量N2O5,发生反应:
反应1:N2O5(g)===N2O4(g)+O2(g)ΔH=+28.4 kJ·mol-1
反应2:N2O4(g)2NO2(g) ΔH=-56.9 kJ·mol-1
现有下列情况:①混合气体的密度保持不变;②气体压强保持不变;③气体的平均摩尔质量保持不变;④保持不变;⑤O2的物质的量保持不变;⑥v正(N2O4)∶v逆(NO2)=1∶2。能表明反应2一定达到平衡状态的是( )
A.①②③⑤ B.②③④⑥
C.①③⑤⑥ D.②③④⑤
【答案】B
【解析】①反应中各物质均为气体,混合气体的总质量不变,且反应在恒容条件下进行,则混合气体的密度始终不变,故不能判断是否达到平衡,错误;②反应2的平衡建立过程中,气体总物质的量不断变化,则气体压强不断变化,当气体压强保持不变时,反应2达到平衡状态,正确;③平衡建立过程中,混合气体的总质量不变,但其总物质的量不断变化,故当气体的平均摩尔质量保持不变时,反应2达到平衡状态,正确;④保持不变,则c(NO2)、c(N2O4)均保持不变,反应2达到平衡状态,正确;⑤反应1是不可逆反应,O2的物质的量始终保持不变,不能据此判断反应2是否达到平衡,错误;⑥v正(N2O4)∶v逆(NO2) =1∶2,正、逆反应速率相等,反应2达到平衡状态,正确。
4.极端假设法判断平衡时组分浓度及范围
极端假设法确定浓度范围的方法
【点拨】可逆反应的平衡物理量一定在最大值和最小值之间,但起始物理量可以为最大值或最小值。
典例5.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
【答案】A
【解析】若X2完全转化为Z,则X2、Y2、Z的浓度分别是0 mol·L-1、0.2 mol·L-1、0.4 mol·L-1;若Z完全转化为X2、Y2,则X2、Y2、Z的浓度分别是0.2 mol·L-1、0.4 mol·L-1、0 mol·L-1;反应为可逆反应,反应物不能完全转化,所以0典例6.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0【答案】D
【解析】由于X、Y的平衡浓度之比为1∶3,转化浓度亦为1∶3,故c1∶c2=1∶3,A、C不正确;Y生成表示逆反应,Z生成表示正反应,平衡时应vY(生成)∶vZ(生成)=3∶2,B不正确;由可逆反应的特点可知0知识点二:化学平衡常数
1.化学平衡常数及表达式
(1)概念:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
(2)表达式
①对于反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数K=。
②固体或纯液体的浓度视为常数,通常不计入平衡常数表达式
a.C(s)+H2O(g)CO(g)+H2(g)的平衡常数表达式K=。
b.Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)的平衡常数表达式K=。
2.平衡常数的换算
化学平衡常数是指某一具体反应的平衡常数,化学反应方向改变或化学计量数改变,化学平衡常数均发生改变。
(1)同一反应的正逆平衡常数互为倒数,即K正=。
(2)反应的化学计量数变为原来的n倍,则平衡常数是原平衡常数的n次方,即K′=Kn。
3.意义及影响因素
意义 K值越大 正反应进行的程度越大
反应物的转化率越大
影响因素 内因 反应物本身的性质
外因 温度升高 ΔH<0,K值减小
ΔH>0,K值增大
【点拨】 一般地,当K>105时,反应基本完全了。
4.主要应用
(1)判断可逆反应的反应方向以及反应是否达到平衡
Q=K 体系处于平衡状态
QQ>K 反应逆向进行
(2)判断可逆反应的反应热
升高温度 K值增大 正反应为吸热反应
K值减小 正反应为放热反应
降低温度 K值增大 正反应为放热反应
K值减小 正反应为吸热反应
【点拨】使用化学平衡常数应注意的问题
(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
(2)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。
(3)化学平衡常数是指某一具体反应的平衡常数。
①若反应方向改变,则平衡常数改变,二者互为倒数。
②若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
如N2+3H22NH3,K=a则有:2NH3N2+3H2,K′=1/a。
N2+H2NH3,K″=。
知识点三:化学平衡转化率
(1)表达式
对于反应:aA+bBcC+dD,反应物A的转化率可以表示为α(A)=×100%=×100%=×100%。
(2)影响因素[以N2(g)+3H2(g)2NH3(g) ΔH<0为例]
①增大N2浓度,α(N2)减小,α(H2)增大。
②升高温度,α(N2)减小。
③增大压强,α(N2)增大。
典例7.对于反应C(s)+H2O(g)CO(g)+H2(g) ΔH>0,下列有关说法正确的是( )
A.平衡常数表达式为K=
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
【答案】B
【解析】固态物质浓度为“常数”,视为“1”,不需写入平衡常数表达式,A项错误;K只与温度有关,因此增大体系压强,平衡常数K不发生变化,B项正确;升温该反应正向进行,K增大,C项错误;增加C(s)的量,平衡不移动,D项错误。
典例8.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
【答案】B
【解析】在书写平衡常数表达式时,纯固体不写,A错误;由于反应③=反应①-反应②,因此平衡常数K=,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。
典例9.可逆反应:2SO2+O22SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Q为浓度商)( )
A.Q不变,K变大,O2转化率增大
B.Q不变,K变大,SO2转化率减小
C.Q变小,K不变,O2转化率减小
D.Q增大,K不变,SO2转化率增大
【答案】C
【解析】当可逆反应2SO2+O22SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Q变小,K不变。
典例10.反应H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应HI(g) H2(g)+I2(g)的平衡常数为K2,则K1、K2的关系式为(平衡常数为同温度下的测定值)( )
A.K1=2K2 B.K1=K C.K1= D.K1=K2
【答案】C
【解析】K1=c2(HI)/[c(H2)·c(I2)],K2=[c(H2)·c(I2)]/c(HI),K1=
核心价值与学科素养
典例11.(1)氢是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,因此氢能被称为人类的终极能源。氢气是一种绿色能源,又是一种重要的化工原料。如何将水中的氢释放出来是目前氢能研究的重要课题。
以生物材质(以C计)与水蒸气反应制取H2是一种低耗能、高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应为
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3。
该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),用K1、K2、K3的代数式表示此反应的平衡常数K。 。
(2)在化学平衡体系中,各气体物质的分压(分压=总压×该气体的体积分数或物质的量分数)代替浓度,计算的平衡常数叫做压强平衡常数。单位与表达式有关。
如反应aA(g)+b(B)gcC(g)+dD(g),p(A)=×p总,Kp=。
对于在恒压容器中进行的反应N2(g)+3H2(g) 2NH3(g),若起始投料为1 mol N2、3 mol H2,转化率为50%,压强平衡常数Kp是多少?(大气压为p0) 。
【解析】(1)已知:Ⅰ:C(s)+H2O(g) CO(g)+H2(g) K1,
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) K2,
Ⅲ:CaO(s)+CO2(g) CaCO3(s) K3,
反应Ⅰ、Ⅱ、Ⅲ之和为反应
C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),则K=K1·K2·K3。
(2)列出“三段式”如下:
N2(g) + 3H2(g) 2NH3(g)
起始 1 mol 3 mol 0
转化 0.5 mol 1.5 mol 1 mol
平衡 0.5 mol 1.5 mol 1 mol
则Kp===。
【跟踪练习】 基础过关
1. 模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g) H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是( )
【答案】C
【解析】可逆反应的特点是反应物、生成物共存。
2. 在一定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L
【答案】B
【解析】反应为可逆反应,反应体系中任何一种物质的转化率都小于100%,所以A、D错误;从题给量的关系知无论反应进行到什么程度,c(N2)∶c(H2)=1∶3,因此两者不可能同时均为0.18 mol/L,故C错误。
3. 一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)2HCl(g)+I2(s)。下列事实不能说明该反应达到平衡状态的是( )
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.容器内气体颜色不再改变
D.断裂1 mol Cl—Cl键的同时断裂1 mol H—Cl键
【答案】D
【解析】反应过程中压强为变量,压强不再改变说明反应达到平衡;反应过程中气体质量为变量,体积不变,所以气体密度是变量,容器内气体密度不再改变说明反应达到平衡;容器内气体颜色不再改变,说明氯气的浓度不变,反应一定达到平衡状态;平衡时断裂1 mol Cl—Cl键的同时断裂2 mol H—Cl键,因此D项不能说明该反应达到平衡状态。
4. 下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关 ②改变反应物浓度或生成物浓度都会改变平衡常数K ③加入催化剂不改变平衡常数K ④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A.①② B.②③ C.③④ D.①③
【答案】D
【解析】平衡常数K是一个温度常数,只与反应本身及温度有关,催化剂不能改变化学平衡,故加入催化剂不改变平衡常数K。
5. 已知下列反应的平衡常数:①H2(g)+S(s)H2S(g),K1;②S(s)+O2(g)SO2(g),K2;则反应H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数是( )
A.K1+K2 B.K1-K2 C.K1×K2 D.
【答案】D
【解析】K1=,K2=,所求反应的平衡常数K3==×=K1×=。
能力达成
6.一定条件下,反应2NH3(g)N2(g)+3H2(g) ΔH>0,达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是( )
A.压强:p1>p2
B.b、c两点对应的平衡常数:Kc>Kb
C.a点:2v正(NH3)=3v逆(H2)
D.a点:NH3的转化率为
【答案】B
【解析】该反应为气体分子数增大的反应,恒温时,压强越大,N2的体积分数越小,则p1Kb,故B正确;反应速率之比等于化学计量数之比,3v正(NH3)=2v逆(H2),故C错误;对于反应2NH3??N2(g)+3H2(g),假设反应前氨的物质的量为1 mol,反应的氨的物质的量为x mol,则=0.1,解得x=,因此氨的转化率为,故D错误。
7. 一定条件下合成乙烯:6H2(g)+2CO2(g)CH2==CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
A.该反应的逆反应为吸热反应
B.平衡常数:KM>KN
C.生成乙烯的速率:v(N)一定大于v(M)
【答案】C
【解析】升高温度CO2的平衡转化率降低,说明平衡逆向移动,则逆反应为吸热反应,A正确;该反应的正反应是放热反应,升温平衡常数减小,B正确;化学反应速率随温度的升高而加快,催化剂在250 ℃时催化活性最高,温度继续升高,其催化效率降低,所以v(N)有可能小于v(M),C错误,D正确。
8. Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
反应 大气固氮N2(g)+O2(g) ??2NO(g) 工业固氮N2(g)+3H2(g) ??2NH3(g)
温度/ ℃ 27 2 000 25 400 450
平衡常数K 3.84×10-31 0.1 5×108 0.507 0.152
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:
_________________________________________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,如图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:____________________________。
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)2NH3(g)。
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α=__________。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=____________________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
【答案】(1)①吸热 ②K值小,正向进行的程度小(或转化率低),不适合大规模生产
(2)A p2>p1 (3)①60% ②或0.255或0.26
【解析】(1)①由表中数据可知随温度从27 ℃升高到2 000 ℃,K值增大,说明平衡向正反应方向移动,说明正反应是吸热反应;②大气固氮的K值小,转化率低。(2)工业固氮,随温度升高,K值减小,平衡向逆反应方向移动,N2的转化率降低,所以A正确。取相同的温度,p1→p2,N2的转化率升高,说明平衡向正反应方向移动,正反应是气体体积减小的反应,说明压强增大,p2>p1。
(3) N2 + 3H2??2NH3
n(始)/mol 1 3 0
n(变)/mol a 3a 2a
n(平)/mol 1-a 3-3a 2a
有(1-a)+(3-3a)+2a=2.8 mol,a=0.6 mol,H2的转化率为60%,N2的平衡分压为×8 MPa,H2、NH3的平衡分压均为×8 MPa,Kp==。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第二章 第二节 化学平衡
第1课时 化学平衡状态 化学平衡常数
【学习目标】
1.通过溶解和结晶过程的分析,认识化学反应的可逆性。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,理解并会判断化学平衡状态的标志。
3.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
4.能够利用化学平衡常数进行简单的计算。如计算物质的平衡浓度、转化率等。
【素养目标】
1.可逆反应都有一定的限度,是可调控的,条件改变,限度被破坏, 达到新的平衡状态。能从多角度、动态地分析化学平衡状态的各种表现。认识温度是决定化学平衡常数的唯一物理量。培养学生“变化观念与平衡思想”学科素养。
2.能建立“逆、等、动、定、变”的认知模型,并利用模型解决化学平衡的实际问题。通过“三段式”分析推理方法,建立化学平衡常数的认知模型,并能根据模型理解本质和规律及进行简单计算。培养学生“证据推理与模型认知”的学科素养。
必备知识与关键能力
知识点一:化学平衡状态
1.化学平衡研究的对象——可逆反应
(1)定义
在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点
双向性 指可逆反应分为方向相反的两个反应:正反应和逆反应
双同性 指正、逆反应是在同一条件下,同时进行
共存性 指反应物的转化率小于100%,反应物与生成物共存
【点拨】可逆反应不等同于可逆过程。可逆过程包括物理变化和化学变化,而可逆反应属于化学反应。
2.化学平衡状态
(1)概念
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度均保持不变,我们称为“化学平衡状态”,简称化学平衡。
(2)建立:以“N2+3H22NH3”为例。
①正反应开始进行的c t图如图(a)
②逆反应开始进行的c t图如图(b)
③反应过程中v正、v逆变化(正反应开始)
以上过程可用v t图表示为
(3)特征
3.化学平衡状态的判定标志
【点拨】 理解平衡状态判定标志 (有正有逆 符合比例;变量不变即平衡)
(1)全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间而变化。
(2)对同一物质而言,断裂的化学键的物质的量与形成的化学键的物质的量相等。
(3)对于有色物质参加或生成的可逆反应,体系的颜色不再随时间而变化。
(4)绝热体系的温度不变,说明反应处于平衡状态。
(5)全部是气体的非等体积反应,恒压条件下,密度不再变化;对于有固体参与或生成的气体平衡体系,密度不再变化。
总之,要抓住变化的量不变可作平衡的标志;如果该物理量始终是一个定值,就不能作为判断是否达平衡的标志。
举例 mA(g)+nB(g)pC(g) +qD(g) 状态
混合物体系中各成分的含量 各物质的物质的量或各物质的物质的量分数一定 平衡
各物质的质量或各物质的质量分数一定 平衡
各气体的体积或体积分数一定 平衡
总压强、总体积、总物质的量一定 不一定平衡
正、逆反应速率的关系 在单位时间内消耗了m mol A,同时生成m mol A,即v正=v逆 平衡
在单位时间内消耗了n mol B,同时生成p mol C 不一定平衡
vA∶vB∶vC∶vD=m∶n∶p∶q,v正不一定等于v逆? 不一定平衡
在单位时间内生成了n mol B,同时消耗了q mol D 不一定平衡
压强 m+n≠p+q时,总压强一定(其他条件一定) 平衡
m+n=p+q时,总压强一定(其他条件一定) 不一定平衡
混合气体的平均相对分子质量() 一定,当m+n≠p+q时 平衡
一定,当m+n=p+q时 不一定平衡
温度 任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定 平衡
密度 密度一定 不一定平衡
颜色 含有有色物质的体系颜色不再变化 平衡
典例1.对于可逆反应2SO2+O22SO3 ΔH<0,在混合气体中充入一定量的 18O2,经足够长的时间后,下列有关说法中正确的是( )
A.18O只存在于O2中
B.18O只存在于O2和SO3中
C.某个二氧化硫分子的相对分子质量可能为66
D.三氧化硫的相对分子质量均为82
【答案】C
【解析】由于2SO2+O22SO3为可逆反应,故18O存在于O2、SO3、SO2中,故A、B项错误;SO2的相对分子质量可能为64或66或68,C项正确;SO3的相对分子质量可能为80或82或84,D项错误。
典例2.在一定温度下,恒容容器中发生:X(g)+2Y(g) 3Z(g)。能说明反应达到平衡状态的是________(填序号)。
①Z的生成速率与Z的分解速率相等
②容器内的压强不再变化
③单位时间内消耗a mol X,同时生成3a mol Z
④混合气体总的物质的量不再变化
⑤混合气体的密度不再变化
⑥c(X)∶c(Y)∶c(Z)=1∶2∶3
⑦c(Z)不再变化
【答案】①⑦
典例3.在一定条件下,向2 L密闭容器中通入2 mol N2和6 mol H2,发生反应:N2(g)+3H2(g)2NH3(g),以下选项能够说明反应已达到平衡状态的是( )
A.c(NH3)∶c(H2)∶c(N2)=2∶3∶1
B.单位时间内1个键断裂的同时,有6个N—H键形成
C.混合气体的平均相对分子质量不再改变
D.单位时间内有6个N—H键形成的同时,有3个H—H键断裂
【答案】C
【解析】c(NH3)∶c(H2)∶c(N2)=2∶3∶1,并不能说明浓度不变,所以不一定是平衡状态,A错误;单位时间内1个键断裂,同时有6个N—H键形成,均是向正反应方向进行,未体现正反应速率与逆反应速率相等的关系,B错误;该反应是反应前后气体分子数不同的反应,未达到平衡前混合气体的物质的量是变量,质量是定量,所以平均摩尔质量是变量,混合气体的平均相对分子质量也是变量,则混合气体的平均相对分子质量不再改变时能说明反应达到平衡,C正确;单位时间内有6个N—H键形成的同时,有3个H—H键断裂,均是向正反应方向进行,未体现正反应速率与逆反应速率相等的关系,D错误。
典例4.在1 L恒温恒容的密闭容器中投入一定量N2O5,发生反应:
反应1:N2O5(g)===N2O4(g)+O2(g)ΔH=+28.4 kJ·mol-1
反应2:N2O4(g)2NO2(g) ΔH=-56.9 kJ·mol-1
现有下列情况:①混合气体的密度保持不变;②气体压强保持不变;③气体的平均摩尔质量保持不变;④保持不变;⑤O2的物质的量保持不变;⑥v正(N2O4)∶v逆(NO2)=1∶2。能表明反应2一定达到平衡状态的是( )
A.①②③⑤ B.②③④⑥
C.①③⑤⑥ D.②③④⑤
【答案】B
【解析】①反应中各物质均为气体,混合气体的总质量不变,且反应在恒容条件下进行,则混合气体的密度始终不变,故不能判断是否达到平衡,错误;②反应2的平衡建立过程中,气体总物质的量不断变化,则气体压强不断变化,当气体压强保持不变时,反应2达到平衡状态,正确;③平衡建立过程中,混合气体的总质量不变,但其总物质的量不断变化,故当气体的平均摩尔质量保持不变时,反应2达到平衡状态,正确;④保持不变,则c(NO2)、c(N2O4)均保持不变,反应2达到平衡状态,正确;⑤反应1是不可逆反应,O2的物质的量始终保持不变,不能据此判断反应2是否达到平衡,错误;⑥v正(N2O4)∶v逆(NO2) =1∶2,正、逆反应速率相等,反应2达到平衡状态,正确。
4.极端假设法判断平衡时组分浓度及范围
极端假设法确定浓度范围的方法
【点拨】可逆反应的平衡物理量一定在最大值和最小值之间,但起始物理量可以为最大值或最小值。
典例5.在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
【答案】A
【解析】若X2完全转化为Z,则X2、Y2、Z的浓度分别是0 mol·L-1、0.2 mol·L-1、0.4 mol·L-1;若Z完全转化为X2、Y2,则X2、Y2、Z的浓度分别是0.2 mol·L-1、0.4 mol·L-1、0 mol·L-1;反应为可逆反应,反应物不能完全转化,所以0
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0
【解析】由于X、Y的平衡浓度之比为1∶3,转化浓度亦为1∶3,故c1∶c2=1∶3,A、C不正确;Y生成表示逆反应,Z生成表示正反应,平衡时应vY(生成)∶vZ(生成)=3∶2,B不正确;由可逆反应的特点可知0
1.化学平衡常数及表达式
(1)概念:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。
(2)表达式
①对于反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数K=。
②固体或纯液体的浓度视为常数,通常不计入平衡常数表达式
a.C(s)+H2O(g)CO(g)+H2(g)的平衡常数表达式K=。
b.Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)的平衡常数表达式K=。
2.平衡常数的换算
化学平衡常数是指某一具体反应的平衡常数,化学反应方向改变或化学计量数改变,化学平衡常数均发生改变。
(1)同一反应的正逆平衡常数互为倒数,即K正=。
(2)反应的化学计量数变为原来的n倍,则平衡常数是原平衡常数的n次方,即K′=Kn。
3.意义及影响因素
意义 K值越大 正反应进行的程度越大
反应物的转化率越大
影响因素 内因 反应物本身的性质
外因 温度升高 ΔH<0,K值减小
ΔH>0,K值增大
【点拨】 一般地,当K>105时,反应基本完全了。
4.主要应用
(1)判断可逆反应的反应方向以及反应是否达到平衡
Q=K 体系处于平衡状态
Q
(2)判断可逆反应的反应热
升高温度 K值增大 正反应为吸热反应
K值减小 正反应为放热反应
降低温度 K值增大 正反应为放热反应
K值减小 正反应为吸热反应
【点拨】使用化学平衡常数应注意的问题
(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关。
(2)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。
(3)化学平衡常数是指某一具体反应的平衡常数。
①若反应方向改变,则平衡常数改变,二者互为倒数。
②若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
如N2+3H22NH3,K=a则有:2NH3N2+3H2,K′=1/a。
N2+H2NH3,K″=。
知识点三:化学平衡转化率
(1)表达式
对于反应:aA+bBcC+dD,反应物A的转化率可以表示为α(A)=×100%=×100%=×100%。
(2)影响因素[以N2(g)+3H2(g)2NH3(g) ΔH<0为例]
①增大N2浓度,α(N2)减小,α(H2)增大。
②升高温度,α(N2)减小。
③增大压强,α(N2)增大。
典例7.对于反应C(s)+H2O(g)CO(g)+H2(g) ΔH>0,下列有关说法正确的是( )
A.平衡常数表达式为K=
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
【答案】B
【解析】固态物质浓度为“常数”,视为“1”,不需写入平衡常数表达式,A项错误;K只与温度有关,因此增大体系压强,平衡常数K不发生变化,B项正确;升温该反应正向进行,K增大,C项错误;增加C(s)的量,平衡不移动,D项错误。
典例8.已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
【答案】B
【解析】在书写平衡常数表达式时,纯固体不写,A错误;由于反应③=反应①-反应②,因此平衡常数K=,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。
典例9.可逆反应:2SO2+O22SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Q为浓度商)( )
A.Q不变,K变大,O2转化率增大
B.Q不变,K变大,SO2转化率减小
C.Q变小,K不变,O2转化率减小
D.Q增大,K不变,SO2转化率增大
【答案】C
【解析】当可逆反应2SO2+O22SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Q变小,K不变。
典例10.反应H2(g)+I2(g) 2HI(g)的平衡常数为K1;反应HI(g) H2(g)+I2(g)的平衡常数为K2,则K1、K2的关系式为(平衡常数为同温度下的测定值)( )
A.K1=2K2 B.K1=K C.K1= D.K1=K2
【答案】C
【解析】K1=c2(HI)/[c(H2)·c(I2)],K2=[c(H2)·c(I2)]/c(HI),K1=
核心价值与学科素养
典例11.(1)氢是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,因此氢能被称为人类的终极能源。氢气是一种绿色能源,又是一种重要的化工原料。如何将水中的氢释放出来是目前氢能研究的重要课题。
以生物材质(以C计)与水蒸气反应制取H2是一种低耗能、高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应为
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3。
该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),用K1、K2、K3的代数式表示此反应的平衡常数K。 。
(2)在化学平衡体系中,各气体物质的分压(分压=总压×该气体的体积分数或物质的量分数)代替浓度,计算的平衡常数叫做压强平衡常数。单位与表达式有关。
如反应aA(g)+b(B)gcC(g)+dD(g),p(A)=×p总,Kp=。
对于在恒压容器中进行的反应N2(g)+3H2(g) 2NH3(g),若起始投料为1 mol N2、3 mol H2,转化率为50%,压强平衡常数Kp是多少?(大气压为p0) 。
【解析】(1)已知:Ⅰ:C(s)+H2O(g) CO(g)+H2(g) K1,
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) K2,
Ⅲ:CaO(s)+CO2(g) CaCO3(s) K3,
反应Ⅰ、Ⅱ、Ⅲ之和为反应
C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),则K=K1·K2·K3。
(2)列出“三段式”如下:
N2(g) + 3H2(g) 2NH3(g)
起始 1 mol 3 mol 0
转化 0.5 mol 1.5 mol 1 mol
平衡 0.5 mol 1.5 mol 1 mol
则Kp===。
【跟踪练习】 基础过关
1. 模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g) H2(g)+Br2(g)反应,下列四个图中可以表示该反应在一定条件下为可逆反应的是( )
【答案】C
【解析】可逆反应的特点是反应物、生成物共存。
2. 在一定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L
【答案】B
【解析】反应为可逆反应,反应体系中任何一种物质的转化率都小于100%,所以A、D错误;从题给量的关系知无论反应进行到什么程度,c(N2)∶c(H2)=1∶3,因此两者不可能同时均为0.18 mol/L,故C错误。
3. 一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)2HCl(g)+I2(s)。下列事实不能说明该反应达到平衡状态的是( )
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.容器内气体颜色不再改变
D.断裂1 mol Cl—Cl键的同时断裂1 mol H—Cl键
【答案】D
【解析】反应过程中压强为变量,压强不再改变说明反应达到平衡;反应过程中气体质量为变量,体积不变,所以气体密度是变量,容器内气体密度不再改变说明反应达到平衡;容器内气体颜色不再改变,说明氯气的浓度不变,反应一定达到平衡状态;平衡时断裂1 mol Cl—Cl键的同时断裂2 mol H—Cl键,因此D项不能说明该反应达到平衡状态。
4. 下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关 ②改变反应物浓度或生成物浓度都会改变平衡常数K ③加入催化剂不改变平衡常数K ④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A.①② B.②③ C.③④ D.①③
【答案】D
【解析】平衡常数K是一个温度常数,只与反应本身及温度有关,催化剂不能改变化学平衡,故加入催化剂不改变平衡常数K。
5. 已知下列反应的平衡常数:①H2(g)+S(s)H2S(g),K1;②S(s)+O2(g)SO2(g),K2;则反应H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数是( )
A.K1+K2 B.K1-K2 C.K1×K2 D.
【答案】D
【解析】K1=,K2=,所求反应的平衡常数K3==×=K1×=。
能力达成
6.一定条件下,反应2NH3(g)N2(g)+3H2(g) ΔH>0,达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是( )
A.压强:p1>p2
B.b、c两点对应的平衡常数:Kc>Kb
C.a点:2v正(NH3)=3v逆(H2)
D.a点:NH3的转化率为
【答案】B
【解析】该反应为气体分子数增大的反应,恒温时,压强越大,N2的体积分数越小,则p1
7. 一定条件下合成乙烯:6H2(g)+2CO2(g)CH2==CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
A.该反应的逆反应为吸热反应
B.平衡常数:KM>KN
C.生成乙烯的速率:v(N)一定大于v(M)
【答案】C
【解析】升高温度CO2的平衡转化率降低,说明平衡逆向移动,则逆反应为吸热反应,A正确;该反应的正反应是放热反应,升温平衡常数减小,B正确;化学反应速率随温度的升高而加快,催化剂在250 ℃时催化活性最高,温度继续升高,其催化效率降低,所以v(N)有可能小于v(M),C错误,D正确。
8. Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
反应 大气固氮N2(g)+O2(g) ??2NO(g) 工业固氮N2(g)+3H2(g) ??2NH3(g)
温度/ ℃ 27 2 000 25 400 450
平衡常数K 3.84×10-31 0.1 5×108 0.507 0.152
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:
_________________________________________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,如图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:____________________________。
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)2NH3(g)。
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α=__________。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=____________________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
【答案】(1)①吸热 ②K值小,正向进行的程度小(或转化率低),不适合大规模生产
(2)A p2>p1 (3)①60% ②或0.255或0.26
【解析】(1)①由表中数据可知随温度从27 ℃升高到2 000 ℃,K值增大,说明平衡向正反应方向移动,说明正反应是吸热反应;②大气固氮的K值小,转化率低。(2)工业固氮,随温度升高,K值减小,平衡向逆反应方向移动,N2的转化率降低,所以A正确。取相同的温度,p1→p2,N2的转化率升高,说明平衡向正反应方向移动,正反应是气体体积减小的反应,说明压强增大,p2>p1。
(3) N2 + 3H2??2NH3
n(始)/mol 1 3 0
n(变)/mol a 3a 2a
n(平)/mol 1-a 3-3a 2a
有(1-a)+(3-3a)+2a=2.8 mol,a=0.6 mol,H2的转化率为60%,N2的平衡分压为×8 MPa,H2、NH3的平衡分压均为×8 MPa,Kp==。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
