3.4 沉淀溶解平衡(第2课时 沉淀溶解平衡的应用)(解析版)
文档属性
| 名称 | 3.4 沉淀溶解平衡(第2课时 沉淀溶解平衡的应用)(解析版) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第三章 第四节 沉淀溶解平衡
第2课时 沉淀溶解平衡的应用
【学习目标】
1.通过实验探究,了解沉淀的生成、溶解与转化。
2.能够根据化学平衡原理分析沉淀的生成、溶解与转化。
3.能举例说明沉淀溶解平衡在生产、生活中的应用。能运用沉淀溶解平衡原理,分析和解决生产、生活中有关的实际问题。
【素养目标】
5.能设计简单的实验方案验证沉淀的生成、溶解与转化,完成实验操作,观察现象,对实验现象作出解释,发现和提出需要进一步研究的问题。培养学生“科学探究与创新意识”的学科素养。
6.通过沉淀的生成、溶解与转化在生产、生活和科学研究中的应用,认识化学对人类做出的重大贡献。培养学生“科学态度与社会责任”的学科素养。
必备知识与关键能力
知识点一:沉淀的生成
1.沉淀生成时沉淀剂的选择原则
(1)使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。
(2)不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。
2.常用的沉淀方法
(1)调节pH法
通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。如用CuO调节CuCl2溶液(含Fe3+)的酸碱性以除去Fe3+。
(2)直接沉淀法 通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。
方法 举例 解释
调节pH法 除去CuCl2溶液中的FeCl3,可向溶液中加入CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3] CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右 Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
沉淀剂法 以H2S、Na2S等沉淀污水中的Hg2+、Cu2+等重金属离子 H2S、Na2S与Cu2+、Hg2+反应生成沉淀
知识点二:沉淀的溶解
沉淀溶解时的关键步骤是加入的试剂能与产生沉淀的离子发生反应,生成挥发性物质(气体)或弱电解质(弱酸、弱碱或水),使平衡向沉淀溶解的方向移动,使沉淀溶解的常用方法主要有四种:①酸溶解法②盐溶液溶解法③氧化还原溶解法④配位溶解法。
1.酸溶解法
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
2.盐溶液溶解法
如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH===Mg2++2NH3·H2O。
实验:氢氧化镁沉淀在蒸馏水、盐酸、氯化铵溶液中的溶解
实验名称 氢氧化镁沉淀在蒸馏水、盐酸、氯化铵溶液中的溶解
实验装置
实验原理 氢氧化镁难溶于水,但与酸反应,溶于酸性溶液。NH4Cl水解显酸性,能溶解氢氧化镁。
实验用品 蒸馏水、盐酸、氯化铵溶液、氢氧化镁固体;三支试管、胶头滴管。
实验步骤 ①取三支干燥的试管,分别加入等量的氢氧化镁固体。 ②分别向三支试管中依次加入蒸馏水、盐酸、氯化铵溶液,充分振荡,观察沉淀的溶解情况。
实验现象 氢氧化镁中加入蒸馏水沉淀量无明显减少;氢氧化镁中加入盐酸溶液,沉淀迅速完全溶解,得无色溶液;氢氧化镁中加入氯化铵溶液,沉淀完全溶解,得无色溶液。
实验结论 ①氢氧化镁溶于酸和酸性溶液。在含有难溶物氢氧化镁的溶液中存在溶解平衡,加入酸或酸性溶液能促进沉淀的溶解。 ②加入能与沉淀溶解所产生的离子发生反应的试剂,生成挥发性物质或弱电解质而使溶解平衡向溶解的方向移动。
3.氧化还原溶解法
如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
4.配位溶解法
如AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
知识点一:沉淀的转化
(1)实质:沉淀溶解平衡的移动。
(2)举例:MgCl2溶液Mg(OH)2Fe(OH)3,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
(3)规律:一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,但溶解度小的沉淀在一定条件下,也能转化为溶解度稍大的沉淀。
(4)应用
锅炉除水垢 将CaSO4转化为CaCO3,离子方程式为CaSO4+CO===CaCO3+SO
矿物转化 CuSO4溶液遇ZnS转化为CuS,离子方程式为ZnS+Cu2+===CuS+Zn2+
(5)实验:氯化银、碘化银、硫化银沉淀的转化
实验名称 氯化银、碘化银、硫化银沉淀的转化
实验装置
实验原理 Ag+ +Cl ===AgCl↓, AgCl+I ===AgI+Cl ,2AgI+S2 ===Ag2S+2I
实验用品 0.1 mol/L AgNO3溶液、0.1 mol/L NaCl溶液、0.1 mol/L KI溶液、0.1 mol/L Na2S溶液;试管、胶头滴管。
实验步骤 ①向盛有10滴0.1 mol/L AgNO3溶液试管中滴加0.1 mol/L NaCl溶液,至不再有白色沉淀生成。 ②向上述固液混合物中滴加适量0.1 mol/L KI溶液,直到沉淀颜色不再改变为止,观察并记录现象。 ③向上支试管中滴加0.1 mol/L Na2S溶液,直到到沉淀颜色不再改变为止,观察并记录现象。
实验现象 ①NaCl溶液和AgNO3溶液混合产生白色沉淀。 ②向所得固液混合物中滴加KI溶液,沉淀颜色逐渐变成黄色。 ③再向所得固液混合物中滴加Na2S溶液,沉淀颜色逐渐变成黑色。
实验结论 ①溶解度由大到小的顺序为: AgCl>AgI>Ag2S [或Ksp(AgCl)>Ksp(AgI),因沉淀类型不同通常不能比较Ksp(AgCl)、Ksp(AgI)与Ksp(Ag2S)的大小]。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。
实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如Ag+)不能过量。
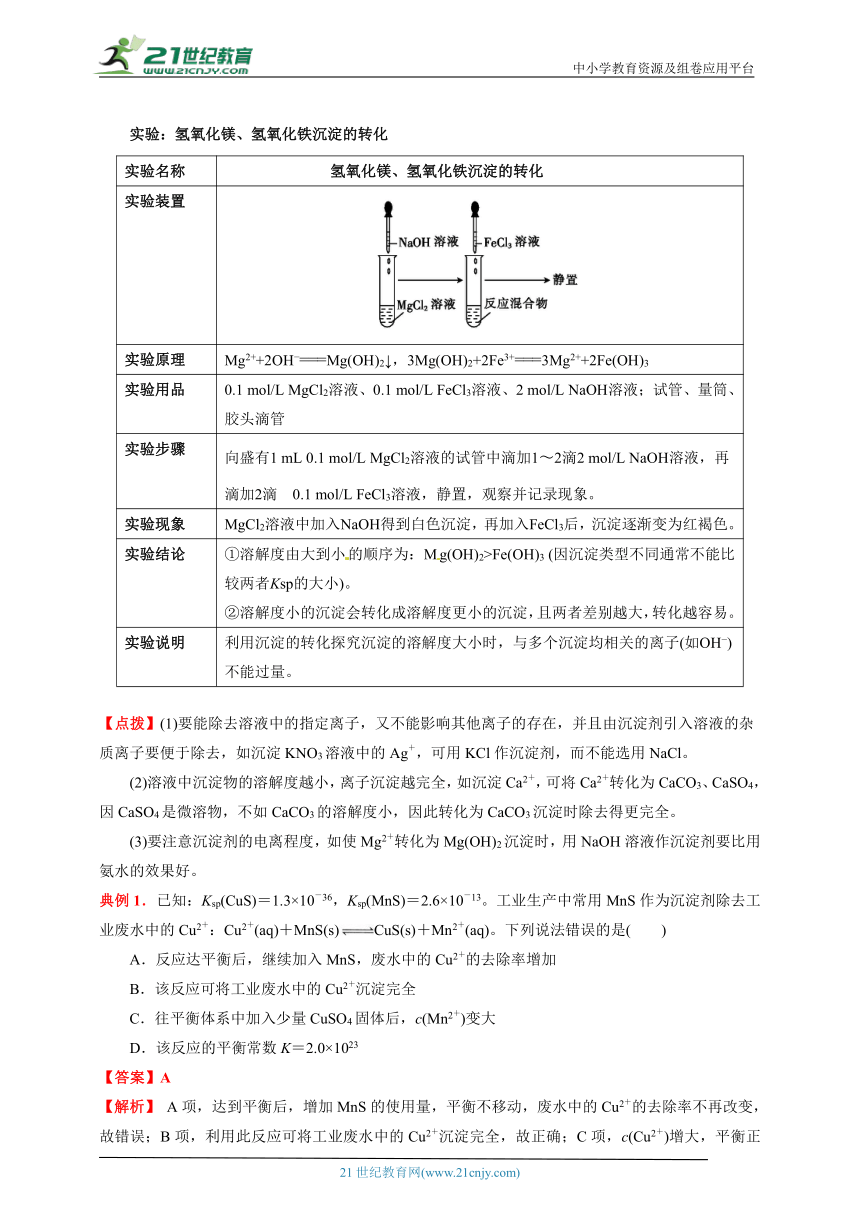
实验:氢氧化镁、氢氧化铁沉淀的转化
实验名称 氢氧化镁、氢氧化铁沉淀的转化
实验装置
实验原理 Mg2++2OH ===Mg(OH)2↓,3Mg(OH)2+2Fe3+===3Mg2++2Fe(OH)3
实验用品 0.1 mol/L MgCl2溶液、0.1 mol/L FeCl3溶液、2 mol/L NaOH溶液;试管、量筒、胶头滴管
实验步骤 向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1 2滴2 mol/L NaOH溶液,再滴加2滴 0.1 mol/L FeCl3溶液,静置,观察并记录现象。
实验现象 MgCl2溶液中加入NaOH得到白色沉淀,再加入FeCl3后,沉淀逐渐变为红褐色。
实验结论 ①溶解度由大到小的顺序为:Mg(OH)2>Fe(OH)3 (因沉淀类型不同通常不能比较两者Ksp的大小)。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。
实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如OH )不能过量。
【点拨】(1)要能除去溶液中的指定离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子要便于除去,如沉淀KNO3溶液中的Ag+,可用KCl作沉淀剂,而不能选用NaCl。
(2)溶液中沉淀物的溶解度越小,离子沉淀越完全,如沉淀Ca2+,可将Ca2+转化为CaCO3、CaSO4,因CaSO4是微溶物,不如CaCO3的溶解度小,因此转化为CaCO3沉淀时除去得更完全。
(3)要注意沉淀剂的电离程度,如使Mg2+转化为Mg(OH)2沉淀时,用NaOH溶液作沉淀剂要比用氨水的效果好。
典例1.已知:Ksp(CuS)=1.3×10-36,Ksp(MnS)=2.6×10-13。工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列说法错误的是( )
A.反应达平衡后,继续加入MnS,废水中的Cu2+的去除率增加
B.该反应可将工业废水中的Cu2+沉淀完全
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=2.0×1023
【答案】A
【解析】 A项,达到平衡后,增加MnS的使用量,平衡不移动,废水中的Cu2+的去除率不再改变,故错误;B项,利用此反应可将工业废水中的Cu2+沉淀完全,故正确;C项,c(Cu2+)增大,平衡正向移动,所以c(Mn2+)变大,故正确;D项,该反应的平衡常数K===2.0×1023,故正确。
典例2.已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S===CuS↓+2H+
C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑
D.FeS+2H+===Fe2++H2S↑
【答案】C
【解析】因为溶解度:Zn(OH)2>ZnS,溶液中离子反应往往是生成更难溶的物质,则Zn2+和S2-结合时更容易生成ZnS,Zn2++S2-===ZnS↓,C项错误。其他选项所产生的沉淀均为所有可能沉淀中溶解度最小的,符合平衡原理。
核心价值与学科素养
典例3.“钡餐”是一种造影剂,用于在X线照射下显示消化道有无病变。可溶性钡盐有毒,医院中常用硫酸钡(俗称“钡餐”)作为内服造影剂,其不溶于水和脂质,所以不会被胃肠道黏膜吸收,因此对人基本无毒性。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是( )
A.BaCO3的溶度积常数表达式为 Ksp(BaCO3)=n(Ba2+)·n(CO)
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
【答案】B
【解析】溶度积常数为离子浓度幂之积,BaCO3的溶度积常数表达式为Ksp(BaCO3)=c(Ba2+)·c(CO),故A错误;根据公式c=得,2%~5%的Na2SO4溶液中Na2SO4的物质的量浓度为0.13 mol·L-1~0.33 mol·L-1,用0.13 mol·L-1~0.33 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)在 mol·L-1~ mol·L-1之间,浓度很小,可起到解毒的作用,故B正确;c(Ba2+)=1.0×10-5 mol·L-1的溶液中钡离子浓度很小,不会引起钡离子中毒,故C错误;因胃酸可与CO反应生成水和二氧化碳,使CO浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO(aq)向溶解方向移动,使Ba2+浓度增大,会引起Ba2+中毒,故不用碳酸钡作为内服造影剂,与Ksp大小无关,故D错误。
典例4.磷酸钙用于制造乳色玻璃、陶瓷、涂料、媒染剂、药物、肥料、家畜饲料添加剂、糖浆澄清剂、塑料稳定剂等。磷酸钙容易形成结石。
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.0×10-6mol·L-1,c(PO)=2.0×10-6mol·L-1,则Ca3(PO4)2的Ksp为( )
A.2.0×10-29 B.3.2×10-29
C.6.3×10-18 D.5.1×10-27
【答案】B
【解析】Ca3(PO4)2(s)3Ca2+(aq)+2PO(aq),所以Ca3(PO4)2的Ksp=c3(Ca2+)·c2(PO)=(2.0×10-6)3×(2.0×10-6)2=3.2×10-29。
典例5.锅炉内如结有水垢会产生以下危害:(1)锅炉钢板、管路因过热而被烧损;(2)燃料大量浪费;(3)增加锅炉检修量;(4)威胁人身安全。
某学习小组欲探究使CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料(25 ℃):
难溶电解质 CaCO3 CaSO4
Ksp 3.4×10-9 4.9×10-5
实验步骤如下:
①向100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成;
②向上述悬浊液中加入3 g Na2CO3固体,搅拌,静置,沉淀后弃去上层清液;
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液;
④ 。
请思考下列问题:
(1)题给的两种物质,Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式: 。
(3)设计第③步操作的目的是什么? 。
(4)请补充第④步操作及发生的现象 。
(5)请写出该转化在实际生活中的一个应用 。
【答案】(1)大 (2)Na2CO3+CaSO4Na2SO4+CaCO3 (3) 洗去沉淀中附着的SO
(4) 向沉淀中加入足量的稀盐酸,沉淀完全溶解
(5) 将锅炉水垢中的CaSO4转化为CaCO3,易于除去
【解析】对于类型相同的难溶物,相同条件下,Ksp越大,其溶解度越大。在CaSO4悬浊液中存在溶解平衡:CaSO4(s)Ca2+(aq)+SO(aq),而加入Na2CO3固体后,溶液中CO浓度较大,而CaCO3的Ksp较小,故CO与Ca2+结合生成沉淀,即CO+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③、④步操作,即验证所得固体是否为CaCO3。然后联系实际生活中除去锅炉水垢的方法,即可解答第(5)小题。
【跟踪练习】 基础过关
1. 已知常温下CaCO3的Ksp=3.4×10-9,CaSO4的Ksp=4.9×10-5,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,下列说法正确的是( )
A.只产生CaCO3沉淀
B.产生等量的CaCO3和CaSO4沉淀
C.产生的CaSO4沉淀更多
D.产生的CaCO3沉淀更多
【答案】C
【解析】二者都是AB型钙盐,其溶度积常数越大溶解度越大,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,溶度积常数大的物质生成的沉淀越多,根据题干信息知,溶度积常数:CaCO32. AgCl和Ag2CrO4的溶度积分别为1.8×10-10和2.0×10-12,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是( )
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D.都是难溶盐,溶解度无意义
【答案】C
【解析】AgCl和Ag2CrO4的阴、阳离子配比类型不同,不能直接利用Ksp来比较二者溶解能力的大小,所以只有C项正确;其余三项叙述均错误。若用溶度积比较溶解度大小,必须是同类型的难溶电解质,否则不能直接比较。
3. 某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
【答案】D
【解析】A项,加入AgNO3,c(Ag+)增大,c(Cl-)减小,而c、d点c(Cl-)相同,错误;B项,加入少量水,平衡右移,但c(Cl-)不变,错误;C项,d点处c(Ag+)大,此时c(Ag+)和c(Cl-)乘积大于溶度积,有氯化银沉淀生成,错误;D项,温度不变,Ksp不变,a、c点是相同温度下的溶解沉淀平衡曲线上的点,Ksp相同,正确。
4. 某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.a点对应的Ksp大于b点对应的Ksp
B.向CuSO4溶液中加入MnS发生反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中,c(Cu2+)∶c(Mn2+)=(2×10-23)∶1
D.该温度下,Ksp(CuS)小于Ksp(MnS)
【答案】A
【解析】因为a点和b点都在CuS的沉淀溶解平衡曲线上,Ksp是定值,A错误;因为Ksp(CuS)5. 向50 mL 0.018 mol·L-1AgNO3溶液中,加入50 mL 0.02 mol·L-1稀盐酸,生成了沉淀。如果溶液中
c(Ag+)和c(Cl-)的乘积是一个常数,Ksp=c(Ag+)·c(Cl-)=1×10-10,则:
(1)生成沉淀后溶液中c(Ag+)是 。
(2)沉淀生成后溶液的pH是 。
【答案】(1) 1×10-7mol·L-1 (2) 2
【解析】(1)c(Cl-)==1×10-3 mol·L-1,则c(Ag+)= mol·L-1=1×10-7 mol·L-1。
(2)沉淀前后n(H+)不变,则c(H+)==0.01 mol·L-1,故pH=2。
折 能力达成
6. 工业上常先以MnO2为原料制得粗MnCl2溶液,通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,下列分析正确的是( )
A.MnS的Ksp小于CuS、PbS、CdS等硫化物的Ksp
B.除杂试剂MnS也可用FeS代替
C.MnS与Cu2+反应的离子方程式是Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)
D.整个过程中涉及的反应类型只有复分解反应
【答案】C
【解析】通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,属于沉淀的转化,由难溶的物质转化为更难溶的物质,MnS的Ksp大于CuS、PbS、CdS等硫化物的Ksp,A错误;除杂试剂MnS如用FeS代替,会引入新的杂质,B错误;MnS与Cu2+反应的离子方程式为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),C正确;工业上以MnO2制MnCl2,锰元素化合价发生变化,属于氧化还原反应,沉淀的转化属于复分解反应,D错误。
7. (1)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH—(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降低为10-5 mol·L-1,溶液的pH应调至________。
(2)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_____ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.10 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________ mol·L-1。
【答案】(1) 5 (2) 2.2×10-8 0.20
【解析】(1) Ksp=c(Cr3+)·c3(OH-)=10-32,则c(OH-)== mol·L-1=10-9 mol·L-1,c(H+)==mol·L-1=10-5 mol·L-1,pH=–lg c(H+)=–lg 10-5=5。
(2) pH=8时c(OH–)=10-6 mol·L-1,由氢氧化铜的溶度积常数可知:Ksp=2.2×10-20=10-12 ×c(Cu2+),得c(Cu2+)=2.2×10-8 mol·L-1;使Cu2+完全沉淀为CuS,已知c(Cu2+)=0.10 mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.20 mol·L-1。
8. 某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废弃物综合利用,方案如图所示:
各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 开始沉淀时的pH 完全沉淀时的pH
Fe2+ 6.34 9.7
Fe3+ 1.48 3.2
Zn2+ 6.2 8.0
请回答下列问题:
(1)加入A物质的目的是 ,物质A可使用下列物质中的 (填字母)。
A.酸性KMnO4溶液 B.O2 C.H2O2溶液 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式为 。
(4)除铁过程中加入氨水的目的是调节溶液的pH,应控制pH的范围是 。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式: 。
(6)物质B可用于生产化肥,其化学式是 。
【答案】(1)将Fe2+氧化成Fe3+,方便后续生成沉淀除去 BC (2)<
(3)Fe+Cu2+===Fe2++Cu (4)3.2≤pH<6.2
(5)2Zn2++4HC===Zn2(OH)2CO3↓+H2O+3CO2↑ (6)(NH4)2SO4
【解析】(1)根据表中数据可知Fe3+易被除去,将Fe2+氧化成Fe3+,以便除去;除铁过程中加入A和氨水,使Fe2+变成Fe(OH)3沉淀,故A应为氧化剂,为不引入新的杂质,应选BC。
(2)相同条件下,溶解度大的物质先溶解,结合在H2SO4作用下ZnS可溶解而CuS不溶,则相同温度下:Ksp(CuS)(3)堆浸后溶液中有Cu2+,加入铁粉后反应生成海绵铜的离子方程式为Fe+Cu2+===Fe2++Cu。
(4)从表中数据可知,Fe3+沉淀完全时pH=3.2,Zn2+开始沉淀时pH=6.2,故除铁时应控制pH的范围是3.2≤pH<6.2。
(5)NH4HCO3溶液与Zn2+反应的离子方程式为2Zn2++4HC===H2O+Zn2(OH)2CO3↓+3CO2↑。
(6)因所用废酸为硫酸,B又可用于生产化肥,故B为(NH4)2SO4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第三章 第四节 沉淀溶解平衡
第2课时 沉淀溶解平衡的应用
【学习目标】
1.通过实验探究,了解沉淀的生成、溶解与转化。
2.能够根据化学平衡原理分析沉淀的生成、溶解与转化。
3.能举例说明沉淀溶解平衡在生产、生活中的应用。能运用沉淀溶解平衡原理,分析和解决生产、生活中有关的实际问题。
【素养目标】
5.能设计简单的实验方案验证沉淀的生成、溶解与转化,完成实验操作,观察现象,对实验现象作出解释,发现和提出需要进一步研究的问题。培养学生“科学探究与创新意识”的学科素养。
6.通过沉淀的生成、溶解与转化在生产、生活和科学研究中的应用,认识化学对人类做出的重大贡献。培养学生“科学态度与社会责任”的学科素养。
必备知识与关键能力
知识点一:沉淀的生成
1.沉淀生成时沉淀剂的选择原则
(1)使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。
(2)不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。
2.常用的沉淀方法
(1)调节pH法
通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。如用CuO调节CuCl2溶液(含Fe3+)的酸碱性以除去Fe3+。
(2)直接沉淀法 通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。
方法 举例 解释
调节pH法 除去CuCl2溶液中的FeCl3,可向溶液中加入CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3] CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至4左右 Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
沉淀剂法 以H2S、Na2S等沉淀污水中的Hg2+、Cu2+等重金属离子 H2S、Na2S与Cu2+、Hg2+反应生成沉淀
知识点二:沉淀的溶解
沉淀溶解时的关键步骤是加入的试剂能与产生沉淀的离子发生反应,生成挥发性物质(气体)或弱电解质(弱酸、弱碱或水),使平衡向沉淀溶解的方向移动,使沉淀溶解的常用方法主要有四种:①酸溶解法②盐溶液溶解法③氧化还原溶解法④配位溶解法。
1.酸溶解法
如CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
2.盐溶液溶解法
如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH===Mg2++2NH3·H2O。
实验:氢氧化镁沉淀在蒸馏水、盐酸、氯化铵溶液中的溶解
实验名称 氢氧化镁沉淀在蒸馏水、盐酸、氯化铵溶液中的溶解
实验装置
实验原理 氢氧化镁难溶于水,但与酸反应,溶于酸性溶液。NH4Cl水解显酸性,能溶解氢氧化镁。
实验用品 蒸馏水、盐酸、氯化铵溶液、氢氧化镁固体;三支试管、胶头滴管。
实验步骤 ①取三支干燥的试管,分别加入等量的氢氧化镁固体。 ②分别向三支试管中依次加入蒸馏水、盐酸、氯化铵溶液,充分振荡,观察沉淀的溶解情况。
实验现象 氢氧化镁中加入蒸馏水沉淀量无明显减少;氢氧化镁中加入盐酸溶液,沉淀迅速完全溶解,得无色溶液;氢氧化镁中加入氯化铵溶液,沉淀完全溶解,得无色溶液。
实验结论 ①氢氧化镁溶于酸和酸性溶液。在含有难溶物氢氧化镁的溶液中存在溶解平衡,加入酸或酸性溶液能促进沉淀的溶解。 ②加入能与沉淀溶解所产生的离子发生反应的试剂,生成挥发性物质或弱电解质而使溶解平衡向溶解的方向移动。
3.氧化还原溶解法
如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
4.配位溶解法
如AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
知识点一:沉淀的转化
(1)实质:沉淀溶解平衡的移动。
(2)举例:MgCl2溶液Mg(OH)2Fe(OH)3,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
(3)规律:一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,但溶解度小的沉淀在一定条件下,也能转化为溶解度稍大的沉淀。
(4)应用
锅炉除水垢 将CaSO4转化为CaCO3,离子方程式为CaSO4+CO===CaCO3+SO
矿物转化 CuSO4溶液遇ZnS转化为CuS,离子方程式为ZnS+Cu2+===CuS+Zn2+
(5)实验:氯化银、碘化银、硫化银沉淀的转化
实验名称 氯化银、碘化银、硫化银沉淀的转化
实验装置
实验原理 Ag+ +Cl ===AgCl↓, AgCl+I ===AgI+Cl ,2AgI+S2 ===Ag2S+2I
实验用品 0.1 mol/L AgNO3溶液、0.1 mol/L NaCl溶液、0.1 mol/L KI溶液、0.1 mol/L Na2S溶液;试管、胶头滴管。
实验步骤 ①向盛有10滴0.1 mol/L AgNO3溶液试管中滴加0.1 mol/L NaCl溶液,至不再有白色沉淀生成。 ②向上述固液混合物中滴加适量0.1 mol/L KI溶液,直到沉淀颜色不再改变为止,观察并记录现象。 ③向上支试管中滴加0.1 mol/L Na2S溶液,直到到沉淀颜色不再改变为止,观察并记录现象。
实验现象 ①NaCl溶液和AgNO3溶液混合产生白色沉淀。 ②向所得固液混合物中滴加KI溶液,沉淀颜色逐渐变成黄色。 ③再向所得固液混合物中滴加Na2S溶液,沉淀颜色逐渐变成黑色。
实验结论 ①溶解度由大到小的顺序为: AgCl>AgI>Ag2S [或Ksp(AgCl)>Ksp(AgI),因沉淀类型不同通常不能比较Ksp(AgCl)、Ksp(AgI)与Ksp(Ag2S)的大小]。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。
实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如Ag+)不能过量。
实验:氢氧化镁、氢氧化铁沉淀的转化
实验名称 氢氧化镁、氢氧化铁沉淀的转化
实验装置
实验原理 Mg2++2OH ===Mg(OH)2↓,3Mg(OH)2+2Fe3+===3Mg2++2Fe(OH)3
实验用品 0.1 mol/L MgCl2溶液、0.1 mol/L FeCl3溶液、2 mol/L NaOH溶液;试管、量筒、胶头滴管
实验步骤 向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1 2滴2 mol/L NaOH溶液,再滴加2滴 0.1 mol/L FeCl3溶液,静置,观察并记录现象。
实验现象 MgCl2溶液中加入NaOH得到白色沉淀,再加入FeCl3后,沉淀逐渐变为红褐色。
实验结论 ①溶解度由大到小的顺序为:Mg(OH)2>Fe(OH)3 (因沉淀类型不同通常不能比较两者Ksp的大小)。 ②溶解度小的沉淀会转化成溶解度更小的沉淀,且两者差别越大,转化越容易。
实验说明 利用沉淀的转化探究沉淀的溶解度大小时,与多个沉淀均相关的离子(如OH )不能过量。
【点拨】(1)要能除去溶液中的指定离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子要便于除去,如沉淀KNO3溶液中的Ag+,可用KCl作沉淀剂,而不能选用NaCl。
(2)溶液中沉淀物的溶解度越小,离子沉淀越完全,如沉淀Ca2+,可将Ca2+转化为CaCO3、CaSO4,因CaSO4是微溶物,不如CaCO3的溶解度小,因此转化为CaCO3沉淀时除去得更完全。
(3)要注意沉淀剂的电离程度,如使Mg2+转化为Mg(OH)2沉淀时,用NaOH溶液作沉淀剂要比用氨水的效果好。
典例1.已知:Ksp(CuS)=1.3×10-36,Ksp(MnS)=2.6×10-13。工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列说法错误的是( )
A.反应达平衡后,继续加入MnS,废水中的Cu2+的去除率增加
B.该反应可将工业废水中的Cu2+沉淀完全
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=2.0×1023
【答案】A
【解析】 A项,达到平衡后,增加MnS的使用量,平衡不移动,废水中的Cu2+的去除率不再改变,故错误;B项,利用此反应可将工业废水中的Cu2+沉淀完全,故正确;C项,c(Cu2+)增大,平衡正向移动,所以c(Mn2+)变大,故正确;D项,该反应的平衡常数K===2.0×1023,故正确。
典例2.已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S===CuS↓+2H+
C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑
D.FeS+2H+===Fe2++H2S↑
【答案】C
【解析】因为溶解度:Zn(OH)2>ZnS,溶液中离子反应往往是生成更难溶的物质,则Zn2+和S2-结合时更容易生成ZnS,Zn2++S2-===ZnS↓,C项错误。其他选项所产生的沉淀均为所有可能沉淀中溶解度最小的,符合平衡原理。
核心价值与学科素养
典例3.“钡餐”是一种造影剂,用于在X线照射下显示消化道有无病变。可溶性钡盐有毒,医院中常用硫酸钡(俗称“钡餐”)作为内服造影剂,其不溶于水和脂质,所以不会被胃肠道黏膜吸收,因此对人基本无毒性。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是( )
A.BaCO3的溶度积常数表达式为 Ksp(BaCO3)=n(Ba2+)·n(CO)
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
【答案】B
【解析】溶度积常数为离子浓度幂之积,BaCO3的溶度积常数表达式为Ksp(BaCO3)=c(Ba2+)·c(CO),故A错误;根据公式c=得,2%~5%的Na2SO4溶液中Na2SO4的物质的量浓度为0.13 mol·L-1~0.33 mol·L-1,用0.13 mol·L-1~0.33 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)在 mol·L-1~ mol·L-1之间,浓度很小,可起到解毒的作用,故B正确;c(Ba2+)=1.0×10-5 mol·L-1的溶液中钡离子浓度很小,不会引起钡离子中毒,故C错误;因胃酸可与CO反应生成水和二氧化碳,使CO浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO(aq)向溶解方向移动,使Ba2+浓度增大,会引起Ba2+中毒,故不用碳酸钡作为内服造影剂,与Ksp大小无关,故D错误。
典例4.磷酸钙用于制造乳色玻璃、陶瓷、涂料、媒染剂、药物、肥料、家畜饲料添加剂、糖浆澄清剂、塑料稳定剂等。磷酸钙容易形成结石。
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.0×10-6mol·L-1,c(PO)=2.0×10-6mol·L-1,则Ca3(PO4)2的Ksp为( )
A.2.0×10-29 B.3.2×10-29
C.6.3×10-18 D.5.1×10-27
【答案】B
【解析】Ca3(PO4)2(s)3Ca2+(aq)+2PO(aq),所以Ca3(PO4)2的Ksp=c3(Ca2+)·c2(PO)=(2.0×10-6)3×(2.0×10-6)2=3.2×10-29。
典例5.锅炉内如结有水垢会产生以下危害:(1)锅炉钢板、管路因过热而被烧损;(2)燃料大量浪费;(3)增加锅炉检修量;(4)威胁人身安全。
某学习小组欲探究使CaSO4沉淀转化为CaCO3沉淀,从而将其除去的可能性,查得如下资料(25 ℃):
难溶电解质 CaCO3 CaSO4
Ksp 3.4×10-9 4.9×10-5
实验步骤如下:
①向100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成;
②向上述悬浊液中加入3 g Na2CO3固体,搅拌,静置,沉淀后弃去上层清液;
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液;
④ 。
请思考下列问题:
(1)题给的两种物质,Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式: 。
(3)设计第③步操作的目的是什么? 。
(4)请补充第④步操作及发生的现象 。
(5)请写出该转化在实际生活中的一个应用 。
【答案】(1)大 (2)Na2CO3+CaSO4Na2SO4+CaCO3 (3) 洗去沉淀中附着的SO
(4) 向沉淀中加入足量的稀盐酸,沉淀完全溶解
(5) 将锅炉水垢中的CaSO4转化为CaCO3,易于除去
【解析】对于类型相同的难溶物,相同条件下,Ksp越大,其溶解度越大。在CaSO4悬浊液中存在溶解平衡:CaSO4(s)Ca2+(aq)+SO(aq),而加入Na2CO3固体后,溶液中CO浓度较大,而CaCO3的Ksp较小,故CO与Ca2+结合生成沉淀,即CO+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③、④步操作,即验证所得固体是否为CaCO3。然后联系实际生活中除去锅炉水垢的方法,即可解答第(5)小题。
【跟踪练习】 基础过关
1. 已知常温下CaCO3的Ksp=3.4×10-9,CaSO4的Ksp=4.9×10-5,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,下列说法正确的是( )
A.只产生CaCO3沉淀
B.产生等量的CaCO3和CaSO4沉淀
C.产生的CaSO4沉淀更多
D.产生的CaCO3沉淀更多
【答案】C
【解析】二者都是AB型钙盐,其溶度积常数越大溶解度越大,将CaCO3与CaSO4的饱和溶液等体积混合,再加入足量浓CaCl2溶液,溶度积常数大的物质生成的沉淀越多,根据题干信息知,溶度积常数:CaCO3
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D.都是难溶盐,溶解度无意义
【答案】C
【解析】AgCl和Ag2CrO4的阴、阳离子配比类型不同,不能直接利用Ksp来比较二者溶解能力的大小,所以只有C项正确;其余三项叙述均错误。若用溶度积比较溶解度大小,必须是同类型的难溶电解质,否则不能直接比较。
3. 某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
【答案】D
【解析】A项,加入AgNO3,c(Ag+)增大,c(Cl-)减小,而c、d点c(Cl-)相同,错误;B项,加入少量水,平衡右移,但c(Cl-)不变,错误;C项,d点处c(Ag+)大,此时c(Ag+)和c(Cl-)乘积大于溶度积,有氯化银沉淀生成,错误;D项,温度不变,Ksp不变,a、c点是相同温度下的溶解沉淀平衡曲线上的点,Ksp相同,正确。
4. 某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.a点对应的Ksp大于b点对应的Ksp
B.向CuSO4溶液中加入MnS发生反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中,c(Cu2+)∶c(Mn2+)=(2×10-23)∶1
D.该温度下,Ksp(CuS)小于Ksp(MnS)
【答案】A
【解析】因为a点和b点都在CuS的沉淀溶解平衡曲线上,Ksp是定值,A错误;因为Ksp(CuS)
c(Ag+)和c(Cl-)的乘积是一个常数,Ksp=c(Ag+)·c(Cl-)=1×10-10,则:
(1)生成沉淀后溶液中c(Ag+)是 。
(2)沉淀生成后溶液的pH是 。
【答案】(1) 1×10-7mol·L-1 (2) 2
【解析】(1)c(Cl-)==1×10-3 mol·L-1,则c(Ag+)= mol·L-1=1×10-7 mol·L-1。
(2)沉淀前后n(H+)不变,则c(H+)==0.01 mol·L-1,故pH=2。
折 能力达成
6. 工业上常先以MnO2为原料制得粗MnCl2溶液,通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,下列分析正确的是( )
A.MnS的Ksp小于CuS、PbS、CdS等硫化物的Ksp
B.除杂试剂MnS也可用FeS代替
C.MnS与Cu2+反应的离子方程式是Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)
D.整个过程中涉及的反应类型只有复分解反应
【答案】C
【解析】通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,属于沉淀的转化,由难溶的物质转化为更难溶的物质,MnS的Ksp大于CuS、PbS、CdS等硫化物的Ksp,A错误;除杂试剂MnS如用FeS代替,会引入新的杂质,B错误;MnS与Cu2+反应的离子方程式为Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),C正确;工业上以MnO2制MnCl2,锰元素化合价发生变化,属于氧化还原反应,沉淀的转化属于复分解反应,D错误。
7. (1)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH—(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降低为10-5 mol·L-1,溶液的pH应调至________。
(2)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_____ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.10 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________ mol·L-1。
【答案】(1) 5 (2) 2.2×10-8 0.20
【解析】(1) Ksp=c(Cr3+)·c3(OH-)=10-32,则c(OH-)== mol·L-1=10-9 mol·L-1,c(H+)==mol·L-1=10-5 mol·L-1,pH=–lg c(H+)=–lg 10-5=5。
(2) pH=8时c(OH–)=10-6 mol·L-1,由氢氧化铜的溶度积常数可知:Ksp=2.2×10-20=10-12 ×c(Cu2+),得c(Cu2+)=2.2×10-8 mol·L-1;使Cu2+完全沉淀为CuS,已知c(Cu2+)=0.10 mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.20 mol·L-1。
8. 某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废弃物综合利用,方案如图所示:
各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 开始沉淀时的pH 完全沉淀时的pH
Fe2+ 6.34 9.7
Fe3+ 1.48 3.2
Zn2+ 6.2 8.0
请回答下列问题:
(1)加入A物质的目的是 ,物质A可使用下列物质中的 (填字母)。
A.酸性KMnO4溶液 B.O2 C.H2O2溶液 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式为 。
(4)除铁过程中加入氨水的目的是调节溶液的pH,应控制pH的范围是 。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式: 。
(6)物质B可用于生产化肥,其化学式是 。
【答案】(1)将Fe2+氧化成Fe3+,方便后续生成沉淀除去 BC (2)<
(3)Fe+Cu2+===Fe2++Cu (4)3.2≤pH<6.2
(5)2Zn2++4HC===Zn2(OH)2CO3↓+H2O+3CO2↑ (6)(NH4)2SO4
【解析】(1)根据表中数据可知Fe3+易被除去,将Fe2+氧化成Fe3+,以便除去;除铁过程中加入A和氨水,使Fe2+变成Fe(OH)3沉淀,故A应为氧化剂,为不引入新的杂质,应选BC。
(2)相同条件下,溶解度大的物质先溶解,结合在H2SO4作用下ZnS可溶解而CuS不溶,则相同温度下:Ksp(CuS)
(4)从表中数据可知,Fe3+沉淀完全时pH=3.2,Zn2+开始沉淀时pH=6.2,故除铁时应控制pH的范围是3.2≤pH<6.2。
(5)NH4HCO3溶液与Zn2+反应的离子方程式为2Zn2++4HC===H2O+Zn2(OH)2CO3↓+3CO2↑。
(6)因所用废酸为硫酸,B又可用于生产化肥,故B为(NH4)2SO4。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
