3.2 水的电离和溶液的pH(第1课时 水的电离 溶液的酸碱性与pH)(解析版)
文档属性
| 名称 | 3.2 水的电离和溶液的pH(第1课时 水的电离 溶液的酸碱性与pH)(解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第三章 第二节 水的电离和溶液的pH
第1课时 水的电离 溶液的酸碱性与pH
【学习目标】
1.认识水的电离,水是一种极弱的电解质。
2.结合电离常数,了解水的离子积常数,其适用于任何水溶液。
3.结合实例,能判断溶液的酸碱性及pH,掌握检测溶液pH的方法。
4.能进行溶液pH的简单计算,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
【素养目标】
1.能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性,培养“宏观辨识与微观探析”学科素养。
2.能从电离平衡的角度,理解外界条件对水的电离平衡的影响,解释溶液酸碱性的变化,培养“变化观念与平衡思想”
3.理解水的离子积常数,形成认知模型,能够运用水的离子积常数进行有关计算及判断,培养“证据推理与模型认知”学科素养。
必备知识与关键能力
知识点一:水的电离
1.水的电离
(1)水是极弱的电解质,水的电离方程式为H2O+H2OH3O++OH-或简写为H2OH++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7mol·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
2.水的离子积常数 (Kw)
(1)含义:因为水的浓度可看作常数,所以水中的c(H+)·c(OH-)可看作常数,称为水的离子积常数,简称水的离子积,用Kw表示。
(2)表达式与数值:表达式Kw=c(H+)·c(OH-),常温时,Kw=1.0×10-14。
(3)影响因素:Kw只受温度影响,由于水的电离是吸热过程,温度升高,Kw增大。
【点拨】对于酸、碱、盐的稀溶液中,c(H2O)也可认为是定值。Kw=c(H+)·c(OH-),但c(H+)、c(OH-)为溶液中的浓度,不一定都是水电离出来的。
理解Kw应注意的几个问题
(1)Kw揭示了在任何水溶液中均存在水的电离平衡,H+和OH-共存,只是相对含量不同而已。
(2)Kw只与温度有关。因为水的电离是吸热过程,所以温度升高,有利于水的电离,Kw增大,如100 ℃,Kw=5.45×10-13。但是在室温下,Kw为1.0×10-14。
(3)Kw不仅适用于纯水,还适用于酸、碱的稀溶液,且由水电离的c水(H+)=c水(OH-)。此时,水溶液中水的离子积常数不变。
3.外界条件对水的电离平衡的影响
改变条件 平衡移动方向 Kw 水的电离程度 c(OH-) c(H+)
HCl 逆 不变 减小 减小 增大
NaOH 逆 不变 减小 增大 减小
Na2CO3 正 不变 增大 增大 减小
NH4Cl 正 不变 增大 减小 增大
NaHSO4 逆 不变 减小 减小 增大
加热 正 增大 增大 增大 增大
典例1.水是最宝贵的资源之一。下列表述正确的是( )
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
【答案】C
【解析】25 ℃时,纯水的pH=7,4 ℃时,纯水的电离程度减小,pH稍大于7,A错误;温度升高,水的电离平衡向右移动,c(H+)与c(OH-)均增大,B错误;水是一种极弱的电解质,电离程度很小,25 ℃时,纯水电离出的H+浓度只有1.0×10-7 mol·L-1,纯水中主要存在形态是水分子,C正确;水的离子积不受溶液酸碱性的影响,D错误。
典例2.在相同温度下,0.01 mol·L-1的NaOH溶液和0.01 mol·L-1的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(H+)相等
B.由水电离出的c(H+)都是1.0×10-12 mol·L-1
C.由水电离出的c(OH-)都是0.01 mol·L-1
D.两者都促进了水的电离
【答案】A
【解析】A项,二者c(H+)、c(OH-)相同,对水电离抑制程度相同;B、C项,没有告诉温度,Kw不知,无法求水电离出的c(H+)H2O、c(OH-)H2O;D项,二者均抑制水电离。
知识点二:溶液的酸碱性与pH
1.溶液的酸碱性 pH概念
(1)pH计算公式:pH=-lg_c(H+)。
(2)溶液呈酸碱性的本质:溶液的酸碱性取决于c(H+)和c(OH-)的相对大小
溶液的酸碱性 c(H+)与c(OH-)比较 常温下溶液pH
酸性溶液 c(H+)>c(OH-) <7
中性溶液 c(H+)=c(OH-) =7
碱性溶液 c(H+)<c(OH-) >7
(3)溶液的酸碱性与pH的关系(常温下)
2.pH的测定
(1)酸碱指示剂法
该法只能测其pH的大致范围,常见指示剂变色范围如下表:
指示剂 变色范围的pH
石蕊 <5.0 红色 5.0~8.0 紫色 >8.0 蓝色
甲基橙 <3.1 红色 3.1~4.4 橙色 >4.4 黄色
酚酞 <8.2 无色 8.2~10.0 浅红色 >10.0 红色
(2)pH试纸法
用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照。
(3)pH计测定
3.pH计算
(1)单一溶液的pH计算
强酸溶液 如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc
强碱溶液(25 ℃) 如B(OH)n,设浓度为c mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg nc
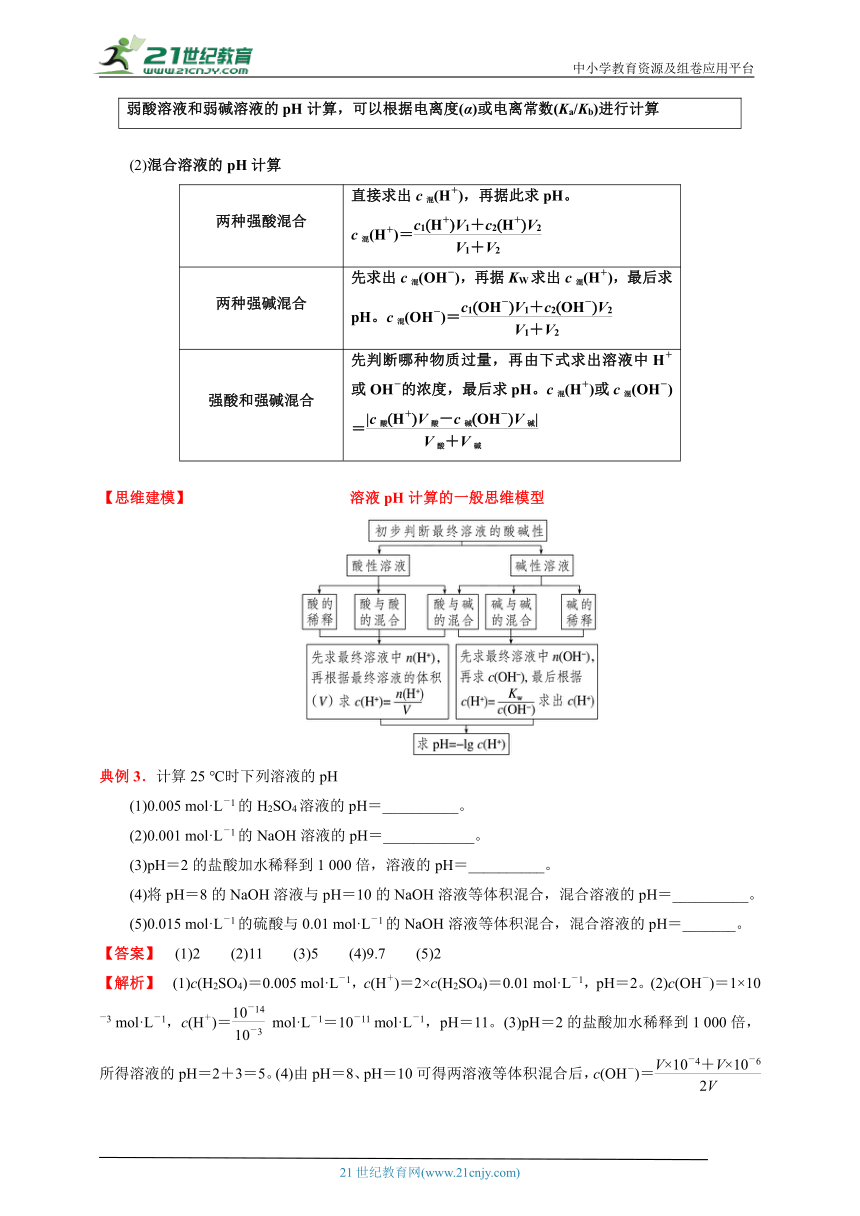
弱酸溶液和弱碱溶液的pH计算,可以根据电离度(α)或电离常数(Ka/Kb)进行计算
(2)混合溶液的pH计算
两种强酸混合 直接求出c混(H+),再据此求pH。 c混(H+)=
两种强碱混合 先求出c混(OH-),再据KW求出c混(H+),最后求pH。c混(OH-)=
强酸和强碱混合 先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c混(H+)或c混(OH-)=
【思维建模】 溶液pH计算的一般思维模型
典例3.计算25 ℃时下列溶液的pH
(1)0.005 mol·L-1的H2SO4溶液的pH=__________。
(2)0.001 mol·L-1的NaOH溶液的pH=____________。
(3)pH=2的盐酸加水稀释到1 000倍,溶液的pH=__________。
(4)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合,混合溶液的pH=__________。
(5)0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH=_______。
【答案】 (1)2 (2)11 (3)5 (4)9.7 (5)2
【解析】 (1)c(H2SO4)=0.005 mol·L-1,c(H+)=2×c(H2SO4)=0.01 mol·L-1,pH=2。(2)c(OH-)=1×10-3 mol·L-1,c(H+)= mol·L-1=10-11 mol·L-1,pH=11。(3)pH=2的盐酸加水稀释到1 000倍,所得溶液的pH=2+3=5。(4)由pH=8、pH=10可得两溶液等体积混合后,c(OH-)= mol·L-1=×10-6 mol·L-1,c(H+)= mol·L-1≈ 2.0×10-10 mol·L-1,pH≈9.7。(5)混合后c(H+)= mol·L-1=0.01 mol·L-1,则pH=2。
典例4.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
【答案】C
【解析】将pH=1的盐酸加适量水,pH升高了1,说明所加的水是原溶液的9倍;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH升高了1,则10-1×1-10-1·x=10-2·(1+x),解得x=,则加入的水与NaOH溶液的体积比为9∶=11∶1。
4.溶液酸、碱性的两种判断方法
(1)根据pH、pOH、p进行判断
pH其中:pOH=-lg c(OH-),p=-lg,pH+pOH=2p。
(2)室温下,已知酸和碱pH之和的溶液等体积混合酸碱性分析
①两强混合
a.若pH之和等于14,则混合后溶液显中性,pH=7。
b.若pH之和大于14,则混合后溶液显碱性,pH>7。
c.若pH之和小于14,则混合后溶液显酸性,pH<7。
②一强一弱混合——“谁弱显谁性”
pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元强碱和一元弱酸等体积混合呈酸性。
(3)酸碱混合呈中性的定量关系
25 ℃,pH=a的强酸溶液与pH=b的强碱溶液,按V1∶V2的体积比混合,混合液呈中性。V1、V2与a、b的定量关系为==10-14+a+b。
典例5.用“碱性”“酸性”“中性”或“不确定”填空。
(1)pH<7的溶液________。
(2)水电离出的c(H+)=1×10-4mol·L-1的溶液______。
(3)pH=0的溶液(25 ℃)________。
(4)25 ℃时,=1×10-10mol·L-1的溶液________。
(5)KW=1×10-13时,pH=7的溶液________。
(6)相同浓度的HCl和NaOH溶液等体积混合________。
(7)25 ℃时,相同浓度NH3·H2O和HCl溶液等体积混合________。
(8)25 ℃时pH=2的HCl和pH=12的NaOH溶液等体积混合________。
(9)25 ℃时pH=2的CH3COOH和pH=12的NaOH溶液等体积混合________。
(10)25 ℃时,pH=2的HCl和pH=12的NH3·H2O等体积混合________。
【答案】(1)不确定 (2)不确定 (3)酸性 (4)酸性 (5)碱性 (6)中性
(7)酸性 (8)中性 (9)酸性 (10)碱性
5.酸碱溶液稀释时pH的变化可用数轴表示。
①强酸、弱酸溶液的稀释:
②强碱、弱碱溶液的稀释:
③变化趋势:
对于pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大(如下图所示)。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)物质的量(水电离的除外)不会增多,而弱酸(或弱碱)随着加水稀释,电离程度增大,H+(或OH-)物质的量会不断增多。
知识点三:水的电离曲线
正确理解水的电离平衡曲线
(1)曲线上的任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。
(2)曲线外的任意点与曲线上任意点的Kw不同,温度不同。
(3)实现曲线上点之间的转化需保持温度相同,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。
典例6.25 ℃时,水溶液中c(H+)与c(OH-)的变化关系如图所示,下列判断错误的是( )
A.ac曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.bd线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25 ℃,pH<7
D.c点溶液不可能是盐溶液
【答案】D
【解析】ac曲线上的任意一点,由于温度相同,所以水的离子积常数相同,根据b点可知,
c(H+)·c(OH-)=10-14,A项正确;bd线段上任意一点都满足c(H+)=c(OH-),溶液一定呈中性,B项正确;d点时,c(H+)=c(OH-)=1×10-6 mol·L-1>1×10-7 mol·L-1,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25 ℃,C项正确;在c点c(H+)=1×10-8 mol·L-1,c(OH-)=1×10-6 mol·L-1,溶液显碱性,而醋酸钠溶液显碱性,所以c点可能为醋酸钠溶液,D项错误。
典例7.水的电离平衡曲线如图所示,回答下列问题。
(1)图中A、B、C、D、E五点Kw间的关系:___________________。
(2)在水中加少量酸,可实现A点向____________点移动。
(3)ABE形成的区域中的点都呈现__________性。
(4)若在B点温度下,pH=2的硫酸溶液中,=________ mol·L-1。
【答案】 (1)B>C>A=E=D (2)D (3)碱 (4)1×10-10
核心价值与学科素养
pH的应用
应用领域 实例
人体健康 人体的各种体液都有一定的pH,当酸碱平衡失调时,人体就表现出病变,因而可以利用检测血液中的pH诊断疾病
生活应用 利用护发素保护头发,就是通过调节头发的pH使之达到适宜的酸碱度
环保领域 酸性或碱性的废水,可以利用中和反应调节pH
农业生产 土壤的pH影响植物对养分的吸收及养分的有效性,各种作物的生长也都对土壤的pH范围有一定的要求,因而应注意保持土壤的酸碱性
科学实验、工业生产 溶液的pH控制常常是影响实验结果或产品质量、产量的一个关键因素
典例8.柠檬是有药用价值的水果之一,对人体十分有益。鲜柠檬维生素含量极为丰富,是美容的天然佳品,能防止和消除皮肤色素沉着,具有美白作用。已知在常温下柠檬水中的c(OH-)=1×10-11 mol/L,则其pH等于( D )
A.11 B.7 C.5 D.3
【解析】c(OH-)=10-11mol/L,则c(H+)===1×10-3 mol/L,pH=3。
典例9.科学家利用太空望远镜首次探测到木星二喷出的羽状物是水蒸气,而这些羽状物的源头证实在它的冰壳下隐藏着一个巨大的咸海洋。
水是最宝贵的资源之一。若在木星二上某地,水的离子积常数Kw=1.0×10-12。
(1)利用我们的地球经验,木星二该地的温度 25 ℃(填“大于”“小于”或“等于”),其理由是 。
(2)已知水中存在如下平衡:H2O+H2OH3O++OH- ΔH>0,现欲使平衡向左移动,且所得溶液呈酸性,选择的方法是 (填字母)。
A.向水中加入NaHSO4 B.向水中加入NaCl
C.加热水至100 ℃ D.在水中加入KOH
(3)水蒸气和沸水的温度都是100 ℃,现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 性(填“酸”“碱”或“中”);若用pH计测定,则pH 7(填“>”“=”或“<”),溶液呈 性(填“酸”“碱”或“中”)。
【答案】(1) 大于 Kw随温度升高而增大 (2) A (3) 淡黄 中 < 中
【解析】(1)Kw随温度升高而增大,温度高于25 ℃。(2)向水中加入NaHSO4,c(H+)增大,平衡向左移动,A正确;向水中加入NaCl对水的电离平衡无影响,平衡不移动,B错误;加热平衡向右移动,仍呈中性,C错误;在水中加入KOH,c(OH-)增大,平衡向左移动,但溶液呈碱性,D错误。(3)100 ℃时水的pH<7,但溶液仍呈中性,因此pH试纸仍为黄色。
典例10.工业废水的种类很多,其中酸碱废水是常见的工业废水,主要来自钢铁厂、化工厂、染料厂、印染厂、皮革厂、造纸厂、炼油厂等。酸碱废水具有较强的腐蚀性,需经适当治理方可外排。治理酸碱废水一般原则是高浓度酸碱废水,应优先考虑回收利用,可采用浓缩的方法回收酸碱。低浓度的酸碱废水,如酸洗槽的清洗水,碱洗槽的漂洗水,应进行中和处理。
(1)常温下,甲酸性废水的pH是4,乙酸性废水的pH是5,则甲与乙的c(OH-)之比为 。
(2)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11。
①该温度下水的离子积常数Kw= 。
②在此温度下,已知碱性废水与酸性废水完全电离,将pH=a的碱性废水Va L与pH=b的酸性废水Vb L混合。
若所得混合液为中性,且a=12,b=2,则Va∶Vb= ;若所得混合液为中性,且a+b=12,则Va∶Vb= 。
【答案】(1) 1∶10 (2) ①10-13 ②1∶10 10∶1
【解析】(1)常温下,水的离子积常数Kw=10-14,甲的pH是4,c(H+)=10-4mol·L-1,则c(OH-)=10-10mol·L-1;乙的pH是5,c(H+)=10-5mol·L-1,则c(OH-)=10-9mol·L-1。所以甲与乙的c(OH-)之比为10-10mol·L-1∶10-9mol·L-1=1∶10。
(2)①由题意知,溶液中c(H+)=10-11mol·L-1,c(OH-)=0.01 mol·L-1,故Kw=c(H+)·c(OH-)=10-13。
②根据中和反应:H++OH-===H2O
c(H+)·V酸=c(OH-)·V碱 10-2·Vb=10-13/10-12·Va,则=1∶10
若所得混合液为中性,且a+b=12,==1013-a-b=10,则Va∶Vb=10∶1。
【跟踪练习】 基础过关
1. 已知常温下0.01 mol·L-1 CH3COOH溶液中c(H+)=4.32×10-4 mol·L-1,则该CH3COOH溶液中水的离子积常数( )
A.<1×10-14 B.>1×10-14
C.=1×10-14 D.无法确定
【答案】C
【解析】水的离子积常数仅仅是温度的函数,只要温度不变,水的离子积常数不变,在常温下,Kw=1×10-14,而与电解质溶液及其电离程度无关,故选C。
2. 下列溶液一定显酸性的是( )
A.溶液中c(OH-)>c(H+) B.滴加紫色石蕊试液后变红色的溶液
C.溶液中c(H+)=10-6 mol·L-1 D.pH<7的溶液
【答案】B
【解析】判断溶液的酸碱性关键看c(H+)和c(OH-)相对大小,若c(H+)>c(OH-),溶液呈酸性;而pH<7或c(H+)<10-7 mol·L-1,仅适用于常温时,若温度不确定,就不能用来判断溶液的酸碱性,而B项中可使紫色石蕊试液变红,则该溶液为酸性。
3. 常温下,关于溶液稀释的下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
【答案】C
【解析】A项,pH=3的醋酸溶液在稀释过程中电离平衡正向移动,稀释100倍时,34. 如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
【答案】B
【解析】依据曲线的起点可判断盐酸和NaOH溶液的浓度均为0.1 mol·L-1,曲线a为NaOH滴定盐酸的滴定曲线,曲线b为盐酸滴定NaOH的滴定曲线,强酸与强碱的中和滴定既可用甲基橙也可用酚酞作指示剂。
5. 如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.温度:T1<T2
D.XZ线上任意点均有pH=7
【答案】D
【解析】温度越高,水的电离程度越大,电离出的c(H+)与c(OH-)越大,所以T2>T1,C项正确;XZ线上任意点都有c(H+)=c(OH-),只有当c(H+)=10-7 mol·L-1时,才有pH=7,D项错误。
能力达成
6. 某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( )
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
【答案】B
【解析】25 ℃时,若测得0.01 mol·L-1NaR溶液pH=7,可知NaR为强酸强碱盐,则HR为强酸,A错误;25 ℃时,若测得0.01 mol·L-1HR溶液pH>2且pH<7,可知溶液中c(H+)<0.01 mol·L-1,HR未完全电离,所以HR为弱酸,B正确;假设HR为强酸,取pH=6的该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得此时溶液pH<7,C错误;假设HR为强酸,则NaR为强酸强碱盐,溶液呈中性,升温至50 ℃,促进水的电离,水的离子积常数增大,pH减小,D错误。
7.按要求计算下列各题(常温下,忽略溶液混合时体积的变化):
(1)25 ℃时,pH=3的硝酸和pH=12的氢氧化钡溶液按照体积比为9∶1混合,混合溶液的pH=________。
(2)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是__________。
(3)将pH=a的NaOH溶液Va L与pH=b的稀盐酸Vb L混合,若所得溶液呈中性,且a+b=13,则=__________。
【答案】(1)10 (2)1∶4 (3)10
【解析】(1)pH=3的硝酸溶液中c(H+)=10-3 mol·L-1,pH=12的Ba(OH)2溶液中c(OH-)= mol·L-1=10-2 mol·L-1,二者以体积比9∶1混合,Ba(OH)2过量,溶液呈碱性,混合溶液中c(OH-)==1×10-4 mol·L-1,则混合后c(H+)== mol·L-1=1×10-10 mol·L-1,故pH=10。
(2)设氢氧化钡溶液的体积为V1 L,硫酸氢钠溶液的体积为V2 L,依题意知,n(Ba2+)=n(SO),由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=5×10-3V1 mol,=1×10-3 mol·L-1,则V1∶V2=1∶4。
(3)pH=a的NaOH溶液中c(OH-)=10a-14 mol·L-1,pH=b的稀盐酸中c(H+)=10-b mol·L-1,根据中和反应H++OH-===H2O,知c(OH-)·Va=c(H+)·Vb,===1014-(a+b),a+b=13,则=10。
8. (1)在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液。回答下列问题:
①若x+y=14,=________(填数值)。
②若x+y=13,=________(填数值)。
③若x+y>14,=____(表达式),且Vx____Vy(填“>”“<”或“=”)(题中x≤6,y≥8)。
(2)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知:Va<Vb和a=0.5b。请填写下列空白:
①a值可否等于3(填“可”或“否”) ,其理由是 。
②a值可否等于5(填“可”或“否”) ,其理由是 。
③a的取值范围是________________________。
【答案】(1)①1 ② ③10(x+y-14) >
(2)①否 a=3 b=6, 溶液呈酸性与题意的强碱溶液不符合
②否 a=5, b=10,满足恰好完全反应时nOH-=nH+,则有Va·10-a= Vb·10 b-14,
,从而可推出va>vb与题意va③
【解析】(1)Vx·10-x=Vy·10-(14-y),==10(x+y-14)。①若x+y=14,则=1。②若x+y=13,则=。③当x+y>14时,根据=10x+y-14,Vx>Vy。
(2)①若a=3,则b=6,溶液显酸性,与题意不符,故a≠3;②若a=5,则c(H+)=10-5mol·L-1,即b=10,c(OH-)=10-4 mol·L-1,Va∶Vb=10>1,与题意不符,故a≠5;③b>7,则2a>7,即a>,又Va∶Vb=10a+b-14<1,则3a<14,即a<,故<a<。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第三章 第二节 水的电离和溶液的pH
第1课时 水的电离 溶液的酸碱性与pH
【学习目标】
1.认识水的电离,水是一种极弱的电解质。
2.结合电离常数,了解水的离子积常数,其适用于任何水溶液。
3.结合实例,能判断溶液的酸碱性及pH,掌握检测溶液pH的方法。
4.能进行溶液pH的简单计算,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
【素养目标】
1.能从微观角度通过c(H+)和c(OH-)的相对大小判断溶液的酸碱性,同时从宏观角度通过pH计、pH试纸等判断溶液的酸碱性,培养“宏观辨识与微观探析”学科素养。
2.能从电离平衡的角度,理解外界条件对水的电离平衡的影响,解释溶液酸碱性的变化,培养“变化观念与平衡思想”
3.理解水的离子积常数,形成认知模型,能够运用水的离子积常数进行有关计算及判断,培养“证据推理与模型认知”学科素养。
必备知识与关键能力
知识点一:水的电离
1.水的电离
(1)水是极弱的电解质,水的电离方程式为H2O+H2OH3O++OH-或简写为H2OH++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7mol·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
2.水的离子积常数 (Kw)
(1)含义:因为水的浓度可看作常数,所以水中的c(H+)·c(OH-)可看作常数,称为水的离子积常数,简称水的离子积,用Kw表示。
(2)表达式与数值:表达式Kw=c(H+)·c(OH-),常温时,Kw=1.0×10-14。
(3)影响因素:Kw只受温度影响,由于水的电离是吸热过程,温度升高,Kw增大。
【点拨】对于酸、碱、盐的稀溶液中,c(H2O)也可认为是定值。Kw=c(H+)·c(OH-),但c(H+)、c(OH-)为溶液中的浓度,不一定都是水电离出来的。
理解Kw应注意的几个问题
(1)Kw揭示了在任何水溶液中均存在水的电离平衡,H+和OH-共存,只是相对含量不同而已。
(2)Kw只与温度有关。因为水的电离是吸热过程,所以温度升高,有利于水的电离,Kw增大,如100 ℃,Kw=5.45×10-13。但是在室温下,Kw为1.0×10-14。
(3)Kw不仅适用于纯水,还适用于酸、碱的稀溶液,且由水电离的c水(H+)=c水(OH-)。此时,水溶液中水的离子积常数不变。
3.外界条件对水的电离平衡的影响
改变条件 平衡移动方向 Kw 水的电离程度 c(OH-) c(H+)
HCl 逆 不变 减小 减小 增大
NaOH 逆 不变 减小 增大 减小
Na2CO3 正 不变 增大 增大 减小
NH4Cl 正 不变 增大 减小 增大
NaHSO4 逆 不变 减小 减小 增大
加热 正 增大 增大 增大 增大
典例1.水是最宝贵的资源之一。下列表述正确的是( )
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
【答案】C
【解析】25 ℃时,纯水的pH=7,4 ℃时,纯水的电离程度减小,pH稍大于7,A错误;温度升高,水的电离平衡向右移动,c(H+)与c(OH-)均增大,B错误;水是一种极弱的电解质,电离程度很小,25 ℃时,纯水电离出的H+浓度只有1.0×10-7 mol·L-1,纯水中主要存在形态是水分子,C正确;水的离子积不受溶液酸碱性的影响,D错误。
典例2.在相同温度下,0.01 mol·L-1的NaOH溶液和0.01 mol·L-1的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(H+)相等
B.由水电离出的c(H+)都是1.0×10-12 mol·L-1
C.由水电离出的c(OH-)都是0.01 mol·L-1
D.两者都促进了水的电离
【答案】A
【解析】A项,二者c(H+)、c(OH-)相同,对水电离抑制程度相同;B、C项,没有告诉温度,Kw不知,无法求水电离出的c(H+)H2O、c(OH-)H2O;D项,二者均抑制水电离。
知识点二:溶液的酸碱性与pH
1.溶液的酸碱性 pH概念
(1)pH计算公式:pH=-lg_c(H+)。
(2)溶液呈酸碱性的本质:溶液的酸碱性取决于c(H+)和c(OH-)的相对大小
溶液的酸碱性 c(H+)与c(OH-)比较 常温下溶液pH
酸性溶液 c(H+)>c(OH-) <7
中性溶液 c(H+)=c(OH-) =7
碱性溶液 c(H+)<c(OH-) >7
(3)溶液的酸碱性与pH的关系(常温下)
2.pH的测定
(1)酸碱指示剂法
该法只能测其pH的大致范围,常见指示剂变色范围如下表:
指示剂 变色范围的pH
石蕊 <5.0 红色 5.0~8.0 紫色 >8.0 蓝色
甲基橙 <3.1 红色 3.1~4.4 橙色 >4.4 黄色
酚酞 <8.2 无色 8.2~10.0 浅红色 >10.0 红色
(2)pH试纸法
用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照。
(3)pH计测定
3.pH计算
(1)单一溶液的pH计算
强酸溶液 如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc
强碱溶液(25 ℃) 如B(OH)n,设浓度为c mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg nc
弱酸溶液和弱碱溶液的pH计算,可以根据电离度(α)或电离常数(Ka/Kb)进行计算
(2)混合溶液的pH计算
两种强酸混合 直接求出c混(H+),再据此求pH。 c混(H+)=
两种强碱混合 先求出c混(OH-),再据KW求出c混(H+),最后求pH。c混(OH-)=
强酸和强碱混合 先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。c混(H+)或c混(OH-)=
【思维建模】 溶液pH计算的一般思维模型
典例3.计算25 ℃时下列溶液的pH
(1)0.005 mol·L-1的H2SO4溶液的pH=__________。
(2)0.001 mol·L-1的NaOH溶液的pH=____________。
(3)pH=2的盐酸加水稀释到1 000倍,溶液的pH=__________。
(4)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合,混合溶液的pH=__________。
(5)0.015 mol·L-1的硫酸与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH=_______。
【答案】 (1)2 (2)11 (3)5 (4)9.7 (5)2
【解析】 (1)c(H2SO4)=0.005 mol·L-1,c(H+)=2×c(H2SO4)=0.01 mol·L-1,pH=2。(2)c(OH-)=1×10-3 mol·L-1,c(H+)= mol·L-1=10-11 mol·L-1,pH=11。(3)pH=2的盐酸加水稀释到1 000倍,所得溶液的pH=2+3=5。(4)由pH=8、pH=10可得两溶液等体积混合后,c(OH-)= mol·L-1=×10-6 mol·L-1,c(H+)= mol·L-1≈ 2.0×10-10 mol·L-1,pH≈9.7。(5)混合后c(H+)= mol·L-1=0.01 mol·L-1,则pH=2。
典例4.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
【答案】C
【解析】将pH=1的盐酸加适量水,pH升高了1,说明所加的水是原溶液的9倍;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH升高了1,则10-1×1-10-1·x=10-2·(1+x),解得x=,则加入的水与NaOH溶液的体积比为9∶=11∶1。
4.溶液酸、碱性的两种判断方法
(1)根据pH、pOH、p进行判断
pH
(2)室温下,已知酸和碱pH之和的溶液等体积混合酸碱性分析
①两强混合
a.若pH之和等于14,则混合后溶液显中性,pH=7。
b.若pH之和大于14,则混合后溶液显碱性,pH>7。
c.若pH之和小于14,则混合后溶液显酸性,pH<7。
②一强一弱混合——“谁弱显谁性”
pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元强碱和一元弱酸等体积混合呈酸性。
(3)酸碱混合呈中性的定量关系
25 ℃,pH=a的强酸溶液与pH=b的强碱溶液,按V1∶V2的体积比混合,混合液呈中性。V1、V2与a、b的定量关系为==10-14+a+b。
典例5.用“碱性”“酸性”“中性”或“不确定”填空。
(1)pH<7的溶液________。
(2)水电离出的c(H+)=1×10-4mol·L-1的溶液______。
(3)pH=0的溶液(25 ℃)________。
(4)25 ℃时,=1×10-10mol·L-1的溶液________。
(5)KW=1×10-13时,pH=7的溶液________。
(6)相同浓度的HCl和NaOH溶液等体积混合________。
(7)25 ℃时,相同浓度NH3·H2O和HCl溶液等体积混合________。
(8)25 ℃时pH=2的HCl和pH=12的NaOH溶液等体积混合________。
(9)25 ℃时pH=2的CH3COOH和pH=12的NaOH溶液等体积混合________。
(10)25 ℃时,pH=2的HCl和pH=12的NH3·H2O等体积混合________。
【答案】(1)不确定 (2)不确定 (3)酸性 (4)酸性 (5)碱性 (6)中性
(7)酸性 (8)中性 (9)酸性 (10)碱性
5.酸碱溶液稀释时pH的变化可用数轴表示。
①强酸、弱酸溶液的稀释:
②强碱、弱碱溶液的稀释:
③变化趋势:
对于pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大(如下图所示)。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)物质的量(水电离的除外)不会增多,而弱酸(或弱碱)随着加水稀释,电离程度增大,H+(或OH-)物质的量会不断增多。
知识点三:水的电离曲线
正确理解水的电离平衡曲线
(1)曲线上的任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。
(2)曲线外的任意点与曲线上任意点的Kw不同,温度不同。
(3)实现曲线上点之间的转化需保持温度相同,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。
典例6.25 ℃时,水溶液中c(H+)与c(OH-)的变化关系如图所示,下列判断错误的是( )
A.ac曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.bd线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25 ℃,pH<7
D.c点溶液不可能是盐溶液
【答案】D
【解析】ac曲线上的任意一点,由于温度相同,所以水的离子积常数相同,根据b点可知,
c(H+)·c(OH-)=10-14,A项正确;bd线段上任意一点都满足c(H+)=c(OH-),溶液一定呈中性,B项正确;d点时,c(H+)=c(OH-)=1×10-6 mol·L-1>1×10-7 mol·L-1,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25 ℃,C项正确;在c点c(H+)=1×10-8 mol·L-1,c(OH-)=1×10-6 mol·L-1,溶液显碱性,而醋酸钠溶液显碱性,所以c点可能为醋酸钠溶液,D项错误。
典例7.水的电离平衡曲线如图所示,回答下列问题。
(1)图中A、B、C、D、E五点Kw间的关系:___________________。
(2)在水中加少量酸,可实现A点向____________点移动。
(3)ABE形成的区域中的点都呈现__________性。
(4)若在B点温度下,pH=2的硫酸溶液中,=________ mol·L-1。
【答案】 (1)B>C>A=E=D (2)D (3)碱 (4)1×10-10
核心价值与学科素养
pH的应用
应用领域 实例
人体健康 人体的各种体液都有一定的pH,当酸碱平衡失调时,人体就表现出病变,因而可以利用检测血液中的pH诊断疾病
生活应用 利用护发素保护头发,就是通过调节头发的pH使之达到适宜的酸碱度
环保领域 酸性或碱性的废水,可以利用中和反应调节pH
农业生产 土壤的pH影响植物对养分的吸收及养分的有效性,各种作物的生长也都对土壤的pH范围有一定的要求,因而应注意保持土壤的酸碱性
科学实验、工业生产 溶液的pH控制常常是影响实验结果或产品质量、产量的一个关键因素
典例8.柠檬是有药用价值的水果之一,对人体十分有益。鲜柠檬维生素含量极为丰富,是美容的天然佳品,能防止和消除皮肤色素沉着,具有美白作用。已知在常温下柠檬水中的c(OH-)=1×10-11 mol/L,则其pH等于( D )
A.11 B.7 C.5 D.3
【解析】c(OH-)=10-11mol/L,则c(H+)===1×10-3 mol/L,pH=3。
典例9.科学家利用太空望远镜首次探测到木星二喷出的羽状物是水蒸气,而这些羽状物的源头证实在它的冰壳下隐藏着一个巨大的咸海洋。
水是最宝贵的资源之一。若在木星二上某地,水的离子积常数Kw=1.0×10-12。
(1)利用我们的地球经验,木星二该地的温度 25 ℃(填“大于”“小于”或“等于”),其理由是 。
(2)已知水中存在如下平衡:H2O+H2OH3O++OH- ΔH>0,现欲使平衡向左移动,且所得溶液呈酸性,选择的方法是 (填字母)。
A.向水中加入NaHSO4 B.向水中加入NaCl
C.加热水至100 ℃ D.在水中加入KOH
(3)水蒸气和沸水的温度都是100 ℃,现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 性(填“酸”“碱”或“中”);若用pH计测定,则pH 7(填“>”“=”或“<”),溶液呈 性(填“酸”“碱”或“中”)。
【答案】(1) 大于 Kw随温度升高而增大 (2) A (3) 淡黄 中 < 中
【解析】(1)Kw随温度升高而增大,温度高于25 ℃。(2)向水中加入NaHSO4,c(H+)增大,平衡向左移动,A正确;向水中加入NaCl对水的电离平衡无影响,平衡不移动,B错误;加热平衡向右移动,仍呈中性,C错误;在水中加入KOH,c(OH-)增大,平衡向左移动,但溶液呈碱性,D错误。(3)100 ℃时水的pH<7,但溶液仍呈中性,因此pH试纸仍为黄色。
典例10.工业废水的种类很多,其中酸碱废水是常见的工业废水,主要来自钢铁厂、化工厂、染料厂、印染厂、皮革厂、造纸厂、炼油厂等。酸碱废水具有较强的腐蚀性,需经适当治理方可外排。治理酸碱废水一般原则是高浓度酸碱废水,应优先考虑回收利用,可采用浓缩的方法回收酸碱。低浓度的酸碱废水,如酸洗槽的清洗水,碱洗槽的漂洗水,应进行中和处理。
(1)常温下,甲酸性废水的pH是4,乙酸性废水的pH是5,则甲与乙的c(OH-)之比为 。
(2)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11。
①该温度下水的离子积常数Kw= 。
②在此温度下,已知碱性废水与酸性废水完全电离,将pH=a的碱性废水Va L与pH=b的酸性废水Vb L混合。
若所得混合液为中性,且a=12,b=2,则Va∶Vb= ;若所得混合液为中性,且a+b=12,则Va∶Vb= 。
【答案】(1) 1∶10 (2) ①10-13 ②1∶10 10∶1
【解析】(1)常温下,水的离子积常数Kw=10-14,甲的pH是4,c(H+)=10-4mol·L-1,则c(OH-)=10-10mol·L-1;乙的pH是5,c(H+)=10-5mol·L-1,则c(OH-)=10-9mol·L-1。所以甲与乙的c(OH-)之比为10-10mol·L-1∶10-9mol·L-1=1∶10。
(2)①由题意知,溶液中c(H+)=10-11mol·L-1,c(OH-)=0.01 mol·L-1,故Kw=c(H+)·c(OH-)=10-13。
②根据中和反应:H++OH-===H2O
c(H+)·V酸=c(OH-)·V碱 10-2·Vb=10-13/10-12·Va,则=1∶10
若所得混合液为中性,且a+b=12,==1013-a-b=10,则Va∶Vb=10∶1。
【跟踪练习】 基础过关
1. 已知常温下0.01 mol·L-1 CH3COOH溶液中c(H+)=4.32×10-4 mol·L-1,则该CH3COOH溶液中水的离子积常数( )
A.<1×10-14 B.>1×10-14
C.=1×10-14 D.无法确定
【答案】C
【解析】水的离子积常数仅仅是温度的函数,只要温度不变,水的离子积常数不变,在常温下,Kw=1×10-14,而与电解质溶液及其电离程度无关,故选C。
2. 下列溶液一定显酸性的是( )
A.溶液中c(OH-)>c(H+) B.滴加紫色石蕊试液后变红色的溶液
C.溶液中c(H+)=10-6 mol·L-1 D.pH<7的溶液
【答案】B
【解析】判断溶液的酸碱性关键看c(H+)和c(OH-)相对大小,若c(H+)>c(OH-),溶液呈酸性;而pH<7或c(H+)<10-7 mol·L-1,仅适用于常温时,若温度不确定,就不能用来判断溶液的酸碱性,而B项中可使紫色石蕊试液变红,则该溶液为酸性。
3. 常温下,关于溶液稀释的下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
【答案】C
【解析】A项,pH=3的醋酸溶液在稀释过程中电离平衡正向移动,稀释100倍时,3
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
【答案】B
【解析】依据曲线的起点可判断盐酸和NaOH溶液的浓度均为0.1 mol·L-1,曲线a为NaOH滴定盐酸的滴定曲线,曲线b为盐酸滴定NaOH的滴定曲线,强酸与强碱的中和滴定既可用甲基橙也可用酚酞作指示剂。
5. 如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.温度:T1<T2
D.XZ线上任意点均有pH=7
【答案】D
【解析】温度越高,水的电离程度越大,电离出的c(H+)与c(OH-)越大,所以T2>T1,C项正确;XZ线上任意点都有c(H+)=c(OH-),只有当c(H+)=10-7 mol·L-1时,才有pH=7,D项错误。
能力达成
6. 某同学拟用pH计测定溶液pH以探究某酸HR是否为弱电解质。下列说法正确的是( )
A.25 ℃时,若测得0.01 mol·L-1 NaR溶液pH=7,则HR是弱酸
B.25 ℃时,若测得0.01 mol·L-1 HR溶液pH>2且pH<7,则HR是弱酸
C.25 ℃时,若测得HR溶液pH=a,取该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得pH=b,b-a<1,则HR是弱酸
D.25 ℃时,若测得NaR溶液pH=a,取该溶液10.0 mL,升温至50 ℃,测得pH=b,a>b,则HR是弱酸
【答案】B
【解析】25 ℃时,若测得0.01 mol·L-1NaR溶液pH=7,可知NaR为强酸强碱盐,则HR为强酸,A错误;25 ℃时,若测得0.01 mol·L-1HR溶液pH>2且pH<7,可知溶液中c(H+)<0.01 mol·L-1,HR未完全电离,所以HR为弱酸,B正确;假设HR为强酸,取pH=6的该溶液10.0 mL,加蒸馏水稀释至100.0 mL,测得此时溶液pH<7,C错误;假设HR为强酸,则NaR为强酸强碱盐,溶液呈中性,升温至50 ℃,促进水的电离,水的离子积常数增大,pH减小,D错误。
7.按要求计算下列各题(常温下,忽略溶液混合时体积的变化):
(1)25 ℃时,pH=3的硝酸和pH=12的氢氧化钡溶液按照体积比为9∶1混合,混合溶液的pH=________。
(2)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是__________。
(3)将pH=a的NaOH溶液Va L与pH=b的稀盐酸Vb L混合,若所得溶液呈中性,且a+b=13,则=__________。
【答案】(1)10 (2)1∶4 (3)10
【解析】(1)pH=3的硝酸溶液中c(H+)=10-3 mol·L-1,pH=12的Ba(OH)2溶液中c(OH-)= mol·L-1=10-2 mol·L-1,二者以体积比9∶1混合,Ba(OH)2过量,溶液呈碱性,混合溶液中c(OH-)==1×10-4 mol·L-1,则混合后c(H+)== mol·L-1=1×10-10 mol·L-1,故pH=10。
(2)设氢氧化钡溶液的体积为V1 L,硫酸氢钠溶液的体积为V2 L,依题意知,n(Ba2+)=n(SO),由Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=5×10-3V1 mol,=1×10-3 mol·L-1,则V1∶V2=1∶4。
(3)pH=a的NaOH溶液中c(OH-)=10a-14 mol·L-1,pH=b的稀盐酸中c(H+)=10-b mol·L-1,根据中和反应H++OH-===H2O,知c(OH-)·Va=c(H+)·Vb,===1014-(a+b),a+b=13,则=10。
8. (1)在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液。回答下列问题:
①若x+y=14,=________(填数值)。
②若x+y=13,=________(填数值)。
③若x+y>14,=____(表达式),且Vx____Vy(填“>”“<”或“=”)(题中x≤6,y≥8)。
(2)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知:Va<Vb和a=0.5b。请填写下列空白:
①a值可否等于3(填“可”或“否”) ,其理由是 。
②a值可否等于5(填“可”或“否”) ,其理由是 。
③a的取值范围是________________________。
【答案】(1)①1 ② ③10(x+y-14) >
(2)①否 a=3 b=6, 溶液呈酸性与题意的强碱溶液不符合
②否 a=5, b=10,满足恰好完全反应时nOH-=nH+,则有Va·10-a= Vb·10 b-14,
,从而可推出va>vb与题意va
【解析】(1)Vx·10-x=Vy·10-(14-y),==10(x+y-14)。①若x+y=14,则=1。②若x+y=13,则=。③当x+y>14时,根据=10x+y-14,Vx>Vy。
(2)①若a=3,则b=6,溶液显酸性,与题意不符,故a≠3;②若a=5,则c(H+)=10-5mol·L-1,即b=10,c(OH-)=10-4 mol·L-1,Va∶Vb=10>1,与题意不符,故a≠5;③b>7,则2a>7,即a>,又Va∶Vb=10a+b-14<1,则3a<14,即a<,故<a<。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
