3.3 盐类的水解(第2课时 盐类的水解的影响及应用)(解析版)
文档属性
| 名称 | 3.3 盐类的水解(第2课时 盐类的水解的影响及应用)(解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 15:30:35 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
第三章 第三节 盐类的水解
第2课时 盐类水解的影响及应用
【学习目标】
1.通过实验探究,认识影响盐类水解的主要因素。
2.结合真实情境中的应用实例,了解盐类水解在生产、生活中的应用。
3.能从盐类水解平衡的角度分析溶液的酸碱性等。
4.能综合运用电离平衡和水解平衡原理,判断溶液中粒子浓度大小关系,分析和解决生产、生活中有关电解质溶液的实际问题。
【素养目标】
1.运用化学平衡原理分析外界条件对盐类水解的影响,建立物质的变化需要一定条件,并遵循一定规律的观念。培养学生“变化观念与平衡思想”的学科素养。
2.根据影响盐类水解平衡的外界因素,设计简单的实验方案进行探究,完成实验操作,观察现象,对实验现象作出解释。培养学生“科学探究与创新意识” 的学科素养。
3.利用平衡思想和守恒关系等认知模型,分析溶液中离子浓度之间的数量关系。培养学生“证据推理与模型认知” 的学科素养。
4.认识盐类水解平衡在生产、生活和科学研究中的应用,利用盐类水解平衡知识解释有关实际问题。培养学生“科学态度与社会责任” 的学科素养。
必备知识与关键能力
知识点一:盐类水解的影响因素
1.影响盐类水解平衡的因素
(1)内因:盐类本身的性质,形成盐的酸或碱越弱,其盐就越易水解。
(2)外因
因素 水解平衡 水解程度 水解产生离子的浓度
温度 升高 右移 增大 增大
浓度 增大 右移 减小 增大
减小(稀释) 右移 增大 减小
外加酸碱 酸 弱碱阳离子的水解程度减小
碱 弱酸根离子的水解程度减小
(3)注意事项
①稀溶液中,盐的浓度越小,水解程度越大,但由于溶液体积的增大是主要的,故水解产生的H+或OH-的浓度是减小的,则溶液酸性(或碱性)越弱。
②向CH3COONa溶液中加入少量冰醋酸,并不会与CH3COONa溶液水解产生的OH-反应,使平衡向水解方向移动,原因是体系中c(CH3COOH)增大是主要因素,会使平衡CH3COO-+H2OCH3COOH+OH-左移。
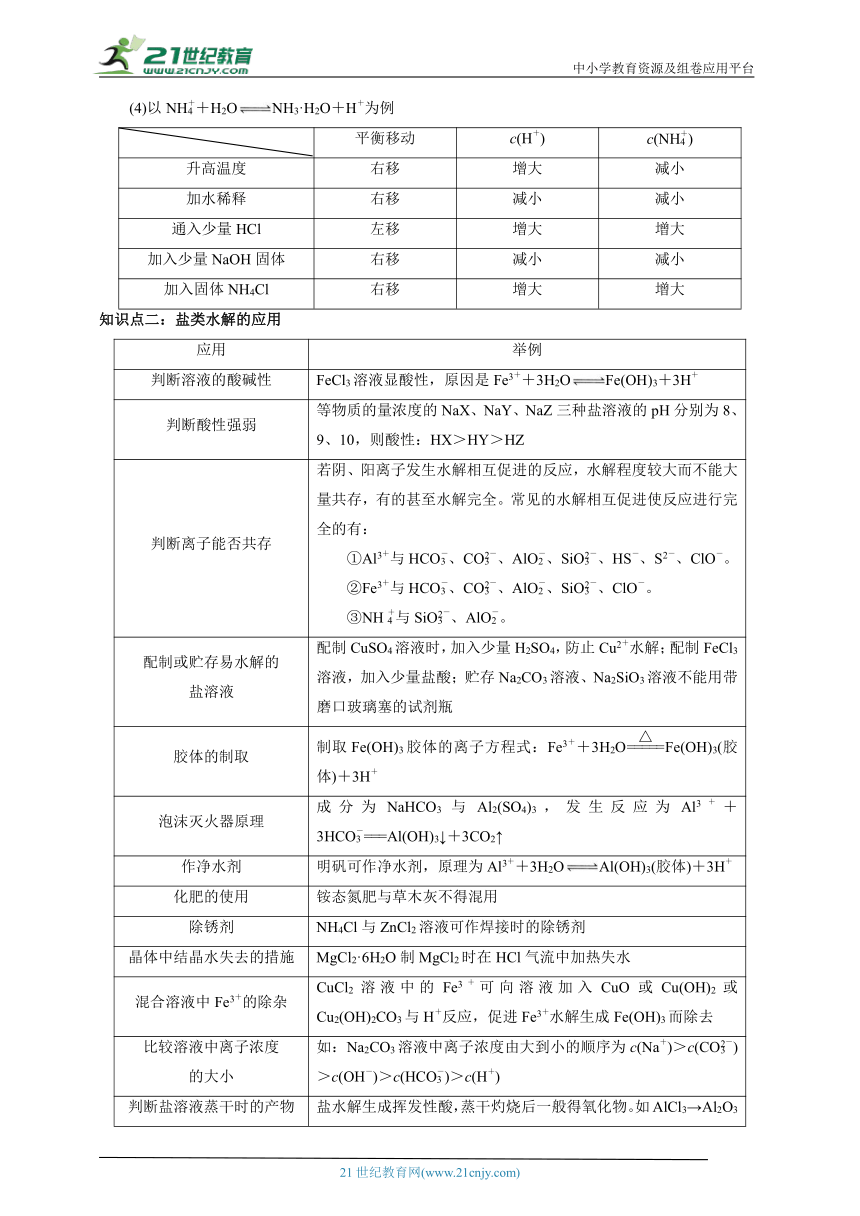
(4)以NH+H2ONH3·H2O+H+为例
平衡移动 c(H+) c(NH)
升高温度 右移 增大 减小
加水稀释 右移 减小 减小
通入少量HCl 左移 增大 增大
加入少量NaOH固体 右移 减小 减小
加入固体NH4Cl 右移 增大 增大
知识点二:盐类水解的应用
应用 举例
判断溶液的酸碱性 FeCl3溶液显酸性,原因是Fe3++3H2OFe(OH)3+3H+
判断酸性强弱 等物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则酸性:HX>HY>HZ
判断离子能否共存 若阴、阳离子发生水解相互促进的反应,水解程度较大而不能大量共存,有的甚至水解完全。常见的水解相互促进使反应进行完全的有: ①Al3+与HCO、CO、AlO、SiO、HS-、S2-、ClO-。 ②Fe3+与HCO、CO、AlO、SiO、ClO-。 ③NH与SiO、AlO。
配制或贮存易水解的 盐溶液 配制CuSO4溶液时,加入少量H2SO4,防止Cu2+水解;配制FeCl3溶液,加入少量盐酸;贮存Na2CO3溶液、Na2SiO3溶液不能用带磨口玻璃塞的试剂瓶
胶体的制取 制取Fe(OH)3胶体的离子方程式:Fe3++3H2OFe(OH)3(胶体)+3H+
泡沫灭火器原理 成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCO===Al(OH)3↓+3CO2↑
作净水剂 明矾可作净水剂,原理为Al3++3H2OAl(OH)3(胶体)+3H+
化肥的使用 铵态氮肥与草木灰不得混用
除锈剂 NH4Cl与ZnCl2溶液可作焊接时的除锈剂
晶体中结晶水失去的措施 MgCl2·6H2O制MgCl2时在HCl气流中加热失水
混合溶液中Fe3+的除杂 CuCl2溶液中的Fe3+可向溶液加入CuO或Cu(OH)2或Cu2(OH)2CO3与H+反应,促进Fe3+水解生成Fe(OH)3而除去
比较溶液中离子浓度 的大小 如:Na2CO3溶液中离子浓度由大到小的顺序为c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
判断盐溶液蒸干时的产物 盐水解生成挥发性酸,蒸干灼烧后一般得氧化物。如AlCl3→Al2O3
盐水解生成难挥发性酸,蒸干后得原物质。如CuSO4→CuSO4
考虑盐受热时是否分解。如KMnO4→K2MnO4和MnO2
还原性盐溶液蒸干时会被O2氧化。如Na2SO3→Na2SO4
弱酸的铵盐溶液蒸干后无固体剩余。如NH4HCO3、(NH4)2CO3
典例1.下列事实与盐类水解无关的是( )
A.MgCO3可以除去MgCl2酸性溶液中的Fe3+
B.氯化铁溶液常用作铜印刷电路板的腐蚀剂
C.常用热的纯碱溶液除去油污
D.长期施用硫酸铵易使土壤酸化
【答案】B
【解析】MgCO3调节pH,使Fe3+的水解平衡正向移动,使Fe3+沉淀完全,转化成Fe(OH)3,MgCO3难溶于水,不引入新杂质,A项与盐类水解有关;氯化铁具有强氧化性,可与铜发生氧化还原反应,可用于腐蚀铜印刷电路板,B项与盐类水解无关;Na2CO3的水解是吸热反应,故升高温度,溶液碱性增强,去油污能力增强,C项和盐类的水解有关;铵态氮肥中铵根离子水解显酸性,长期施用硫酸铵易使土壤酸化,D项与盐类水解有关。
典例2.下列应用与盐类水解有关的是( )
①明矾和FeCl3可作为净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在较浓的盐酸中,然后加水稀释
④NH4Cl与ZnCl2溶液可作为焊接中的除锈剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作为泡沫灭火剂
⑦长期使用硫酸铵,土壤酸性增强
⑧草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全有关
【答案】D
【解析】①明矾和氯化铁水解生成氢氧化铝胶体、氢氧化铁胶体等,可吸附水中的杂质;②在氯化铁溶液中加入盐酸,抑制Fe3+的水解;③AlCl3水解生成氢氧化铝和盐酸,先溶解在较浓的盐酸中可以抑制水解;④氯化铵、氯化锌溶液水解呈酸性,利用酸溶解金属氧化物;⑤碳酸钠水解,溶液呈碱性,与玻璃中的主要成分二氧化硅反应生成具有黏合性的硅酸钠;⑥碳酸氢钠和硫酸铝溶液混合,发生双水解反应;⑦硫酸铵水解,溶液呈酸性,使土壤酸性增强;⑧铵态氮肥水解呈酸性,而草木灰的主要成分是碳酸钾,水解呈碱性,混合后发生反应,使肥效降低。
典例3.列根据反应原理设计的应用,不正确的是( )
A.CO+H2OHCO+OH- 热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl 制备TiO2·xH2O
D.SnCl2+H2OSn(OH)Cl+HCl 配制氯化亚锡溶液时加入稀H2SO4
【答案】D
【解析】加入稀H2SO4可以抑制Sn2+水解,但引入SO,D不正确。
知识点三:溶液中粒子浓度的大小比较
(一)理解“两大理论”,贯通思维障碍
1.电离理论——弱电解质的电离是微弱的
(1)弱电解质的电离是微弱的,电离产生的粒子都非常少,同时还要考虑水的电离。
如氨水中:NH3·H2O、NH、OH-、H+浓度的大小关系是c(NH3·H2O)>c(OH-)>c(NH)>c(H+)。
(2)多元弱酸的电离是分步进行的,其主要是第一步电离(第一步电离程度远大于第二步电离)。
如在H2S溶液中:H2S、HS-、S2-、H+的浓度大小关系是c(H2S)>c(H+)>c(HS-)>c(S2-)。
2.水解理论——弱电解质离子的水解是微弱的
(1)弱电解质离子的水解是微弱的(水解相互促进的除外),但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度。
如NH4Cl溶液中:NH、Cl-、NH3·H2O、H+的浓度大小关系是c(Cl-)>c(NH)>c(H+)>c(NH3·H2O)。
(2)多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解。
如在Na2CO3溶液中:CO、HCO、H2CO3的浓度大小关系应是c(CO)>c(HCO)>c(H2CO3)。
(二)巧用“三个守恒”,明确浓度关系
1.电荷守恒
电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。如NaHCO3溶液中:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)。
2.物料守恒
物料守恒也就是元素守恒,变化前后某种元素的原子个数守恒。
(1)单一元素守恒,如1 mol NH3通入水中形成氨水,就有n(NH3)+n(NH3·H2O)+n(NH)=1 mol,即氮元素守恒。
(2)两元素守恒,如NaHCO3溶液中,c(Na+)=c(H2CO3)+c(HCO)+c(CO),即钠元素与碳元素守恒。
3.质子守恒
电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转移,转移过程中质子数量保持不变,称为质子守恒。如NaHCO3溶液中:
c(H2CO3)+c(H+)=c(CO)+c(OH-)。
注:质子守恒可以通过电荷守恒与物料守恒加减得到。
典例4.(1)(NH4)2SO4溶液中各粒子浓度关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
(2)0.1 mol·L-1的Na2CO3溶液中各粒子浓度的关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
(3)0.1 mol·L-1的NaHCO3溶液中各粒子浓度的关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
【答案】(1) ①c(NH)>c(SO)>c(H+)>c(OH-) ②c(NH)+c(NH3·H2O)=2c(SO)
③c(NH)+c(H+)=2c(SO)+c(OH-) ④c(H+)=c(NH3·H2O)+c(OH-)
(2) ①c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) ②c(Na+)=2[c(CO)+c(HCO)+c(H2CO3)]
③c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-) ④c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
(3) ①c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO) ②c(Na+)=c(HCO)+c(CO)+c(H2CO3)
③c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO) ④c(OH-)+c(CO)=c(H2CO3)+c(H+)
【思维建模】
相关溶液粒子浓度关系的解题步骤
典例5.常温下,浓度均为0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
A.氨水中,c(NH)=c(OH-)=0.1 mol·L-1
B.NH4Cl溶液中,c(NH)>c(Cl-)
C.Na2SO4溶液中,c(Na+)>c(SO)>c(OH-)=c(H+)
D.Na2SO3溶液中,c(Na+)=2c(SO)+c(HSO)+c(H2SO3)
【答案】C
【解析】氨水为弱碱溶液,NH3·H2O只能部分电离出OH-,结合电荷守恒c(NH)+c(H+)=c(OH-)可得:c(NH)<c(OH-)<0.1 mol·L-1,A错误;NH4Cl溶液中,NH部分水解,Cl-浓度不变,则溶液中c(NH)<c(Cl-),B错误;Na2SO4溶液显中性,c(OH-)=c(H+),结合电荷守恒可得:c(Na+)=2c(SO),溶液中离子浓度大小为c(Na+)>c(SO)>c(OH-)=c(H+),C正确;根据Na2SO3溶液中的物料守恒可得:c(Na+)=2c(SO)+2c(HSO)+2c(H2SO3),D错误。
【思维建模】
不同溶液中同种粒子浓度大小的比较
典例6.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3。下列关系或者说法正确的是( )
A.c(CO)的大小关系:②>⑤>③>④>①
B.c(HCO)的大小关系:④>③>⑤>②>①
C.将溶液蒸干灼烧只有①不能得到对应的原有物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
【答案】A
【解析】由于④中NH与HCO水解相互促进,故c(HCO)大小为③>④,c(CO)大小也是③>④,B错误;将各溶液蒸干后①③④⑤都分解,得不到原来的物质,C错误;Na2CO3只能与盐酸反应,而与NaOH溶液不反应,D错误;NH与CO水解相互促进,c(CO)大小为②>⑤,HCO既水解又电离,水解程度大于电离程度,c(CO)大小为③、④<②、⑤,H2CO3是弱酸,二级电离Ka2很小,H2CO3中的c(CO)最小,A正确。
典例7.有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa(混合溶液呈中性) ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合溶液呈碱性)。下列各项排序正确的是( )
A.pH:②<①<③<④ B.溶液中c(H+):①<③<②<④
C.c(NH):①<③<②<④ D.c(NH3·H2O):①<③<④<②
【答案】C
【解析】A项,④呈碱性,①呈中性,③呈弱酸性,②呈强酸性,pH:②<③<①<④,错误;B项,溶液中c(H+):④<①<③<②,错误;D项,c(NH3·H2O):②<③<①<④,错误。
典例8.下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol·L-1:①H2S溶液、②KHS溶液、③K2S溶液、④H2S和KHS混合溶液(已知常温下KHS溶液的pH>7)。下列说法正确的是( )
A.溶液的pH从大到小的顺序为③>②>①>④
B.在H2S和KHS混合溶液中:c(H2S)+c(HS-)+c(S2-)=2c(K+)
C.c(H2S)从大到小的顺序为①>④>③>②
D.在KHS溶液中:c(H+)+c(K+)=c(HS-)+c(S2-)+c(OH-)
【答案】B
【解析】H2S溶液、H2S和KHS混合溶液均显酸性,但HS-的存在抑制了H2S的电离,故pH:④>①;K2S溶液中S2-的水解程度大于KHS溶液中HS-的水解程度,则pH:③>②,故溶液pH从大到小的顺序为③>②>④>①,A错误。在浓度均为0.1 mol·L-1 H2S和KHS混合溶液中,根据物料守恒可得:c(H2S)+c(HS-)+c(S2-)=2c(K+),B正确。在K2S溶液中S2-发生两步水解生成H2S,而KHS溶液中HS-发生一步水解生成H2S,故溶液中c(H2S):②>③,C错误。在KHS溶液中根据电荷守恒可得:c(H+)+c(K+)=c(HS-)+2c(S2-)+c(OH-),D错误。
核心价值与学科素养
【知识结构化】
典例9.下列有关盐类水解的事实或应用、解释的说法不正确的是( )
选项 事实或应用 解释
A 用热的纯碱溶液去除油污 纯碱与油污直接发生反应,生成易溶于水的物质
B 泡沫灭火器灭火 Al2(SO4)3与NaHCO3溶液反应产生CO2气体
C 施肥时,草木灰(主要成分K2CO3)与NH4Cl不能混合使用 K2CO3与NH4Cl反应生成NH3,降低肥效
D 明矾[KAl(SO4)2·12H2O]作净水剂 明矾溶于水生成Al(OH)3胶体
【答案】A
【解析】用热的纯碱溶液去除油污,其原因是Na2CO3水解使溶液显碱性,油脂在碱性溶液中发生水解生成高级脂肪酸盐和甘油,并非纯碱与油污直接发生反应,A项错误;泡沫灭火器灭火的反应原理是利用Al2(SO4)3与NaHCO3溶液发生相互促进的水解反应:Al3++3HCO===Al(OH)3↓+3CO2↑,生成CO2气体,B项正确;K2CO3是弱酸强碱盐,NH4Cl是强酸弱碱盐,混合使用时,二者发生相互促进的水解反应生成NH3,降低肥效,C项正确;明矾溶于水电离产生的Al3+发生水解反应,生成Al(OH)3胶体,Al(OH)3胶体能吸附水中悬浮的杂质,从而起到净水作用,D项正确。
【跟踪练习】 基础过关
1. 生活中处处有化学,下列有关说法正确的是( )
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
【答案】D
【解析】A项,天然硬水是因为其中含有较多的Mg2+、Ca2+等离子,错误;B项,NH4Cl是强酸弱碱盐,水解显酸性,因此能溶解铁锈,错误;C项,惰性电极电解食盐水生成物是H2、Cl2、NaOH,Cl2与NaOH溶液反应可以制备漂白液,与水解无关,错误;D项,Na2CO3溶液中存在水解平衡CO+H2O??HCO+OH-,加入BaCl2溶液后生成BaCO3沉淀,c(CO)降低,溶液的碱性减弱,所以红色逐渐褪去,正确。
2. 已知某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是( )
A.NaHX的电离方程式为NaHX===Na++H++X2-
B.HX-的电离程度小于HX-的水解程度
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-)
D.加水稀释,促进HX-水解,c(HX-)增大
【答案】B
【解析】酸式盐(NaHX)溶液显碱性,HX-水解程度大于电离程度,说明H2X是弱酸,NaHX的电离方程式为NaHX===Na++HX-,A错误;溶液显碱性,HX-的电离程度小于HX-的水解程度,B正确;由电荷守恒可知离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),C错误;加水稀释,促进HX-水解,c(HX-)减小,D错误。
3. 为了得到比较纯净的物质,使用的方法恰当的是( )
A.向Na2CO3饱和溶液中,通入过量的CO2后,在加压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液可得到纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量的NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
【答案】D
【解析】A不正确,因为NaHCO3加热要分解;B、C项也不正确, 因为AlCl3与FeCl3在加热蒸发的情况下,水解趋于完全,分别发生下列反应:Al3++3H2OAl(OH)3+3H+,2Al(OH)3Al2O3+3H2O,Fe3++3H2OFe(OH)3+3H+,2Fe(OH)3Fe2O3+3H2O。
4. 常温下,浓度均为0.1 mol·L-1的四种盐溶液,其pH如表所示,下列说法正确的是( )
序号 ① ② ③ ④
溶液 CH3COONa NaHCO3 Na2CO3 NaClO
pH 8.8 9.7 11.6 10.3
A.等浓度的CH3COOH和HClO溶液,pH小的是HClO
B.Na2CO3和NaHCO3溶液中离子种类不同
C.溶液中水的电离程度:①>②>④>③
D.NaHCO3溶液中:c(Na+)=c(CO)+c(HCO)+c(H2CO3)
【答案】D
【解析】等浓度的CH3COONa和NaClO溶液相比,前者的pH小于后者,说明ClO-的水解程度大于CH3COO-的水解程度,根据盐类“越弱越水解”的规律推知,酸性:CH3COOH>HClO,故等浓度的CH3COOH和HClO溶液,pH小的是CH3COOH溶液,A错误;Na2CO3和NaHCO3溶液中均含有两种阳离子(Na+、H+)和三种阴离子(OH-、HCO、CO),B错误;盐的水解促进了水的电离,等浓度的四种盐溶液,盐的水解程度越大,溶液的pH越大;由表可知,水解程度:Na2CO3>NaClO>NaHCO3>CH3COONa,则水的电离程度:③>④>②>①,C错误;NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO)+c(HCO)+c(H2CO3),D正确。
5. 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度的大小关系一定是:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
【答案】D
【解析】本题考查电解质溶液有关知识,意在考查考生综合分析问题的能力。常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,说明水的电离受到抑制,可能为酸溶液也可能为碱溶液,若为酸溶液,则pH=a,若为碱溶液,则pH=14-a,A项错误;当溶质为硫化钠时,浓度大小关系符合,当溶质为硫氢化钠和硫化氢,且溶液呈酸性时,浓度大小关系不符合,B项错误;由电荷守恒知,2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),混合液的pH等于7,故c(OH-)=c(H+),应有2c(R2-)+c(HR-)=c(Na+),C项错误;根据电荷守恒知,c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒知,c(A-)+c(HA)=2c(Na+),二者联立可得:2c(OH-)+c(A-)=2c(H+)+c(HA),D项正确。
能力达成
6. 室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A.NaHCO3 Na2CO3混合溶液(pH=10.30):c(Na+)>c(HCO)>c(OH-)>c(CO)
B.氨水 NH4Cl混合溶液(pH=9.25):c(NH)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4 NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2O)+c(OH-)
【答案】D
【解析】CO的水解程度大于HCO的水解程度,HCO的水解程度大于其电离程度,所以溶液中c(Na+)>c(HCO)>c(CO)>c(OH-),A项错误;NH3·H2O的电离程度大于NH的水解程度,溶液中c(NH3·H2O)c(NH3·H2O)+c(OH-),B项错误;CH3COOH的电离程度大于CH3COO-的水解程度,则溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),C项错误;根据电荷守恒有c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O),根据物料守恒有2c(Na+)=c(C2O)+c(H2C2O4)+c(HC2O),联立上述两式得c(H+)+c(H2C2O4)=c(Na+)+c(C2O)+c(OH-),D项正确。
7. FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2OFe(OH)+H+ K2
Fe(OH)+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2OFex(OH)+yH+,欲使平衡正向移动可采用的方法是________(填字母)。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是__________。
(2)天津某污水处理厂用聚合氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为______mg·L-1。
【答案】(1)K1>K2>K3 bd 调节溶液的pH (2)18~20
【解析】铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,所以答案选bd;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH。(2)由图像可知,聚合氯化铁的浓度在18~20 mg·L-1时,去除率达到最大值,污水的浑浊度减小。
8. 10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) 10 20 30 加热煮沸后冷却到50 ℃
pH 8.3 8.4 8.5 8.8
甲同学认为,该溶液的pH升高的原因是HCO的水解程度增大,故碱性增强,该反应的离子方程式为: 。
乙同学类比加热Ca(HCO3)2溶液,会出现________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:Na2CO3________NaHCO3(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明________(填“甲”或“乙”)判断正确。试剂X是________(填字母)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10 ℃,若溶液的pH________(填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。
【答案】HCO+H2OH2CO3+OH- 浑浊 大于 (1)乙 B (2)等于
【解析】(1)HCO水解方程式:HCO+H2O??H2CO3+OH-。
(2)加热煮沸后,若HCO分解成CO,加入BaCl2溶液则生成沉淀。不能选A、C、D,因为它们均有OH-,能与HCO反应生成CO。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
第三章 第三节 盐类的水解
第2课时 盐类水解的影响及应用
【学习目标】
1.通过实验探究,认识影响盐类水解的主要因素。
2.结合真实情境中的应用实例,了解盐类水解在生产、生活中的应用。
3.能从盐类水解平衡的角度分析溶液的酸碱性等。
4.能综合运用电离平衡和水解平衡原理,判断溶液中粒子浓度大小关系,分析和解决生产、生活中有关电解质溶液的实际问题。
【素养目标】
1.运用化学平衡原理分析外界条件对盐类水解的影响,建立物质的变化需要一定条件,并遵循一定规律的观念。培养学生“变化观念与平衡思想”的学科素养。
2.根据影响盐类水解平衡的外界因素,设计简单的实验方案进行探究,完成实验操作,观察现象,对实验现象作出解释。培养学生“科学探究与创新意识” 的学科素养。
3.利用平衡思想和守恒关系等认知模型,分析溶液中离子浓度之间的数量关系。培养学生“证据推理与模型认知” 的学科素养。
4.认识盐类水解平衡在生产、生活和科学研究中的应用,利用盐类水解平衡知识解释有关实际问题。培养学生“科学态度与社会责任” 的学科素养。
必备知识与关键能力
知识点一:盐类水解的影响因素
1.影响盐类水解平衡的因素
(1)内因:盐类本身的性质,形成盐的酸或碱越弱,其盐就越易水解。
(2)外因
因素 水解平衡 水解程度 水解产生离子的浓度
温度 升高 右移 增大 增大
浓度 增大 右移 减小 增大
减小(稀释) 右移 增大 减小
外加酸碱 酸 弱碱阳离子的水解程度减小
碱 弱酸根离子的水解程度减小
(3)注意事项
①稀溶液中,盐的浓度越小,水解程度越大,但由于溶液体积的增大是主要的,故水解产生的H+或OH-的浓度是减小的,则溶液酸性(或碱性)越弱。
②向CH3COONa溶液中加入少量冰醋酸,并不会与CH3COONa溶液水解产生的OH-反应,使平衡向水解方向移动,原因是体系中c(CH3COOH)增大是主要因素,会使平衡CH3COO-+H2OCH3COOH+OH-左移。
(4)以NH+H2ONH3·H2O+H+为例
平衡移动 c(H+) c(NH)
升高温度 右移 增大 减小
加水稀释 右移 减小 减小
通入少量HCl 左移 增大 增大
加入少量NaOH固体 右移 减小 减小
加入固体NH4Cl 右移 增大 增大
知识点二:盐类水解的应用
应用 举例
判断溶液的酸碱性 FeCl3溶液显酸性,原因是Fe3++3H2OFe(OH)3+3H+
判断酸性强弱 等物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则酸性:HX>HY>HZ
判断离子能否共存 若阴、阳离子发生水解相互促进的反应,水解程度较大而不能大量共存,有的甚至水解完全。常见的水解相互促进使反应进行完全的有: ①Al3+与HCO、CO、AlO、SiO、HS-、S2-、ClO-。 ②Fe3+与HCO、CO、AlO、SiO、ClO-。 ③NH与SiO、AlO。
配制或贮存易水解的 盐溶液 配制CuSO4溶液时,加入少量H2SO4,防止Cu2+水解;配制FeCl3溶液,加入少量盐酸;贮存Na2CO3溶液、Na2SiO3溶液不能用带磨口玻璃塞的试剂瓶
胶体的制取 制取Fe(OH)3胶体的离子方程式:Fe3++3H2OFe(OH)3(胶体)+3H+
泡沫灭火器原理 成分为NaHCO3与Al2(SO4)3,发生反应为Al3++3HCO===Al(OH)3↓+3CO2↑
作净水剂 明矾可作净水剂,原理为Al3++3H2OAl(OH)3(胶体)+3H+
化肥的使用 铵态氮肥与草木灰不得混用
除锈剂 NH4Cl与ZnCl2溶液可作焊接时的除锈剂
晶体中结晶水失去的措施 MgCl2·6H2O制MgCl2时在HCl气流中加热失水
混合溶液中Fe3+的除杂 CuCl2溶液中的Fe3+可向溶液加入CuO或Cu(OH)2或Cu2(OH)2CO3与H+反应,促进Fe3+水解生成Fe(OH)3而除去
比较溶液中离子浓度 的大小 如:Na2CO3溶液中离子浓度由大到小的顺序为c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
判断盐溶液蒸干时的产物 盐水解生成挥发性酸,蒸干灼烧后一般得氧化物。如AlCl3→Al2O3
盐水解生成难挥发性酸,蒸干后得原物质。如CuSO4→CuSO4
考虑盐受热时是否分解。如KMnO4→K2MnO4和MnO2
还原性盐溶液蒸干时会被O2氧化。如Na2SO3→Na2SO4
弱酸的铵盐溶液蒸干后无固体剩余。如NH4HCO3、(NH4)2CO3
典例1.下列事实与盐类水解无关的是( )
A.MgCO3可以除去MgCl2酸性溶液中的Fe3+
B.氯化铁溶液常用作铜印刷电路板的腐蚀剂
C.常用热的纯碱溶液除去油污
D.长期施用硫酸铵易使土壤酸化
【答案】B
【解析】MgCO3调节pH,使Fe3+的水解平衡正向移动,使Fe3+沉淀完全,转化成Fe(OH)3,MgCO3难溶于水,不引入新杂质,A项与盐类水解有关;氯化铁具有强氧化性,可与铜发生氧化还原反应,可用于腐蚀铜印刷电路板,B项与盐类水解无关;Na2CO3的水解是吸热反应,故升高温度,溶液碱性增强,去油污能力增强,C项和盐类的水解有关;铵态氮肥中铵根离子水解显酸性,长期施用硫酸铵易使土壤酸化,D项与盐类水解有关。
典例2.下列应用与盐类水解有关的是( )
①明矾和FeCl3可作为净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在较浓的盐酸中,然后加水稀释
④NH4Cl与ZnCl2溶液可作为焊接中的除锈剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作为泡沫灭火剂
⑦长期使用硫酸铵,土壤酸性增强
⑧草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全有关
【答案】D
【解析】①明矾和氯化铁水解生成氢氧化铝胶体、氢氧化铁胶体等,可吸附水中的杂质;②在氯化铁溶液中加入盐酸,抑制Fe3+的水解;③AlCl3水解生成氢氧化铝和盐酸,先溶解在较浓的盐酸中可以抑制水解;④氯化铵、氯化锌溶液水解呈酸性,利用酸溶解金属氧化物;⑤碳酸钠水解,溶液呈碱性,与玻璃中的主要成分二氧化硅反应生成具有黏合性的硅酸钠;⑥碳酸氢钠和硫酸铝溶液混合,发生双水解反应;⑦硫酸铵水解,溶液呈酸性,使土壤酸性增强;⑧铵态氮肥水解呈酸性,而草木灰的主要成分是碳酸钾,水解呈碱性,混合后发生反应,使肥效降低。
典例3.列根据反应原理设计的应用,不正确的是( )
A.CO+H2OHCO+OH- 热的纯碱溶液清洗油污
B.Al3++3H2OAl(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)TiO2·xH2O↓+4HCl 制备TiO2·xH2O
D.SnCl2+H2OSn(OH)Cl+HCl 配制氯化亚锡溶液时加入稀H2SO4
【答案】D
【解析】加入稀H2SO4可以抑制Sn2+水解,但引入SO,D不正确。
知识点三:溶液中粒子浓度的大小比较
(一)理解“两大理论”,贯通思维障碍
1.电离理论——弱电解质的电离是微弱的
(1)弱电解质的电离是微弱的,电离产生的粒子都非常少,同时还要考虑水的电离。
如氨水中:NH3·H2O、NH、OH-、H+浓度的大小关系是c(NH3·H2O)>c(OH-)>c(NH)>c(H+)。
(2)多元弱酸的电离是分步进行的,其主要是第一步电离(第一步电离程度远大于第二步电离)。
如在H2S溶液中:H2S、HS-、S2-、H+的浓度大小关系是c(H2S)>c(H+)>c(HS-)>c(S2-)。
2.水解理论——弱电解质离子的水解是微弱的
(1)弱电解质离子的水解是微弱的(水解相互促进的除外),但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度。
如NH4Cl溶液中:NH、Cl-、NH3·H2O、H+的浓度大小关系是c(Cl-)>c(NH)>c(H+)>c(NH3·H2O)。
(2)多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解。
如在Na2CO3溶液中:CO、HCO、H2CO3的浓度大小关系应是c(CO)>c(HCO)>c(H2CO3)。
(二)巧用“三个守恒”,明确浓度关系
1.电荷守恒
电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。如NaHCO3溶液中:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)。
2.物料守恒
物料守恒也就是元素守恒,变化前后某种元素的原子个数守恒。
(1)单一元素守恒,如1 mol NH3通入水中形成氨水,就有n(NH3)+n(NH3·H2O)+n(NH)=1 mol,即氮元素守恒。
(2)两元素守恒,如NaHCO3溶液中,c(Na+)=c(H2CO3)+c(HCO)+c(CO),即钠元素与碳元素守恒。
3.质子守恒
电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转移,转移过程中质子数量保持不变,称为质子守恒。如NaHCO3溶液中:
c(H2CO3)+c(H+)=c(CO)+c(OH-)。
注:质子守恒可以通过电荷守恒与物料守恒加减得到。
典例4.(1)(NH4)2SO4溶液中各粒子浓度关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
(2)0.1 mol·L-1的Na2CO3溶液中各粒子浓度的关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
(3)0.1 mol·L-1的NaHCO3溶液中各粒子浓度的关系
①大小关系(离子): 。
②元素质量守恒: 。
③电荷守恒: 。
④质子守恒: 。
【答案】(1) ①c(NH)>c(SO)>c(H+)>c(OH-) ②c(NH)+c(NH3·H2O)=2c(SO)
③c(NH)+c(H+)=2c(SO)+c(OH-) ④c(H+)=c(NH3·H2O)+c(OH-)
(2) ①c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) ②c(Na+)=2[c(CO)+c(HCO)+c(H2CO3)]
③c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-) ④c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
(3) ①c(Na+)>c(HCO)>c(OH-)>c(H+)>c(CO) ②c(Na+)=c(HCO)+c(CO)+c(H2CO3)
③c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO) ④c(OH-)+c(CO)=c(H2CO3)+c(H+)
【思维建模】
相关溶液粒子浓度关系的解题步骤
典例5.常温下,浓度均为0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是( )
A.氨水中,c(NH)=c(OH-)=0.1 mol·L-1
B.NH4Cl溶液中,c(NH)>c(Cl-)
C.Na2SO4溶液中,c(Na+)>c(SO)>c(OH-)=c(H+)
D.Na2SO3溶液中,c(Na+)=2c(SO)+c(HSO)+c(H2SO3)
【答案】C
【解析】氨水为弱碱溶液,NH3·H2O只能部分电离出OH-,结合电荷守恒c(NH)+c(H+)=c(OH-)可得:c(NH)<c(OH-)<0.1 mol·L-1,A错误;NH4Cl溶液中,NH部分水解,Cl-浓度不变,则溶液中c(NH)<c(Cl-),B错误;Na2SO4溶液显中性,c(OH-)=c(H+),结合电荷守恒可得:c(Na+)=2c(SO),溶液中离子浓度大小为c(Na+)>c(SO)>c(OH-)=c(H+),C正确;根据Na2SO3溶液中的物料守恒可得:c(Na+)=2c(SO)+2c(HSO)+2c(H2SO3),D错误。
【思维建模】
不同溶液中同种粒子浓度大小的比较
典例6.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3。下列关系或者说法正确的是( )
A.c(CO)的大小关系:②>⑤>③>④>①
B.c(HCO)的大小关系:④>③>⑤>②>①
C.将溶液蒸干灼烧只有①不能得到对应的原有物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
【答案】A
【解析】由于④中NH与HCO水解相互促进,故c(HCO)大小为③>④,c(CO)大小也是③>④,B错误;将各溶液蒸干后①③④⑤都分解,得不到原来的物质,C错误;Na2CO3只能与盐酸反应,而与NaOH溶液不反应,D错误;NH与CO水解相互促进,c(CO)大小为②>⑤,HCO既水解又电离,水解程度大于电离程度,c(CO)大小为③、④<②、⑤,H2CO3是弱酸,二级电离Ka2很小,H2CO3中的c(CO)最小,A正确。
典例7.有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与CH3COONa(混合溶液呈中性) ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合溶液呈碱性)。下列各项排序正确的是( )
A.pH:②<①<③<④ B.溶液中c(H+):①<③<②<④
C.c(NH):①<③<②<④ D.c(NH3·H2O):①<③<④<②
【答案】C
【解析】A项,④呈碱性,①呈中性,③呈弱酸性,②呈强酸性,pH:②<③<①<④,错误;B项,溶液中c(H+):④<①<③<②,错误;D项,c(NH3·H2O):②<③<①<④,错误。
典例8.下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol·L-1:①H2S溶液、②KHS溶液、③K2S溶液、④H2S和KHS混合溶液(已知常温下KHS溶液的pH>7)。下列说法正确的是( )
A.溶液的pH从大到小的顺序为③>②>①>④
B.在H2S和KHS混合溶液中:c(H2S)+c(HS-)+c(S2-)=2c(K+)
C.c(H2S)从大到小的顺序为①>④>③>②
D.在KHS溶液中:c(H+)+c(K+)=c(HS-)+c(S2-)+c(OH-)
【答案】B
【解析】H2S溶液、H2S和KHS混合溶液均显酸性,但HS-的存在抑制了H2S的电离,故pH:④>①;K2S溶液中S2-的水解程度大于KHS溶液中HS-的水解程度,则pH:③>②,故溶液pH从大到小的顺序为③>②>④>①,A错误。在浓度均为0.1 mol·L-1 H2S和KHS混合溶液中,根据物料守恒可得:c(H2S)+c(HS-)+c(S2-)=2c(K+),B正确。在K2S溶液中S2-发生两步水解生成H2S,而KHS溶液中HS-发生一步水解生成H2S,故溶液中c(H2S):②>③,C错误。在KHS溶液中根据电荷守恒可得:c(H+)+c(K+)=c(HS-)+2c(S2-)+c(OH-),D错误。
核心价值与学科素养
【知识结构化】
典例9.下列有关盐类水解的事实或应用、解释的说法不正确的是( )
选项 事实或应用 解释
A 用热的纯碱溶液去除油污 纯碱与油污直接发生反应,生成易溶于水的物质
B 泡沫灭火器灭火 Al2(SO4)3与NaHCO3溶液反应产生CO2气体
C 施肥时,草木灰(主要成分K2CO3)与NH4Cl不能混合使用 K2CO3与NH4Cl反应生成NH3,降低肥效
D 明矾[KAl(SO4)2·12H2O]作净水剂 明矾溶于水生成Al(OH)3胶体
【答案】A
【解析】用热的纯碱溶液去除油污,其原因是Na2CO3水解使溶液显碱性,油脂在碱性溶液中发生水解生成高级脂肪酸盐和甘油,并非纯碱与油污直接发生反应,A项错误;泡沫灭火器灭火的反应原理是利用Al2(SO4)3与NaHCO3溶液发生相互促进的水解反应:Al3++3HCO===Al(OH)3↓+3CO2↑,生成CO2气体,B项正确;K2CO3是弱酸强碱盐,NH4Cl是强酸弱碱盐,混合使用时,二者发生相互促进的水解反应生成NH3,降低肥效,C项正确;明矾溶于水电离产生的Al3+发生水解反应,生成Al(OH)3胶体,Al(OH)3胶体能吸附水中悬浮的杂质,从而起到净水作用,D项正确。
【跟踪练习】 基础过关
1. 生活中处处有化学,下列有关说法正确的是( )
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
【答案】D
【解析】A项,天然硬水是因为其中含有较多的Mg2+、Ca2+等离子,错误;B项,NH4Cl是强酸弱碱盐,水解显酸性,因此能溶解铁锈,错误;C项,惰性电极电解食盐水生成物是H2、Cl2、NaOH,Cl2与NaOH溶液反应可以制备漂白液,与水解无关,错误;D项,Na2CO3溶液中存在水解平衡CO+H2O??HCO+OH-,加入BaCl2溶液后生成BaCO3沉淀,c(CO)降低,溶液的碱性减弱,所以红色逐渐褪去,正确。
2. 已知某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是( )
A.NaHX的电离方程式为NaHX===Na++H++X2-
B.HX-的电离程度小于HX-的水解程度
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-)
D.加水稀释,促进HX-水解,c(HX-)增大
【答案】B
【解析】酸式盐(NaHX)溶液显碱性,HX-水解程度大于电离程度,说明H2X是弱酸,NaHX的电离方程式为NaHX===Na++HX-,A错误;溶液显碱性,HX-的电离程度小于HX-的水解程度,B正确;由电荷守恒可知离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),C错误;加水稀释,促进HX-水解,c(HX-)减小,D错误。
3. 为了得到比较纯净的物质,使用的方法恰当的是( )
A.向Na2CO3饱和溶液中,通入过量的CO2后,在加压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液可得到纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量的NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
【答案】D
【解析】A不正确,因为NaHCO3加热要分解;B、C项也不正确, 因为AlCl3与FeCl3在加热蒸发的情况下,水解趋于完全,分别发生下列反应:Al3++3H2OAl(OH)3+3H+,2Al(OH)3Al2O3+3H2O,Fe3++3H2OFe(OH)3+3H+,2Fe(OH)3Fe2O3+3H2O。
4. 常温下,浓度均为0.1 mol·L-1的四种盐溶液,其pH如表所示,下列说法正确的是( )
序号 ① ② ③ ④
溶液 CH3COONa NaHCO3 Na2CO3 NaClO
pH 8.8 9.7 11.6 10.3
A.等浓度的CH3COOH和HClO溶液,pH小的是HClO
B.Na2CO3和NaHCO3溶液中离子种类不同
C.溶液中水的电离程度:①>②>④>③
D.NaHCO3溶液中:c(Na+)=c(CO)+c(HCO)+c(H2CO3)
【答案】D
【解析】等浓度的CH3COONa和NaClO溶液相比,前者的pH小于后者,说明ClO-的水解程度大于CH3COO-的水解程度,根据盐类“越弱越水解”的规律推知,酸性:CH3COOH>HClO,故等浓度的CH3COOH和HClO溶液,pH小的是CH3COOH溶液,A错误;Na2CO3和NaHCO3溶液中均含有两种阳离子(Na+、H+)和三种阴离子(OH-、HCO、CO),B错误;盐的水解促进了水的电离,等浓度的四种盐溶液,盐的水解程度越大,溶液的pH越大;由表可知,水解程度:Na2CO3>NaClO>NaHCO3>CH3COONa,则水的电离程度:③>④>②>①,C错误;NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO)+c(HCO)+c(H2CO3),D正确。
5. 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度的大小关系一定是:
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
【答案】D
【解析】本题考查电解质溶液有关知识,意在考查考生综合分析问题的能力。常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,说明水的电离受到抑制,可能为酸溶液也可能为碱溶液,若为酸溶液,则pH=a,若为碱溶液,则pH=14-a,A项错误;当溶质为硫化钠时,浓度大小关系符合,当溶质为硫氢化钠和硫化氢,且溶液呈酸性时,浓度大小关系不符合,B项错误;由电荷守恒知,2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),混合液的pH等于7,故c(OH-)=c(H+),应有2c(R2-)+c(HR-)=c(Na+),C项错误;根据电荷守恒知,c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒知,c(A-)+c(HA)=2c(Na+),二者联立可得:2c(OH-)+c(A-)=2c(H+)+c(HA),D项正确。
能力达成
6. 室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A.NaHCO3 Na2CO3混合溶液(pH=10.30):c(Na+)>c(HCO)>c(OH-)>c(CO)
B.氨水 NH4Cl混合溶液(pH=9.25):c(NH)+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4 NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2O)+c(OH-)
【答案】D
【解析】CO的水解程度大于HCO的水解程度,HCO的水解程度大于其电离程度,所以溶液中c(Na+)>c(HCO)>c(CO)>c(OH-),A项错误;NH3·H2O的电离程度大于NH的水解程度,溶液中c(NH3·H2O)
7. FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2OFe(OH)+H+ K2
Fe(OH)+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2OFex(OH)+yH+,欲使平衡正向移动可采用的方法是________(填字母)。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是__________。
(2)天津某污水处理厂用聚合氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为______mg·L-1。
【答案】(1)K1>K2>K3 bd 调节溶液的pH (2)18~20
【解析】铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,所以答案选bd;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH。(2)由图像可知,聚合氯化铁的浓度在18~20 mg·L-1时,去除率达到最大值,污水的浑浊度减小。
8. 10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) 10 20 30 加热煮沸后冷却到50 ℃
pH 8.3 8.4 8.5 8.8
甲同学认为,该溶液的pH升高的原因是HCO的水解程度增大,故碱性增强,该反应的离子方程式为: 。
乙同学类比加热Ca(HCO3)2溶液,会出现________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:Na2CO3________NaHCO3(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明________(填“甲”或“乙”)判断正确。试剂X是________(填字母)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10 ℃,若溶液的pH________(填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。
【答案】HCO+H2OH2CO3+OH- 浑浊 大于 (1)乙 B (2)等于
【解析】(1)HCO水解方程式:HCO+H2O??H2CO3+OH-。
(2)加热煮沸后,若HCO分解成CO,加入BaCl2溶液则生成沉淀。不能选A、C、D,因为它们均有OH-,能与HCO反应生成CO。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
