酸碱盐化学基础知识梳理
图片预览



文档简介
酸:由氢离子和酸根离子构成的化合物(氢头酸尾)
酸的组成: H++酸根离子(Cl-、SO42-、NO3-、CO32-)
1.浓酸的性质
浓盐酸 浓硫酸 浓硝酸
色、态 无色、液体 无色、粘稠、油状液体 无色、液体
气味 有刺激性气味 无气味 有刺激性气味
特性 挥发性(瓶口形成白雾:盐酸小液滴) 吸水性(用于干燥O2、H2、CO2、SO2,不可以干燥NH3)——物理性质脱水性(腐蚀性)——化学性质3.强氧化性:与金属反应生成水等而不是H24.溶于水放热 1、挥发性(瓶口形成白雾)2.强氧化性
2.酸的通性:溶液中都有H+
化学方程式
①与指示剂作用 酸溶液可使紫色石蕊试液变红酸溶液不能使无色酚酞试液变色
②与活泼金属反应 酸+活泼金属→盐+氢气 (酸不指“浓硫酸、硝酸”这两种氧化性酸)
③与金属氧化物反应(复分解反应) 酸+金属氧化物→盐+水 (除锈)
④与碱反应(复分解反应) 酸+碱→盐+水
⑤与某些盐反应 (复分解反应) 酸+盐→新酸+新盐(反应条件:生成物中至少有“”之一)
二、碱:由金属离子和氢氧根离子构成的化合物(金或铵头碱尾)
碱的组成: 金属离子或铵根离子(Na+、K+、Ca2+、Ba2+、NH4+)+OH-
1、固体氢氧化钠和氢氧化钙的性质
氢氧化钠 氢氧化钙
俗名 火碱、烧碱、苛性钠 熟石灰、消石灰
色、态 白色、片状固体 白色、粉末状固体
溶解性 1.极易溶于水,溶解放热2.易潮解(用于干燥气体如O2、H2、CO、NH3不可以干燥CO2、SO2) 微溶于水
腐蚀性 有较强的腐蚀性 有一定的腐蚀性(比NaOH弱)(改良酸性土壤)
水溶液 PH>7 PH>7,水溶液成为石灰水
2、碱的通性 溶液中都有H+
化学方程式
①与指示剂作用 碱溶液可使紫色石蕊试液变蓝碱溶液可使无色酚酞试液变红
②与部分非金属氧化物反应 碱+非金属氧化物→盐+水(反应条件:碱必须为“碱溶液”)
③与碱反应(复分解反应) 碱+酸→盐+水
④与某些盐反应 (复分解反应) 碱+盐→新碱+新盐(反应条件:①反应物“碱和盐”必须为“碱溶液、盐溶液”;②生成物中至少有“”之一)
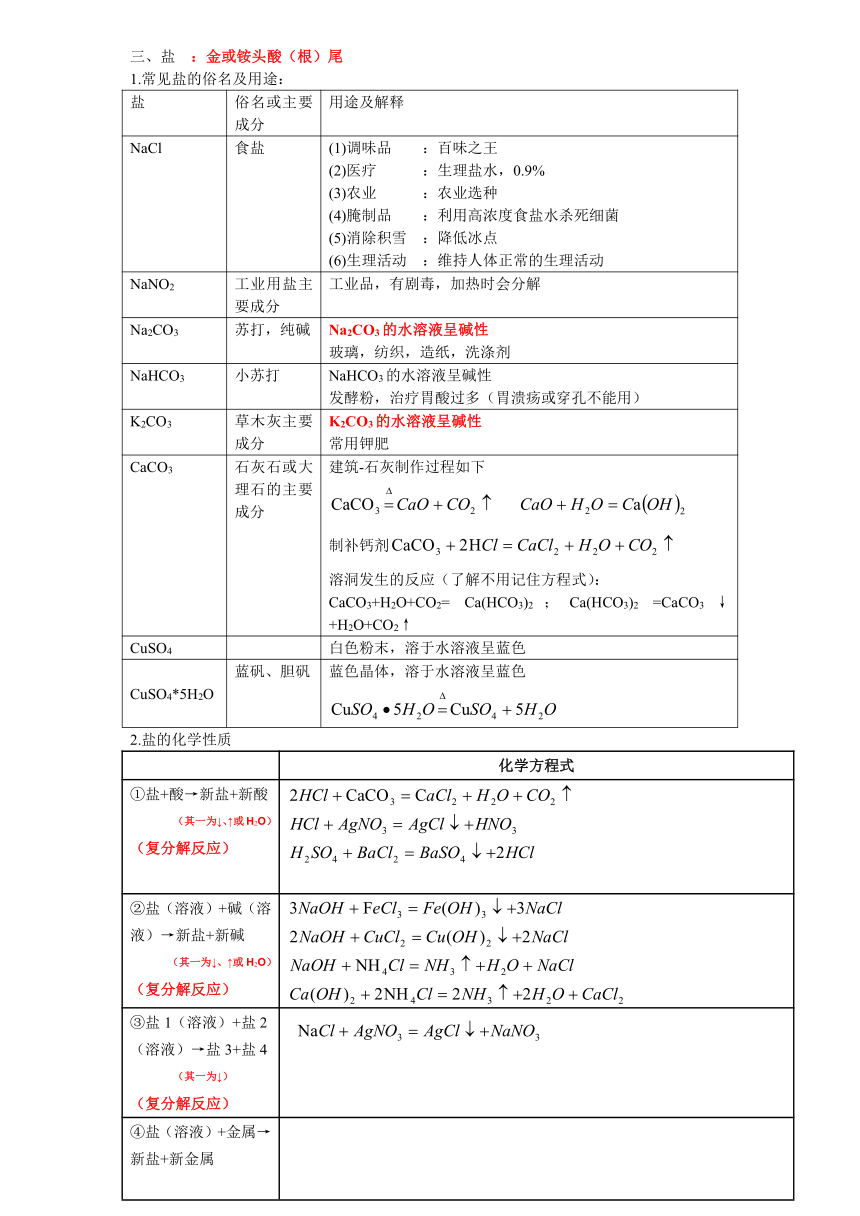
三、盐 :金或铵头酸(根)尾
1.常见盐的俗名及用途:
盐 俗名或主要成分 用途及解释
NaCl 食盐 (1)调味品 :百味之王 (2)医疗 :生理盐水,0.9%(3)农业 :农业选种(4)腌制品 :利用高浓度食盐水杀死细菌(5)消除积雪 :降低冰点(6)生理活动 :维持人体正常的生理活动
NaNO2 工业用盐主要成分 工业品,有剧毒,加热时会分解
Na2CO3 苏打,纯碱 Na2CO3的水溶液呈碱性玻璃,纺织,造纸,洗涤剂
NaHCO3 小苏打 NaHCO3的水溶液呈碱性发酵粉,治疗胃酸过多(胃溃疡或穿孔不能用)
K2CO3 草木灰主要成分 K2CO3的水溶液呈碱性常用钾肥
CaCO3 石灰石或大理石的主要成分 建筑-石灰制作过程如下制补钙剂溶洞发生的反应(了解不用记住方程式):CaCO3+H2O+CO2= Ca(HCO3)2;Ca(HCO3)2 =CaCO3↓+H2O+CO2↑
CuSO4 白色粉末,溶于水溶液呈蓝色
CuSO4*5H2O 蓝矾、胆矾 蓝色晶体,溶于水溶液呈蓝色
2.盐的化学性质
化学方程式
①盐+酸→新盐+新酸(其一为↓、↑或H2O)(复分解反应)
②盐(溶液)+碱(溶液)→新盐+新碱 (其一为↓、↑或H2O)(复分解反应)
③盐1(溶液)+盐2(溶液)→盐3+盐4(其一为↓)(复分解反应)
④盐(溶液)+金属→新盐+新金属
复分解反应 :由两种化合物互相交换成份,生成另外两种化合物的反应AB+CD=AD+CB
特点:①内内结合,外外结合 ;②元素化合价不变;
2.复分解反应发生的条件:
反应物:有酸 酸溶即可,无酸两都溶
生成物:之一为沉淀、气体或水。(具备了其中一个条件就可发生)
3.反应规律总结:
1、酸+金属氧化物=盐+水
2、酸+碱=盐+水(中和反应)
3、酸+盐=新酸+新盐
4、碱+盐=新碱+新盐
5、盐1+盐2=新盐3+新盐4
注意:非金属氧化物 + 碱=盐 + 水 (碱溶于水,元素化合价不变)不属于复分解反应
常见的沉淀:
氧气
(1)氧气的物理性质。
常温下,氧气是一种无色无味的气体,不易溶于水。在标准状况下,氧气的密度比空气略大。
三态变化:氧气(无色气体) 液氧(淡蓝色液体) 固态氧(淡蓝色雪花状)
(2)氧气的化学性质。
氧气是一种化学性质比较活泼的气体,能支持燃烧,有较强的氧化性。
化学反应
与木炭(灰黑色)反应 C+ O2CO2(O2充足)2C+ O22CO(O2不充足)
与硫(淡黄色)反应 S+ O2SO2
与红磷(暗红色固体) 4P+5O22P2O5(白色粉末)
与铁(银白色固体)反应 3Fe+2O2Fe3O4
镁(银白色固体) 2Mg+ O22MgO
与化合物的反应 2CO+ O22CO2CH4+ 2O2CO2+2H2OC2H5OH+3O22CO2+3H2O
氧气制取 2KClO3═══KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑2 H2O2=======2 H2O + O2↑
二氧化碳
(1)二氧化碳的物理性质
通常情况下为无色无味的气体(加压降温:无色气体→无色液体→白色固体(俗称“干冰”)),密度比空气大,能溶于水。
(2)二氧化碳的化学性质
①二氧化碳不能燃烧,一般也不支持燃烧
(一些活泼的金属在二氧化碳中可以燃烧,如2Mg+CO22MgO+C)
②二氧化碳能与水反应生成碳酸,而碳酸极不稳定,易分解
CO2+H2OH2CO3 H2CO3CO2↑+H2O
③能与碱溶液反应
二氧化碳的制取
实验室:
工业:
单质碳及其化合物之间的互相转化规律:
金属
常见金属的化学性质
①大多数金属能与O2反应
②金属能与酸反应(Fe→Fe2+)
③金属能与盐溶液反应(Fe→Fe2+)
金属冶炼
常见物质的主要物理特征:
固体 白色 CuSO4 MgO P2O5 CaO Ca(OH)2 CaCO3NaCl Na2CO3 NaOH
红色 CuO Fe2O3
黑色 C(木炭) CuO MnO2 Fe3O4 Fe粉
蓝色
淡黄色 S
液体 蓝色 含Cu2+的溶液
黄色 含Fe3+的溶液
浅绿色 含Fe2+的溶液
紫红色 KMnO4溶液 紫色石蕊试液
气体 有刺激性气味 HCl NH3 SO2
有颜色的气体 Cl2(黄绿色) NO2(红棕色)
无色无味气体 O2 H2 N2 CO CO2
常见的沉淀_离子组合:
-218℃
101kPa
-183℃
101kPa
MnO2
△
MnO2
酸的组成: H++酸根离子(Cl-、SO42-、NO3-、CO32-)
1.浓酸的性质
浓盐酸 浓硫酸 浓硝酸
色、态 无色、液体 无色、粘稠、油状液体 无色、液体
气味 有刺激性气味 无气味 有刺激性气味
特性 挥发性(瓶口形成白雾:盐酸小液滴) 吸水性(用于干燥O2、H2、CO2、SO2,不可以干燥NH3)——物理性质脱水性(腐蚀性)——化学性质3.强氧化性:与金属反应生成水等而不是H24.溶于水放热 1、挥发性(瓶口形成白雾)2.强氧化性
2.酸的通性:溶液中都有H+
化学方程式
①与指示剂作用 酸溶液可使紫色石蕊试液变红酸溶液不能使无色酚酞试液变色
②与活泼金属反应 酸+活泼金属→盐+氢气 (酸不指“浓硫酸、硝酸”这两种氧化性酸)
③与金属氧化物反应(复分解反应) 酸+金属氧化物→盐+水 (除锈)
④与碱反应(复分解反应) 酸+碱→盐+水
⑤与某些盐反应 (复分解反应) 酸+盐→新酸+新盐(反应条件:生成物中至少有“”之一)
二、碱:由金属离子和氢氧根离子构成的化合物(金或铵头碱尾)
碱的组成: 金属离子或铵根离子(Na+、K+、Ca2+、Ba2+、NH4+)+OH-
1、固体氢氧化钠和氢氧化钙的性质
氢氧化钠 氢氧化钙
俗名 火碱、烧碱、苛性钠 熟石灰、消石灰
色、态 白色、片状固体 白色、粉末状固体
溶解性 1.极易溶于水,溶解放热2.易潮解(用于干燥气体如O2、H2、CO、NH3不可以干燥CO2、SO2) 微溶于水
腐蚀性 有较强的腐蚀性 有一定的腐蚀性(比NaOH弱)(改良酸性土壤)
水溶液 PH>7 PH>7,水溶液成为石灰水
2、碱的通性 溶液中都有H+
化学方程式
①与指示剂作用 碱溶液可使紫色石蕊试液变蓝碱溶液可使无色酚酞试液变红
②与部分非金属氧化物反应 碱+非金属氧化物→盐+水(反应条件:碱必须为“碱溶液”)
③与碱反应(复分解反应) 碱+酸→盐+水
④与某些盐反应 (复分解反应) 碱+盐→新碱+新盐(反应条件:①反应物“碱和盐”必须为“碱溶液、盐溶液”;②生成物中至少有“”之一)
三、盐 :金或铵头酸(根)尾
1.常见盐的俗名及用途:
盐 俗名或主要成分 用途及解释
NaCl 食盐 (1)调味品 :百味之王 (2)医疗 :生理盐水,0.9%(3)农业 :农业选种(4)腌制品 :利用高浓度食盐水杀死细菌(5)消除积雪 :降低冰点(6)生理活动 :维持人体正常的生理活动
NaNO2 工业用盐主要成分 工业品,有剧毒,加热时会分解
Na2CO3 苏打,纯碱 Na2CO3的水溶液呈碱性玻璃,纺织,造纸,洗涤剂
NaHCO3 小苏打 NaHCO3的水溶液呈碱性发酵粉,治疗胃酸过多(胃溃疡或穿孔不能用)
K2CO3 草木灰主要成分 K2CO3的水溶液呈碱性常用钾肥
CaCO3 石灰石或大理石的主要成分 建筑-石灰制作过程如下制补钙剂溶洞发生的反应(了解不用记住方程式):CaCO3+H2O+CO2= Ca(HCO3)2;Ca(HCO3)2 =CaCO3↓+H2O+CO2↑
CuSO4 白色粉末,溶于水溶液呈蓝色
CuSO4*5H2O 蓝矾、胆矾 蓝色晶体,溶于水溶液呈蓝色
2.盐的化学性质
化学方程式
①盐+酸→新盐+新酸(其一为↓、↑或H2O)(复分解反应)
②盐(溶液)+碱(溶液)→新盐+新碱 (其一为↓、↑或H2O)(复分解反应)
③盐1(溶液)+盐2(溶液)→盐3+盐4(其一为↓)(复分解反应)
④盐(溶液)+金属→新盐+新金属
复分解反应 :由两种化合物互相交换成份,生成另外两种化合物的反应AB+CD=AD+CB
特点:①内内结合,外外结合 ;②元素化合价不变;
2.复分解反应发生的条件:
反应物:有酸 酸溶即可,无酸两都溶
生成物:之一为沉淀、气体或水。(具备了其中一个条件就可发生)
3.反应规律总结:
1、酸+金属氧化物=盐+水
2、酸+碱=盐+水(中和反应)
3、酸+盐=新酸+新盐
4、碱+盐=新碱+新盐
5、盐1+盐2=新盐3+新盐4
注意:非金属氧化物 + 碱=盐 + 水 (碱溶于水,元素化合价不变)不属于复分解反应
常见的沉淀:
氧气
(1)氧气的物理性质。
常温下,氧气是一种无色无味的气体,不易溶于水。在标准状况下,氧气的密度比空气略大。
三态变化:氧气(无色气体) 液氧(淡蓝色液体) 固态氧(淡蓝色雪花状)
(2)氧气的化学性质。
氧气是一种化学性质比较活泼的气体,能支持燃烧,有较强的氧化性。
化学反应
与木炭(灰黑色)反应 C+ O2CO2(O2充足)2C+ O22CO(O2不充足)
与硫(淡黄色)反应 S+ O2SO2
与红磷(暗红色固体) 4P+5O22P2O5(白色粉末)
与铁(银白色固体)反应 3Fe+2O2Fe3O4
镁(银白色固体) 2Mg+ O22MgO
与化合物的反应 2CO+ O22CO2CH4+ 2O2CO2+2H2OC2H5OH+3O22CO2+3H2O
氧气制取 2KClO3═══KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑2 H2O2=======2 H2O + O2↑
二氧化碳
(1)二氧化碳的物理性质
通常情况下为无色无味的气体(加压降温:无色气体→无色液体→白色固体(俗称“干冰”)),密度比空气大,能溶于水。
(2)二氧化碳的化学性质
①二氧化碳不能燃烧,一般也不支持燃烧
(一些活泼的金属在二氧化碳中可以燃烧,如2Mg+CO22MgO+C)
②二氧化碳能与水反应生成碳酸,而碳酸极不稳定,易分解
CO2+H2OH2CO3 H2CO3CO2↑+H2O
③能与碱溶液反应
二氧化碳的制取
实验室:
工业:
单质碳及其化合物之间的互相转化规律:
金属
常见金属的化学性质
①大多数金属能与O2反应
②金属能与酸反应(Fe→Fe2+)
③金属能与盐溶液反应(Fe→Fe2+)
金属冶炼
常见物质的主要物理特征:
固体 白色 CuSO4 MgO P2O5 CaO Ca(OH)2 CaCO3NaCl Na2CO3 NaOH
红色 CuO Fe2O3
黑色 C(木炭) CuO MnO2 Fe3O4 Fe粉
蓝色
淡黄色 S
液体 蓝色 含Cu2+的溶液
黄色 含Fe3+的溶液
浅绿色 含Fe2+的溶液
紫红色 KMnO4溶液 紫色石蕊试液
气体 有刺激性气味 HCl NH3 SO2
有颜色的气体 Cl2(黄绿色) NO2(红棕色)
无色无味气体 O2 H2 N2 CO CO2
常见的沉淀_离子组合:
-218℃
101kPa
-183℃
101kPa
MnO2
△
MnO2
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
