人教版化学九上第二单元课题1 空气(第1课时)课件(共34张PPT)
文档属性
| 名称 | 人教版化学九上第二单元课题1 空气(第1课时)课件(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-07 18:02:03 | ||
图片预览










文档简介
(共34张PPT)
课题1 空气
第二单元 我们周围的空气
第1课时
1.用空气的成分填空:空气能供呼吸,含有_____;空调制冷,压缩机小管有液体流出,空气含有_________。
氧气
水蒸气
2.按右图①和②进行实验。实验操作:将注射器的活塞从0刻度拉至25 mL。瓶内空气抽走了_____mL。烧杯中的水将_______,体积约为_____mL。
25
倒流
25
LOGO
一、空气是由什么组分组成的
(一)空气是的组成
为了搞清楚空气的成分,很多科学家致力于这方面的研究,如瑞典化学家舍勒和英国化学家普里斯特里。
舍 勒
瑞典化学家,氧气的发现人之一,同时对二氧化碳等多种气体都有深入的研究。
普利斯特里
英国化学家,自学成才的气体化学大师。
法国化学家
拉瓦锡
他建立了燃烧理论,创立了化学物质分类新体系,开创了化学发展的新纪元。
为了搞清楚空气的成分,很多科学家致力于这方面的研究,其中最有名的就是法国化学家拉瓦锡做的实验。
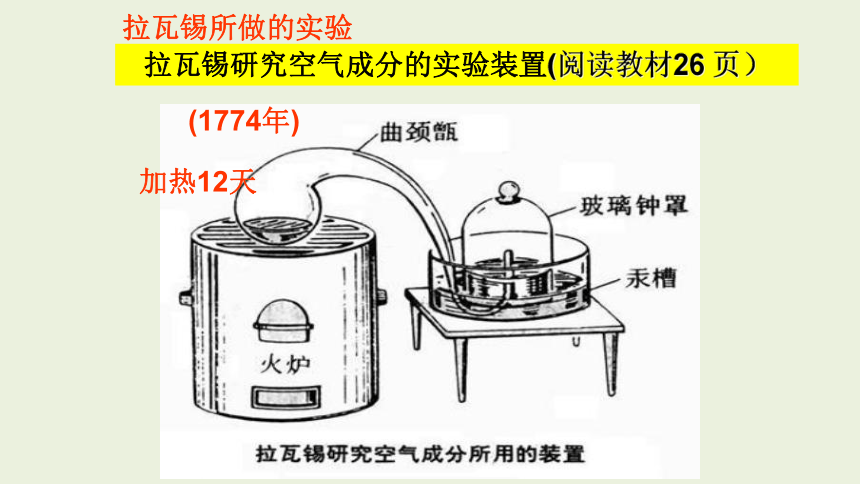
拉瓦锡研究空气成分的实验装置(阅读教材26 页)
(1774年)
拉瓦锡所做的实验
加热12天
二百多年前(1774年),法国化学家拉瓦锡用定量的方法研究了空气的成分。他把少量汞放在密闭的容器里连续加热12天。发现有一部分银白色的液态汞变成红色粉未,同时容器里空气的体积差不多减少了1/5。他研究了剩余4/5体积的气体,发现这部分气体既不能供给呼吸,也不能支持燃烧,他误认为这些气体全部都是氮气(拉丁文原意是“不能维持生命”)。
拉瓦锡把在汞表面上所生成的红色粉未收集起来,放在另一个较小的容器里再加强热,得到了汞和氧气,而且氧气的体积恰好等于密闭容器里所减少的体积。他把得到的氧气加到前一个容器里剩下的4/5体积的气体中,结果所得气体跟空气的性质完全一样。
加热12天
拉瓦锡得出了空气由氧气(O2)和氮气(N2)组成,其中,氧气约占空气体积的1/5的结论。
知识点1 空气组成的探究
1.拉瓦锡对空气组成的探究
【课堂活动1】阅读课本第26页,了解拉瓦锡探究空气中氧气含量的实验,思考完成以下问题:
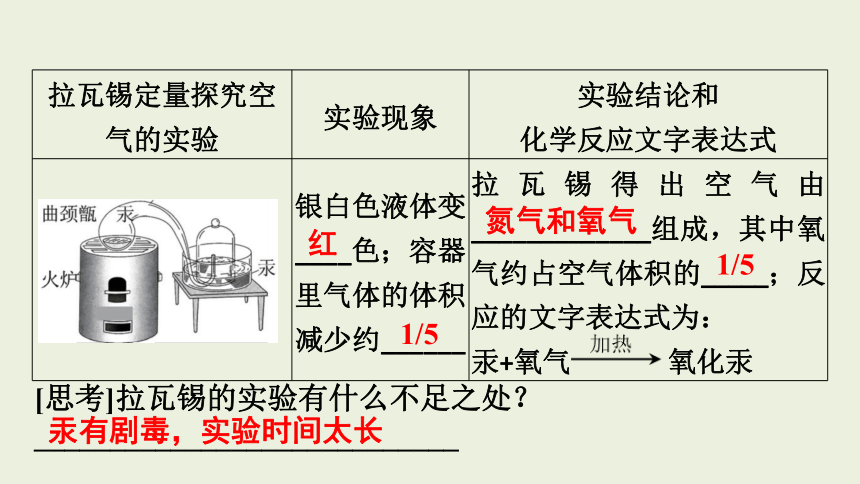
拉瓦锡定量探究空气的实验 实验现象 实验结论和
化学反应文字表达式
银白色液体变____色;容器里气体的体积减少约______ 拉瓦锡得出空气由_____________组成,其中氧气约占空气体积的_____;反应的文字表达式为:
汞+氧气 氧化汞
[思考]拉瓦锡的实验有什么不足之处?
____________________________
红
1/5
氮气和氧气
1/5
汞有剧毒,实验时间太长
在密闭容器中,利用可燃物燃烧消耗氧气,使容器内气压减小,与外界大气压形成压强差,将水压入容器内,进入水的体积即是容器内空气中氧气的体积。
1. 实验原理:
验证空气中氧气体积含量的实验
①能够在空气中燃烧,且只能和氧气发生反应,不能和空气中的其他成分发生反应。
②生成物最好是固体,如果是气体要能被液体吸收。
2. 可燃物的选择:
思考:我们知道的可燃物有哪些?
C、S、P、Fe、Mg、石蜡
×
×
×
×
×
红P或白P
2.实验室仿照实验
【课堂活动2】观察课本第27页演示实验“实验2-1”,记录和分析实验现象:
实验步骤:
①连接装置并检查装置的气密性;
②在集气瓶内装入少量的水,再把剩余的容积分成五等份,并用橡皮筋做上记号;
③用弹簧夹夹紧乳胶管,点燃燃烧匙内的红磷,立即伸入瓶中,并把塞子塞紧;
④燃烧结束并冷却至室温后,打开弹簧夹。
测定空气中氧气体积含量 实验现象 实验分析和结论
红磷燃烧,产生___________; ①先在集气瓶中加入少量水的作用是____________________
②化学反应的文字表达式:
红磷+氧气
_________________;
③空气中氧气约占体积的______
冷却后,打开弹簧夹,__________________ __________________ 大量白烟
水倒流进入集气瓶中
约占瓶内体积的1/5。(至刻度1)
吸收白烟和降温
五氧化二磷
1/5
红磷+氧气 五氧化二磷
点燃
P
O2
P2O5
[小结]实验的原理是:利用红磷燃烧消耗瓶内的_______,生成____(“气”或“固”)体物质,使瓶内气体体积_________(填“增大”或“减小”)、压强________(填“增大”或“减小”),烧杯中的水会_________________,来推测空气里氧气的含量。
氧气
固
减小
减小
被压入集气瓶
[思考]测定氧气含量的实验中,集气瓶内剩余的气体主要是氮气。据此讨论。
(1)氮气的性质:红磷熄灭了,这种现象说明氮气具有的化学性质是__________________________________________;集气瓶内水面上升一定高度后,不能继续上升,得到氮气的物理性质是___________。
不能燃烧,不支持燃烧(或化学性质不活泼)
难溶于水
(2)实验误差:
①如果装置漏气,测出氧气的含量会________(填“偏大”“偏小”,下同);如果红磷的量很少,实验中测出氧气的含量会________;如果装置没有冷却就打开弹簧夹,测出氧气的含量会_________。
②如果实验中没有用弹簧夹夹紧胶皮管,实验过程中集气瓶内气体受热________,会沿导气管逸出,当红磷熄灭并冷却后,测出氧气的含量会_______(填“偏大”“偏小”)。
偏小
偏小
偏小
膨胀
偏大
实验结论:
空气中氧气约占空气总体积的1/5。
注意事项:
①红磷要过量; ②装置必须密封;
③完全冷却后打开弹簧夹;
④插入燃烧匙的速度要快;
⑤弹簧夹要夹紧; ⑥集气瓶内加入少量水
⑦实验所用药品一般为红磷,不能用硫、木炭、铁丝等物质代替。
红磷
弹簧夹
水
【课堂练习1】有关刚刚完成的测定空气中氧气的体积分数实验,下列说法不正确的是( )
A.实验时取用的红磷应足量
B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹
D.最终进入瓶中水的体积约为氧气的体积
C
实验误差小,环保,节能
实验装置的再设计
知识点2 空气的组成
【课堂活动3】阅读课本第27页,了解空气的组成成分并填写下表:
成分
体积分数
78%
氧气
21%
稀有气体
0.94%
二氧化碳
0.03%
其他气体
0.03%
氮气
三 区分混合物和纯净物
不同的“水”:海水、河水、雨水、自来水、矿泉水、蒸馏水、冰水和市售纯净水。
上述所列物质中,哪些是混合物,哪些是纯净物?怎样来确定物质是纯净物还是混合物?
三 纯净物和混合物
由两种或两种以上的物质混合而成的物质叫做混合物。
只由一种物质组成的物质叫做纯净物。
它们之间有怎样的联系呢?
纯净物 混合物
特性
表示方法
举例
联系 有固定的组成和性质,如熔点、沸点等
没有固定的组成和性质,各物质都保持各自的性质
可用化学符号表示,如氮气(N2)、二氧化碳(CO2)等
不能用固定的化学符号来表示
氧气(O2)、硫(S)、一氧化碳(CO)、水(H2O)、氦气(He)、红磷(P)、五氧化二磷(P2O5)等
空气、稀有气体、海水、糖水等
混合物 纯净物
分离、提纯
混合
知识点3 纯净物和混合物
【课堂活动4】分析下列物质的组成,其中由同种物质组成的是_______________(填序号,下同),由不同物质组成的是__________。
①氧气 ②氮气
③二氧化碳 ④森林里的空气
⑤澄清石灰水 ⑥水
⑦五氧化二磷 ⑧稀盐酸
①②③⑥⑦
④⑤⑧
[归纳提升]
纯净物和混合物是根据物质的种类来划分的。只含有一种物质的就属于纯净物,含有两种或两种以上物质的就属于混合物。具体区分时不要被表面的一些字眼所迷惑,如洁净的空气、纯净的食盐水等均属于混合物,而冰水混合物则是由一种物质组成的纯净物。
纯净物:
物质
由一种物质组成。
(可以用专门的化学符号表示)
混合物:
如:氮气N2、氧气O2、二氧化碳CO2、红磷P、五氧化二磷P2O5、水H2O等。
由两种或多种物质组成。
如:空气、矿泉水、泥水、汤水、可口可乐、啤酒等。
小结:
纯净物与混合物
[小结]纯净物:___________________________;
混合物:___________________________。
【课堂练习2】下列物质里,属于混合物的有:________________(填序号)。
①红磷 ②自来水 ③胆矾晶体
④冰水混合物 ⑤稀有气体 ⑥加碘盐
⑦氮气 ⑧大理石 ⑨低钠盐
⑩液态空气
由同种物质组成的物质
由不同种物质组成的物质
②⑤⑥⑧⑨⑩
1.空气中含量较多且性质不活泼的气体是( )
A.氧气 B.氮气
C.二氧化碳 D.水蒸气
2.下列气体不是空气中固定成分的是( )
A.氧气 B.氮气
C.稀有气体 D.二氧化硫
B
D
测评反馈
3.下列属于纯净物的是( )
A.新鲜空气 B.澄清石灰水
C.冰水混合物 D.矿泉水
4.区分氮气和二氧化碳气体,可根据它们下列性质中的( )
A.颜色 B.能否使火焰熄灭
C.气味 D.能否使石灰水变浑浊
C
D
5.空气中氧气含量测定的实验装置如图所示。下列有关说法正确的是( )
A.燃烧匙中的红磷可以换成木炭
B.选用红磷是因为它消耗氧气,生成固态的
五氧化二磷,使钟罩内的压强减小
C.本实验可以证明空气含有N2、O2、CO2和稀有气体
D.燃烧匙中的红磷越多,水位上升越高
B
1.空气中氧气体积分数测定的探究实验解析。
(1)药品选择:①只能与空气中O2反应,②生成物没有气体(如不选蜡烛、木炭、硫)。因此选择红磷等物质。
(2)实验结论的表达:空气中氧气约占体积的1/5。关键词:“约”“体积”(不是“质量”)。
名师点睛
(3)操作注意点:①红磷要过量,装置必须密封,点燃红磷之前要用弹簧夹夹紧胶管;②点燃红磷后要立即伸入瓶中,迅速塞紧塞子,目的是防止瓶内空气受热逸出,导致结果偏大;③瓶中加水的目的:降温、吸收五氧化二磷。
(4)实验误差:①偏小:装置漏气、红磷不足等;②偏大:点燃红磷前没有夹紧弹簧夹等。
(5)实验的改进。改进总的目的是提高实验的精确度,减少对空气的污染。主要思路如下:
①在装置内点燃红磷,避免瓶内空气受热膨胀逸出,同时避免五氧化二磷扩散到空气中污染空气;
②使用量筒或有刻度的玻璃管,主要是便于计算出实验结果。
2.易错点:①“烟”“雾”“气”的判断(“烟”是固体小颗粒分散在空气中;“雾”是小液滴分散在空气中。红磷在空气中燃烧产生浓厚的白烟,不是“白雾”);②氧气、氮气等在空气中的含量是“体积分数”不是“质量分数”;③“稀有气体”为混合物,“冰水混合物”为纯净物。
课题1 空气
第二单元 我们周围的空气
第1课时
1.用空气的成分填空:空气能供呼吸,含有_____;空调制冷,压缩机小管有液体流出,空气含有_________。
氧气
水蒸气
2.按右图①和②进行实验。实验操作:将注射器的活塞从0刻度拉至25 mL。瓶内空气抽走了_____mL。烧杯中的水将_______,体积约为_____mL。
25
倒流
25
LOGO
一、空气是由什么组分组成的
(一)空气是的组成
为了搞清楚空气的成分,很多科学家致力于这方面的研究,如瑞典化学家舍勒和英国化学家普里斯特里。
舍 勒
瑞典化学家,氧气的发现人之一,同时对二氧化碳等多种气体都有深入的研究。
普利斯特里
英国化学家,自学成才的气体化学大师。
法国化学家
拉瓦锡
他建立了燃烧理论,创立了化学物质分类新体系,开创了化学发展的新纪元。
为了搞清楚空气的成分,很多科学家致力于这方面的研究,其中最有名的就是法国化学家拉瓦锡做的实验。
拉瓦锡研究空气成分的实验装置(阅读教材26 页)
(1774年)
拉瓦锡所做的实验
加热12天
二百多年前(1774年),法国化学家拉瓦锡用定量的方法研究了空气的成分。他把少量汞放在密闭的容器里连续加热12天。发现有一部分银白色的液态汞变成红色粉未,同时容器里空气的体积差不多减少了1/5。他研究了剩余4/5体积的气体,发现这部分气体既不能供给呼吸,也不能支持燃烧,他误认为这些气体全部都是氮气(拉丁文原意是“不能维持生命”)。
拉瓦锡把在汞表面上所生成的红色粉未收集起来,放在另一个较小的容器里再加强热,得到了汞和氧气,而且氧气的体积恰好等于密闭容器里所减少的体积。他把得到的氧气加到前一个容器里剩下的4/5体积的气体中,结果所得气体跟空气的性质完全一样。
加热12天
拉瓦锡得出了空气由氧气(O2)和氮气(N2)组成,其中,氧气约占空气体积的1/5的结论。
知识点1 空气组成的探究
1.拉瓦锡对空气组成的探究
【课堂活动1】阅读课本第26页,了解拉瓦锡探究空气中氧气含量的实验,思考完成以下问题:
拉瓦锡定量探究空气的实验 实验现象 实验结论和
化学反应文字表达式
银白色液体变____色;容器里气体的体积减少约______ 拉瓦锡得出空气由_____________组成,其中氧气约占空气体积的_____;反应的文字表达式为:
汞+氧气 氧化汞
[思考]拉瓦锡的实验有什么不足之处?
____________________________
红
1/5
氮气和氧气
1/5
汞有剧毒,实验时间太长
在密闭容器中,利用可燃物燃烧消耗氧气,使容器内气压减小,与外界大气压形成压强差,将水压入容器内,进入水的体积即是容器内空气中氧气的体积。
1. 实验原理:
验证空气中氧气体积含量的实验
①能够在空气中燃烧,且只能和氧气发生反应,不能和空气中的其他成分发生反应。
②生成物最好是固体,如果是气体要能被液体吸收。
2. 可燃物的选择:
思考:我们知道的可燃物有哪些?
C、S、P、Fe、Mg、石蜡
×
×
×
×
×
红P或白P
2.实验室仿照实验
【课堂活动2】观察课本第27页演示实验“实验2-1”,记录和分析实验现象:
实验步骤:
①连接装置并检查装置的气密性;
②在集气瓶内装入少量的水,再把剩余的容积分成五等份,并用橡皮筋做上记号;
③用弹簧夹夹紧乳胶管,点燃燃烧匙内的红磷,立即伸入瓶中,并把塞子塞紧;
④燃烧结束并冷却至室温后,打开弹簧夹。
测定空气中氧气体积含量 实验现象 实验分析和结论
红磷燃烧,产生___________; ①先在集气瓶中加入少量水的作用是____________________
②化学反应的文字表达式:
红磷+氧气
_________________;
③空气中氧气约占体积的______
冷却后,打开弹簧夹,__________________ __________________ 大量白烟
水倒流进入集气瓶中
约占瓶内体积的1/5。(至刻度1)
吸收白烟和降温
五氧化二磷
1/5
红磷+氧气 五氧化二磷
点燃
P
O2
P2O5
[小结]实验的原理是:利用红磷燃烧消耗瓶内的_______,生成____(“气”或“固”)体物质,使瓶内气体体积_________(填“增大”或“减小”)、压强________(填“增大”或“减小”),烧杯中的水会_________________,来推测空气里氧气的含量。
氧气
固
减小
减小
被压入集气瓶
[思考]测定氧气含量的实验中,集气瓶内剩余的气体主要是氮气。据此讨论。
(1)氮气的性质:红磷熄灭了,这种现象说明氮气具有的化学性质是__________________________________________;集气瓶内水面上升一定高度后,不能继续上升,得到氮气的物理性质是___________。
不能燃烧,不支持燃烧(或化学性质不活泼)
难溶于水
(2)实验误差:
①如果装置漏气,测出氧气的含量会________(填“偏大”“偏小”,下同);如果红磷的量很少,实验中测出氧气的含量会________;如果装置没有冷却就打开弹簧夹,测出氧气的含量会_________。
②如果实验中没有用弹簧夹夹紧胶皮管,实验过程中集气瓶内气体受热________,会沿导气管逸出,当红磷熄灭并冷却后,测出氧气的含量会_______(填“偏大”“偏小”)。
偏小
偏小
偏小
膨胀
偏大
实验结论:
空气中氧气约占空气总体积的1/5。
注意事项:
①红磷要过量; ②装置必须密封;
③完全冷却后打开弹簧夹;
④插入燃烧匙的速度要快;
⑤弹簧夹要夹紧; ⑥集气瓶内加入少量水
⑦实验所用药品一般为红磷,不能用硫、木炭、铁丝等物质代替。
红磷
弹簧夹
水
【课堂练习1】有关刚刚完成的测定空气中氧气的体积分数实验,下列说法不正确的是( )
A.实验时取用的红磷应足量
B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹
D.最终进入瓶中水的体积约为氧气的体积
C
实验误差小,环保,节能
实验装置的再设计
知识点2 空气的组成
【课堂活动3】阅读课本第27页,了解空气的组成成分并填写下表:
成分
体积分数
78%
氧气
21%
稀有气体
0.94%
二氧化碳
0.03%
其他气体
0.03%
氮气
三 区分混合物和纯净物
不同的“水”:海水、河水、雨水、自来水、矿泉水、蒸馏水、冰水和市售纯净水。
上述所列物质中,哪些是混合物,哪些是纯净物?怎样来确定物质是纯净物还是混合物?
三 纯净物和混合物
由两种或两种以上的物质混合而成的物质叫做混合物。
只由一种物质组成的物质叫做纯净物。
它们之间有怎样的联系呢?
纯净物 混合物
特性
表示方法
举例
联系 有固定的组成和性质,如熔点、沸点等
没有固定的组成和性质,各物质都保持各自的性质
可用化学符号表示,如氮气(N2)、二氧化碳(CO2)等
不能用固定的化学符号来表示
氧气(O2)、硫(S)、一氧化碳(CO)、水(H2O)、氦气(He)、红磷(P)、五氧化二磷(P2O5)等
空气、稀有气体、海水、糖水等
混合物 纯净物
分离、提纯
混合
知识点3 纯净物和混合物
【课堂活动4】分析下列物质的组成,其中由同种物质组成的是_______________(填序号,下同),由不同物质组成的是__________。
①氧气 ②氮气
③二氧化碳 ④森林里的空气
⑤澄清石灰水 ⑥水
⑦五氧化二磷 ⑧稀盐酸
①②③⑥⑦
④⑤⑧
[归纳提升]
纯净物和混合物是根据物质的种类来划分的。只含有一种物质的就属于纯净物,含有两种或两种以上物质的就属于混合物。具体区分时不要被表面的一些字眼所迷惑,如洁净的空气、纯净的食盐水等均属于混合物,而冰水混合物则是由一种物质组成的纯净物。
纯净物:
物质
由一种物质组成。
(可以用专门的化学符号表示)
混合物:
如:氮气N2、氧气O2、二氧化碳CO2、红磷P、五氧化二磷P2O5、水H2O等。
由两种或多种物质组成。
如:空气、矿泉水、泥水、汤水、可口可乐、啤酒等。
小结:
纯净物与混合物
[小结]纯净物:___________________________;
混合物:___________________________。
【课堂练习2】下列物质里,属于混合物的有:________________(填序号)。
①红磷 ②自来水 ③胆矾晶体
④冰水混合物 ⑤稀有气体 ⑥加碘盐
⑦氮气 ⑧大理石 ⑨低钠盐
⑩液态空气
由同种物质组成的物质
由不同种物质组成的物质
②⑤⑥⑧⑨⑩
1.空气中含量较多且性质不活泼的气体是( )
A.氧气 B.氮气
C.二氧化碳 D.水蒸气
2.下列气体不是空气中固定成分的是( )
A.氧气 B.氮气
C.稀有气体 D.二氧化硫
B
D
测评反馈
3.下列属于纯净物的是( )
A.新鲜空气 B.澄清石灰水
C.冰水混合物 D.矿泉水
4.区分氮气和二氧化碳气体,可根据它们下列性质中的( )
A.颜色 B.能否使火焰熄灭
C.气味 D.能否使石灰水变浑浊
C
D
5.空气中氧气含量测定的实验装置如图所示。下列有关说法正确的是( )
A.燃烧匙中的红磷可以换成木炭
B.选用红磷是因为它消耗氧气,生成固态的
五氧化二磷,使钟罩内的压强减小
C.本实验可以证明空气含有N2、O2、CO2和稀有气体
D.燃烧匙中的红磷越多,水位上升越高
B
1.空气中氧气体积分数测定的探究实验解析。
(1)药品选择:①只能与空气中O2反应,②生成物没有气体(如不选蜡烛、木炭、硫)。因此选择红磷等物质。
(2)实验结论的表达:空气中氧气约占体积的1/5。关键词:“约”“体积”(不是“质量”)。
名师点睛
(3)操作注意点:①红磷要过量,装置必须密封,点燃红磷之前要用弹簧夹夹紧胶管;②点燃红磷后要立即伸入瓶中,迅速塞紧塞子,目的是防止瓶内空气受热逸出,导致结果偏大;③瓶中加水的目的:降温、吸收五氧化二磷。
(4)实验误差:①偏小:装置漏气、红磷不足等;②偏大:点燃红磷前没有夹紧弹簧夹等。
(5)实验的改进。改进总的目的是提高实验的精确度,减少对空气的污染。主要思路如下:
①在装置内点燃红磷,避免瓶内空气受热膨胀逸出,同时避免五氧化二磷扩散到空气中污染空气;
②使用量筒或有刻度的玻璃管,主要是便于计算出实验结果。
2.易错点:①“烟”“雾”“气”的判断(“烟”是固体小颗粒分散在空气中;“雾”是小液滴分散在空气中。红磷在空气中燃烧产生浓厚的白烟,不是“白雾”);②氧气、氮气等在空气中的含量是“体积分数”不是“质量分数”;③“稀有气体”为混合物,“冰水混合物”为纯净物。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
