专题硫酸和硝酸专练提升练习 高一化学必修第二册暑假作业人教版(2019)
文档属性
| 名称 | 专题硫酸和硝酸专练提升练习 高一化学必修第二册暑假作业人教版(2019) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-13 10:33:04 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
专题03硫酸和硝酸专练提升练习
2022~2023学年高一化学期末复习(人教版)
一、单选题,共15小题
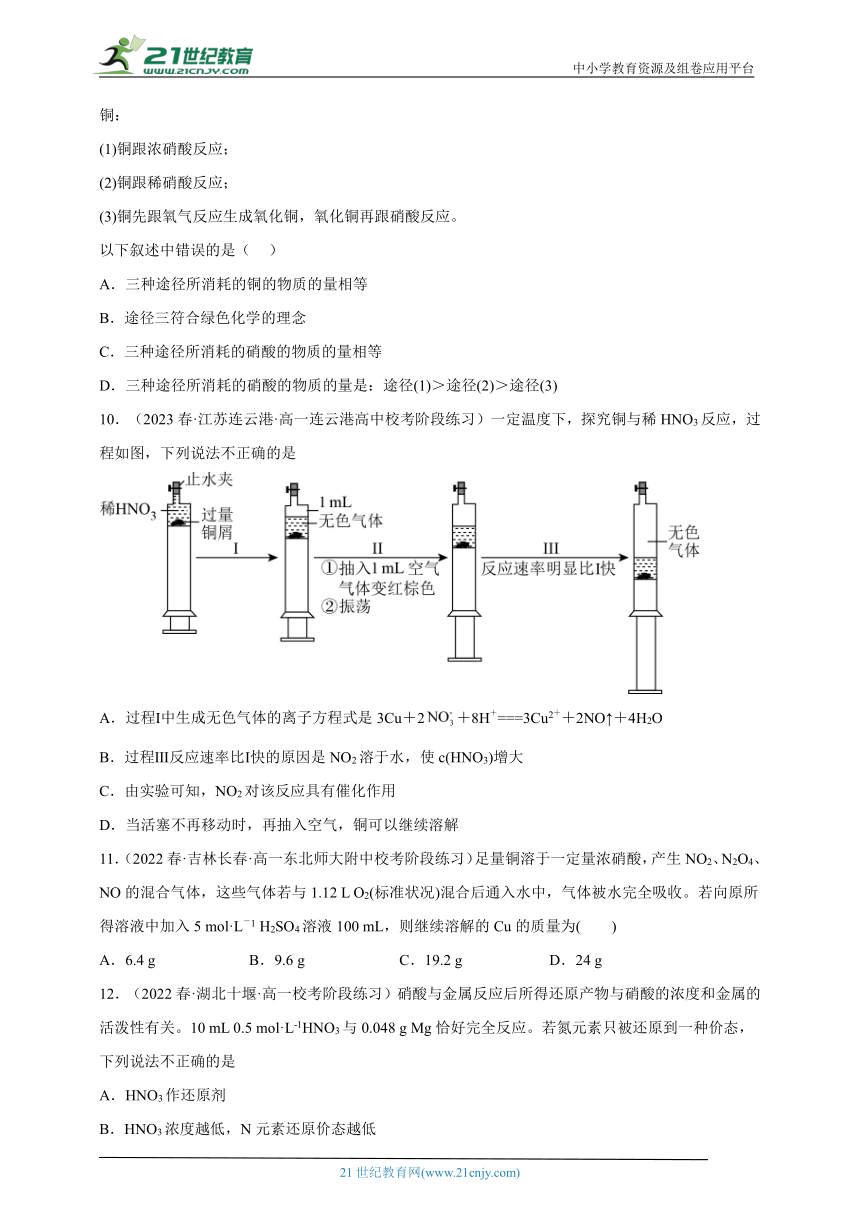
1.(2023春·北京西城·高一北京八中校考阶段练习)下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A.A B.B C.C D.D
2.(2023春·北京东城·高一北京五十五中校考期中)某同学设想用下表所给装置来验证浓硫酸的某些性质,其中不能达到实验目的的是( )
选项 A B C D
实验目的 吸水性 脱水性 稀释放热 强氧化性
实验装置
A.A B.B C.C D.D
3.(2017·四川成都·高一假期作业)下列反应中硝酸既能表现出酸性又表现出氧化性的是
A.使石蕊试液变红
B.与S单质混合共热时生成H2SO4和NO2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与铜反应放出NO气体,生成Cu(NO3)2
4.(2023春·贵州铜仁·高一贵州省松桃民族中学校考阶段练习)下列过程中,最终的白色沉淀物不一定是BaSO4的是
A.Fe(NO3)2溶液白色沉淀
B.Ba(NO3)2溶液白色沉淀
C.无色溶液白色沉淀
D.无色溶液无色溶液白色沉淀
5.(2022春·安徽黄山·高一统考期末)下列有关实验操作、现象和解释或结论都正确的是
选项 操作 现象 解释或结论
A 过量的Fe粉中加入稀硝酸,充分反应后,滴加KSCN 溶液 溶液呈红色 稀硝酸将Fe氧化为Fe3+
B Al 箔插入稀硝酸中 无现象 Al箔表面被HNO3氧化形成致密的氧化膜
C 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 试纸变蓝色 浓氨水呈碱性
D 向淀粉溶液中加入少量稀H2SO4,加热,冷却后加NaOH溶液至碱性,再加少量新制的Cu(OH)2,加热 生成砖红色沉淀 淀粉完全水解
A.A B.B C.C D.D
6.(2023春·上海杨浦·高三复旦附中校考阶段练习)推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是
A.试管内CCl4层溶液褪色,说明Br2具有氧化性
B.试管中的红色花瓣褪色,说明SO2具有漂白性
C.试管中产生大量气泡,说明Na2SO3被氧化产生SO3
D.一段时间后试管内有白色沉淀,说明有SO生成
7.(2019秋·河北石家庄·高一石家庄外国语学校校考期末)相同质量的铜分别与足量的稀硝酸和浓硝酸完全反应,在相同条件下用排水法收集反应产生的气体,下列叙述正确的是
A.硝酸浓度越大,反应消耗的硝酸越少
B.硝酸浓度不同,生成Cu(NO3)2的物质的量不同
C.硝酸浓度越大,产生的气体越少
D.两者用排水法收集到的气体体积相等
8.(2023春·安徽马鞍山·高一安徽省当涂第一中学校考期中)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀有碳酸钡
B.Z导管口无红棕色气体出现
C.洗气瓶中产生的沉淀是亚硫酸钡
D.Z导管出来的气体中有二氧化碳
9.(2020秋·山西太原·高三太原市实验中学校考阶段练习)用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应;
(2)铜跟稀硝酸反应;
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。
以下叙述中错误的是( )
A.三种途径所消耗的铜的物质的量相等
B.途径三符合绿色化学的理念
C.三种途径所消耗的硝酸的物质的量相等
D.三种途径所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
10.(2023春·江苏连云港·高一连云港高中校考阶段练习)一定温度下,探究铜与稀HNO3反应,过程如图,下列说法不正确的是
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2+8H+===3Cu2++2NO↑+4H2O
B.过程Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
11.(2022春·吉林长春·高一东北师大附中校考阶段练习)足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12 L O2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
A.6.4 g B.9.6 g C.19.2 g D.24 g
12.(2022春·湖北十堰·高一校考阶段练习)硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。10 mL 0.5 mol·L-1HNO3与0.048 g Mg恰好完全反应。若氮元素只被还原到一种价态,下列说法不正确的是
A.HNO3作还原剂
B.HNO3浓度越低,N元素还原价态越低
C.反应中转移电子数为0.004 mol
D.还原产物可能为NH4NO3
13.(2022春·黑龙江牡丹江·高一牡丹江市第三高级中学校考期中)有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为
A.224 mL B.166 ml C.112 mL D.89.5mL
14.(2023秋·新疆乌鲁木齐·高一乌市八中校考期末)向一定量的、、、的混合物中加入的稀硝酸恰好使混合物完全溶解,放出标准状况,往所得溶液中加入溶液,无红色出现。若用足量的在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. B. C. D.
15.(2023春·山西朔州·高一朔州市朔城区第一中学校校联考阶段练习)向200mL稀与稀的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中的物质的量浓度为1 mol/L
B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜
C.
D.每一阶段反应转移电子数目之比为
二、实验题,共2小题
16.(2023春·北京顺义·高一牛栏山一中校考阶段练习)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应,2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后________
(3)装置①中发生反应的化学方程式是_________
(4)装置②的作用是________,发生反应的化学方程式是__________
(5)该小组得出的结论依据的实验现象是___________
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)( )
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
17.(2012·甘肃天水·高三阶段练习)某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)填写装置的作用:B ______ ,C______,G______。
(2)先点燃______处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作______。
(3)证明有SO2生成的现象是______。
(4)可以证明气体X中含有氢气的实验现象是:______。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?______(填“能”或“不能”),原因是______。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是______。
三、计算题,共1小题
18.(2022·上海·高一专题练习)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
参考答案:
1.A
【详解】A.蘸有浓盐酸和浓氨水的玻璃棒靠近,氨气与氯化氢反应生成氯化铵,反应无化合价变化,不属于氧化还原反应,A符合题意;
B.铝丝伸入硫酸铜溶液中,发生反应2Al+3Cu2+=3Cu+2Al3+,有化合价变化,属于氧化还原反应,B不符合题意;
C.氯气通入NaBr溶液中变成黄色,发生反应2NaBr+Cl2=2NaCl+Br2,有化合价变化,属于氧化还原反应,C不符合题意;
D.浓硫酸具有脱水性,能将蔗糖中的H、O元素以2:1脱去,蔗糖转变为C和H2O,同时C和浓硫酸反应生成二氧化硫、二氧化碳和水,发生氧化还原反应,D不符合题意;
故选A。
2.D
【详解】A.盛有水的烧杯中水量减少可以证明浓硫酸具有吸水性,故A项不符合题意;
B.滤纸片脱水炭化可以证明浓硫酸具有脱水性,故B项不符合题意;
C.右侧仪器中的水面右高左低,说明稀释浓硫酸时放出大量的热,使锥形瓶中压强增大,故C项不符合题意;
D.与浓常温下不反应,不能体现浓硫酸的强氧化性,故D项符合题意。
答案选D。
3.D
【详解】A、使石蕊变红,只能说明硝酸具有酸性,不能说明氧化性,选项A错误;B、与S单质混合共热时生成H2SO4 和NO2 ,只表现硝酸的氧化性,不表现酸性,选项B错误; C、与Na2CO3 反应放出CO2 气体生成NaNO3 ,说明硝酸的酸性比碳酸强,不发生氧化还原反应,选项C错误;D、与铜反应生成Cu(NO3)2 和NO气体,生成硝酸铜表现酸性,生成NO表现硝酸的氧化性,选项D正确。答案选B。
4.C
【详解】A.Fe(NO3)2溶液中加入过量盐酸,发生反应生成Fe3+等,通入过量SO2,Fe3+将其氧化生成H2SO4等,加入BaCl2溶液,生成BaSO4白色沉淀,A不符合题意;
B.Ba(NO3)2溶液中加入过量盐酸,后加入的少量Na2SO3会被氧化为Na2SO4,与Ba2+反应生成BaSO4白色沉淀,B不符合题意;
C.无色溶液可能为AgNO3溶液,加入HNO3和BaCl2溶液,生成AgCl白色沉淀,C符合题意;
D.无色溶液中加入过量盐酸,得到无色溶液,则原溶液中不含有AgNO3、Na2SO3等,加入BaCl2溶液,产生的白色沉淀一定是BaSO4,D不符合题意;
故选C。
5.C
【详解】A.过量的 Fe 粉中加入稀硝酸,充分反应后,溶液中只存在Fe2+,不存在Fe3+,所以滴加KSCN溶液,不变红色,A不正确;
B.Al 箔插入稀硝酸中,不能形成钝化膜,铝箔不断溶解,有气泡产生,B不正确;
C.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,石蕊的颜色是遇酸变红、遇碱变蓝,所以试纸变蓝色,表明浓氨水呈碱性,C正确;
D.生成砖红色沉淀,只能表明有葡萄糖生成,不能证明淀粉是否发生完全水解,D不正确;
故选C。
6.C
【详解】A.锥形瓶内发生反应 ,产生的SO2进入到试管中,CCl4层溶液褪色,证明Br2发生反应,SO2具有还原性,可以被Br2氧化,证明Br2具有氧化性,A项正确;
B.试管中花瓣褪色,说明SO2可以漂白花瓣中的有色物质,证明SO2具有漂白性,B项正确;
C.试管中产生大量气泡是锥形瓶中产生的SO2进入到试管中引起的,Na2SO3没有发生氧化还原反应,发生的是“强酸制弱酸”的复分解反应,C项错误;
D.试管中Br2可将SO2氧化,生成H2SO4和HBr, 可以和Ba2+结合成不溶于酸的白色沉淀,D项正确;
故答案为C。
7.D
【详解】一定质量的铜分别与足量的稀硝酸和浓硝酸完全反应,发生3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
A.等量的Cu与酸反应,浓硝酸消耗的多,故A错误;
B.等量的Cu与酸反应,生成Cu(NO3)2的物质的量相同,故B错误;
C.等量的Cu与酸反应,浓硝酸反应生成气体多,故C错误;
D.因3NO2+H2O=2HNO3+NO,最终收集气体均为NO,由电子守恒可知,收集NO的体积相等,故D正确;
故选D。
8.D
【分析】碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2。
【详解】A.由分析可知洗气瓶中产生的是硫酸钡沉淀,二氧化碳不与氯化钡反应,所以没有BaCO3生成,A项错误;
B.Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2,故Z导管口有红棕色气体出现,B项错误;
C.洗气瓶中产生的是硫酸钡沉淀,C项错误;
D.Z处逸出的气体中有CO2,D项正确;
答案选D。
9.C
【分析】(1)铜跟浓硝酸反应,反应的化学方程式为Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O;
(2)铜跟稀硝酸反应,反应的化学方程式为3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O;
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应,反应的化学方程式为2Cu+O2+4HNO3==2Cu(NO3)2+2H2O。
【详解】A. 从方程式可以看出,生成相同量的Cu(NO3)2,三种途径所消耗的铜的物质的量相等,A正确;
B. 途径三中不产生污染环境的气体,符合绿色化学的理念,B正确;
C. 生成相同量的Cu(NO3)2,途径一中硝酸消耗最多,途径三中硝酸消耗最少,C错误;
D. 生成3mol Cu(NO3)2,三种途径所消耗的硝酸的物质的量是12mol、8mol、6mol,D正确;
故选C。
10.B
【详解】A.过程发生的反应为Cu和稀HNO3的反应离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,故A正确;
B.随着反应的进行,溶液里生成硝酸铜,根据氮元素守恒,溶液中c(HNO3)应比原硝酸浓度减小,不会增大,故B错误;
C.加入NO2后反应速率加快,说明NO2对该反应具有催化剂,故C正确;
D.反应停止后,再抽入空气,空气中的氧气能与一氧化氮,水继续反应生成硝酸,可继续溶解铜,故D正确;
故选B。
11.C
【详解】Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)==0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>1/4,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.2mol
192g:2mol=x:0.2mol,解得x=19.2g。
答案选C。
【点晴】明确物质之间的反应是解本题的关键,注意进行过量计算,注意转移电子守恒、原子守恒的利用,难点和易错点是没有进行过量计算。
12.A
【详解】A.HNO3与金属反应时,表现酸性和强氧化性,故A错误;
B.HNO3浓度越高,氧化性越强,氧化同种金属时,N元素被还原的价态就越高,故B正确;
C.HNO3与Mg反应,还原剂只有Mg,Mg的化合价由0→+2,0.048g Mg的物质的量为0.002mol,根据得失电子守恒,反应中转移电子为0.004mol,故C正确;
D.硝酸的物质的量为0.01L×0.5mol·L-1=0.005mol,生成0.002mol Mg(NO3)2,根据N原子守恒,可能生成0.0005 mol NH4NO3,若生成0.0005 mol NH4NO3转移电子为0.004mol,符合电子守恒,故D正确;
故答案为A。
13.A
【详解】由题意可知,n(HNO3)=1mol/L×0.02L=0.02mol,n(H2SO4)=2mol/L×0.02L=0.04mol,、n(H+)=n(HNO3)+2n(H2SO4)=0.02mol+0.04mol×2=0.1mol,n(Cu)= ,发生反应:3Cu+8H++2NO =3Cu2++2NO +4H2O,根据方程式分析,铜完全反应需要氢离子为0.04mol,需要硝酸根离子的物质的量为0.01mol,则硝酸根离子和氢离子都有剩余,反应生成的一氧化氮由铜进行计算,根据反应方程式计算可知,生成的NO的物质的量为0.01mol,故标准状况下体积为 ;
故选A。
14.A
【详解】因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入125mL 4mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,标准状况下2.24L NO的物质的量为:,根据N元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.125L×4mol/L-0.1mol=0.4mol,所以硝酸亚铁的物质的量为:n[Fe(NO3)2]==0.2mol,由铁元素守恒可知,若用足量的H2在加热条件下还原相同质量的混合物,得到铁的物质的量为n(Fe)=n[Fe(NO3)2]=0.2mol,故选:A。
15.B
【分析】向200mL稀与稀的混合溶液中逐渐加入铁粉,依次发生反应①、②、③;OA段为反应①,生成NO0.2mol;AB为反应②、BC为反应③,生成氢气0.1mol;
【详解】A.由分析可知,OA段为反应①,生成NO0.2mol,根据氮元素守恒可知,混合溶液中的物质的量浓度为0.2mol÷0.2L=1 mol/L,A正确;
B.由分析可知,200mL溶液中硝酸根离子为0.2mol、氢离子为0.2mol×4+0.1mol×2=1.0mol,,则氢离子过量、硝酸根离子完全反应消耗铜0.3mol,质量为19.2g,则若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g÷2=9.6g铜,B错误;
C.由分析可知,3个反应分别消耗铁0.2mol、0.1mol、0.1mol,共消耗铁0.4mol,质量为22.4g铁,C正确;
D.由分析可知,每一阶段反应转移电子数目之比为,D正确;
故选B。
16. 3mol/L稀硝酸、浓硝酸、氢氧化钠溶液 通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 Cu + 4HNO3(浓)= Cu(NO3)2+ 2NO2↑ + 2H2O 将NO2转化为NO 3NO2 + H2O =2HNO3 + NO 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色 acd
【分析】要验证浓硝酸可以将NO氧化成NO2,而稀硝酸不可以。装置①为铜和浓硝酸反应生成NO2的装置,经②与水发生反应生成NO,再分别通过浓硝酸和稀硝酸,进行验证试验;由于氮氧化物均为有毒物质,所以均需要尾气处理。
【详解】(1)氮氧化物均为有毒气体,均需要尾气处理,根据已知,NO不能被NaOH吸收,而NO2可以,则装置⑥为NaOH吸收NO2的装置,则④中盛放的为浓硝酸,将NO氧化成NO2,装置③中为稀硝酸,不能将NO氧化,而NO不溶于水,排水法收集。答案为3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:Cu + 4HNO3(浓)=Cu(NO3)2+ 2NO2↑ +2 H2O;
(4)装置①为铜和浓硝酸反应生成NO2的装置,经②与水发生反应生成NO。所欲装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+ H2O=2HNO3+ NO。
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体;答案为装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。二是增加溶液中Cu(NO3)2溶液的浓度(d方案)观察反应后的颜色变化;答案为acd。
17. 防止倒吸 验证有SO2生成 防止空气中的H2O进入F A 检验氢气的纯度 酸性高锰酸钾溶液变浅 黑色(CuO)变成红色(Cu) ;白色粉末变成蓝色 不能 因为混合气体中可能含H2O,会干扰H2的检验 取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+
【详解】试题分析:(1)由于SO2极易溶于水,所以B装置的主要作用是防止倒吸;二氧化硫极易还原性,能使酸性高锰酸钾溶液褪色,所以C装置的作用是验证有SO2生成;由于空气中也含有水蒸气,会干扰实验,所以G装置的作用是防止空气中的H2O进入F。
(2)由于装置中含有空气,所以应该首先点燃A处酒精灯,以排尽装置中的空气。由于生成的氢气是可燃性气体,在点燃之前需要检验氢气的纯度,所以点燃E处酒精灯前一步操作检验氢气的纯度。
(3)根据(1)中分析可知,证明有SO2生成的现象是酸性高锰酸钾溶液变浅。
(4)氢气具有还原性,能把氧化铜还原生成铜和水,而无水硫酸铜极易吸水变成胆矾,所以可以证明气体X中含有氢气的实验现象是黑色(CuO)变成红色(Cu)、白色粉末变成蓝色;由于混合气体中可能含H2O,会干扰H2的检验,所以不能根据F中的现象判断气体中有氢气。
(5)亚铁离子具有还原性,据此可以检验。即取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+。
考点:考查SO2、氢气的检验,实验安全以及亚离子的有关检验等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考查探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的--实验原理;3.结合实验材料,初步确定设计对策--实验方案。
18. 5.376 5.824 1.52 57.8
【详解】铜的物质的量为n(Cu)==0.51mol,混合气体的物质的量为n(NO)+n(NO2)==0.5mol;
(1)设NO为xmol,NO2为ymol,电子得失守恒得:3x+y=0.51×2,气体的总物质的量为x+y=0.5,解之得x=0.26,y=0.24,则V(NO)=0.26mol×22.4L/mol≈5.8L,V(NO2)=0.24mol×22.4L/mol≈5.4L;
(2)铜与硝酸反应,反应生成硝酸铜、NO和NO2,由N原子守恒:参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.51mol×2+0.5mol=1.52mol;
(3)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,根据氮元素守恒,HNO3的物质的量为n(Na+)+n(NO)+n(NO2),n(Na+)=n(NaOH)=aV×10-3mol,n(NO)+n(NO2)=0.5mol,则原硝酸溶液的浓度为mol/L;
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,由得失电子守恒可得n(H2O2)×2=3n(NO)+n(NO2)=0.26mol×3+0.24mol,n(H2O2)=0.51mol,m(H2O2)==57.8g。
【点睛】本题以硝酸与铜反应为载体考查了氧化还原反应的有关计算,本题计算量较大,(1)用列方程组解较方便;(2)和(3)要注意反应中部分硝酸参加氧化还原反应,运用N原子守恒的解题,是本题的难点;(4)利用电子守恒技巧能快速解题,是本题的又一难点。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
专题03硫酸和硝酸专练提升练习
2022~2023学年高一化学期末复习(人教版)
一、单选题,共15小题
1.(2023春·北京西城·高一北京八中校考阶段练习)下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A.A B.B C.C D.D
2.(2023春·北京东城·高一北京五十五中校考期中)某同学设想用下表所给装置来验证浓硫酸的某些性质,其中不能达到实验目的的是( )
选项 A B C D
实验目的 吸水性 脱水性 稀释放热 强氧化性
实验装置
A.A B.B C.C D.D
3.(2017·四川成都·高一假期作业)下列反应中硝酸既能表现出酸性又表现出氧化性的是
A.使石蕊试液变红
B.与S单质混合共热时生成H2SO4和NO2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与铜反应放出NO气体,生成Cu(NO3)2
4.(2023春·贵州铜仁·高一贵州省松桃民族中学校考阶段练习)下列过程中,最终的白色沉淀物不一定是BaSO4的是
A.Fe(NO3)2溶液白色沉淀
B.Ba(NO3)2溶液白色沉淀
C.无色溶液白色沉淀
D.无色溶液无色溶液白色沉淀
5.(2022春·安徽黄山·高一统考期末)下列有关实验操作、现象和解释或结论都正确的是
选项 操作 现象 解释或结论
A 过量的Fe粉中加入稀硝酸,充分反应后,滴加KSCN 溶液 溶液呈红色 稀硝酸将Fe氧化为Fe3+
B Al 箔插入稀硝酸中 无现象 Al箔表面被HNO3氧化形成致密的氧化膜
C 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 试纸变蓝色 浓氨水呈碱性
D 向淀粉溶液中加入少量稀H2SO4,加热,冷却后加NaOH溶液至碱性,再加少量新制的Cu(OH)2,加热 生成砖红色沉淀 淀粉完全水解
A.A B.B C.C D.D
6.(2023春·上海杨浦·高三复旦附中校考阶段练习)推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是
A.试管内CCl4层溶液褪色,说明Br2具有氧化性
B.试管中的红色花瓣褪色,说明SO2具有漂白性
C.试管中产生大量气泡,说明Na2SO3被氧化产生SO3
D.一段时间后试管内有白色沉淀,说明有SO生成
7.(2019秋·河北石家庄·高一石家庄外国语学校校考期末)相同质量的铜分别与足量的稀硝酸和浓硝酸完全反应,在相同条件下用排水法收集反应产生的气体,下列叙述正确的是
A.硝酸浓度越大,反应消耗的硝酸越少
B.硝酸浓度不同,生成Cu(NO3)2的物质的量不同
C.硝酸浓度越大,产生的气体越少
D.两者用排水法收集到的气体体积相等
8.(2023春·安徽马鞍山·高一安徽省当涂第一中学校考期中)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A.洗气瓶中产生的沉淀有碳酸钡
B.Z导管口无红棕色气体出现
C.洗气瓶中产生的沉淀是亚硫酸钡
D.Z导管出来的气体中有二氧化碳
9.(2020秋·山西太原·高三太原市实验中学校考阶段练习)用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应;
(2)铜跟稀硝酸反应;
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。
以下叙述中错误的是( )
A.三种途径所消耗的铜的物质的量相等
B.途径三符合绿色化学的理念
C.三种途径所消耗的硝酸的物质的量相等
D.三种途径所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
10.(2023春·江苏连云港·高一连云港高中校考阶段练习)一定温度下,探究铜与稀HNO3反应,过程如图,下列说法不正确的是
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2+8H+===3Cu2++2NO↑+4H2O
B.过程Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
11.(2022春·吉林长春·高一东北师大附中校考阶段练习)足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12 L O2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
A.6.4 g B.9.6 g C.19.2 g D.24 g
12.(2022春·湖北十堰·高一校考阶段练习)硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。10 mL 0.5 mol·L-1HNO3与0.048 g Mg恰好完全反应。若氮元素只被还原到一种价态,下列说法不正确的是
A.HNO3作还原剂
B.HNO3浓度越低,N元素还原价态越低
C.反应中转移电子数为0.004 mol
D.还原产物可能为NH4NO3
13.(2022春·黑龙江牡丹江·高一牡丹江市第三高级中学校考期中)有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为
A.224 mL B.166 ml C.112 mL D.89.5mL
14.(2023秋·新疆乌鲁木齐·高一乌市八中校考期末)向一定量的、、、的混合物中加入的稀硝酸恰好使混合物完全溶解,放出标准状况,往所得溶液中加入溶液,无红色出现。若用足量的在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. B. C. D.
15.(2023春·山西朔州·高一朔州市朔城区第一中学校校联考阶段练习)向200mL稀与稀的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中的物质的量浓度为1 mol/L
B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜
C.
D.每一阶段反应转移电子数目之比为
二、实验题,共2小题
16.(2023春·北京顺义·高一牛栏山一中校考阶段练习)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应,2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后________
(3)装置①中发生反应的化学方程式是_________
(4)装置②的作用是________,发生反应的化学方程式是__________
(5)该小组得出的结论依据的实验现象是___________
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)( )
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
17.(2012·甘肃天水·高三阶段练习)某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)填写装置的作用:B ______ ,C______,G______。
(2)先点燃______处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作______。
(3)证明有SO2生成的现象是______。
(4)可以证明气体X中含有氢气的实验现象是:______。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?______(填“能”或“不能”),原因是______。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是______。
三、计算题,共1小题
18.(2022·上海·高一专题练习)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
参考答案:
1.A
【详解】A.蘸有浓盐酸和浓氨水的玻璃棒靠近,氨气与氯化氢反应生成氯化铵,反应无化合价变化,不属于氧化还原反应,A符合题意;
B.铝丝伸入硫酸铜溶液中,发生反应2Al+3Cu2+=3Cu+2Al3+,有化合价变化,属于氧化还原反应,B不符合题意;
C.氯气通入NaBr溶液中变成黄色,发生反应2NaBr+Cl2=2NaCl+Br2,有化合价变化,属于氧化还原反应,C不符合题意;
D.浓硫酸具有脱水性,能将蔗糖中的H、O元素以2:1脱去,蔗糖转变为C和H2O,同时C和浓硫酸反应生成二氧化硫、二氧化碳和水,发生氧化还原反应,D不符合题意;
故选A。
2.D
【详解】A.盛有水的烧杯中水量减少可以证明浓硫酸具有吸水性,故A项不符合题意;
B.滤纸片脱水炭化可以证明浓硫酸具有脱水性,故B项不符合题意;
C.右侧仪器中的水面右高左低,说明稀释浓硫酸时放出大量的热,使锥形瓶中压强增大,故C项不符合题意;
D.与浓常温下不反应,不能体现浓硫酸的强氧化性,故D项符合题意。
答案选D。
3.D
【详解】A、使石蕊变红,只能说明硝酸具有酸性,不能说明氧化性,选项A错误;B、与S单质混合共热时生成H2SO4 和NO2 ,只表现硝酸的氧化性,不表现酸性,选项B错误; C、与Na2CO3 反应放出CO2 气体生成NaNO3 ,说明硝酸的酸性比碳酸强,不发生氧化还原反应,选项C错误;D、与铜反应生成Cu(NO3)2 和NO气体,生成硝酸铜表现酸性,生成NO表现硝酸的氧化性,选项D正确。答案选B。
4.C
【详解】A.Fe(NO3)2溶液中加入过量盐酸,发生反应生成Fe3+等,通入过量SO2,Fe3+将其氧化生成H2SO4等,加入BaCl2溶液,生成BaSO4白色沉淀,A不符合题意;
B.Ba(NO3)2溶液中加入过量盐酸,后加入的少量Na2SO3会被氧化为Na2SO4,与Ba2+反应生成BaSO4白色沉淀,B不符合题意;
C.无色溶液可能为AgNO3溶液,加入HNO3和BaCl2溶液,生成AgCl白色沉淀,C符合题意;
D.无色溶液中加入过量盐酸,得到无色溶液,则原溶液中不含有AgNO3、Na2SO3等,加入BaCl2溶液,产生的白色沉淀一定是BaSO4,D不符合题意;
故选C。
5.C
【详解】A.过量的 Fe 粉中加入稀硝酸,充分反应后,溶液中只存在Fe2+,不存在Fe3+,所以滴加KSCN溶液,不变红色,A不正确;
B.Al 箔插入稀硝酸中,不能形成钝化膜,铝箔不断溶解,有气泡产生,B不正确;
C.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,石蕊的颜色是遇酸变红、遇碱变蓝,所以试纸变蓝色,表明浓氨水呈碱性,C正确;
D.生成砖红色沉淀,只能表明有葡萄糖生成,不能证明淀粉是否发生完全水解,D不正确;
故选C。
6.C
【详解】A.锥形瓶内发生反应 ,产生的SO2进入到试管中,CCl4层溶液褪色,证明Br2发生反应,SO2具有还原性,可以被Br2氧化,证明Br2具有氧化性,A项正确;
B.试管中花瓣褪色,说明SO2可以漂白花瓣中的有色物质,证明SO2具有漂白性,B项正确;
C.试管中产生大量气泡是锥形瓶中产生的SO2进入到试管中引起的,Na2SO3没有发生氧化还原反应,发生的是“强酸制弱酸”的复分解反应,C项错误;
D.试管中Br2可将SO2氧化,生成H2SO4和HBr, 可以和Ba2+结合成不溶于酸的白色沉淀,D项正确;
故答案为C。
7.D
【详解】一定质量的铜分别与足量的稀硝酸和浓硝酸完全反应,发生3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
A.等量的Cu与酸反应,浓硝酸消耗的多,故A错误;
B.等量的Cu与酸反应,生成Cu(NO3)2的物质的量相同,故B错误;
C.等量的Cu与酸反应,浓硝酸反应生成气体多,故C错误;
D.因3NO2+H2O=2HNO3+NO,最终收集气体均为NO,由电子守恒可知,收集NO的体积相等,故D正确;
故选D。
8.D
【分析】碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2。
【详解】A.由分析可知洗气瓶中产生的是硫酸钡沉淀,二氧化碳不与氯化钡反应,所以没有BaCO3生成,A项错误;
B.Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2,故Z导管口有红棕色气体出现,B项错误;
C.洗气瓶中产生的是硫酸钡沉淀,C项错误;
D.Z处逸出的气体中有CO2,D项正确;
答案选D。
9.C
【分析】(1)铜跟浓硝酸反应,反应的化学方程式为Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O;
(2)铜跟稀硝酸反应,反应的化学方程式为3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O;
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应,反应的化学方程式为2Cu+O2+4HNO3==2Cu(NO3)2+2H2O。
【详解】A. 从方程式可以看出,生成相同量的Cu(NO3)2,三种途径所消耗的铜的物质的量相等,A正确;
B. 途径三中不产生污染环境的气体,符合绿色化学的理念,B正确;
C. 生成相同量的Cu(NO3)2,途径一中硝酸消耗最多,途径三中硝酸消耗最少,C错误;
D. 生成3mol Cu(NO3)2,三种途径所消耗的硝酸的物质的量是12mol、8mol、6mol,D正确;
故选C。
10.B
【详解】A.过程发生的反应为Cu和稀HNO3的反应离子方程式为3Cu+2+8H+=3Cu2++2NO↑+4H2O,故A正确;
B.随着反应的进行,溶液里生成硝酸铜,根据氮元素守恒,溶液中c(HNO3)应比原硝酸浓度减小,不会增大,故B错误;
C.加入NO2后反应速率加快,说明NO2对该反应具有催化剂,故C正确;
D.反应停止后,再抽入空气,空气中的氧气能与一氧化氮,水继续反应生成硝酸,可继续溶解铜,故D正确;
故选B。
11.C
【详解】Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)==0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>1/4,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.2mol
192g:2mol=x:0.2mol,解得x=19.2g。
答案选C。
【点晴】明确物质之间的反应是解本题的关键,注意进行过量计算,注意转移电子守恒、原子守恒的利用,难点和易错点是没有进行过量计算。
12.A
【详解】A.HNO3与金属反应时,表现酸性和强氧化性,故A错误;
B.HNO3浓度越高,氧化性越强,氧化同种金属时,N元素被还原的价态就越高,故B正确;
C.HNO3与Mg反应,还原剂只有Mg,Mg的化合价由0→+2,0.048g Mg的物质的量为0.002mol,根据得失电子守恒,反应中转移电子为0.004mol,故C正确;
D.硝酸的物质的量为0.01L×0.5mol·L-1=0.005mol,生成0.002mol Mg(NO3)2,根据N原子守恒,可能生成0.0005 mol NH4NO3,若生成0.0005 mol NH4NO3转移电子为0.004mol,符合电子守恒,故D正确;
故答案为A。
13.A
【详解】由题意可知,n(HNO3)=1mol/L×0.02L=0.02mol,n(H2SO4)=2mol/L×0.02L=0.04mol,、n(H+)=n(HNO3)+2n(H2SO4)=0.02mol+0.04mol×2=0.1mol,n(Cu)= ,发生反应:3Cu+8H++2NO =3Cu2++2NO +4H2O,根据方程式分析,铜完全反应需要氢离子为0.04mol,需要硝酸根离子的物质的量为0.01mol,则硝酸根离子和氢离子都有剩余,反应生成的一氧化氮由铜进行计算,根据反应方程式计算可知,生成的NO的物质的量为0.01mol,故标准状况下体积为 ;
故选A。
14.A
【详解】因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入125mL 4mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,标准状况下2.24L NO的物质的量为:,根据N元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.125L×4mol/L-0.1mol=0.4mol,所以硝酸亚铁的物质的量为:n[Fe(NO3)2]==0.2mol,由铁元素守恒可知,若用足量的H2在加热条件下还原相同质量的混合物,得到铁的物质的量为n(Fe)=n[Fe(NO3)2]=0.2mol,故选:A。
15.B
【分析】向200mL稀与稀的混合溶液中逐渐加入铁粉,依次发生反应①、②、③;OA段为反应①,生成NO0.2mol;AB为反应②、BC为反应③,生成氢气0.1mol;
【详解】A.由分析可知,OA段为反应①,生成NO0.2mol,根据氮元素守恒可知,混合溶液中的物质的量浓度为0.2mol÷0.2L=1 mol/L,A正确;
B.由分析可知,200mL溶液中硝酸根离子为0.2mol、氢离子为0.2mol×4+0.1mol×2=1.0mol,,则氢离子过量、硝酸根离子完全反应消耗铜0.3mol,质量为19.2g,则若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g÷2=9.6g铜,B错误;
C.由分析可知,3个反应分别消耗铁0.2mol、0.1mol、0.1mol,共消耗铁0.4mol,质量为22.4g铁,C正确;
D.由分析可知,每一阶段反应转移电子数目之比为,D正确;
故选B。
16. 3mol/L稀硝酸、浓硝酸、氢氧化钠溶液 通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 Cu + 4HNO3(浓)= Cu(NO3)2+ 2NO2↑ + 2H2O 将NO2转化为NO 3NO2 + H2O =2HNO3 + NO 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色 acd
【分析】要验证浓硝酸可以将NO氧化成NO2,而稀硝酸不可以。装置①为铜和浓硝酸反应生成NO2的装置,经②与水发生反应生成NO,再分别通过浓硝酸和稀硝酸,进行验证试验;由于氮氧化物均为有毒物质,所以均需要尾气处理。
【详解】(1)氮氧化物均为有毒气体,均需要尾气处理,根据已知,NO不能被NaOH吸收,而NO2可以,则装置⑥为NaOH吸收NO2的装置,则④中盛放的为浓硝酸,将NO氧化成NO2,装置③中为稀硝酸,不能将NO氧化,而NO不溶于水,排水法收集。答案为3mol/L稀硝酸、浓硝酸、氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出;
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:Cu + 4HNO3(浓)=Cu(NO3)2+ 2NO2↑ +2 H2O;
(4)装置①为铜和浓硝酸反应生成NO2的装置,经②与水发生反应生成NO。所欲装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+ H2O=2HNO3+ NO。
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体;答案为装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色;
(6)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。二是增加溶液中Cu(NO3)2溶液的浓度(d方案)观察反应后的颜色变化;答案为acd。
17. 防止倒吸 验证有SO2生成 防止空气中的H2O进入F A 检验氢气的纯度 酸性高锰酸钾溶液变浅 黑色(CuO)变成红色(Cu) ;白色粉末变成蓝色 不能 因为混合气体中可能含H2O,会干扰H2的检验 取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+
【详解】试题分析:(1)由于SO2极易溶于水,所以B装置的主要作用是防止倒吸;二氧化硫极易还原性,能使酸性高锰酸钾溶液褪色,所以C装置的作用是验证有SO2生成;由于空气中也含有水蒸气,会干扰实验,所以G装置的作用是防止空气中的H2O进入F。
(2)由于装置中含有空气,所以应该首先点燃A处酒精灯,以排尽装置中的空气。由于生成的氢气是可燃性气体,在点燃之前需要检验氢气的纯度,所以点燃E处酒精灯前一步操作检验氢气的纯度。
(3)根据(1)中分析可知,证明有SO2生成的现象是酸性高锰酸钾溶液变浅。
(4)氢气具有还原性,能把氧化铜还原生成铜和水,而无水硫酸铜极易吸水变成胆矾,所以可以证明气体X中含有氢气的实验现象是黑色(CuO)变成红色(Cu)、白色粉末变成蓝色;由于混合气体中可能含H2O,会干扰H2的检验,所以不能根据F中的现象判断气体中有氢气。
(5)亚铁离子具有还原性,据此可以检验。即取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+。
考点:考查SO2、氢气的检验,实验安全以及亚离子的有关检验等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考查探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的--实验原理;3.结合实验材料,初步确定设计对策--实验方案。
18. 5.376 5.824 1.52 57.8
【详解】铜的物质的量为n(Cu)==0.51mol,混合气体的物质的量为n(NO)+n(NO2)==0.5mol;
(1)设NO为xmol,NO2为ymol,电子得失守恒得:3x+y=0.51×2,气体的总物质的量为x+y=0.5,解之得x=0.26,y=0.24,则V(NO)=0.26mol×22.4L/mol≈5.8L,V(NO2)=0.24mol×22.4L/mol≈5.4L;
(2)铜与硝酸反应,反应生成硝酸铜、NO和NO2,由N原子守恒:参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.51mol×2+0.5mol=1.52mol;
(3)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,根据氮元素守恒,HNO3的物质的量为n(Na+)+n(NO)+n(NO2),n(Na+)=n(NaOH)=aV×10-3mol,n(NO)+n(NO2)=0.5mol,则原硝酸溶液的浓度为mol/L;
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,由得失电子守恒可得n(H2O2)×2=3n(NO)+n(NO2)=0.26mol×3+0.24mol,n(H2O2)=0.51mol,m(H2O2)==57.8g。
【点睛】本题以硝酸与铜反应为载体考查了氧化还原反应的有关计算,本题计算量较大,(1)用列方程组解较方便;(2)和(3)要注意反应中部分硝酸参加氧化还原反应,运用N原子守恒的解题,是本题的难点;(4)利用电子守恒技巧能快速解题,是本题的又一难点。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
