甘肃省张掖市高台县2022-2023学年高二下学期7月月考化学试题(含答案)
文档属性
| 名称 | 甘肃省张掖市高台县2022-2023学年高二下学期7月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 431.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-08 15:11:21 | ||
图片预览



文档简介
高台县2022-2023学年高二下学期7月月考
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共8页,总分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56
第Ⅰ卷(选择题 共45分)
一、选择题:本题共15小题,每小题2分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境,实现绿色发展至关重要。碳中和是指CO2的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是( )
A.将重质油裂解为轻质油作为燃料 B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染 D.研发催化剂将CO2还原为甲醇
2.某烯烃与氢气加成后得到2,3-二甲基戊烷,烯烃的名称错误的是( )
A.2,3-二甲基-1-戊烯 B.2,3-二甲基-4-戊烯
C.3,4-二甲基-2-戊烯 D.2,3-二甲基-2-戊烯
3.据报道:清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维。下列说法正确的是( )
A.石墨烯属于烯烃,属于有机物 B.碳纳米管和石墨烯互为同分异构体
C.蚕丝纤维属于纤维素,可发生水解反应 D.鉴别某丝织品是否为真蚕丝可以用灼烧的方法
4.我国屠呦呦等科学家通过元素分析和______分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。经______和______分析,确定青蒿素分子中含有酯基和甲基等结构片段。通过______最终测定了青蒿素的分子结构。以上横线中使用方法顺序正确的是( )
a.X射线衍射实验 b.红外光谱法 c.核磁共振氢谱 d.质谱法
A.d—b—c—a B.b—c—d—a C.a—b—c—d D.c—d—b—a
5.如图为某烃的键线式,下列说法错误的是( )
A.该烃与环己二烯相差5个“CH2”基团
B.一定条件下,能发生加聚反应
C.苯环上只有一个取代基的同分异构体共有8种
D.该烃和Br2按物质的量之比1:1加成时,所得产物共有5种
6.实验室用环戊醇(沸点160.8℃,密度)与溴化氢反应制备溴代环戊烷(沸点138℃,密度),其反应原理如下:
则制备溴代环戊烷的装置可以选择( )
A. B. C. D.
7.下列说法错误的有( )
①乙醇、苯等有机溶剂易挥发且易被引燃,使用时需远离明火,用毕立即塞紧瓶塞
②第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
③高分子分离膜根据膜孔大小分为微滤膜、超滤膜、纳滤膜和反渗透膜等
④聚乳酸具有良好的生物相容性和生物可吸收性,可以用于手术缝合线等
⑤价层电子对互斥模型中,键电子对数不计入中心原子的价层电子对数
⑥H2O比H2S稳定是因为水分子间存在氢键
⑦卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量增大而升高
⑧邻羟基苯甲醛容易形成分子间氢键
A.①③⑥⑧ B.③④⑤⑥ C.⑥⑦⑧ D.②⑦⑧
8.下列转化不能通过一步反应实现的是( )
A.
B.
C.
D.
9.根据下列事实得出的结论,正确的是( )
选项 事实 结论
A 甲、乙两种有机物分子式均为C3H8O 甲和乙分子中C—H键数一定不同
B 某烷烃分子结构对称 该烷烃一氯代物不可能有多种
C 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 等质量的甲和乙完全燃烧时消耗氧气的量也一定相同
D 某有机物的分子式为C4H4 该有机物分子中不可能只有单键
10.某药物合成的中间体结构简式如图。下列关于该化合物的说法错误的是( )
A.化学式为C16H18O5 B.存在顺反异构和对映异构
C.其晶体类型属于共价晶体 D.苯环上的氢原子共有3种
11.有机物的结构共有(不考虑立体异构)( )
A.24种 B.28种 C.32种 D.36种
12.光刻胶是微电子技术中芯片微细图形加工的关键材料之一,其国产化势在必行。某光刻胶可由降冰片烯()与马来酸酐()共聚而成。下列说法正确的是( )
A.降冰片烯可发生加成、加聚、氧化、还原、取代等反应
B.与互为同分异构体
C.马来酸酐可稳定存在于碱性溶液中
D.该光刻胶的结构简式一定为
13.邻氨基吡啶的铜配合物在有机不对称合成中有催化诱导效应,结构简式如图所示。下列说法正确的是( )
A.的配位数是2 B.配位原子为N原子和O原子
C.N原子的杂化类型均为sp3 D.O的电负性与第一电离能均大于N
14.溴乙烷是有机合成的重要原料,实验室中可由乙醇与氢溴酸反应制备,合成路线为
下列说法错误的是( )
A.浓硫酸的浓度过大,会使粗产品略显橙色
B.用5% Na2CO3溶液洗涤分液时,有机相在分液漏斗的下层
C.无水MgSO4的作用是除去有机相中残存的少量水
D.蒸馏除去残余反应物乙醇时,乙醇先被蒸馏出体系
15.工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):。在容积固定的密闭容器中,投入等物质的量的CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示。下列说法错误的是( )
A.增大压强,甲醇转化率增大 B.b点反应速率
C.反应速率 D.生产时反应温度控制在80~85℃为宜
二、选择题:本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题目要求,全部选对得3分,选对但不全的得1分,有选错的得0分。
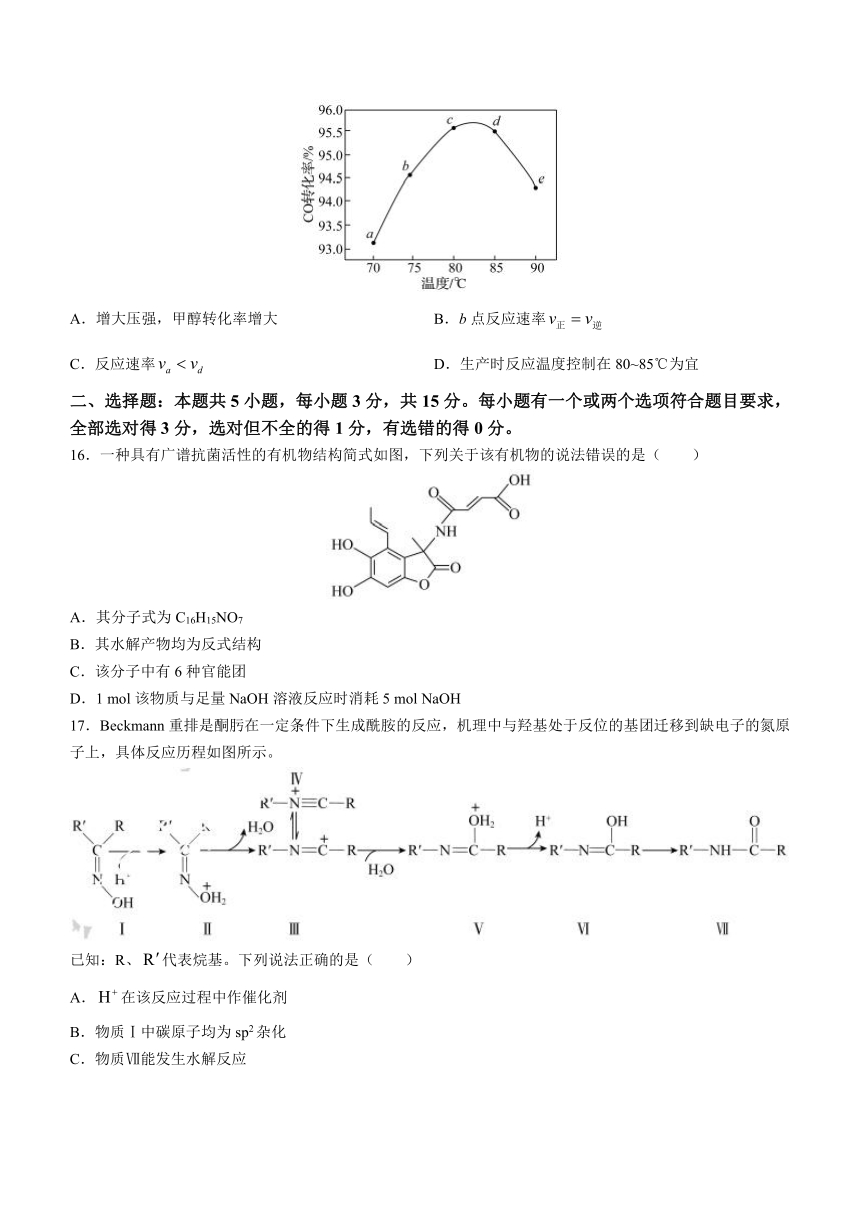
16.一种具有广谱抗菌活性的有机物结构简式如图,下列关于该有机物的说法错误的是( )
A.其分子式为C16H15NO7
B.其水解产物均为反式结构
C.该分子中有6种官能团
D.1 mol该物质与足量NaOH溶液反应时消耗5 mol NaOH
17.Beckmann重排是酮肟在一定条件下生成酰胺的反应,机理中与羟基处于反位的基团迁移到缺电子的氮原子上,具体反应历程如图所示。
已知:R、代表烷基。下列说法正确的是( )
A.在该反应过程中作催化剂
B.物质Ⅰ中碳原子均为sp2杂化
C.物质Ⅶ能发生水解反应
D.发生上述反应生成
18.在160℃、200℃条件下,分别向两个固定容积为2 L的容器中充入2 mol CO和2 mol N2O(g),发生反应: 。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是( )
A.ac段N2的平均反应速率为
B.曲线ac对应160℃条件下的反应
C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
D.160℃时,该反应的平衡常数
19.工业上利用废铁屑(含少量Fe2O3、Al2O3)生产碱式硫酸铁的工艺流程如图:
下列说法正确的是( )
A.该工艺流程符合绿色化学的理念
B.滤液中所含的阳离子主要为、、
C.反应Ⅱ加入H2SO4只是用于调节溶液酸碱性
D.蒸发过程中可以升高温度,在加快反应速率的同时还能让充分水解
20.乙烷脱氢过程中因为条件控制不当可能发生多个副反应,常温常压下有关数据如表所示。
序号 反应 正反应活化能/() 逆反应活化能/()
1 a b
2 c d
3 e f
4 — —
下列说法错误的是( )
A.已知反应1的,则其在高温下可以自发进行
B.反应2中,
C.若反应3使用催化剂,则正、逆反应活化能的减小值恰好相等
D.反应4的
第Ⅱ卷(非选择题 共55分)
三、非选择题:本题共5小题,共55分。
21.(12分)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化制备苯甲酸,反应原理如下:
(1)实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后,当出现______现象时,表明反应已基本完成,停止反应即可。
按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸相对分子质量为122,熔点为122.4℃,在25℃和95℃时,溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(2)操作Ⅰ为______,需要用到的主要玻璃分离仪器为______;操作Ⅱ为______。
(3)测定白色固体B的熔点,发现其在115℃时开始熔化,达到130℃时仍有少量不熔,该同学推测固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请将相关的实验操作或实验现象填写在下列空格中。
①将白色固体B加入水中,______、______、过滤,得到白色晶体和无色溶液。
②取少量滤液于试管中,______,会生成白色沉淀,表明滤液含。
③取干燥白色晶体,______,表明白色晶体是苯甲酸。
22.(10分)氧化锌在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中应用广泛。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有量筒、烧杯、______(填名称)。
(2)写出第Ⅰ步中Cu参加反应的离子方程式:____________________。
(3)若溶液C中、,常温下,有关离子沉淀的pH如表所示(当离子浓度为时认为沉淀完全):
离子
开始沉淀的pH 2.3 7.3 6.2
沉淀完全的pH 3.3 — 8.37
①溶液C中加入过氧化氢溶液的目的是____________________。
②查阅资料发现,沉淀的pH不能大于11,其原因是____________________。
(4)第Ⅴ步中“系列操作”指的是过滤、洗涤和煅烧,检验沉淀洗涤干净的试剂是______(写出试剂名称)。
23.(9分)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃,FeCO3开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
Ⅰ.已知25℃,101 kPa时:
(1) ______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为
①原子序数为26的铁元素位于元素周期表的第______周期。
②反应在5 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量消耗4.8 g。则该段时间内用H2表达的平均反应速率为______。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______(填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.
d.固体的总质量不变
(3)FeO可用CO进行还原,已知:T℃时,,,若在1 L密闭容器中加入0.04 mol FeO(s),并通入x mol CO,T℃时反应达到平衡,此时FeO(s)的转化率为50%,则______。
24.(10分)铁系元素是第一过渡系列第Ⅷ族的三个相邻元素——Fe、Co、Ni,它们是人体必需的微量元素,也是现代工业和高新技术的重要材料。
(1)基态Ni的轨道中未成对电子有______个。
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测是______(填“极性”或“非极性”)分子;写出CO的结构式:______。
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故在酸性溶液中常发生水解:(配离子)。则配离子中的配位数为______,1 mol该配离子所含键的数目为______(设为阿伏加德罗常数)。
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为______。
25.(14分)医药中间体M()的一种合成路线如图:
已知:
ⅰ.
ⅱ.(R代表烃基,X代表卤素原子)
ⅲ.(代表烃基或氢原子,代表烃基)
回答下列问题:
(1)M中含氧官能团的名称为______;A的名称为______,试剂a为______。
(2)同时满足下列条件的C的同分异构体有______种。
a.含有苯环 b.核磁共振氢谱显示四组峰,且峰面积之比为1:1:2:6
(3)G生成H的同时还生成一种有机物______(写结构简式);H→I的反应类型为______。
(4)J→K可认为分三步进行:JXYK,则Y的结构简式为______。
(5)综合上述信息,写出由甲苯和甲醇制备的合成路线:______。
参考答案
一、选择题
1~5 DBDAA 6~10 CCDCC 11~15 DABDB
二、选择题
16.CD 17.AC 18.D 19.B 20.D
三、非选择题
21.(1)油层高度不变或紫色消失(2分) (2)分液(2分) 分液漏斗(1分) 蒸馏(1分)
(3)①加热溶解(1分) 冷却结晶(1分) ②滴加2~3滴硝酸酸化的硝酸银溶液(2分)
③加热使其熔化,并测其熔点,熔点为122.4℃(2分)
22.(1)玻璃棒(合理即可,2分)
(2)(2分)
(3)①将溶液中的亚铁离子氧化为铁离子(2分)
②碱性太强时,溶解转化为,从而降低ZnO的产率(2分)
(4)稀盐酸、氯化钡溶液(2分)
23.Ⅰ.(1)(2分)
Ⅱ.(2)①四(1分) ②(2分) ③bcd(2分) (3)0.06(2分)
24.(1)2(1分) (2)非极性(2分) C≡O(2分)
(3)6(1分) (2分) (4)FeMg2H2(2分)
25.(1)酰胺基(1分) 苯乙烯(1分) HCl、H2O2(2分)
(2)6(2分)
(3)CH3CH2OH(2分) 取代反应(1分)
(4)(2分)
(5)(后三步每步1分,只写对第一步不得分,写错第一步扣1分,3分)
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共8页,总分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56
第Ⅰ卷(选择题 共45分)
一、选择题:本题共15小题,每小题2分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境,实现绿色发展至关重要。碳中和是指CO2的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是( )
A.将重质油裂解为轻质油作为燃料 B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染 D.研发催化剂将CO2还原为甲醇
2.某烯烃与氢气加成后得到2,3-二甲基戊烷,烯烃的名称错误的是( )
A.2,3-二甲基-1-戊烯 B.2,3-二甲基-4-戊烯
C.3,4-二甲基-2-戊烯 D.2,3-二甲基-2-戊烯
3.据报道:清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维。下列说法正确的是( )
A.石墨烯属于烯烃,属于有机物 B.碳纳米管和石墨烯互为同分异构体
C.蚕丝纤维属于纤维素,可发生水解反应 D.鉴别某丝织品是否为真蚕丝可以用灼烧的方法
4.我国屠呦呦等科学家通过元素分析和______分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。经______和______分析,确定青蒿素分子中含有酯基和甲基等结构片段。通过______最终测定了青蒿素的分子结构。以上横线中使用方法顺序正确的是( )
a.X射线衍射实验 b.红外光谱法 c.核磁共振氢谱 d.质谱法
A.d—b—c—a B.b—c—d—a C.a—b—c—d D.c—d—b—a
5.如图为某烃的键线式,下列说法错误的是( )
A.该烃与环己二烯相差5个“CH2”基团
B.一定条件下,能发生加聚反应
C.苯环上只有一个取代基的同分异构体共有8种
D.该烃和Br2按物质的量之比1:1加成时,所得产物共有5种
6.实验室用环戊醇(沸点160.8℃,密度)与溴化氢反应制备溴代环戊烷(沸点138℃,密度),其反应原理如下:
则制备溴代环戊烷的装置可以选择( )
A. B. C. D.
7.下列说法错误的有( )
①乙醇、苯等有机溶剂易挥发且易被引燃,使用时需远离明火,用毕立即塞紧瓶塞
②第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
③高分子分离膜根据膜孔大小分为微滤膜、超滤膜、纳滤膜和反渗透膜等
④聚乳酸具有良好的生物相容性和生物可吸收性,可以用于手术缝合线等
⑤价层电子对互斥模型中,键电子对数不计入中心原子的价层电子对数
⑥H2O比H2S稳定是因为水分子间存在氢键
⑦卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量增大而升高
⑧邻羟基苯甲醛容易形成分子间氢键
A.①③⑥⑧ B.③④⑤⑥ C.⑥⑦⑧ D.②⑦⑧
8.下列转化不能通过一步反应实现的是( )
A.
B.
C.
D.
9.根据下列事实得出的结论,正确的是( )
选项 事实 结论
A 甲、乙两种有机物分子式均为C3H8O 甲和乙分子中C—H键数一定不同
B 某烷烃分子结构对称 该烷烃一氯代物不可能有多种
C 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 等质量的甲和乙完全燃烧时消耗氧气的量也一定相同
D 某有机物的分子式为C4H4 该有机物分子中不可能只有单键
10.某药物合成的中间体结构简式如图。下列关于该化合物的说法错误的是( )
A.化学式为C16H18O5 B.存在顺反异构和对映异构
C.其晶体类型属于共价晶体 D.苯环上的氢原子共有3种
11.有机物的结构共有(不考虑立体异构)( )
A.24种 B.28种 C.32种 D.36种
12.光刻胶是微电子技术中芯片微细图形加工的关键材料之一,其国产化势在必行。某光刻胶可由降冰片烯()与马来酸酐()共聚而成。下列说法正确的是( )
A.降冰片烯可发生加成、加聚、氧化、还原、取代等反应
B.与互为同分异构体
C.马来酸酐可稳定存在于碱性溶液中
D.该光刻胶的结构简式一定为
13.邻氨基吡啶的铜配合物在有机不对称合成中有催化诱导效应,结构简式如图所示。下列说法正确的是( )
A.的配位数是2 B.配位原子为N原子和O原子
C.N原子的杂化类型均为sp3 D.O的电负性与第一电离能均大于N
14.溴乙烷是有机合成的重要原料,实验室中可由乙醇与氢溴酸反应制备,合成路线为
下列说法错误的是( )
A.浓硫酸的浓度过大,会使粗产品略显橙色
B.用5% Na2CO3溶液洗涤分液时,有机相在分液漏斗的下层
C.无水MgSO4的作用是除去有机相中残存的少量水
D.蒸馏除去残余反应物乙醇时,乙醇先被蒸馏出体系
15.工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):。在容积固定的密闭容器中,投入等物质的量的CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示。下列说法错误的是( )
A.增大压强,甲醇转化率增大 B.b点反应速率
C.反应速率 D.生产时反应温度控制在80~85℃为宜
二、选择题:本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题目要求,全部选对得3分,选对但不全的得1分,有选错的得0分。
16.一种具有广谱抗菌活性的有机物结构简式如图,下列关于该有机物的说法错误的是( )
A.其分子式为C16H15NO7
B.其水解产物均为反式结构
C.该分子中有6种官能团
D.1 mol该物质与足量NaOH溶液反应时消耗5 mol NaOH
17.Beckmann重排是酮肟在一定条件下生成酰胺的反应,机理中与羟基处于反位的基团迁移到缺电子的氮原子上,具体反应历程如图所示。
已知:R、代表烷基。下列说法正确的是( )
A.在该反应过程中作催化剂
B.物质Ⅰ中碳原子均为sp2杂化
C.物质Ⅶ能发生水解反应
D.发生上述反应生成
18.在160℃、200℃条件下,分别向两个固定容积为2 L的容器中充入2 mol CO和2 mol N2O(g),发生反应: 。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是( )
A.ac段N2的平均反应速率为
B.曲线ac对应160℃条件下的反应
C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
D.160℃时,该反应的平衡常数
19.工业上利用废铁屑(含少量Fe2O3、Al2O3)生产碱式硫酸铁的工艺流程如图:
下列说法正确的是( )
A.该工艺流程符合绿色化学的理念
B.滤液中所含的阳离子主要为、、
C.反应Ⅱ加入H2SO4只是用于调节溶液酸碱性
D.蒸发过程中可以升高温度,在加快反应速率的同时还能让充分水解
20.乙烷脱氢过程中因为条件控制不当可能发生多个副反应,常温常压下有关数据如表所示。
序号 反应 正反应活化能/() 逆反应活化能/()
1 a b
2 c d
3 e f
4 — —
下列说法错误的是( )
A.已知反应1的,则其在高温下可以自发进行
B.反应2中,
C.若反应3使用催化剂,则正、逆反应活化能的减小值恰好相等
D.反应4的
第Ⅱ卷(非选择题 共55分)
三、非选择题:本题共5小题,共55分。
21.(12分)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化制备苯甲酸,反应原理如下:
(1)实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后,当出现______现象时,表明反应已基本完成,停止反应即可。
按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸相对分子质量为122,熔点为122.4℃,在25℃和95℃时,溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(2)操作Ⅰ为______,需要用到的主要玻璃分离仪器为______;操作Ⅱ为______。
(3)测定白色固体B的熔点,发现其在115℃时开始熔化,达到130℃时仍有少量不熔,该同学推测固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请将相关的实验操作或实验现象填写在下列空格中。
①将白色固体B加入水中,______、______、过滤,得到白色晶体和无色溶液。
②取少量滤液于试管中,______,会生成白色沉淀,表明滤液含。
③取干燥白色晶体,______,表明白色晶体是苯甲酸。
22.(10分)氧化锌在半导体领域的液晶显示器、薄膜晶体管、发光二极管等产品中应用广泛。实验室利用清洗过的废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
已知:锌灰的主要成分为Zn、ZnO,含有铁及其氧化物杂质;ZnO、均为两性化合物。
(1)实验室用质量分数30%的双氧水配制约15%的双氧水通常使用的玻璃仪器有量筒、烧杯、______(填名称)。
(2)写出第Ⅰ步中Cu参加反应的离子方程式:____________________。
(3)若溶液C中、,常温下,有关离子沉淀的pH如表所示(当离子浓度为时认为沉淀完全):
离子
开始沉淀的pH 2.3 7.3 6.2
沉淀完全的pH 3.3 — 8.37
①溶液C中加入过氧化氢溶液的目的是____________________。
②查阅资料发现,沉淀的pH不能大于11,其原因是____________________。
(4)第Ⅴ步中“系列操作”指的是过滤、洗涤和煅烧,检验沉淀洗涤干净的试剂是______(写出试剂名称)。
23.(9分)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃,FeCO3开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
Ⅰ.已知25℃,101 kPa时:
(1) ______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为
①原子序数为26的铁元素位于元素周期表的第______周期。
②反应在5 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量消耗4.8 g。则该段时间内用H2表达的平均反应速率为______。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______(填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.
d.固体的总质量不变
(3)FeO可用CO进行还原,已知:T℃时,,,若在1 L密闭容器中加入0.04 mol FeO(s),并通入x mol CO,T℃时反应达到平衡,此时FeO(s)的转化率为50%,则______。
24.(10分)铁系元素是第一过渡系列第Ⅷ族的三个相邻元素——Fe、Co、Ni,它们是人体必需的微量元素,也是现代工业和高新技术的重要材料。
(1)基态Ni的轨道中未成对电子有______个。
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测是______(填“极性”或“非极性”)分子;写出CO的结构式:______。
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故在酸性溶液中常发生水解:(配离子)。则配离子中的配位数为______,1 mol该配离子所含键的数目为______(设为阿伏加德罗常数)。
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为______。
25.(14分)医药中间体M()的一种合成路线如图:
已知:
ⅰ.
ⅱ.(R代表烃基,X代表卤素原子)
ⅲ.(代表烃基或氢原子,代表烃基)
回答下列问题:
(1)M中含氧官能团的名称为______;A的名称为______,试剂a为______。
(2)同时满足下列条件的C的同分异构体有______种。
a.含有苯环 b.核磁共振氢谱显示四组峰,且峰面积之比为1:1:2:6
(3)G生成H的同时还生成一种有机物______(写结构简式);H→I的反应类型为______。
(4)J→K可认为分三步进行:JXYK,则Y的结构简式为______。
(5)综合上述信息,写出由甲苯和甲醇制备的合成路线:______。
参考答案
一、选择题
1~5 DBDAA 6~10 CCDCC 11~15 DABDB
二、选择题
16.CD 17.AC 18.D 19.B 20.D
三、非选择题
21.(1)油层高度不变或紫色消失(2分) (2)分液(2分) 分液漏斗(1分) 蒸馏(1分)
(3)①加热溶解(1分) 冷却结晶(1分) ②滴加2~3滴硝酸酸化的硝酸银溶液(2分)
③加热使其熔化,并测其熔点,熔点为122.4℃(2分)
22.(1)玻璃棒(合理即可,2分)
(2)(2分)
(3)①将溶液中的亚铁离子氧化为铁离子(2分)
②碱性太强时,溶解转化为,从而降低ZnO的产率(2分)
(4)稀盐酸、氯化钡溶液(2分)
23.Ⅰ.(1)(2分)
Ⅱ.(2)①四(1分) ②(2分) ③bcd(2分) (3)0.06(2分)
24.(1)2(1分) (2)非极性(2分) C≡O(2分)
(3)6(1分) (2分) (4)FeMg2H2(2分)
25.(1)酰胺基(1分) 苯乙烯(1分) HCl、H2O2(2分)
(2)6(2分)
(3)CH3CH2OH(2分) 取代反应(1分)
(4)(2分)
(5)(后三步每步1分,只写对第一步不得分,写错第一步扣1分,3分)
同课章节目录
