2.2.1氯气的性质 课件(共26张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质 课件(共26张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 09:26:32 | ||
图片预览





文档简介
(共26张PPT)
第二节 氯及其化合物
第一课时 氯气的性质
第二章海水中的重要元素——钠和氯
目录
CONTENT
第二章海水中的重要元素——钠和氯
一、氯气的物理性质
二、与金属、非金属单质的反应
三、与水和碱的反应
1.
2.
3.
4.
学习目标
了解氯气的主要性质和用途
掌握氯气与金属单质、非金属单质及水
的反应
了解氯水的漂白现象及原理并能够作出解释
培养科学探究与创新精神
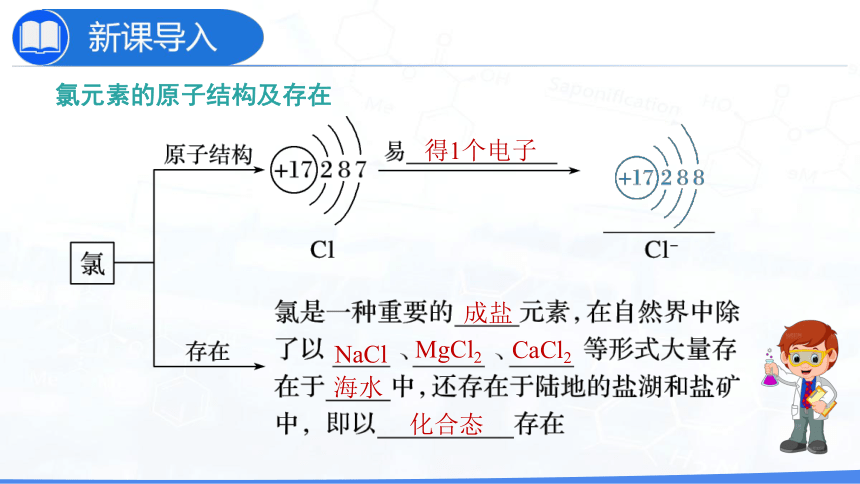
得1个电子
成盐
NaCl
MgCl2
CaCl2
海水
化合态
氯元素的原子结构及存在
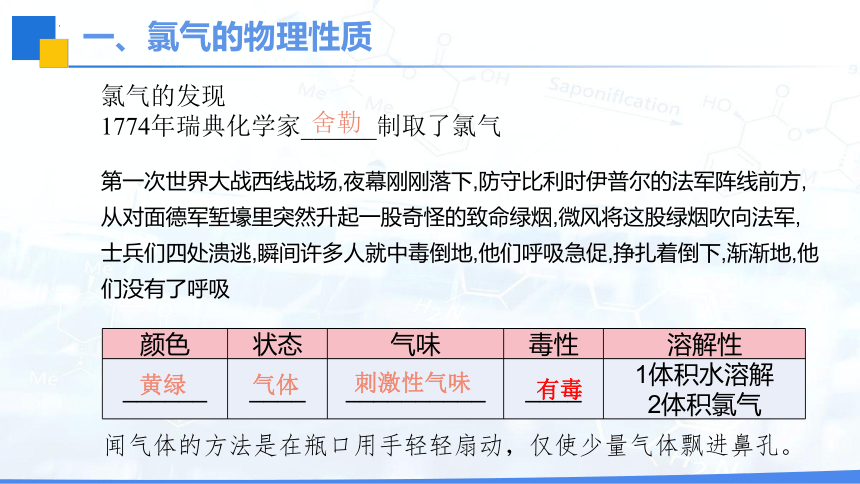
一、氯气的物理性质
颜色 状态 气味 毒性 溶解性
______ ____ __________ ____ 1体积水溶解
2体积氯气
黄绿
气体
刺激性气味
有毒
氯气的发现
1774年瑞典化学家______制取了氯气
舍勒
第一次世界大战西线战场,夜幕刚刚落下,防守比利时伊普尔的法军阵线前方,从对面德军堑壕里突然升起一股奇怪的致命绿烟,微风将这股绿烟吹向法军,士兵们四处溃逃,瞬间许多人就中毒倒地,他们呼吸急促,挣扎着倒下,渐渐地,他们没有了呼吸
闻气体的方法是在瓶口用手轻轻扇动,仅使少量气体飘进鼻孔。
判断
(1)虽然氯气有毒,但仍可闻氯气的气味,方法是用手轻轻在集气瓶瓶口扇动,使极少量氯气飘进鼻孔( )
(2)发生氯气泄漏时,污染区的居民应向低洼处转移( )
(3)收集氯气时,可根据集气瓶内是否充满黄绿色气体来检验是否收集满( )
(4)充满氯气的塑料矿泉水瓶中加入20 mL水,盖好瓶盖,用力振荡,矿泉水瓶会变瘪( )
(5)氯气的密度比空气大,常用向上排空气法收集氯气,也可用排水法收集( )
×
√
×
√
√
返回
一、氯气的物理性质
二、与金属、非金属单质的反应
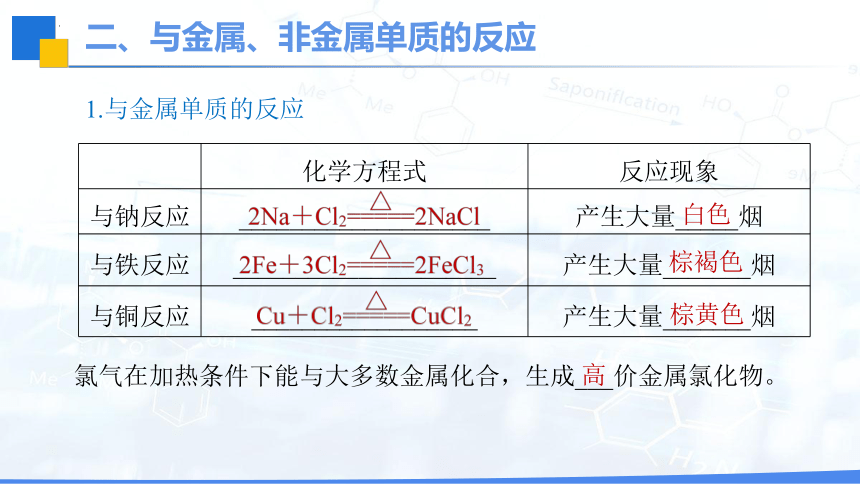
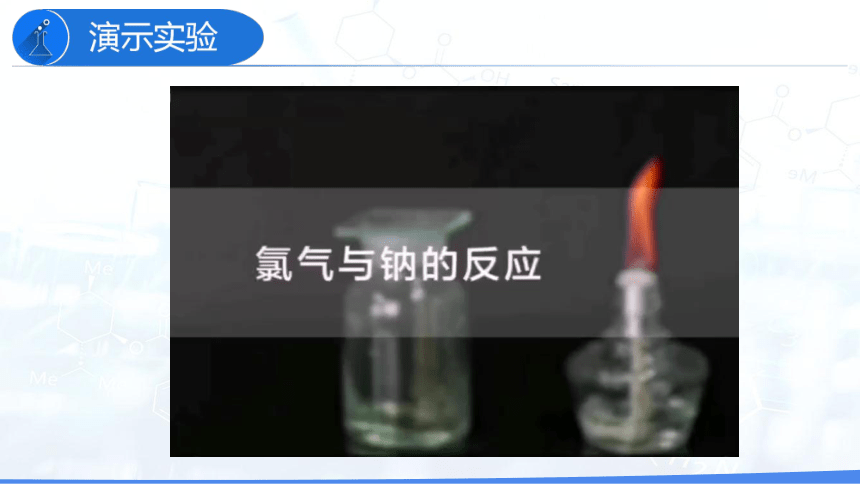
1.与金属单质的反应
化学方程式 反应现象
与钠反应 ____________________ 产生大量_____烟
与铁反应 _____________________ 产生大量_______烟
与铜反应 __________________ 产生大量_______烟
白色
棕褐色
棕黄色
氯气在加热条件下能与大多数金属化合,生成___价金属氯化物。
高
二、与金属、非金属单质的反应
2.与非金属单质的反应
实验[2-7]在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中,观察现象。
实验操作 实验现象 化学方程式
在空气中点燃H2,然后把导管缓慢伸入盛满Cl2的集气瓶中 H2在Cl2中安静地燃烧 ,发出_____________ __________________
燃烧结束后,抽去盖在集气瓶口处的毛玻璃片 瓶口上方出现_______ 苍白色火焰
H2+Cl2 2HCl
点燃
====
白雾
提醒 (1)燃烧是发光发热的剧烈的化学反应,不一定要有氧气参与。如2P+3Cl2 2PCl3等。
(2)若将H2与Cl2混合点燃或强光照射会发生爆炸。
二、与金属、非金属单质的反应
(1)燃烧是发光发热的剧烈的化学反应,必须有氧气参与( )
(2)铁丝在少量的Cl2中燃烧可生成FeCl2( )
(3)纯净的H2在Cl2中安静地燃烧,发出苍白色火焰( )
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液( )
×
√
×
×
1.与水的反应
三、与水和碱的反应
①常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应的化学方程式是_______________________。
②次氯酸漂白原理的探究实验
[实验2-8]
Cl2+H2O===HCl+HClO
③次氯酸的性质和用途
(1) 弱酸性 酸性很弱,比碳酸还_____
(2) 不稳定性 不稳定,见光易分解,化学方程式:_______________________
(3) 强氧化性 用于漂白、杀菌消毒
弱
三、与水和碱的反应
漂白性:氯水有漂白作用,起漂白作用的是__________。
用途:次氯酸可用作棉、麻和纸张的漂白剂。
HClO
知识拓展
认识氯水因具有强氧化性,常用来消毒。氯水有多种成分,因而具有多重性质。
氯水的成分
氯水中存在反应:
Cl2+H2O===HCl+HClO,HClO和HCl发生电离。氯水中含有以下粒子:
①三分子:Cl2、HClO、H2O;
②四离子:H+、Cl-、ClO-、OH-。
液氯 新制氯水 久置氯水
粒子种类 Cl2 H2O、Cl2、HClO、H+、 Cl-、ClO-、OH- H2O、H+、
Cl-、OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 强氧化性 酸性、强氧化性、 漂白性 酸性
液氯、氯水的比较
2.与碱的反应
三、与水和碱的反应
①与氢氧化钠溶液反应——制取漂白液
(1)制取反应的化学方程式:__________________________________。
(2)漂白液的有效成分是_________。
Cl2+2NaOH===NaCl+NaClO+H2O
次氯酸钠
②.与石灰乳反应——制取漂白粉
(1)制取反应的化学方程式:______________________________________。
(2)漂白粉的主要成分是________________,有效成分是_________,漂粉精的主要成分是_________。
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的__________与酸(如盐酸或碳酸等)反应生成具有漂白性的_______。
(4)漂白粉的保存:漂白粉应_____、_____保存,并置于_____干燥处。
次氯酸钙
次氯酸
密封
避光
阴凉
三、与水和碱的反应
注意:(1)自来水常用氯气来杀菌消毒,但因氯气的溶解度不大,而且生成的次氯酸很不稳定,不便于保存,而次氯酸盐性质稳定,且遇酸或空气中的CO2和水蒸气可生成HClO。因此常用氯气与碱反应制取漂白粉。
(2)漂白粉在空气中保存不当会变质。因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处。
1.漂白粉长期露置于空气中,最终会失效,写出失效所发生的化学方程式。
提示 Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;
2HClO 2HCl+O2↑。
2.用次氯酸盐而不用氯水作漂白剂的优点是什么?工业制取漂白粉时,为什么用石灰乳而不用澄清石灰水?
提示 便于保存且使用时生成的次氯酸浓度比氯水中的大。Ca(OH)2在水中溶解度小,用石灰乳可以更好的(吸收Cl2)制取漂白粉。
(1)次氯酸盐比次氯酸稳定,不易分解且次氯酸盐固体比氯水(次氯酸)易于贮存和运输,故生产、生活中常用次氯酸盐(如漂白粉)代替次氯酸作漂白剂和消毒剂。
(2)次氯酸盐中的ClO-具有氧化性,且随着溶液酸性的增强,其氧化性增强。
(3)具有漂白和消毒作用的含氯化合物有次氯酸、次氯酸盐(次氯酸钙、次氯酸钠)、二氧化氯(ClO2)。二氧化氯的漂白和消毒能力比氯气强且使用起来更安全。
归纳总结
1.下列说法正确的是( )
A.自来水中通入少量Cl2用于杀菌、消毒是利用了Cl2能杀菌、消毒
B.漂白粉的主要成分是Ca(ClO)2,可用于杀菌、消毒
C.漂白粉是由Cl2和NaOH浓溶液制得
D.漂白粉与空气中的CO2和H2O反应而失效,因此要密封保存在干燥阴凉处
D
2.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
C
3.下列实验现象的描述正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟雾
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在空气中燃烧,发出黄色火焰,生成白色固体
C
4.下列氯化物中,既能由金属和Cl2直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.MgCl2 C.FeCl2 D.FeCl3
B
5.某同学利用如图所示的装置进行有关实验。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。
请回答下列问题:
(1)该实验的主要目的是研究干燥
的氯气是否具有______作用。
漂白
(2)浓硫酸的作用是___________________。
除去H2O(干燥氯气)
(3)实验过程中观察到B瓶中干燥的有色布条________(填“褪”或“不褪”)色。
不褪
谢谢
第二节 氯及其化合物
第一课时 氯气的性质
第二章海水中的重要元素——钠和氯
目录
CONTENT
第二章海水中的重要元素——钠和氯
一、氯气的物理性质
二、与金属、非金属单质的反应
三、与水和碱的反应
1.
2.
3.
4.
学习目标
了解氯气的主要性质和用途
掌握氯气与金属单质、非金属单质及水
的反应
了解氯水的漂白现象及原理并能够作出解释
培养科学探究与创新精神
得1个电子
成盐
NaCl
MgCl2
CaCl2
海水
化合态
氯元素的原子结构及存在
一、氯气的物理性质
颜色 状态 气味 毒性 溶解性
______ ____ __________ ____ 1体积水溶解
2体积氯气
黄绿
气体
刺激性气味
有毒
氯气的发现
1774年瑞典化学家______制取了氯气
舍勒
第一次世界大战西线战场,夜幕刚刚落下,防守比利时伊普尔的法军阵线前方,从对面德军堑壕里突然升起一股奇怪的致命绿烟,微风将这股绿烟吹向法军,士兵们四处溃逃,瞬间许多人就中毒倒地,他们呼吸急促,挣扎着倒下,渐渐地,他们没有了呼吸
闻气体的方法是在瓶口用手轻轻扇动,仅使少量气体飘进鼻孔。
判断
(1)虽然氯气有毒,但仍可闻氯气的气味,方法是用手轻轻在集气瓶瓶口扇动,使极少量氯气飘进鼻孔( )
(2)发生氯气泄漏时,污染区的居民应向低洼处转移( )
(3)收集氯气时,可根据集气瓶内是否充满黄绿色气体来检验是否收集满( )
(4)充满氯气的塑料矿泉水瓶中加入20 mL水,盖好瓶盖,用力振荡,矿泉水瓶会变瘪( )
(5)氯气的密度比空气大,常用向上排空气法收集氯气,也可用排水法收集( )
×
√
×
√
√
返回
一、氯气的物理性质
二、与金属、非金属单质的反应
1.与金属单质的反应
化学方程式 反应现象
与钠反应 ____________________ 产生大量_____烟
与铁反应 _____________________ 产生大量_______烟
与铜反应 __________________ 产生大量_______烟
白色
棕褐色
棕黄色
氯气在加热条件下能与大多数金属化合,生成___价金属氯化物。
高
二、与金属、非金属单质的反应
2.与非金属单质的反应
实验[2-7]在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中,观察现象。
实验操作 实验现象 化学方程式
在空气中点燃H2,然后把导管缓慢伸入盛满Cl2的集气瓶中 H2在Cl2中安静地燃烧 ,发出_____________ __________________
燃烧结束后,抽去盖在集气瓶口处的毛玻璃片 瓶口上方出现_______ 苍白色火焰
H2+Cl2 2HCl
点燃
====
白雾
提醒 (1)燃烧是发光发热的剧烈的化学反应,不一定要有氧气参与。如2P+3Cl2 2PCl3等。
(2)若将H2与Cl2混合点燃或强光照射会发生爆炸。
二、与金属、非金属单质的反应
(1)燃烧是发光发热的剧烈的化学反应,必须有氧气参与( )
(2)铁丝在少量的Cl2中燃烧可生成FeCl2( )
(3)纯净的H2在Cl2中安静地燃烧,发出苍白色火焰( )
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液( )
×
√
×
×
1.与水的反应
三、与水和碱的反应
①常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应的化学方程式是_______________________。
②次氯酸漂白原理的探究实验
[实验2-8]
Cl2+H2O===HCl+HClO
③次氯酸的性质和用途
(1) 弱酸性 酸性很弱,比碳酸还_____
(2) 不稳定性 不稳定,见光易分解,化学方程式:_______________________
(3) 强氧化性 用于漂白、杀菌消毒
弱
三、与水和碱的反应
漂白性:氯水有漂白作用,起漂白作用的是__________。
用途:次氯酸可用作棉、麻和纸张的漂白剂。
HClO
知识拓展
认识氯水因具有强氧化性,常用来消毒。氯水有多种成分,因而具有多重性质。
氯水的成分
氯水中存在反应:
Cl2+H2O===HCl+HClO,HClO和HCl发生电离。氯水中含有以下粒子:
①三分子:Cl2、HClO、H2O;
②四离子:H+、Cl-、ClO-、OH-。
液氯 新制氯水 久置氯水
粒子种类 Cl2 H2O、Cl2、HClO、H+、 Cl-、ClO-、OH- H2O、H+、
Cl-、OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 强氧化性 酸性、强氧化性、 漂白性 酸性
液氯、氯水的比较
2.与碱的反应
三、与水和碱的反应
①与氢氧化钠溶液反应——制取漂白液
(1)制取反应的化学方程式:__________________________________。
(2)漂白液的有效成分是_________。
Cl2+2NaOH===NaCl+NaClO+H2O
次氯酸钠
②.与石灰乳反应——制取漂白粉
(1)制取反应的化学方程式:______________________________________。
(2)漂白粉的主要成分是________________,有效成分是_________,漂粉精的主要成分是_________。
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的__________与酸(如盐酸或碳酸等)反应生成具有漂白性的_______。
(4)漂白粉的保存:漂白粉应_____、_____保存,并置于_____干燥处。
次氯酸钙
次氯酸
密封
避光
阴凉
三、与水和碱的反应
注意:(1)自来水常用氯气来杀菌消毒,但因氯气的溶解度不大,而且生成的次氯酸很不稳定,不便于保存,而次氯酸盐性质稳定,且遇酸或空气中的CO2和水蒸气可生成HClO。因此常用氯气与碱反应制取漂白粉。
(2)漂白粉在空气中保存不当会变质。因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处。
1.漂白粉长期露置于空气中,最终会失效,写出失效所发生的化学方程式。
提示 Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;
2HClO 2HCl+O2↑。
2.用次氯酸盐而不用氯水作漂白剂的优点是什么?工业制取漂白粉时,为什么用石灰乳而不用澄清石灰水?
提示 便于保存且使用时生成的次氯酸浓度比氯水中的大。Ca(OH)2在水中溶解度小,用石灰乳可以更好的(吸收Cl2)制取漂白粉。
(1)次氯酸盐比次氯酸稳定,不易分解且次氯酸盐固体比氯水(次氯酸)易于贮存和运输,故生产、生活中常用次氯酸盐(如漂白粉)代替次氯酸作漂白剂和消毒剂。
(2)次氯酸盐中的ClO-具有氧化性,且随着溶液酸性的增强,其氧化性增强。
(3)具有漂白和消毒作用的含氯化合物有次氯酸、次氯酸盐(次氯酸钙、次氯酸钠)、二氧化氯(ClO2)。二氧化氯的漂白和消毒能力比氯气强且使用起来更安全。
归纳总结
1.下列说法正确的是( )
A.自来水中通入少量Cl2用于杀菌、消毒是利用了Cl2能杀菌、消毒
B.漂白粉的主要成分是Ca(ClO)2,可用于杀菌、消毒
C.漂白粉是由Cl2和NaOH浓溶液制得
D.漂白粉与空气中的CO2和H2O反应而失效,因此要密封保存在干燥阴凉处
D
2.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
C
3.下列实验现象的描述正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟雾
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在空气中燃烧,发出黄色火焰,生成白色固体
C
4.下列氯化物中,既能由金属和Cl2直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.MgCl2 C.FeCl2 D.FeCl3
B
5.某同学利用如图所示的装置进行有关实验。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。
请回答下列问题:
(1)该实验的主要目的是研究干燥
的氯气是否具有______作用。
漂白
(2)浓硫酸的作用是___________________。
除去H2O(干燥氯气)
(3)实验过程中观察到B瓶中干燥的有色布条________(填“褪”或“不褪”)色。
不褪
谢谢
