第三章《晶体结构与性质》测试(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章《晶体结构与性质》测试(含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 368.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 11:08:11 | ||
图片预览



文档简介
第三章《晶体结构与性质》测试
一、单选题
1.炼钢厂排放的烟气中主要含SO2、NO、N2等。臭氧(O3)具有强氧化性,可用于烟气的脱硫脱硝,其空间构型与SO2相同。向含NO的模拟烟气中通入足量O3,发生的反应为2NO(g)+3O3(g)=N2O5(g)+3O2(g) ΔH<0,生成的N2O5再用NH3还原为N2;向含SO2的模拟烟气中通入一定量NH3、O3,一段时间后检测到有(NH4)2SO4和少量(NH4)2SO3生成。下列有关O3 、SO、SO和NH3的说法正确的是
A.O3的空间构型为三角锥形
B.SO与SO中硫氧键的键角相等
C.氨气易液化是因为NH3与H2O之间形成了分子间氢键
D.NH3能与Ag+、Cu2+形成配合物是因为NH3中的N存在孤电子对
2.下列各物质的晶体中,晶体类型相同的是
A.SO2和H2O B.HCl和NaCl C.CO2和SiO2 D.Cu和Ne
3.下列关于晶格能的说法正确的是
A.晶格能指形成1mol离子键所放出的能量
B.晶格能指破坏1mol离子键所吸收的能量
C.晶格能指将1mol离子晶体完全气化为气态阴、阳离子所吸收的能量
D.晶格能的大小与晶体的熔点、硬度都无关
4.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①SiO2和SO3 ②石墨和碘 ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮
A.③④ B.③④⑤ C.①③④ D.①②⑤
5.下列物质都是固体,其中不是晶体的是
①橡胶 ②石墨 ③水 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦ C.②④⑤⑦ D.①③⑥
6.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如下图所示。假设CeO2晶胞边长为apm,下列说法不正确的是
A.基态O原子的价层电子排布式为
B.CeO2晶体结构中与相邻且最近的有12个
C.CeO2晶胞中与最近的核间距为
D.每个CeO2-x晶胞中个数为1-2x
7.下列属于离子化合物的是
A.H2O B.NaCl C.HCl D.CH4
8.CaTiO3的晶体结构模型如图所示(图中Ca2+、O2 、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是
A.CaTiO3的摩尔质量为136
B.CaTiO3 晶体中每个Ti4+与12 个Ca2+紧相邻
C.CaTiO3晶体中每个Ti4+与12 个O2 紧相邻
D.CaTiO3晶体中每个Ti4+与12 个Ti4+紧相邻
9.硫代硫酸钠Na2S2O3(相当于中一个氧被硫替代)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法不正确的是
A.基态Br原子核外电子的运动状态有35种
B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C.中心原子S的杂化方式为sp3
D.1molNa3[Ag(S2O3)2]中含有10molσ键
10.下列关于化学键的说法正确的是( )
A.阴、阳离子之间通过相互吸引作用形成的化学键叫离子键
B.根据电离方程式HCl=H++Cl-,可判断HCl分子里存在离子键
C.化学键的断裂和形成是化学反应能量变化的主要原因
D.离子化合物一定由金属元素和非金属元素组成
11.从严格意义上讲石墨属于
A.分子晶体 B.原子晶体 C.金属晶体 D.混合型晶体
12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍,下列说法正确的是
A.X与Y形成的化合物只有一种
B.X和W形成的化合物能与R单质发生置换反应
C.R与X,R与Z形成的化合物,化学键类型相同
D.YR4分子中各原子的最外层电子数不能满足8电子稳定结构
二、填空题
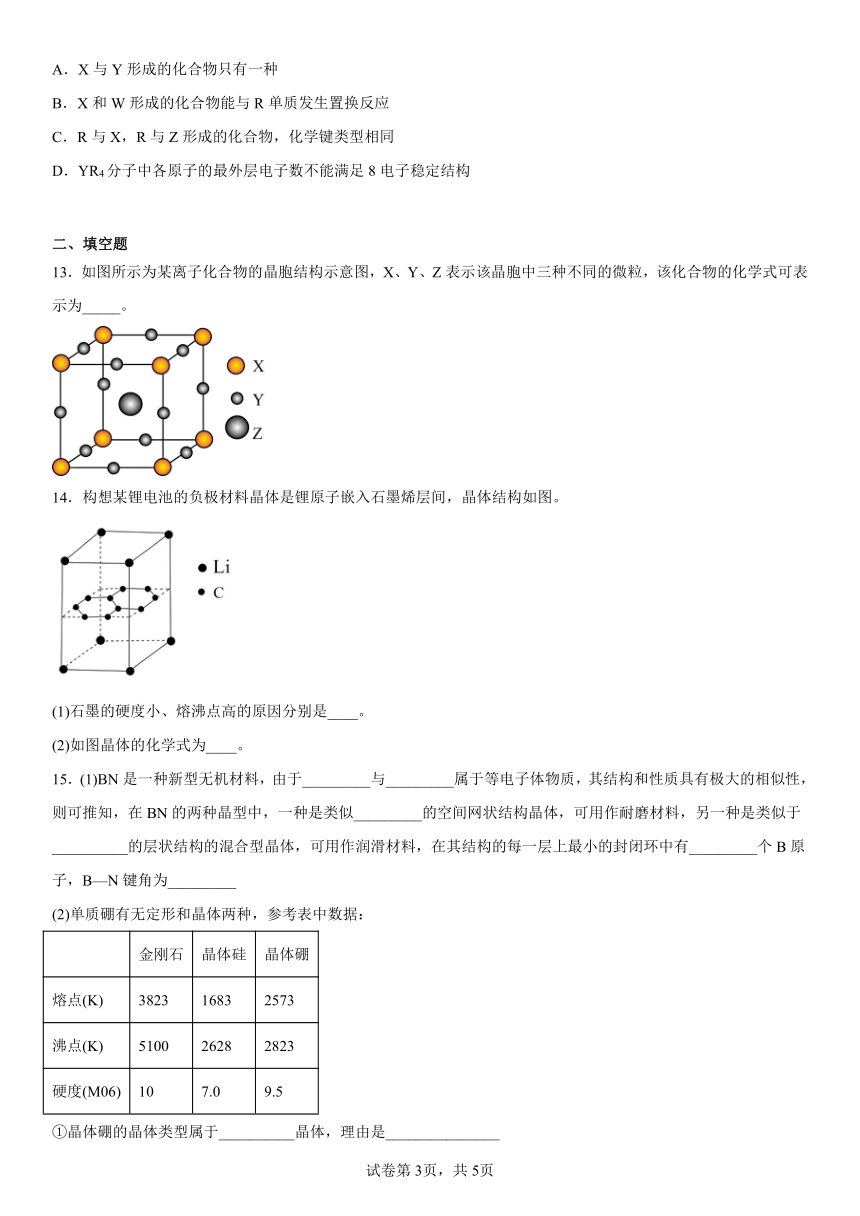
13.如图所示为某离子化合物的晶胞结构示意图,X、Y、Z表示该晶胞中三种不同的微粒,该化合物的化学式可表示为_____。
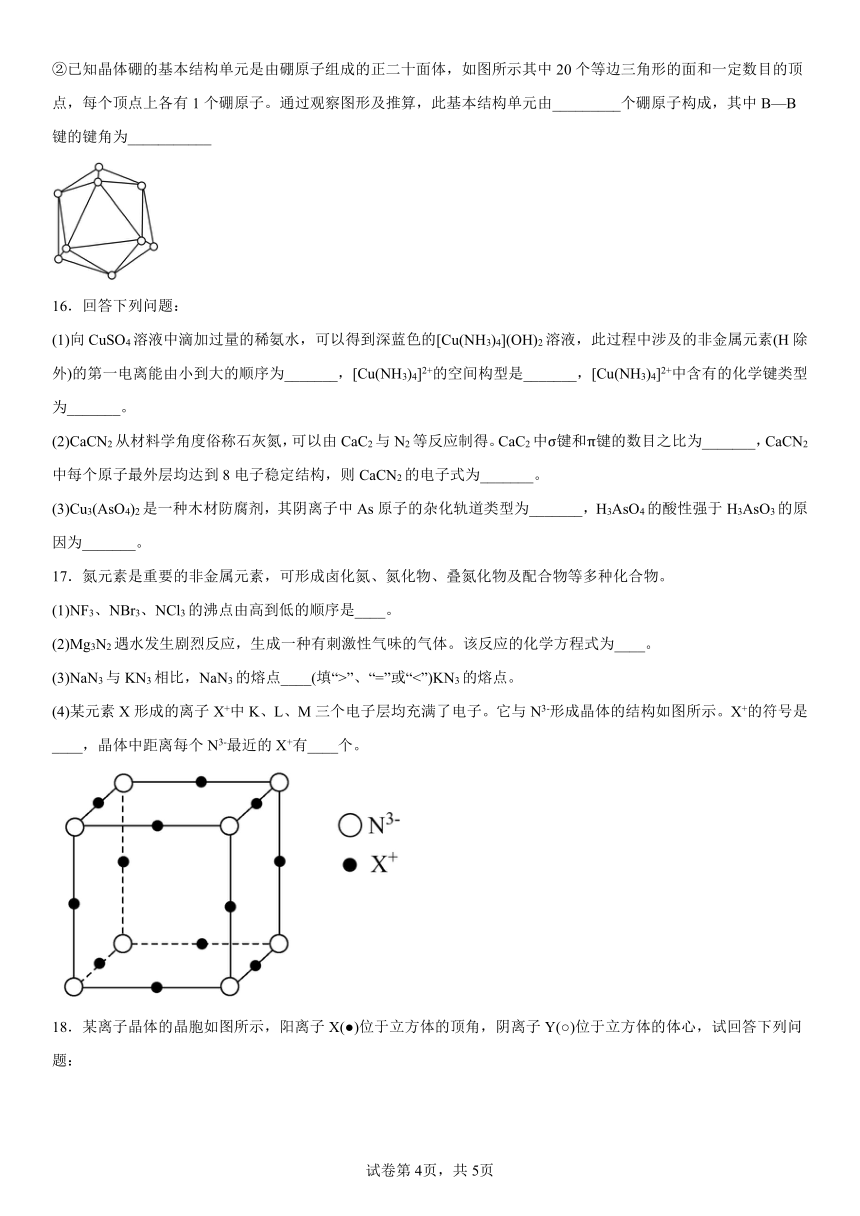
14.构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
(1)石墨的硬度小、熔沸点高的原因分别是____。
(2)如图晶体的化学式为____。
15.(1)BN是一种新型无机材料,由于_________与_________属于等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料,另一种是类似于__________的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有_________个B原子,B—N键角为_________
(2)单质硼有无定形和晶体两种,参考表中数据:
金刚石 晶体硅 晶体硼
熔点(K) 3823 1683 2573
沸点(K) 5100 2628 2823
硬度(M06) 10 7.0 9.5
①晶体硼的晶体类型属于__________晶体,理由是_______________
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示其中20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成,其中B—B键的键角为___________
16.回答下列问题:
(1)向CuSO4溶液中滴加过量的稀氨水,可以得到深蓝色的[Cu(NH3)4](OH)2溶液,此过程中涉及的非金属元素(H除外)的第一电离能由小到大的顺序为_______,[Cu(NH3)4]2+的空间构型是_______,[Cu(NH3)4]2+中含有的化学键类型为_______。
(2)CaCN2从材料学角度俗称石灰氮,可以由CaC2与N2等反应制得。CaC2中σ键和π键的数目之比为_______,CaCN2中每个原子最外层均达到8电子稳定结构,则CaCN2的电子式为_______。
(3)Cu3(AsO4)2是一种木材防腐剂,其阴离子中As原子的杂化轨道类型为_______,H3AsO4的酸性强于H3AsO3的原因为_______。
17.氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是____。
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为____。
(3)NaN3与KN3相比,NaN3的熔点____(填“>”、“=”或“<”)KN3的熔点。
(4)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是____,晶体中距离每个N3-最近的X+有____个。
18.某离子晶体的晶胞如图所示,阳离子X(●)位于立方体的顶角,阴离子Y(○)位于立方体的体心,试回答下列问题:
(1)该晶体的化学式为______。
(2)在晶胞中,每个X周围与它最近且距离相等的X有______个。
19.下列反应曾用于检测司机是否酒后驾驶:2Cr2O+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。
(1)Cr3+基态核外电子排布式为____;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是____(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为____。
(3)1mol[Cr(H2O)6]3+中含有σ键____mol;H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.SO2空间构型为V形,所以O3的空间构型为V形,故A错误;
B.SO中S有1个孤电子对,SO中S没有孤电子对,SO中硫氧键的键角大于SO,故B错误;
C.氨气易液化是因为NH3分子间能形成氢键,故C错误;
D.NH3能与Ag+、Cu2+形成配合物是因为NH3中的N存在1个孤电子对,故D正确;
选D。
2.A
【详解】A.SO2和H2O都属于分子晶体,故A符合题意;
B.HCl为分子晶体,NaCl为离子化合物,属于离子晶体,故B不符合题意;
C.CO2为分子晶体,SiO2属于共价晶体,故C不符合题意;
D.Cu属于金属晶体,Ne属于分子晶体,故D不符合题意;
故答案:A。
3.C
【详解】晶格能是指将离子晶体完全气化为气态阴、阳离子所吸收的能量,选项A、B错误,选项C正确;
晶格能越大,离子晶体的熔点越高,硬度越大,选项D错误。
答案选C。
4.A
【详解】①SiO2是由共价键形成的原子晶体(或者共价晶体),SO3是通过共价键形成SO3分子,再通过分子间作用力形成分子晶体,二者化学键类型相同,晶体类型不同,不合题意;②石墨是层内通过共价键、层与层之间通过金属键形成的过渡型晶体,碘则是通过共价键形成I2分子然后再通过分子间作用力形成分子晶体,二者化学键类型不完全相同,分子类型不同,不合题意;③CO2和SO2均为先由共价键形成分子,再通过分子间作用力形成分子晶体,化学键类型和晶体类型均相同,符合题意;④晶体硅和金刚石均为由共价键形成的原子(或共价)晶体,化学键类型和晶体类型均相同,符合题意;⑤晶体氖中不含任何化学键,仅通过分子间作用力形成的分子晶体,晶体氮先由共价键形成分子,再通过分子间作用力形成分子晶体,化学键类型不同,晶体类型相同,不合题意;综上分析,只有③④符合题意,故答案为:A。
5.A
【详解】晶体有固定的熔沸点,属于纯净物;①橡胶属于高分子,为混合物;⑥石蜡是石油分馏的产品之一,属于多种烃的混合物;⑦玻璃的主要成分为硅酸钠、硅酸钙和二氧化硅,属于混合物;以上三种固体均不属于晶体;而②石墨、③水(固态的水为分子晶体)、④干冰(固态二氧化碳)、⑤冰醋酸均为纯净物,均属于晶体;
故选A。
6.D
【详解】A.O原子核外有8个电子,分别位于1s、2s、2p轨道,1s、2s、2p轨道电子数分别是2、2、4,价层电子排布式为,A正确;
B.由图2可知,以任一顶点的为例,距离其最近的位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的的个数为12,B正确;
C.晶胞中与最近的核间距为晶胞对角线长度的,即,C正确;
D.假设中的和的个数分别为和,则,由化合价代数和为0可得,解得,由晶胞结构可知,位于顶点和面心的或个数为,所以每个晶胞中的个数为,D错误;
故选D。
7.B
【分析】非金属元素的原子间存在共价键,活泼金属和活泼非金属之间以及铵盐中存在离子键,含有离子键的化合物为离子化合物。
【详解】A.H2O中氢原子和氧原子间只存在共价键,是共价化合物,故A不选;
B.NaCl中钠离子和氯离子之间存在离子键,是离子化合物,故B选;
C.HCl中氢原子和氯原子间存在共价键,是共价化合物,故C不选;
D.CH4中碳原子和氢原子间只存在共价键,是共价化合物,故D不选;
答案选B。
8.C
【详解】A.CaTiO3 的摩尔质量为136 g mol 1,故A错误;
B.Ca2+在体心,根据CaTiO3 晶体结构分析,每个Ti4+与8个Ca2+紧相邻,故B错误;
C.CaTiO3 晶体中以顶点的Ti4+分析,每个面有4个O2 紧相邻,有3个横截面,因此每个Ti4+与12 个O2 紧相邻,故C正确;
D.CaTiO3 晶体中每个Ti4+与6个Ti4+紧相邻,分别是上下左右前后,故D错误。
综上所述,答案为C。
9.B
【详解】A.Br为35号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p5,核外电子的运动状态有35种,A正确;
B.[Ag(S2O3)2]3-中存在着Ag+和S2O之间的配位键,S原子和O原子间的共价键,但不存在离子键,B错误;
C.S2O与硫酸根离子原子总数相同,价电子数相同,所以中心硫原子的杂化方式相同,硫酸根离子中心硫原子的价层电子对数为4,属于sp3,所以S2O中心原子S的杂化方式为sp3,C正确;
D.Na3[Ag(S2O3)2]是离子化合物,阴离子[Ag(S2O3)2]3-中含有共价键,1个Ag+和2个S2O形成2个配位键,配位键也是键,1个S2O中有4个键,所1molNa3[Ag(S2O3)2]中含有2+4×2=10mol键,D正确;
故选B。
10.C
【详解】A.阴、阳离子之间通过静电作用形成的化学键叫离子键,A错误;
B.根据电离方程式HCl=H++Cl-不能判断HCl分子里存在离子键,氯化氢分子中含有极性键,B错误;
C.断键吸热,形成化学键放热,则化学键的断裂和形成是化学反应能量变化的主要原因,C正确;
D.离子化合物不一定由金属元素和非金属元素组成,例如氯化铵是由非金属元素组成的,D错误;
答案选C。
11.D
【详解】石墨晶体中层与层之间通过分子间作用力相连,同一层内通过共价键相连,所以从严格意义上讲石墨属于混合型晶体,答案选D。
12.B
【分析】X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,则X为H元素,Z的二价阳离子与氖原子具有相同的核外电子排布,则Z为Mg元素,W原子最外层电子数是最内层电子数的3倍,最外层电子数为6,结合原子序数可知,W为S元素,故R为Cl,Y的最高正价与最低负价的代数和为0,处于IVA族,原子序数小于Mg,故Y为C元素,结合元素周期律与元素化合物性质解答。
【详解】由上分析可知,X为H元素,Y为C元素,Z为Mg元素,W为S元素,R为Cl元素;
A.X为H元素,Y为C元素,H元素与C元素形成烃类物质,化合物种类繁多,故A错误;
B.X为H元素,W为S元素,H元素与S元素形成H2S,R为Cl元素,单质为Cl2,Cl2与H2S发生反应生成HCl和S,即Cl2+H2S=2HCl+S↓,属于置换反应,故B正确;
C.X为H元素,Z为Mg元素,R为Cl元素,R与X形成HCl,R与Z形成MgCl2,HCl是非金属元素形成的化合物,属于共价化合物,只含共价键,MgCl2是金属元素与非金属元素形成的化合物,属于离子化合物,含有离子键,二者化学键类型不同,故C错误;
D.Y为C元素,R为Cl元素,YR4为CCl4,C原子最外层4个电子,与4个Cl形成4对共用电子对,C原子达到8电子稳定结构,Cl原子最外层7个电子,每个Cl与C形成一对共用电子对,Cl原子也达到8电子稳定结构,其电子式为,二元素均满足8电子稳定结构,故D错误;
答案为B。
13.XY3Z
【详解】晶胞中X位于顶点,一个晶胞中数目为;晶胞中Y位于棱上,一个晶胞中数目为;Z位于晶胞内部,一个晶胞中数目为1;则化学式为XY3Z。
14.(1)石墨晶体为层状结构,层间作用力为范德华力,硬度小,层内碳原子间以共价键结合,熔沸点高
(2)LiC6
【解析】(1)
由于石墨晶体为层状结构,层间作用力为范德华力,导致其硬度小,但层内碳原子间以共价键结合,导致其熔沸点又很高,故石墨的硬度小、熔沸点高的原因分别是石墨晶体为层状结构,层间作用力为范德华力,硬度小,层内碳原子间以共价键结合,熔沸点高。
(2)
由题干晶胞图可知,Li位于8个顶点,C有8个位于侧面上,2个位于体内,故一个晶胞含有的Li为:8×=1,C原子个数为:×8+2=6,则晶体的化学式为LiC6。
15. 金刚石 石墨 3 120° 原子 晶体硼的诸参数(熔沸点、硬度)均介于金刚石(原子晶体)和晶体硅(原子晶体)之间,且据其在周期表中的位置(B、C相邻,B与Si处于性质相似的对角线位置)也可推知晶体硼属于原子晶体 12 60°
【分析】(1)通过比较金刚石、晶体硅、晶体硼的熔沸点、硬度可知,晶体硼的熔点、硬度均介于两者之间,金刚石和晶体硅都是原子晶体,所以晶体硼也是原子晶体;
(2)根据晶体硼的成键特点及相关数据进行分析。
【详解】(1)BN是一种新型无机材料,由于与属于等电子体物质;其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似金刚石的空间网状结构晶体,可用作耐磨材料,另一种是类似于石墨的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有3个B原子,B-N键角为120°;
(2)①通过比较金刚石、晶体硅、晶体硼的熔沸点、硬度可知,晶体硼的熔点、硬度均介于两者之间,金刚石和晶体硅都是原子晶体,所以晶体硼也是原子晶体;
②晶体硼有20个三角形,每个三角形有三条边,每两个三角形共用一条边,一共30个B-B键,结合欧拉定律:顶点数+面数-棱数=2,所以硼原子个数=30-20+2=12;每3个B-B键形成一个正三角形,B-B键的键角为60°。
16.(1) S<O<N 平面正方形 配位键和极性共价键
(2) 1:2
(3) sp3 H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+
【详解】(1)同周期元素从左到右第一电离能呈增大趋势,但N的2p轨道为半充满状态,较稳定,故第一电离能:O<N;同主族元素自上而下第一电离能逐渐减小,故第一电离能:S<O,则第一电离能:S<O<N;据晶体衍射实验观测的结果,[Cu(NH3)4]2+的空间构型是平面正方形;Cu2+和NH3之间为配位键,NH3分子内部为极性共价键。答案为:S<O<N;平面正方形;配位键和极性共价键;
(2)CaC2中的存在碳碳三键,所以σ键和π键的数目之比为1:2,CaCN2是离子化合物,各原子最外层均达到8电子稳定结构,则CaCN2的电子式为。答案为:1:2;;
(3)的中心As原子孤电子对数,价层电子对数=4+0=4,故As原子采取sp3杂化,H3AsO4中非羟基氧数目为1,而H3AsO3中非羟基氧数目为0,H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+,从而酸性更强。答案为:sp3;H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+。
【点睛】当原子的价电子轨道处于半满、全满或全空时,轨道的能量低,原子稳定。
17.(1)NBr3>NCl3>NF3
(2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)>
(4) Cu+ 6
【解析】(1)
NF3、NBr3、NCl3都是分子晶体,且结构相似,则相对分子质量越大熔沸点越高,相对分子质量:NBr3>NCl3>NF3,沸点由高到低的顺序是:NBr3>NCl3>NF3。
(2)
Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体为氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。
(3)
NaN3与KN3均为离子晶体,离子半径越小、所带电荷量越多,晶格能越大,离子晶体熔沸点越高,钠离子与钾离子所带电荷量一样,但钠离子的半径小于钾离子,因此晶格能NaN3>KN3,熔点NaN3>KN3。
(4)
X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X为铜元素,X+为Cu+,根据晶体结构图可知,每个N3-距离最近且相等的Cu+有6个。
18. XY 6
【详解】(1)Y位于立方体的体心,X位于立方体的8个顶角,根据均摊法可知,该晶体的化学式为XY;
(2)在晶胞中,每个X周围与它最近且距离相等的X有6个(上、下、左、右、前、后各1个)。
19.(1) 1s22s22p63s23p63d3 (或[Ar]3d3) O
(2)sp2、sp3
(3) 18 H2O与CH3CH2OH分子间可以形成氢键
【详解】(1)Cr原子的原子序数为24,失去三个电子得到Cr3+,则Cr3+的电子排布为1s22s22p63s23p63d3;Cr3+含有空轨道,H2O的O原子含有孤对电子,H2O的O原子向Cr3+的共轨道提供孤对电子,形成配位键。
(2)CH3COOH中的甲基可看成是甲烷失去一个氢得到,使得甲基有一个孤对电子,则甲基为三角锥形,故该C原子为sp3杂化;羧基中的碳与氧通过双键连接,该C原子为sp2杂化;
(3)O-H和配位键都为σ键,1mol[Cr(H2O)6]3+中含有12个O-H和6个配位键,故1mol[Cr(H2O)6]3+分子中含有18molσ键;H2O和CH3CH2OH可以任意比例互溶,除它们都是极性分子外,还因为O原子、F原子的电负性强,H2O和CH3CH2OH之间可以形成氢键。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.炼钢厂排放的烟气中主要含SO2、NO、N2等。臭氧(O3)具有强氧化性,可用于烟气的脱硫脱硝,其空间构型与SO2相同。向含NO的模拟烟气中通入足量O3,发生的反应为2NO(g)+3O3(g)=N2O5(g)+3O2(g) ΔH<0,生成的N2O5再用NH3还原为N2;向含SO2的模拟烟气中通入一定量NH3、O3,一段时间后检测到有(NH4)2SO4和少量(NH4)2SO3生成。下列有关O3 、SO、SO和NH3的说法正确的是
A.O3的空间构型为三角锥形
B.SO与SO中硫氧键的键角相等
C.氨气易液化是因为NH3与H2O之间形成了分子间氢键
D.NH3能与Ag+、Cu2+形成配合物是因为NH3中的N存在孤电子对
2.下列各物质的晶体中,晶体类型相同的是
A.SO2和H2O B.HCl和NaCl C.CO2和SiO2 D.Cu和Ne
3.下列关于晶格能的说法正确的是
A.晶格能指形成1mol离子键所放出的能量
B.晶格能指破坏1mol离子键所吸收的能量
C.晶格能指将1mol离子晶体完全气化为气态阴、阳离子所吸收的能量
D.晶格能的大小与晶体的熔点、硬度都无关
4.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是
①SiO2和SO3 ②石墨和碘 ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮
A.③④ B.③④⑤ C.①③④ D.①②⑤
5.下列物质都是固体,其中不是晶体的是
①橡胶 ②石墨 ③水 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦ C.②④⑤⑦ D.①③⑥
6.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如下图所示。假设CeO2晶胞边长为apm,下列说法不正确的是
A.基态O原子的价层电子排布式为
B.CeO2晶体结构中与相邻且最近的有12个
C.CeO2晶胞中与最近的核间距为
D.每个CeO2-x晶胞中个数为1-2x
7.下列属于离子化合物的是
A.H2O B.NaCl C.HCl D.CH4
8.CaTiO3的晶体结构模型如图所示(图中Ca2+、O2 、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是
A.CaTiO3的摩尔质量为136
B.CaTiO3 晶体中每个Ti4+与12 个Ca2+紧相邻
C.CaTiO3晶体中每个Ti4+与12 个O2 紧相邻
D.CaTiO3晶体中每个Ti4+与12 个Ti4+紧相邻
9.硫代硫酸钠Na2S2O3(相当于中一个氧被硫替代)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法不正确的是
A.基态Br原子核外电子的运动状态有35种
B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C.中心原子S的杂化方式为sp3
D.1molNa3[Ag(S2O3)2]中含有10molσ键
10.下列关于化学键的说法正确的是( )
A.阴、阳离子之间通过相互吸引作用形成的化学键叫离子键
B.根据电离方程式HCl=H++Cl-,可判断HCl分子里存在离子键
C.化学键的断裂和形成是化学反应能量变化的主要原因
D.离子化合物一定由金属元素和非金属元素组成
11.从严格意义上讲石墨属于
A.分子晶体 B.原子晶体 C.金属晶体 D.混合型晶体
12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍,下列说法正确的是
A.X与Y形成的化合物只有一种
B.X和W形成的化合物能与R单质发生置换反应
C.R与X,R与Z形成的化合物,化学键类型相同
D.YR4分子中各原子的最外层电子数不能满足8电子稳定结构
二、填空题
13.如图所示为某离子化合物的晶胞结构示意图,X、Y、Z表示该晶胞中三种不同的微粒,该化合物的化学式可表示为_____。
14.构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
(1)石墨的硬度小、熔沸点高的原因分别是____。
(2)如图晶体的化学式为____。
15.(1)BN是一种新型无机材料,由于_________与_________属于等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料,另一种是类似于__________的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有_________个B原子,B—N键角为_________
(2)单质硼有无定形和晶体两种,参考表中数据:
金刚石 晶体硅 晶体硼
熔点(K) 3823 1683 2573
沸点(K) 5100 2628 2823
硬度(M06) 10 7.0 9.5
①晶体硼的晶体类型属于__________晶体,理由是_______________
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示其中20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成,其中B—B键的键角为___________
16.回答下列问题:
(1)向CuSO4溶液中滴加过量的稀氨水,可以得到深蓝色的[Cu(NH3)4](OH)2溶液,此过程中涉及的非金属元素(H除外)的第一电离能由小到大的顺序为_______,[Cu(NH3)4]2+的空间构型是_______,[Cu(NH3)4]2+中含有的化学键类型为_______。
(2)CaCN2从材料学角度俗称石灰氮,可以由CaC2与N2等反应制得。CaC2中σ键和π键的数目之比为_______,CaCN2中每个原子最外层均达到8电子稳定结构,则CaCN2的电子式为_______。
(3)Cu3(AsO4)2是一种木材防腐剂,其阴离子中As原子的杂化轨道类型为_______,H3AsO4的酸性强于H3AsO3的原因为_______。
17.氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是____。
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为____。
(3)NaN3与KN3相比,NaN3的熔点____(填“>”、“=”或“<”)KN3的熔点。
(4)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是____,晶体中距离每个N3-最近的X+有____个。
18.某离子晶体的晶胞如图所示,阳离子X(●)位于立方体的顶角,阴离子Y(○)位于立方体的体心,试回答下列问题:
(1)该晶体的化学式为______。
(2)在晶胞中,每个X周围与它最近且距离相等的X有______个。
19.下列反应曾用于检测司机是否酒后驾驶:2Cr2O+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH。
(1)Cr3+基态核外电子排布式为____;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是____(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为____。
(3)1mol[Cr(H2O)6]3+中含有σ键____mol;H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.SO2空间构型为V形,所以O3的空间构型为V形,故A错误;
B.SO中S有1个孤电子对,SO中S没有孤电子对,SO中硫氧键的键角大于SO,故B错误;
C.氨气易液化是因为NH3分子间能形成氢键,故C错误;
D.NH3能与Ag+、Cu2+形成配合物是因为NH3中的N存在1个孤电子对,故D正确;
选D。
2.A
【详解】A.SO2和H2O都属于分子晶体,故A符合题意;
B.HCl为分子晶体,NaCl为离子化合物,属于离子晶体,故B不符合题意;
C.CO2为分子晶体,SiO2属于共价晶体,故C不符合题意;
D.Cu属于金属晶体,Ne属于分子晶体,故D不符合题意;
故答案:A。
3.C
【详解】晶格能是指将离子晶体完全气化为气态阴、阳离子所吸收的能量,选项A、B错误,选项C正确;
晶格能越大,离子晶体的熔点越高,硬度越大,选项D错误。
答案选C。
4.A
【详解】①SiO2是由共价键形成的原子晶体(或者共价晶体),SO3是通过共价键形成SO3分子,再通过分子间作用力形成分子晶体,二者化学键类型相同,晶体类型不同,不合题意;②石墨是层内通过共价键、层与层之间通过金属键形成的过渡型晶体,碘则是通过共价键形成I2分子然后再通过分子间作用力形成分子晶体,二者化学键类型不完全相同,分子类型不同,不合题意;③CO2和SO2均为先由共价键形成分子,再通过分子间作用力形成分子晶体,化学键类型和晶体类型均相同,符合题意;④晶体硅和金刚石均为由共价键形成的原子(或共价)晶体,化学键类型和晶体类型均相同,符合题意;⑤晶体氖中不含任何化学键,仅通过分子间作用力形成的分子晶体,晶体氮先由共价键形成分子,再通过分子间作用力形成分子晶体,化学键类型不同,晶体类型相同,不合题意;综上分析,只有③④符合题意,故答案为:A。
5.A
【详解】晶体有固定的熔沸点,属于纯净物;①橡胶属于高分子,为混合物;⑥石蜡是石油分馏的产品之一,属于多种烃的混合物;⑦玻璃的主要成分为硅酸钠、硅酸钙和二氧化硅,属于混合物;以上三种固体均不属于晶体;而②石墨、③水(固态的水为分子晶体)、④干冰(固态二氧化碳)、⑤冰醋酸均为纯净物,均属于晶体;
故选A。
6.D
【详解】A.O原子核外有8个电子,分别位于1s、2s、2p轨道,1s、2s、2p轨道电子数分别是2、2、4,价层电子排布式为,A正确;
B.由图2可知,以任一顶点的为例,距离其最近的位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的的个数为12,B正确;
C.晶胞中与最近的核间距为晶胞对角线长度的,即,C正确;
D.假设中的和的个数分别为和,则,由化合价代数和为0可得,解得,由晶胞结构可知,位于顶点和面心的或个数为,所以每个晶胞中的个数为,D错误;
故选D。
7.B
【分析】非金属元素的原子间存在共价键,活泼金属和活泼非金属之间以及铵盐中存在离子键,含有离子键的化合物为离子化合物。
【详解】A.H2O中氢原子和氧原子间只存在共价键,是共价化合物,故A不选;
B.NaCl中钠离子和氯离子之间存在离子键,是离子化合物,故B选;
C.HCl中氢原子和氯原子间存在共价键,是共价化合物,故C不选;
D.CH4中碳原子和氢原子间只存在共价键,是共价化合物,故D不选;
答案选B。
8.C
【详解】A.CaTiO3 的摩尔质量为136 g mol 1,故A错误;
B.Ca2+在体心,根据CaTiO3 晶体结构分析,每个Ti4+与8个Ca2+紧相邻,故B错误;
C.CaTiO3 晶体中以顶点的Ti4+分析,每个面有4个O2 紧相邻,有3个横截面,因此每个Ti4+与12 个O2 紧相邻,故C正确;
D.CaTiO3 晶体中每个Ti4+与6个Ti4+紧相邻,分别是上下左右前后,故D错误。
综上所述,答案为C。
9.B
【详解】A.Br为35号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p5,核外电子的运动状态有35种,A正确;
B.[Ag(S2O3)2]3-中存在着Ag+和S2O之间的配位键,S原子和O原子间的共价键,但不存在离子键,B错误;
C.S2O与硫酸根离子原子总数相同,价电子数相同,所以中心硫原子的杂化方式相同,硫酸根离子中心硫原子的价层电子对数为4,属于sp3,所以S2O中心原子S的杂化方式为sp3,C正确;
D.Na3[Ag(S2O3)2]是离子化合物,阴离子[Ag(S2O3)2]3-中含有共价键,1个Ag+和2个S2O形成2个配位键,配位键也是键,1个S2O中有4个键,所1molNa3[Ag(S2O3)2]中含有2+4×2=10mol键,D正确;
故选B。
10.C
【详解】A.阴、阳离子之间通过静电作用形成的化学键叫离子键,A错误;
B.根据电离方程式HCl=H++Cl-不能判断HCl分子里存在离子键,氯化氢分子中含有极性键,B错误;
C.断键吸热,形成化学键放热,则化学键的断裂和形成是化学反应能量变化的主要原因,C正确;
D.离子化合物不一定由金属元素和非金属元素组成,例如氯化铵是由非金属元素组成的,D错误;
答案选C。
11.D
【详解】石墨晶体中层与层之间通过分子间作用力相连,同一层内通过共价键相连,所以从严格意义上讲石墨属于混合型晶体,答案选D。
12.B
【分析】X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,则X为H元素,Z的二价阳离子与氖原子具有相同的核外电子排布,则Z为Mg元素,W原子最外层电子数是最内层电子数的3倍,最外层电子数为6,结合原子序数可知,W为S元素,故R为Cl,Y的最高正价与最低负价的代数和为0,处于IVA族,原子序数小于Mg,故Y为C元素,结合元素周期律与元素化合物性质解答。
【详解】由上分析可知,X为H元素,Y为C元素,Z为Mg元素,W为S元素,R为Cl元素;
A.X为H元素,Y为C元素,H元素与C元素形成烃类物质,化合物种类繁多,故A错误;
B.X为H元素,W为S元素,H元素与S元素形成H2S,R为Cl元素,单质为Cl2,Cl2与H2S发生反应生成HCl和S,即Cl2+H2S=2HCl+S↓,属于置换反应,故B正确;
C.X为H元素,Z为Mg元素,R为Cl元素,R与X形成HCl,R与Z形成MgCl2,HCl是非金属元素形成的化合物,属于共价化合物,只含共价键,MgCl2是金属元素与非金属元素形成的化合物,属于离子化合物,含有离子键,二者化学键类型不同,故C错误;
D.Y为C元素,R为Cl元素,YR4为CCl4,C原子最外层4个电子,与4个Cl形成4对共用电子对,C原子达到8电子稳定结构,Cl原子最外层7个电子,每个Cl与C形成一对共用电子对,Cl原子也达到8电子稳定结构,其电子式为,二元素均满足8电子稳定结构,故D错误;
答案为B。
13.XY3Z
【详解】晶胞中X位于顶点,一个晶胞中数目为;晶胞中Y位于棱上,一个晶胞中数目为;Z位于晶胞内部,一个晶胞中数目为1;则化学式为XY3Z。
14.(1)石墨晶体为层状结构,层间作用力为范德华力,硬度小,层内碳原子间以共价键结合,熔沸点高
(2)LiC6
【解析】(1)
由于石墨晶体为层状结构,层间作用力为范德华力,导致其硬度小,但层内碳原子间以共价键结合,导致其熔沸点又很高,故石墨的硬度小、熔沸点高的原因分别是石墨晶体为层状结构,层间作用力为范德华力,硬度小,层内碳原子间以共价键结合,熔沸点高。
(2)
由题干晶胞图可知,Li位于8个顶点,C有8个位于侧面上,2个位于体内,故一个晶胞含有的Li为:8×=1,C原子个数为:×8+2=6,则晶体的化学式为LiC6。
15. 金刚石 石墨 3 120° 原子 晶体硼的诸参数(熔沸点、硬度)均介于金刚石(原子晶体)和晶体硅(原子晶体)之间,且据其在周期表中的位置(B、C相邻,B与Si处于性质相似的对角线位置)也可推知晶体硼属于原子晶体 12 60°
【分析】(1)通过比较金刚石、晶体硅、晶体硼的熔沸点、硬度可知,晶体硼的熔点、硬度均介于两者之间,金刚石和晶体硅都是原子晶体,所以晶体硼也是原子晶体;
(2)根据晶体硼的成键特点及相关数据进行分析。
【详解】(1)BN是一种新型无机材料,由于与属于等电子体物质;其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似金刚石的空间网状结构晶体,可用作耐磨材料,另一种是类似于石墨的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有3个B原子,B-N键角为120°;
(2)①通过比较金刚石、晶体硅、晶体硼的熔沸点、硬度可知,晶体硼的熔点、硬度均介于两者之间,金刚石和晶体硅都是原子晶体,所以晶体硼也是原子晶体;
②晶体硼有20个三角形,每个三角形有三条边,每两个三角形共用一条边,一共30个B-B键,结合欧拉定律:顶点数+面数-棱数=2,所以硼原子个数=30-20+2=12;每3个B-B键形成一个正三角形,B-B键的键角为60°。
16.(1) S<O<N 平面正方形 配位键和极性共价键
(2) 1:2
(3) sp3 H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+
【详解】(1)同周期元素从左到右第一电离能呈增大趋势,但N的2p轨道为半充满状态,较稳定,故第一电离能:O<N;同主族元素自上而下第一电离能逐渐减小,故第一电离能:S<O,则第一电离能:S<O<N;据晶体衍射实验观测的结果,[Cu(NH3)4]2+的空间构型是平面正方形;Cu2+和NH3之间为配位键,NH3分子内部为极性共价键。答案为:S<O<N;平面正方形;配位键和极性共价键;
(2)CaC2中的存在碳碳三键,所以σ键和π键的数目之比为1:2,CaCN2是离子化合物,各原子最外层均达到8电子稳定结构,则CaCN2的电子式为。答案为:1:2;;
(3)的中心As原子孤电子对数,价层电子对数=4+0=4,故As原子采取sp3杂化,H3AsO4中非羟基氧数目为1,而H3AsO3中非羟基氧数目为0,H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+,从而酸性更强。答案为:sp3;H3AsO4的非羟基氧原子更多,使其中As-O-H中羟基极性更大,更容易电离出H+。
【点睛】当原子的价电子轨道处于半满、全满或全空时,轨道的能量低,原子稳定。
17.(1)NBr3>NCl3>NF3
(2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)>
(4) Cu+ 6
【解析】(1)
NF3、NBr3、NCl3都是分子晶体,且结构相似,则相对分子质量越大熔沸点越高,相对分子质量:NBr3>NCl3>NF3,沸点由高到低的顺序是:NBr3>NCl3>NF3。
(2)
Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体为氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。
(3)
NaN3与KN3均为离子晶体,离子半径越小、所带电荷量越多,晶格能越大,离子晶体熔沸点越高,钠离子与钾离子所带电荷量一样,但钠离子的半径小于钾离子,因此晶格能NaN3>KN3,熔点NaN3>KN3。
(4)
X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X为铜元素,X+为Cu+,根据晶体结构图可知,每个N3-距离最近且相等的Cu+有6个。
18. XY 6
【详解】(1)Y位于立方体的体心,X位于立方体的8个顶角,根据均摊法可知,该晶体的化学式为XY;
(2)在晶胞中,每个X周围与它最近且距离相等的X有6个(上、下、左、右、前、后各1个)。
19.(1) 1s22s22p63s23p63d3 (或[Ar]3d3) O
(2)sp2、sp3
(3) 18 H2O与CH3CH2OH分子间可以形成氢键
【详解】(1)Cr原子的原子序数为24,失去三个电子得到Cr3+,则Cr3+的电子排布为1s22s22p63s23p63d3;Cr3+含有空轨道,H2O的O原子含有孤对电子,H2O的O原子向Cr3+的共轨道提供孤对电子,形成配位键。
(2)CH3COOH中的甲基可看成是甲烷失去一个氢得到,使得甲基有一个孤对电子,则甲基为三角锥形,故该C原子为sp3杂化;羧基中的碳与氧通过双键连接,该C原子为sp2杂化;
(3)O-H和配位键都为σ键,1mol[Cr(H2O)6]3+中含有12个O-H和6个配位键,故1mol[Cr(H2O)6]3+分子中含有18molσ键;H2O和CH3CH2OH可以任意比例互溶,除它们都是极性分子外,还因为O原子、F原子的电负性强,H2O和CH3CH2OH之间可以形成氢键。
答案第1页,共2页
答案第1页,共2页
