2 2.2.3杂化轨道理论 课件(共28张ppt)化学人教版(2019)选择性必修
文档属性
| 名称 | 2 2.2.3杂化轨道理论 课件(共28张ppt)化学人教版(2019)选择性必修 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 11:43:20 | ||
图片预览




文档简介
(共28张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第3课时 杂化轨道理论
温故知新
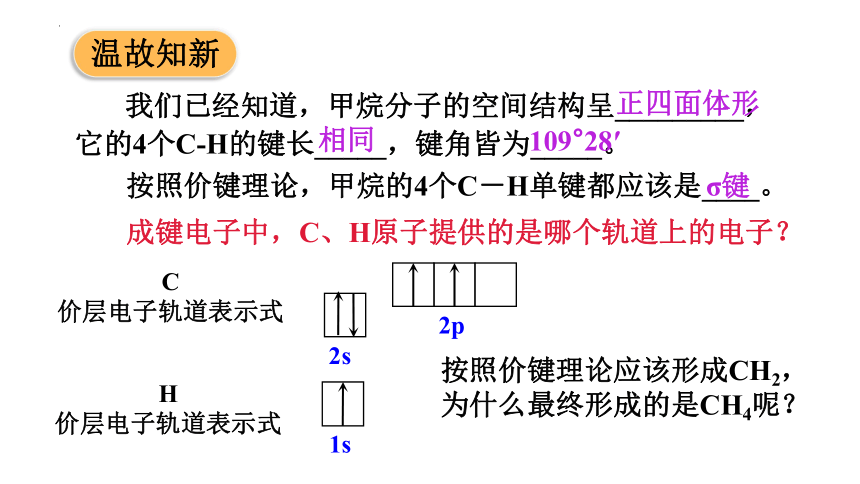
我们已经知道,甲烷分子的空间结构呈_________,它的4个C-H的键长_____,键角皆为_____。
按照价键理论,甲烷的4个C-H单键都应该是____。
σ键
正四面体形
相同
109°28′
成键电子中,C、H原子提供的是哪个轨道上的电子?
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
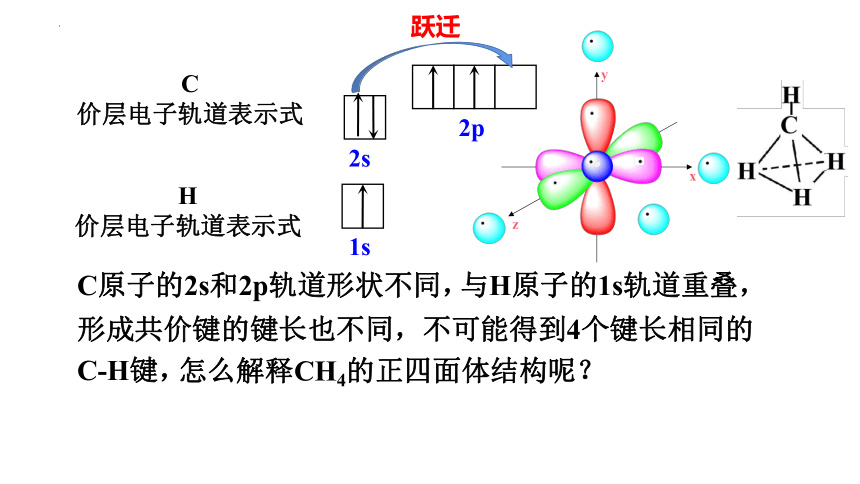
按照价键理论应该形成CH2,为什么最终形成的是CH4呢?
形成共价键的键长也不同,不可能得到4个键长相同的C-H键,
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
跃迁
x
y
z
C原子的2s和2p轨道形状不同,
怎么解释CH4的正四面体结构呢?
与H原子的1s轨道重叠,
莱纳斯·卡尔·鲍林
为解决这一矛盾, 1931年鲍林在价键理论的基础上提出了杂化轨道理论,它实际上仍属于现代价键理论。
杂化轨道理论
在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程叫做原子轨道的杂化。
重新组合后形成的一组新的原子轨道,
叫做杂化原子轨道,简称杂化轨道。
x
y
z
跃迁
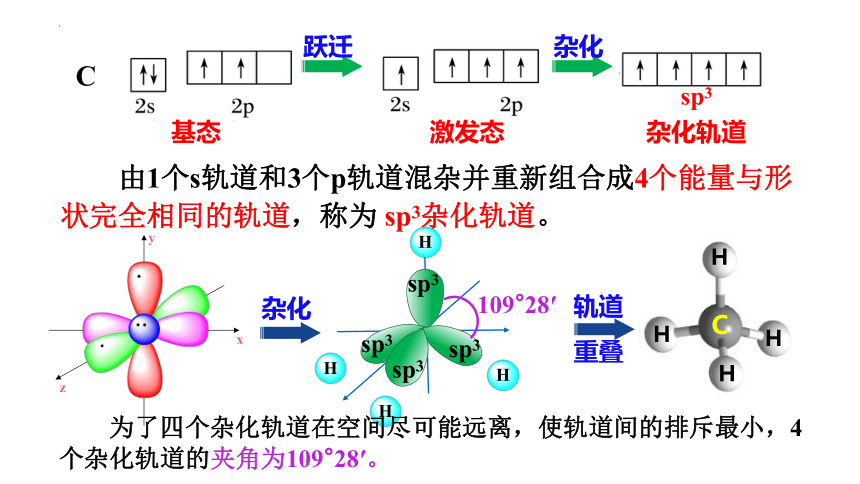
C
基态
激发态
杂化
杂化轨道
sp3
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道,称为 sp3杂化轨道。
z
sp3
sp3
sp3
sp3
109°28′
杂化
H
H
H
H
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的夹角为109°28′。
轨道重叠
C
H
H
H
H
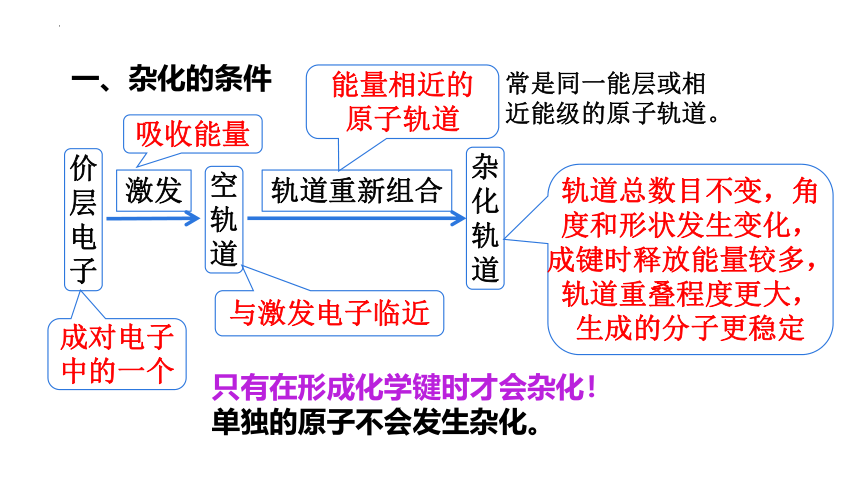
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子
中的一个
与激发电子临近
能量相近的原子轨道
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
只有在形成化学键时才会杂化!
单独的原子不会发生杂化。
一、杂化的条件
常是同一能层或相近能级的原子轨道。
一、杂化的条件
1、只有在形成化学键时才能杂化!单独的原子不会发生杂化。
2、只有能量相近的轨道间才能杂化!常是同一能级或相近能级的原子轨道。
杂化:在外界条件影响下,原子内部能量相近的原子轨道 发生混杂,重新组合成一组新的轨道的过程。
二、杂化的特点
4、杂化轨道只用于形成σ键和容纳孤电子对!
未参与杂化的p轨道可用于形成π键。
1、杂化前后轨道数目不变
2、杂化后轨道形状、方向发生改变,成键能力增强
3、杂化轨道之间要满足最小排斥、最大夹角原理
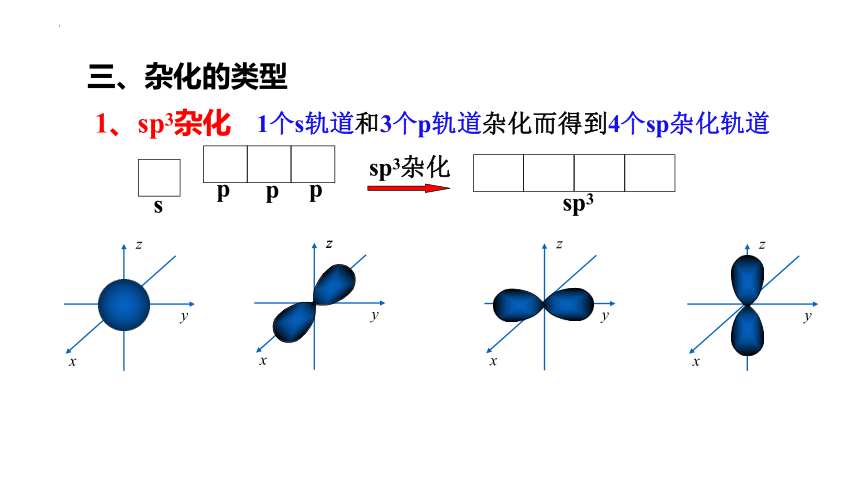
三、杂化的类型
1、sp3杂化
1个s轨道和3个p轨道杂化而得到4个sp杂化轨道
p
p
p
s
sp3杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
sp3
三、杂化的类型
1、sp3杂化
1个s轨道和3个p轨道杂化而得到4个sp3杂化轨道
p
p
p
s
sp3杂化
sp3
sp3
sp3
sp3
109°28′
sp3杂化轨道间的夹角是_____,空间结构为_________。
109°28′
正四面体形
sp3
三、杂化的类型
2、sp2杂化
1个s轨道和2个p轨道杂化而得到3个sp2杂化轨道
p
p
p
s
sp2杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
sp2
sp2
sp2
sp2杂化轨道间的夹角是_____,空间结构为_________。
120°
平面三角形
120°
sp2
p
x
y
z
sp2
sp2
sp2
p
sp2
sp2
sp2
sp2杂化后,未参与杂化的一个np轨道可以用于形成π键,如:乙烯分子碳碳双键的形成。
头碰头
σ键
肩并肩
肩并肩
σ键
π键
H
H
H
H
乙烯中sp2杂化C原子成键过程
三、杂化的类型
3、sp杂化
1个s轨道和1个p轨道杂化而得到2个sp杂化轨道
p
p
p
s
sp杂化
sp
p
x
y
z
x
y
z
z
x
y
z
x
y
z
sp
sp
sp杂化轨道间的夹角是_____,空间结构为_________。
180°
直线形
180°
p
p
sp
sp
sp
sp
x
y
z
x
y
z
sp杂化后,未参与杂化的两个np轨道可以用于形成π键,如乙炔分子中的碳碳三键的形成。
头碰头
σ键
肩并肩
肩并肩
σ键
H
H
乙炔中sp杂化C原子成键过程
π键
π键
中心原子的杂化轨道类型与VSEPR模型有什么联系?填写下表,回答问题。
实例 孤电子对数 价层电子对数 VSEPR模型 杂化 轨道数 中心原子的杂化轨道类型
CO2 2 sp
SO2 3 sp2
SO3 3 sp2
H2O 4 sp3
NH3 4 sp3
CH4 4 sp3
0
2
直线形
1
3
平面三角形
0
4
平面三角形
2
3
四面体形
1
4
四面体形
0
4
正四面体形
杂化轨道模型
中心原子的杂化轨道模型与VSEPR模型相同。
价层电子对数=杂化轨道数(x),中心原子采取 spx-1 杂化
四、判断中心原子的杂化类型
1、计算价层电子对数
杂化轨道数(x)=价层电子对数,中心原子采取 spx-1 杂化
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对
孤电子对
杂化轨道数
杂化类型
2
0
2
sp
2
1
3
sp2
3
0
3
sp2
4
0
4
sp3
4
0
4
sp3
3
2
1
2
4
4
sp3
sp3
=σ 键电子对数+中心原子孤电子对数
四、判断中心原子的杂化类型
2、根据杂化轨道的夹角判断
杂化轨道夹角 180° 120° 109°28′
杂化轨道类型 sp sp2 sp3
四、判断中心原子的杂化类型
单键碳原子采取sp3杂化;
双键碳原子采取sp2杂化;
三键碳原子采取sp杂化。
3、有机物中碳原子杂化类型判断方法
5
1
2
3
4
苯分子中的碳原子是什么杂化类型?
苯C6H6
平面正六边形
6个碳原子之间的化学键完全相同,是介于单键和双键之间的一种独特的键。
120°
Π
6个p轨道
6个电子
苯分子中碳原子取sp2杂化,3个杂化轨道分别用于形成3个σ 键,故苯分子键角为120°;苯分子每个碳原子均有1个未参与杂化杂化的p轨道,垂直于分子平面而相互平行,6个“肩并肩”的平行p轨道上总共6个电子一起形成了弥散在整个苯环的1个p-p大π键。
6
6
丁二烯
Π
4个p轨道
4个电子
4
4
石墨分子结构是层形结构,每层是由无限个碳六元环所形成的平面,碳原子取sp2杂化,每个碳原子均有1个未参与杂化杂化的p轨道,垂直于分子平面而相互平行,平行的n个p轨道形成了1个p-p大π键。
电子在这个中可以自由移动,所以石墨能导电。
课 堂 小 结
价层电子对
互斥模型
杂化轨
道理论
计算价层
电子对数
价层电子对数=σ 键电子对数+中心原子孤电子对数
2
3
4
直线形
平面三角形
四面体形
sp杂化,直线形
sp2杂化,平面三角形
sp3杂化,四面体形
预测分子结构
略去孤电子对
解释分子空间结构
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③CH≡CH ④NH3 ⑤CH4
A.①② B.①⑤⑥ C.②③④ D.③⑤⑥
A
2.下列说法中正确的是( )
A.PCl3分子呈三角锥形,是P原子采取sp2杂化的结果
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体
D.AB3型的分子立体构型必为平面三角形
C
3.(1)[2021年全国甲卷]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。
sp3
(2)[2021年全国乙卷]PH3中P采取的杂化类型为 。
sp3
(3)在硅酸盐中,SiO42-四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为____。
sp3
第二章 分子结构与性质
第二节 分子的空间结构
第3课时 杂化轨道理论
温故知新
我们已经知道,甲烷分子的空间结构呈_________,它的4个C-H的键长_____,键角皆为_____。
按照价键理论,甲烷的4个C-H单键都应该是____。
σ键
正四面体形
相同
109°28′
成键电子中,C、H原子提供的是哪个轨道上的电子?
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
按照价键理论应该形成CH2,为什么最终形成的是CH4呢?
形成共价键的键长也不同,不可能得到4个键长相同的C-H键,
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
跃迁
x
y
z
C原子的2s和2p轨道形状不同,
怎么解释CH4的正四面体结构呢?
与H原子的1s轨道重叠,
莱纳斯·卡尔·鲍林
为解决这一矛盾, 1931年鲍林在价键理论的基础上提出了杂化轨道理论,它实际上仍属于现代价键理论。
杂化轨道理论
在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程叫做原子轨道的杂化。
重新组合后形成的一组新的原子轨道,
叫做杂化原子轨道,简称杂化轨道。
x
y
z
跃迁
C
基态
激发态
杂化
杂化轨道
sp3
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道,称为 sp3杂化轨道。
z
sp3
sp3
sp3
sp3
109°28′
杂化
H
H
H
H
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的夹角为109°28′。
轨道重叠
C
H
H
H
H
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子
中的一个
与激发电子临近
能量相近的原子轨道
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
只有在形成化学键时才会杂化!
单独的原子不会发生杂化。
一、杂化的条件
常是同一能层或相近能级的原子轨道。
一、杂化的条件
1、只有在形成化学键时才能杂化!单独的原子不会发生杂化。
2、只有能量相近的轨道间才能杂化!常是同一能级或相近能级的原子轨道。
杂化:在外界条件影响下,原子内部能量相近的原子轨道 发生混杂,重新组合成一组新的轨道的过程。
二、杂化的特点
4、杂化轨道只用于形成σ键和容纳孤电子对!
未参与杂化的p轨道可用于形成π键。
1、杂化前后轨道数目不变
2、杂化后轨道形状、方向发生改变,成键能力增强
3、杂化轨道之间要满足最小排斥、最大夹角原理
三、杂化的类型
1、sp3杂化
1个s轨道和3个p轨道杂化而得到4个sp杂化轨道
p
p
p
s
sp3杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
sp3
三、杂化的类型
1、sp3杂化
1个s轨道和3个p轨道杂化而得到4个sp3杂化轨道
p
p
p
s
sp3杂化
sp3
sp3
sp3
sp3
109°28′
sp3杂化轨道间的夹角是_____,空间结构为_________。
109°28′
正四面体形
sp3
三、杂化的类型
2、sp2杂化
1个s轨道和2个p轨道杂化而得到3个sp2杂化轨道
p
p
p
s
sp2杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
sp2
sp2
sp2
sp2杂化轨道间的夹角是_____,空间结构为_________。
120°
平面三角形
120°
sp2
p
x
y
z
sp2
sp2
sp2
p
sp2
sp2
sp2
sp2杂化后,未参与杂化的一个np轨道可以用于形成π键,如:乙烯分子碳碳双键的形成。
头碰头
σ键
肩并肩
肩并肩
σ键
π键
H
H
H
H
乙烯中sp2杂化C原子成键过程
三、杂化的类型
3、sp杂化
1个s轨道和1个p轨道杂化而得到2个sp杂化轨道
p
p
p
s
sp杂化
sp
p
x
y
z
x
y
z
z
x
y
z
x
y
z
sp
sp
sp杂化轨道间的夹角是_____,空间结构为_________。
180°
直线形
180°
p
p
sp
sp
sp
sp
x
y
z
x
y
z
sp杂化后,未参与杂化的两个np轨道可以用于形成π键,如乙炔分子中的碳碳三键的形成。
头碰头
σ键
肩并肩
肩并肩
σ键
H
H
乙炔中sp杂化C原子成键过程
π键
π键
中心原子的杂化轨道类型与VSEPR模型有什么联系?填写下表,回答问题。
实例 孤电子对数 价层电子对数 VSEPR模型 杂化 轨道数 中心原子的杂化轨道类型
CO2 2 sp
SO2 3 sp2
SO3 3 sp2
H2O 4 sp3
NH3 4 sp3
CH4 4 sp3
0
2
直线形
1
3
平面三角形
0
4
平面三角形
2
3
四面体形
1
4
四面体形
0
4
正四面体形
杂化轨道模型
中心原子的杂化轨道模型与VSEPR模型相同。
价层电子对数=杂化轨道数(x),中心原子采取 spx-1 杂化
四、判断中心原子的杂化类型
1、计算价层电子对数
杂化轨道数(x)=价层电子对数,中心原子采取 spx-1 杂化
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对
孤电子对
杂化轨道数
杂化类型
2
0
2
sp
2
1
3
sp2
3
0
3
sp2
4
0
4
sp3
4
0
4
sp3
3
2
1
2
4
4
sp3
sp3
=σ 键电子对数+中心原子孤电子对数
四、判断中心原子的杂化类型
2、根据杂化轨道的夹角判断
杂化轨道夹角 180° 120° 109°28′
杂化轨道类型 sp sp2 sp3
四、判断中心原子的杂化类型
单键碳原子采取sp3杂化;
双键碳原子采取sp2杂化;
三键碳原子采取sp杂化。
3、有机物中碳原子杂化类型判断方法
5
1
2
3
4
苯分子中的碳原子是什么杂化类型?
苯C6H6
平面正六边形
6个碳原子之间的化学键完全相同,是介于单键和双键之间的一种独特的键。
120°
Π
6个p轨道
6个电子
苯分子中碳原子取sp2杂化,3个杂化轨道分别用于形成3个σ 键,故苯分子键角为120°;苯分子每个碳原子均有1个未参与杂化杂化的p轨道,垂直于分子平面而相互平行,6个“肩并肩”的平行p轨道上总共6个电子一起形成了弥散在整个苯环的1个p-p大π键。
6
6
丁二烯
Π
4个p轨道
4个电子
4
4
石墨分子结构是层形结构,每层是由无限个碳六元环所形成的平面,碳原子取sp2杂化,每个碳原子均有1个未参与杂化杂化的p轨道,垂直于分子平面而相互平行,平行的n个p轨道形成了1个p-p大π键。
电子在这个中可以自由移动,所以石墨能导电。
课 堂 小 结
价层电子对
互斥模型
杂化轨
道理论
计算价层
电子对数
价层电子对数=σ 键电子对数+中心原子孤电子对数
2
3
4
直线形
平面三角形
四面体形
sp杂化,直线形
sp2杂化,平面三角形
sp3杂化,四面体形
预测分子结构
略去孤电子对
解释分子空间结构
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③CH≡CH ④NH3 ⑤CH4
A.①② B.①⑤⑥ C.②③④ D.③⑤⑥
A
2.下列说法中正确的是( )
A.PCl3分子呈三角锥形,是P原子采取sp2杂化的结果
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体
D.AB3型的分子立体构型必为平面三角形
C
3.(1)[2021年全国甲卷]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。
sp3
(2)[2021年全国乙卷]PH3中P采取的杂化类型为 。
sp3
(3)在硅酸盐中,SiO42-四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为____。
sp3
