2.1.1共价键 课件(共30张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1共价键 课件(共30张ppt)化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-07-09 20:10:36 | ||
图片预览






文档简介
(共30张PPT)
第二章 分子结构与性质
第一节 共 价 键
第1课时 共价键
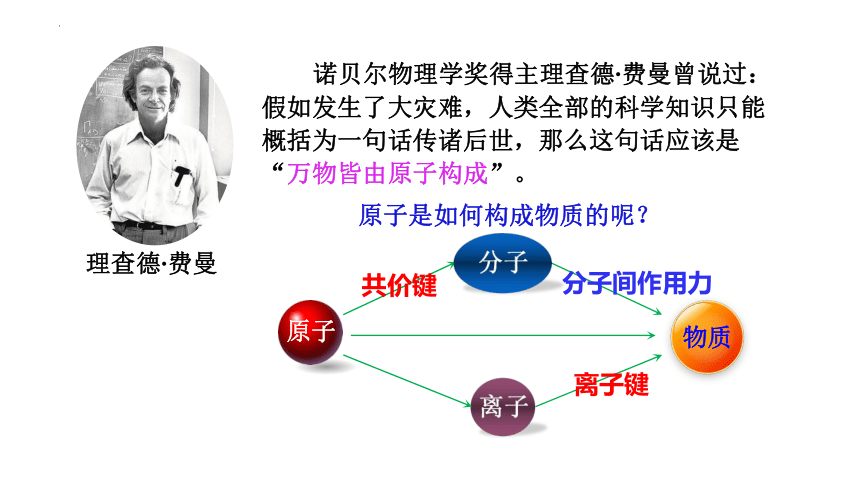
诺贝尔物理学奖得主理查德 费曼曾说过:
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
理查德 费曼
原子是如何构成物质的呢?
物质
原子
分子
离子
共价键
离子键
分子间作用力
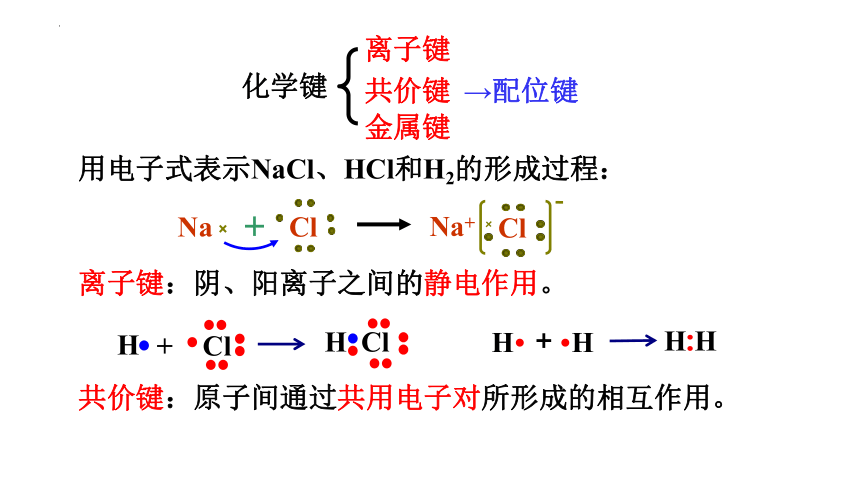
离子键:阴、阳离子之间的静电作用。
共价键:原子间通过共用电子对所形成的相互作用。
化学键
离子键
共价键
金属键
→配位键
用电子式表示NaCl、HCl和H2的形成过程:
Na+
Cl
Na
Cl
H Cl
H
+
Cl
H·
·H
+
H:H
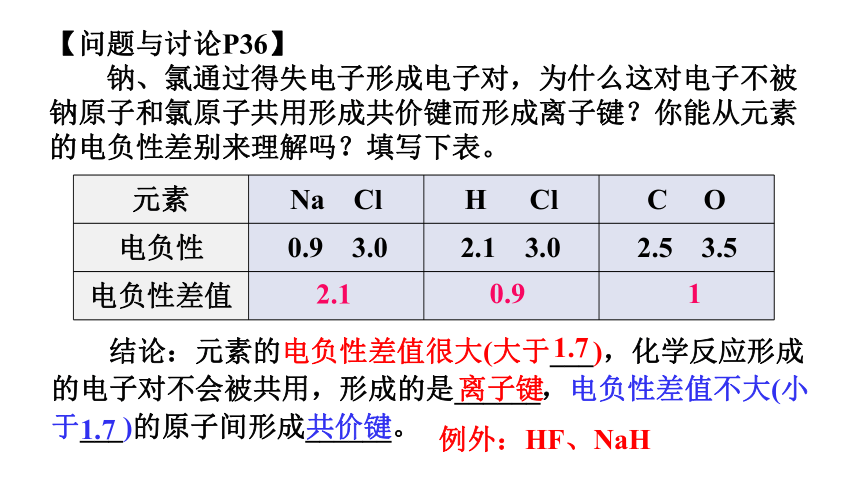
元素 Na Cl H Cl C O
电负性
电负性差值
【问题与讨论P36】
钠、氯通过得失电子形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键?你能从元素的电负性差别来理解吗?填写下表。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1
结论:元素的电负性差值很大(大于___),化学反应形成的电子对不会被共用,形成的是______,电负性差值不大(小于___)的原子间形成______。
例外:HF、NaH
1.7
离子键
1.7
共价键
H·
·H
+
H:H
一、从原子轨道的角度分析共价键的特点:
↑
1s
↑
1s
↓
1s
电子配对原理:
两个原子各自提供1个自旋方向相反的电子彼此配对。
按照共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,说明共价键具有______。
饱和性
共价键的饱和性决定了分子的组成。所以只能有H2、HCl、Cl2等,而不可能有H3、H2Cl、Cl3等。
一、从原子轨道的角度分析共价键的特点:
两个原子共用电子,意味着两个原子的距离足够近使得其原子轨道在核间出现了重叠。
最大重叠原理:
两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
除s轨道是球形外,原子轨道都有一定的空间取向,所以要使原子轨道最大重叠,共价键必然有______。
方向性
共价键的方向性决定了分子的空间结构。
并不是所有共价键都有方向性!如s-s轨道重叠形成的共价键就没有方向性。
1、在所有分子中都存在化学键( )
2、共价键的成键原子只能是非金属原子( )
3、形成共价键后体系的能量降低,趋于稳定( )
4、Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的( )
5、共价键的方向性是由成键原子轨道的方向性决定的( )
6、共价键都有饱和性和方向性( )
正误判断
×
×
×
×
s-s轨道重叠形成的共价键没有方向性。
二、共价键的类型
共价键
按共用电子对是否偏移
按共用电子对数目
极性键
非极性键
单键
双键
三键
按原子轨道的重叠方式
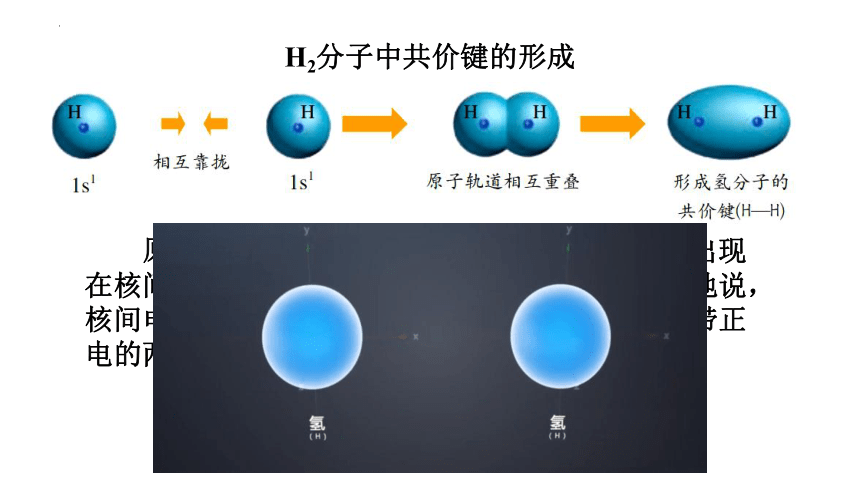
H2分子中共价键的形成
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核"黏结”在一起了。
靠拢
重叠
成键
靠拢
重叠
成键
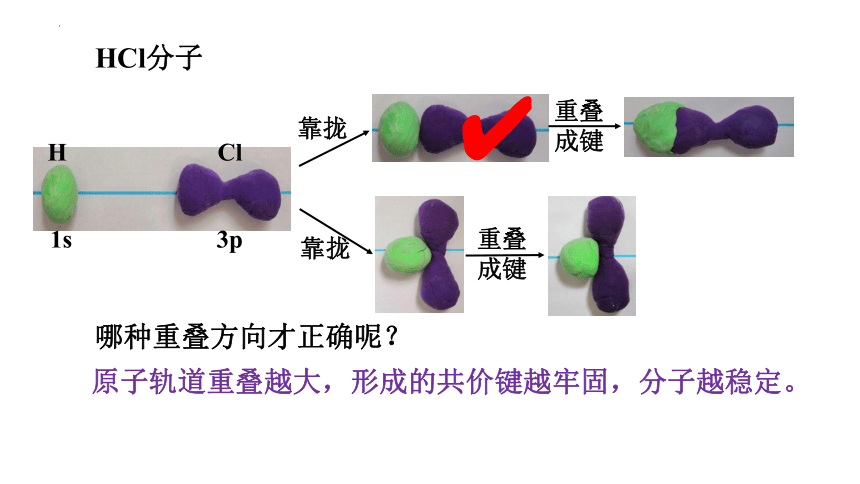
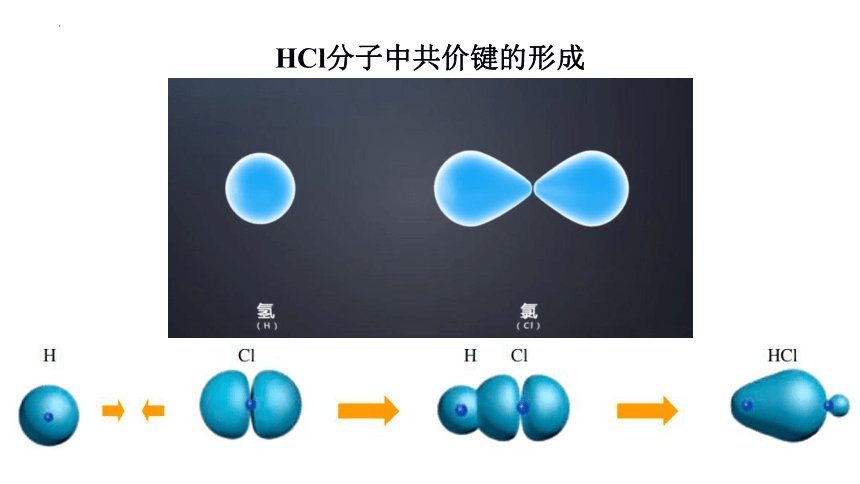
HCl分子
1s 3p
H Cl
哪种重叠方向才正确呢?
原子轨道重叠越大,形成的共价键越牢固,分子越稳定。
HCl分子中共价键的形成
Cl2分子中共价键的形成
请归纳H-H、H-Cl和Cl-Cl的成键相同点。
原子轨道以“头碰头”的方式重叠形成的共价键。
s-s σ键
s-p σ键
p-p σ键
以形成共价键的两原子核的连线为轴作旋转操作,
共价键的电子云形状不变(σ 键不断裂),称为轴对称。
二、共价键的类型
1、σ 键
“头碰头”
原子轨道的重叠方式:
特征:电子云图形轴对称,能旋转
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
种类
形成σ键的原子轨道的重叠程度较大,故σ键较稳定。
σ键的常见类型有(1)s-s, (2)s-p, (3)p-p,请指出下列分子
σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
s-p
s-p
p-p
s-s
原子轨道除了以“头碰头”的方式重叠以外,还有没有可能以其他的方式重叠成键?
“肩并肩”
2、π 键
原子轨道的重叠方式:
特征:
p-p π键
种类:
电子云由两块组成,镜面对称,
不能旋转
不存在s-s π键,s-p π键!
π键不能单独存在!通常存在于共价双键或共价三键中。
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
+
:
:
:
:
N
:
N
N
·
·
·
:
N
·
·
·
:
↑
↑
↑
↑↓
2s
2p
N
x
y
z
N的2p轨道
x
y
z
x
y
z
“头碰头”
y
z
x
y
z
“肩并肩”
“肩并肩”
y
z
x
y
z
p-p σ键
p-p π键
p-p π键
两原子形成共价键时,先形成σ键,然后才能形成π键。
三、σ 键和 π 键的判断
共价单键 共价双键 共价三键
σ键
s-s
s-p
p-p
1个σ键、1个π键
1个σ键、2个π键
注意:分子中存在π键,则一定存在σ键;若存在σ键,则不一定存在π键。
【问题与预测P36】
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
7个σ键
5个σ键和1个π键
3个σ键和2个π键
乙烯分子中σ键和π键的形成过程
乙炔分子中σ键和π键的形成过程
σ键 π键
重叠方式
成键类型
对称类型
能否旋转
存在情况
键的强度 “头碰头”
“肩并肩”
s-s σ键
s-p σ键
p-p σ键
p-p π键
轴对称
镜面对称
能绕轴旋转
不能绕轴旋转
能单独存在
不能单独存在,必须与σ键共存
σ键和π键的强度不同。
在烯烃、炔烃分子中的π键不如σ键强,容易断裂。
1、下列说法正确的是( )。
A、π键是由两个p轨道“头碰头”重叠形成的
B、σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C、所有的 键的强度都比 键的大
D、共价化合物中,一定有 键,可能有 键
D
2、丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
3、已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4molN—H断裂,则形成的π键的数目为______。
3NA
4、有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。
(1)只有σ键的是______________(填序号,下同);既有σ键又有π键的是________。
①②③⑥⑦⑧
④⑤⑨
(2)含有由两个原子的s轨道重叠形成的σ键的是____。
⑦
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
①③⑤⑥⑧⑨
②④⑤⑥⑧⑨
第二章 分子结构与性质
第一节 共 价 键
第1课时 共价键
诺贝尔物理学奖得主理查德 费曼曾说过:
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
理查德 费曼
原子是如何构成物质的呢?
物质
原子
分子
离子
共价键
离子键
分子间作用力
离子键:阴、阳离子之间的静电作用。
共价键:原子间通过共用电子对所形成的相互作用。
化学键
离子键
共价键
金属键
→配位键
用电子式表示NaCl、HCl和H2的形成过程:
Na+
Cl
Na
Cl
H Cl
H
+
Cl
H·
·H
+
H:H
元素 Na Cl H Cl C O
电负性
电负性差值
【问题与讨论P36】
钠、氯通过得失电子形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键?你能从元素的电负性差别来理解吗?填写下表。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1
结论:元素的电负性差值很大(大于___),化学反应形成的电子对不会被共用,形成的是______,电负性差值不大(小于___)的原子间形成______。
例外:HF、NaH
1.7
离子键
1.7
共价键
H·
·H
+
H:H
一、从原子轨道的角度分析共价键的特点:
↑
1s
↑
1s
↓
1s
电子配对原理:
两个原子各自提供1个自旋方向相反的电子彼此配对。
按照共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,说明共价键具有______。
饱和性
共价键的饱和性决定了分子的组成。所以只能有H2、HCl、Cl2等,而不可能有H3、H2Cl、Cl3等。
一、从原子轨道的角度分析共价键的特点:
两个原子共用电子,意味着两个原子的距离足够近使得其原子轨道在核间出现了重叠。
最大重叠原理:
两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
除s轨道是球形外,原子轨道都有一定的空间取向,所以要使原子轨道最大重叠,共价键必然有______。
方向性
共价键的方向性决定了分子的空间结构。
并不是所有共价键都有方向性!如s-s轨道重叠形成的共价键就没有方向性。
1、在所有分子中都存在化学键( )
2、共价键的成键原子只能是非金属原子( )
3、形成共价键后体系的能量降低,趋于稳定( )
4、Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的( )
5、共价键的方向性是由成键原子轨道的方向性决定的( )
6、共价键都有饱和性和方向性( )
正误判断
×
×
×
×
s-s轨道重叠形成的共价键没有方向性。
二、共价键的类型
共价键
按共用电子对是否偏移
按共用电子对数目
极性键
非极性键
单键
双键
三键
按原子轨道的重叠方式
H2分子中共价键的形成
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核"黏结”在一起了。
靠拢
重叠
成键
靠拢
重叠
成键
HCl分子
1s 3p
H Cl
哪种重叠方向才正确呢?
原子轨道重叠越大,形成的共价键越牢固,分子越稳定。
HCl分子中共价键的形成
Cl2分子中共价键的形成
请归纳H-H、H-Cl和Cl-Cl的成键相同点。
原子轨道以“头碰头”的方式重叠形成的共价键。
s-s σ键
s-p σ键
p-p σ键
以形成共价键的两原子核的连线为轴作旋转操作,
共价键的电子云形状不变(σ 键不断裂),称为轴对称。
二、共价键的类型
1、σ 键
“头碰头”
原子轨道的重叠方式:
特征:电子云图形轴对称,能旋转
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
种类
形成σ键的原子轨道的重叠程度较大,故σ键较稳定。
σ键的常见类型有(1)s-s, (2)s-p, (3)p-p,请指出下列分子
σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
s-p
s-p
p-p
s-s
原子轨道除了以“头碰头”的方式重叠以外,还有没有可能以其他的方式重叠成键?
“肩并肩”
2、π 键
原子轨道的重叠方式:
特征:
p-p π键
种类:
电子云由两块组成,镜面对称,
不能旋转
不存在s-s π键,s-p π键!
π键不能单独存在!通常存在于共价双键或共价三键中。
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
+
:
:
:
:
N
:
N
N
·
·
·
:
N
·
·
·
:
↑
↑
↑
↑↓
2s
2p
N
x
y
z
N的2p轨道
x
y
z
x
y
z
“头碰头”
y
z
x
y
z
“肩并肩”
“肩并肩”
y
z
x
y
z
p-p σ键
p-p π键
p-p π键
两原子形成共价键时,先形成σ键,然后才能形成π键。
三、σ 键和 π 键的判断
共价单键 共价双键 共价三键
σ键
s-s
s-p
p-p
1个σ键、1个π键
1个σ键、2个π键
注意:分子中存在π键,则一定存在σ键;若存在σ键,则不一定存在π键。
【问题与预测P36】
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
7个σ键
5个σ键和1个π键
3个σ键和2个π键
乙烯分子中σ键和π键的形成过程
乙炔分子中σ键和π键的形成过程
σ键 π键
重叠方式
成键类型
对称类型
能否旋转
存在情况
键的强度 “头碰头”
“肩并肩”
s-s σ键
s-p σ键
p-p σ键
p-p π键
轴对称
镜面对称
能绕轴旋转
不能绕轴旋转
能单独存在
不能单独存在,必须与σ键共存
σ键和π键的强度不同。
在烯烃、炔烃分子中的π键不如σ键强,容易断裂。
1、下列说法正确的是( )。
A、π键是由两个p轨道“头碰头”重叠形成的
B、σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C、所有的 键的强度都比 键的大
D、共价化合物中,一定有 键,可能有 键
D
2、丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
3、已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4molN—H断裂,则形成的π键的数目为______。
3NA
4、有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。
(1)只有σ键的是______________(填序号,下同);既有σ键又有π键的是________。
①②③⑥⑦⑧
④⑤⑨
(2)含有由两个原子的s轨道重叠形成的σ键的是____。
⑦
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
①③⑤⑥⑧⑨
②④⑤⑥⑧⑨
